Lungenwürmer und Herzwürmer bei Katzen
Lungenwürmer und Herzwürmer sind eine unterschätzte, aber potenziell ernste Bedrohung für viele Katzen, wie uns dieser Artikel erläutert.
Kernaussagen
Kardiopulmonale Nematoden sollten bei Katzen mit Atemwegserkrankungen immer auf der Liste der Differenzialdiagnosen stehen, insbesondere, wenn die betroffene Katze in einer fr Lungen- und/oder Herzwrmer endemischen Region lebt.
Wilde Feliden und streunende Katzen spielen eine wichtige Rolle als Lungenwurmreservoir fr Hauskatzen.
Jagende Katzen sind dem Risiko einer Infektion mit Aelurostrongylus abstrusus und Troglostrongylus brevior durch die Aufnahme infektiser Larven im Gewebe paratenischer Wirte ausgesetzt.
Katzen, die in fr den kaninen Herzwurm endemischen Regionen leben, tragen das Risiko der Entwicklung der Heartworm Associated Respiratory Disease und sollten deshalb regelmig prventiv behandelt werden.
Einleitung
Relativ weit verbreitet ist die Annahme, dass Lungenwürmer und Herzwürmer zwar eine durchaus ernste Bedrohung für Hunde darstellen, das Risiko für Katzen aber allenfalls marginal ist, und mögliche Infektionsfälle klinisch eher nicht relevant sind. Tierärzte kennen die Risiken der in vielen Teilen der Erde endemischen Angiostrongylose und der Dirofilariose als lebensbedrohende kardiopulmonale Erkrankungen bei Hunden sehr gut. Katzen infizieren sich dagegen nicht mit dem caninen Lungenwurm Angiostrongylus vasorum, und der Herzwurm Dirofilaria immitis löst bei Feliden klinisch weitaus weniger relevante Infektionen aus. Der Katzenlungenwurm Aelurostrongylus abstrusus galt früher als eher selten und von geringer Pathogenität, er wird heute aber als der weltweit häufigste Nematode des Atemtraktes bei Hauskatzen betrachtet. Darüber hinaus gilt der in Südeuropa nachzuweisende und bis vor kurzem überwiegend mit wilden Feliden in Verbindung gebrachte Lungenwurm Troglostrongylus brevior heute als eine bedeutende Ursache hochgradiger Bronchopneumonien bei Katzenwelpen und jungen Katzen, und auch der vorwiegend bei Hunden und wilden Karnivoren zu findende Capillaria aerophila (syn. Eucoleus aerophilus) ist heute in zunehmendem Maße auch bei Katzen nachzuweisen. Tabelle 1 bietet eine kurze Übersicht über die klinischen Symptome bei Katzen mit Infektionen durch kardiopulmonale Parasiten.
Tabelle 1. Klinische Symptome bei Katzen mit Lungenwurminfektionen oder Herzwurminfektionen.
| Parasit | Alter betroffener Katzen | Lokalisation der Parasiten | Symptome |
|---|---|---|---|
| A. abstrusus | Adulte Katzen, selten Katzenwelpen | Bronchiolen, Alveolen, Alveolargänge, subpleurale Knoten | Bronchitis und Pneumonie: Husten, Niesen, Giemen, Maulatmung, Tachypnoe, mukopurulenter Nasenausfluss |
| T. brevior | Katzenwelpen und junge adulte Katzen | Bronchitis und Pneumonie: Husten, Profuser Nasenausfluss, Tachypnoe, Augenausfluss, Anorexie, Dehydratation, Hypo- oder Hyperthermie, Desorientierung und Lethargie | |
| C. aerophila | Adulte Katzen | Submukosa der Trachea, Bronchien und Bronchiolen | Husten, Niesen, Tachypnoe, Kurzatmigkeit |
| D. immitis | junge adulte Katzen | Pulmonalarterie, rechter Ventrikel |
oft asymptomatisch, Selbstheilung kann vorkommen, hochgradiges Lungensyndrom: Husten, Lethargie, Tachykardie, Erbrechen, Diarrhoe, Konvulsionen, Kollaps, plötzlicher Tod
|
Aelurostrongylus abstrusus
Die umfangreiche Forschung zur Epidemiologie und Diagnose von A. abstrusus bei Hauskatzen während der vergangenen zehn Jahre hat das allgemeine Bewusstsein für die Bedrohung durch diesen Parasiten geschärft. In der Folge wird heute eine größere Zahl von Fällen einer Aelurostrongylose diagnostiziert, wobei aber nach wie vor unklar ist, ob es sich dabei tatsächlich um einen echten Anstieg der Prävalenz und der geographischen Ausbreitung dieses Parasiten handelt. A. abstrusus ist aber zweifellos der weltweit am häufigsten vorkommende Lungenwurm bei Hauskatzen und wird aus Gründen der Vereinfachung oft auch als „Katzenlungenwurm“ bezeichnet, weil er als sehr speziesspezifisch gilt [1],[2],[3] Bei der Aelurostrongylose handelt es sich um eine der klinisch bedeutsamsten Parasitosen der Katze, da der Nematode in vielen Gebieten der Erde endemisch vorkommt, mit einer Prävalenz von bis zu 35 % (Tabelle 2). Eine Übersichtsstudie aus Europa kommt zu dem Ergebnis, dass die Aelurostrongylose eine Bedrohung für alle Hauskatzen mit regelmäßigem Zugang ins Freie darstellt, und zwar unabhängig von Alter, Geschlecht oder geographischer Lokalisation [4]. A. abstrusus kann auch wilde Feliden infizieren, die Nager und Vögel als Beutetiere nutzen, und in der Nachbarschaft von Hauskatzen leben [3]. So wird der Lungenwurm zum Beispiel bei Europäischen Wildkatzen (Felis silvestris silvestris) in Italien mit einer Prävalenz von 62,5 % nachgewiesen (Abbildung 1), und verursacht hochgradige Lungenschäden [5].
Tabelle 2. Zusammenfassung von Studien zur Prävalenz kardiopulmonaler Parasiten bei Katzen.
| Europa [4],[24],[25] | Anzahl untersuchter Katzen | A. abstrusus | T. brevior | C. aerophila |
|---|---|---|---|---|
| Belgien | 108 | 0,9 % | - | 0,9 % |
| Frankreich | 92, 120 | 4,3 % | - | 0,8 % |
| Schweiz | 124 | 0,8 % | - | - |
| Italien | 138, 120, 170 | 5-12,9 % | 1,4-14,2 % | 0,6 % |
| Spanien | 200 | 5 % | 3 % | - |
| Portugal | 360 | 4,7 % | - | 0,6 % |
| Griechenland | 118 | 8,5 % | - | 4,2 % |
| Ungarn | 120 | 22,5 % | - | - |
| Rumänien | 120 | 14,2 % | - | 6,7 % |
| Bulgarien | 120 | 27,5 % | 10,8 % | 10,8 % |
| Deutschland | 837, 378 | 1,0-6,1 % | - | - |
| Polen | 716 | 1 % | 0,1 % | - |
| Nordamerika [9] | ||||
|---|---|---|---|---|
| USA | 3625 | 2,07 % | - | - |
| Südamerika [26] | ||||
|---|---|---|---|---|
| Kolumbien | 121 | 0,2 % | - | - |
| Uruguay | 8 | 25 % | - | - |
| Chile | 200 | 10 % | - | - |
| Brasilien | ? | 1,3 %, 29,5 % | - | - |
| Argentinien | 17 | 35,3 % | - | - |

Shutterstock
Entwicklungszyklus
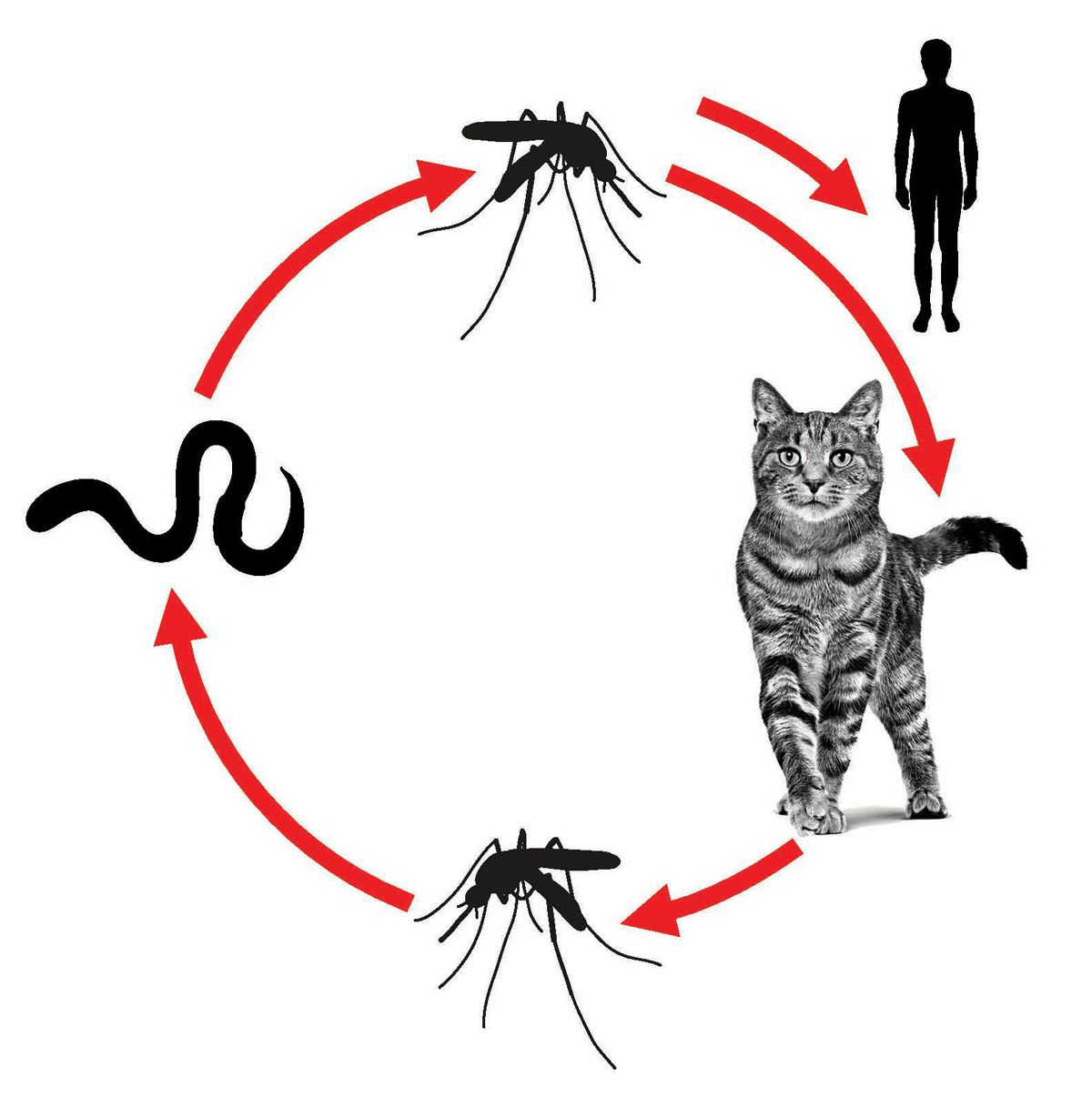
Der adulte Nematode ist klein (männliche Tiere sind 5-10 mm lang, weibliche bis zu 10 mm) und sehr dünn (weniger als 100 µm oder geringfügig dicker als ein Haar). Der Parasit bewohnt die Bronchiolen, die Alveolargänge und die Alveolen, kommt aber auch in subpleuralen Knoten im Lungenparenchym vor [1],[3],[6]. A. abstrusus hat einen indirekten Entwicklungszyklus, wobei terrestrische Mollusken als Zwischenwirte dienen, möglicherweise aber auch aquatische Schnecken eine Rolle spielen. Amphibien, Reptilien, Vögel und Nager spielen eine wichtige epidemiologische Rolle, da sie durch orale Aufnahme infizierter Mollusken zu paratenischen Wirten (Reservoir) werden. Katzen infizieren sich überwiegend durch orale Aufnahme der infektiösen dritten Larvenstadien (L3) in paratenischen Wirten oder seltener auch durch eine direkte orale Aufnahme infizierter Mollusken (Abbildung 2). Die Präpatenzzeit liegt im typischen Fall bei 35-48 Tagen, sie kann aber auch bis zu 63 Tage andauern [7]. Die weiblichen Würmer legen Eier, aus denen Larven in den Alveolargängen schlüpfen. Die ersten Larvenstadien (L1) wandern zum Pharynx, werden dann heraufgehustet, abgeschluckt und über die Fäzes ausgeschieden. In der Umwelt penetrieren die L1 Schnecken, in denen sie sich dann zu den infektiösen L3 entwickeln. Ihre höchste Intensität erreicht die Ausscheidung von Larven über die Fäzes der Katze etwa 10-14 Tage nach der Infektion, sie kann aber auch mehrere Monate und bei einzelnen Tieren sogar mehr als ein Jahr anhalten [1]. Die Ausscheidung von Larven kann intermittierend erfolgen und dadurch den Nachweis im Kot erschweren, wobei die Infektion bei Wirtskatzen über bis zu zwei Jahre anhalten kann [8].

Shutterstock
Epidemiologie
Die Ausbreitung von A. abstrusus wird durch eine feuchte Umgebung und die Nähe zu Wasser begünstigt [9], da die L1 in feuchten Habitaten über einen Zeitraum von bis zu fünf Monaten überleben können [8]. Die L3 können in terrestrischen Schnecken (Helix aspersa) über bis zu 120 Tage überleben, was die Wahrscheinlichkeit einer Infektion paratenischer Wirte erhöht [6]. Aber auch in toten Schnecken können L3 über Zeiträume von bis zu drei Wochen überleben [8]. Nachzuweisen sind L3 in dem von infizierten Schnecken abgesonderten Schleim und in Wasser, das tote infizierte Schnecken enthält [10]. In paratenischen Wirten sind L3 über einen Zeitraum von mindestens 12 Wochen lebensfähig und somit in der Lage, eine Katze zu infizieren [8].
Die Lebensweise einer Katze hat einen signifikanten Einfluss auf ihr Infektionsrisiko. So neigen zum Beispiel Katzen mit regelmäßigem Zugang ins Freie eher zur Aufnahme von A. abstrusus, und bei frei laufenden Katzen kann die Prävalenz bis zu 50 % erreichen [1],[6]. Nicht abschließend geklärt ist, ob das Alter der Katze einen Risikofaktor für die Aelurostrongylose darstellt. Groß angelegte Studien in 12 europäischen Ländern zeigen jedoch, dass Infektionen am häufigsten bei Tieren im Alter zwischen sechs Monaten und zwei Jahren diagnostiziert werden [4]. Auch umfangreiche Forschungen in den USA deuten darauf hin, dass das Alter durchaus ein signifikanter Risikofaktor ist. So zeigt zum Beispiel eine Studie, dass 5,15 % der Katzen im Alter von 1-2 Monaten positiv für A. abstrusus waren, aber nur 0,65 % der Katzen über 12 Monaten [9]. Andere Übersichtsarbeiten berichten dagegen, dass Lungenwürmer häufiger bei adulten Katzen vorkommen, die größere Jagdfähigkeiten besitzen und somit naturgemäß auch eine höhere Chance haben, infektiöse Larven mit dem Gewebe der als Beutetiere dienenden paratenischen Wirte aufzunehmen [1].
Klinische Symptome
A. abstrusus verursacht im Allgemeinen geringgradige klinische Symptome, eine infizierte Katze kann aber auch asymptomatisch sein oder im Falle einer hochgradigen Infektion Symptome einer Bronchitis und Pneumonie entwickeln [1],[6],[8], wobei adulte Parasiten und schlüpfende L1 entsprechende Schäden im Lungenparenchym hervorrufen. Die häufigsten Symptome sind gering- bis hochgradiger Husten, Niesen, Giemen, Dyspnoe, Tachypnoe, abdominale Atmung bei geöffnetem Maul und mukopurulenter Nasenausfluss. Ebenfalls beschrieben werden Apathie, Lethargie und Gewichtsverlust [1],[8],[11]. Todesfälle kommen selten vor, können in hochgradigen Fällen aber durchaus auftreten, insbesondere bei jungen, geschwächten oder immunsupprimierten Tieren [1].
Diagnose
Diagnosis of aelurostrongylosis relies upon the detection of L1 larvae in the feces (Figure 3), with the Baermann method regarded as the gold standard, as it has much higher sensitivity than the classical flotation technique [2],[6],[9],[11] und darüber hinaus quantitative Informationen über die Höhe der Wurmbürde liefert, die mit dem Grad der Erkrankung korreliert. Im Präpatenzstadium kann eine Infektion auf diesem Weg jedoch nicht diagnostiziert werden, und da die Larvenausscheidung intermittierend erfolgt, sollte die Untersuchung drei Mal zu unterschiedlichen Zeitpunkten durchgeführt werden, um falsch negative Ergebnisse zu vermeiden. Wichtige Einschränkungen der Baermann-Methode sind, dass die gesamte Durchführung 12-24 Stunden dauert, und dass die Kotprobe frisch sein muss (oder maximal einige Tage im Kühlschrank gelagert), um ausreichende bewegliche Larven zu erhalten [2]. Die Flotationsmethode ist weniger sensitiv [9], und es besteht die Gefahr, dass die Larven in den gesättigten Flotationslösungen geschädigt werden [2],[6]. Eine alternative Option ist das kürzlich entwickelte FLOTAC-Verfahren, mit dessen Hilfe Larven auch in konservierten oder tiefgefrorenen Kotproben nachgewiesen werden können [1],[6]. Larven können aber auch in Tracheallavageproben nachgewiesen werden. Bei einer Bronchoskopie und einer bronchoalveolären Lavage (BAL) handelt es sich dagegen um deutlich invasivere Techniken, die insbesondere bei Katzen mit respiratorischen Symptomen heikel sein können und für den Nachweis von Lungenwürmern nicht verlässlich sind [2]. Die Bestimmung von A. abstrusus-Larven erfordert sehr viel Erfahrung, denn allein die Länge der Larven ist kein ausreichendes Kriterium für ihre Identifikation und eine Abgrenzung gegenüber T. brevior. Die eindeutige Diagnose erfordert vielmehr eine vollständige morphologische und morphometrische Bestimmung, falls möglich ergänzt durch eine molekulardiagnostische Bestätigung [2],[3]. Während die in der Literatur beschriebene durchschnittliche Länge der L1 von A. abstrusus 300-400 µm beträgt, ist die tatsächliche Spanne mit 210-495 µm breiter und stimmt somit durchaus mit den morphometrischen Werten für T. brevior (203-521 µm) überein [2],[3],[4]. Ein charakteristisches morphologisches Merkmal der L1 von A. abstrusus ist der kaudale Abschnitt mit seinem geknickten „S“-förmigen Schwanz mit dorsaler und ventraler Einkerbung und einem terminalen höckerartigen Fortsatz [2],[6],[12].
Eine alternative diagnostische Methode sind genetische Tests, zum Beispiel mit Hilfe der geschachtelten PCR [13]. Serologische Tests wurden für den Nachweis von Antikörpern gegen A. abstrusus entwickelt, kommerzielle praxisinterne Schnelltests zum einfachen Nachweis des Katzenlungenwurms sind gegenwärtig aber nicht verfügbar [2],[9].
Bildgebende Verfahren (Thoraxröntgen, Computertomographie) sollten in Fällen mit Verdacht auf eine Lungenentzündung als vorläufige Untersuchungen durchgeführt werden und können im positiven Fall disseminierte interstitielle und peribronchiale Veränderungen zeigen. Erforderlich ist aber in jedem Fall die Bestätigung einer parasitären Ätiologie, und eine Differenzierung von anderen felinen Lungennematoden ist ratsam [2],[6].
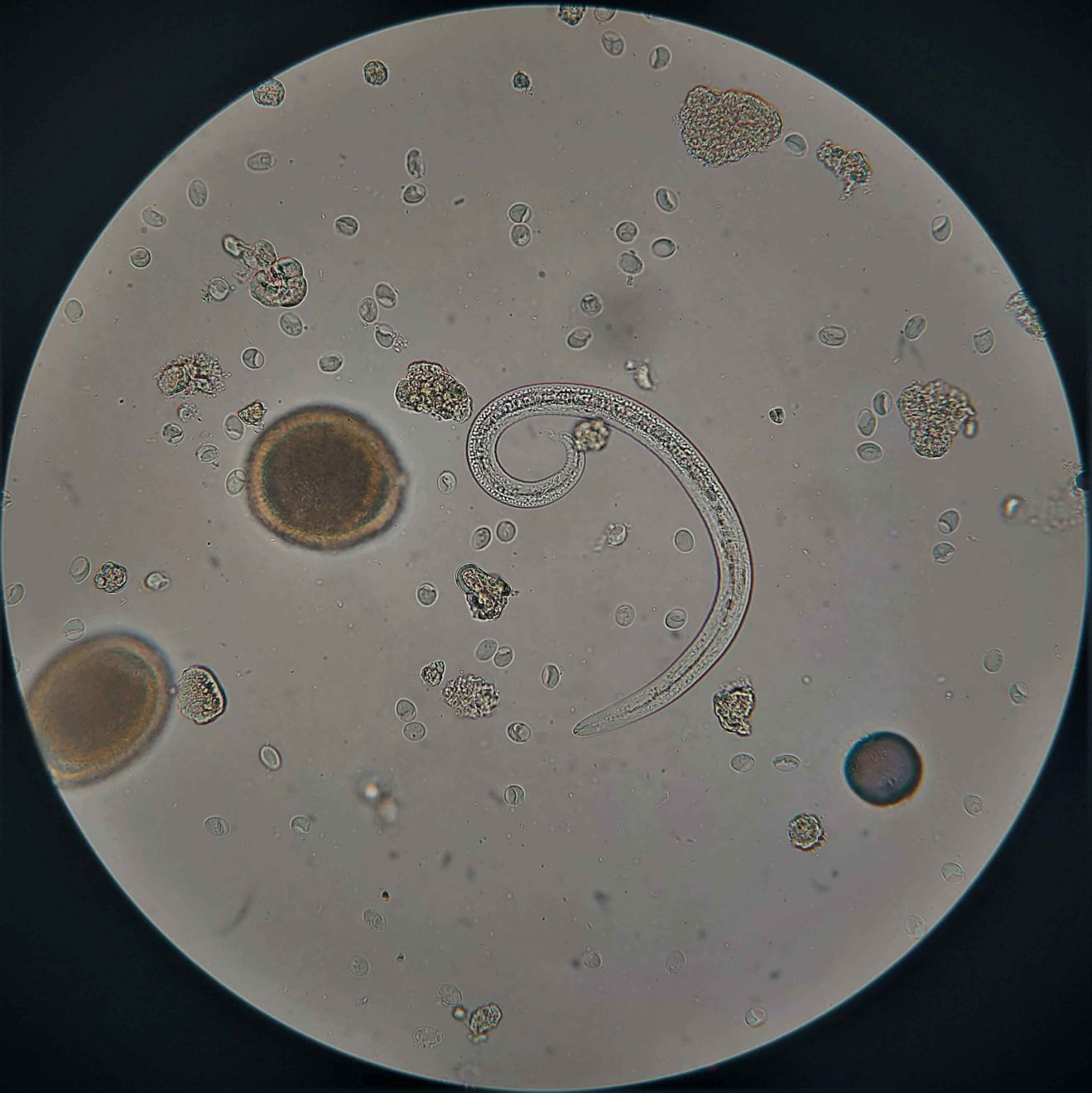
Courtesy of Dr Dawid Jańczak, ANIMALLAB Veterinary Laboratory, Warsaw
Behandlung
Tabelle 3 listet Behandlungsoptionen für die Kontrolle einer diagnostizierten Infektion mit A. abstrusus bei Katzen auf. Formulierungen mit Moxidectin, Eprinomectin oder Emodepsid sind in vielen Ländern zugelassen in Dosierungen, die je nach Produkt variieren. Mindestens ein Spot-on-Produkt mit Imidacloprid 10 %/Moxidectin 1 % ist in Europa für die adultizide Behandlung von A. abstrusus bei Katzen zugelassen [2]. Eine neuere Studie zeigt, dass eine Einzeldosis einer topischen Formulierung mit 2 mg Moxidectin + 40 mg Fluralaner/kg bei 5-7 Monate alten Katzen über einen Zeitraum von mindestens 12 Wochen in vollem Umfang präventiv wirksam ist gegen die Aelurostrongylose [14]. Eine weitere Untersuchung bestätigt, dass ein Spot-on-Präparat mit Moxidectin 1 % (1 mg/kg) + Imidacloprid 10 % (10 mg/kg) bei monatlicher Anwendung wirksam ist zur Prävention von Lungenschäden und patenter A. abstrusus-Infektionen, wobei für eine zu 100 % wirksame Behandlung einer bestehenden Infektion laut dieser Studie drei Applikationen im Abstand von jeweils einem Monat erforderlich waren [15].
Tabelle 3. Optionen für die Behandlung und Prävention von Lungen- und Herzwürmern bei Katzen.
| Arzneimittel und Applikationsweg | A. abstrusus | T. brevior | C. aerophila | D. immitis |
|---|---|---|---|---|
| Emodepsid (Spot-on) 2 mg/kg | + | + | +? | - |
| Moxidectin (Spot-on) 2 mg/kg | + | + | + | +P |
| Eprinomectin (Spot-on) 0,5 mg/kg | + | + | + | +P |
| Selamectin (Spot-on) 6-10 mg/kg | +? | ? | ? | +P |
| Milbemycinoxim (oral) 2-4 mg/kg | +? | ? | ? | +P |
| Fenbendazol (oral) 50 mg/kg | + | + | ? | - |
P - nur zur Prävention der Infektion (Larvenbehandlung); +? – Wirksamkeit basiert auf einer einzigen Studie/keine Daten zur Wirksamkeit
Beachte: Nicht alle genannten Arzneimittel sind in allen Ländern zugelassen.
Zur Wirksamkeit von Milbemycinoxim und Selamectin gegen A. abstrusus liegen bislang nur vorläufige Daten vor, aber in den gegenwärtig für Katzen vermarkteten Produkten führen beide Wirkstoffe nachweislich zu einem wirksamen Stopp der Larvenausscheidung und erreichen bereits nach einmaliger Applikation eine klinische Erholung [2]. Das in einigen Ländern zur Behandlung der Aelurostrongylose zugelassene orale Fenbendazol ist wirksam in einer Dosierung von 50 mg/kg täglich über mindestens drei Tage [2],[12] oder in einer Dosierung von 20-50 mg/kg über 5-15 Tage [8].
Troglostrongylus brevior
Eine jüngst in Europa durchgeführte umfassende Studie bestätigt, dass es sich bei T. brevior um die bei Katzen am zweithäufigsten nachzuweisende Lungenwurmspezies handelt, und kommt zu dem Ergebnis, dass von 201 untersuchten Katzen mit Lungenwurmbefall 78,1 % mit A. abstrusus infiziert waren und 19,5 % mit T. brevior [4]. T. brevior hat eine begrenzte geographische Verbreitung und kommt bei Katzen eher selten vor, diese Lungenwurmspezies wird bei Katzen aber zunehmend häufig diagnostiziert und ist weiter verbreitet, als ursprünglich angenommen (Tabelle 2) [4]. Vor dem Hintergrund entsprechender Fallberichte bei Hauskatzen in südlichen Regionen Europas, wo der Parasit bei den als natürliche Wirte geltenden Wildkatzen endemisch vorkommt, wurde das Risiko der felinen Troglostrongylose in den vergangenen zehn Jahren zunehmend erkannt [3]. Nachgewiesen wird T. brevior insbesondere bei Katzen im Mittelmeerraum (Italien, Griechenland, Albanien, Bulgarien und auf den größeren Mittelmeerinseln) [3],[4], es gibt aber auch Berichte über entsprechende Nachweise bei einer Katze in Polen und bei Wildkatzen in Deutschland und Rumänien [16]. Die Troglostrongylose tritt überwiegend bei Katzenwelpen und bei jungen adulten Katzen auf und verläuft bei diesen Tieren – im Unterschied zur Aelurostrongylose – oft hochgradig und gelegentlich sogar tödlich [2],[3]. Eine Studie aus Italien über 775 Hauskatzen berichtet, dass eine T. brevior-Infektion bei 18,2 % der Katzenwelpen im Alter von unter sechs Monaten nachgewiesen wurde und bei 3,2 % der Katzen im Alter zwischen 6 und 24 Monaten, während bei Katzen über zwei Jahren keine Infektionen gefunden werden konnten [17].
Entwicklungszyklus und klinische Symptome
Der Entwicklungszyklus von T. brevior ähnelt sehr stark dem von A. abstrusus und umfasst terrestrische Mollusken als Zwischenwirte sowie Eidechsen, Vögel und kleine Säugetiere als paratenische Wirte. Eine jüngste Studie aus Italien wies T. brevior-Larven in der Landschnecke Cornu aspertum, sowie in Ratten und Eidechsen nach [18]. Der Nematode bewohnt den oberen Atemtrakt der Katze (d. h. die Trachea und die Bronchien) [2],[13],[17],[19]. Ein Merkmal der Infektion mit diesem Parasiten ist die Möglichkeit einer vertikalen Übertragung von der Mutterkatze auf ihre Nachkommen. Reife T. brevior wurden bei zwei 18 Tage alten Katzenwelpen mit hochgradigen klinischen Atemwegssymptomen gefunden, was auf eine mögliche Übertragung der Larven über das Kolostrum oder die Milch der Mutterkatze auf die Welpen hinweist [18]. Eine solche frühzeitige patente Infektion bei Katzenwelpen deutet aber auch darauf hin, dass eine transplazentale Übertragung nicht ausgeschlossen werden kann. Jüngst konnte nach experimenteller Infektion von 5-6 Monate alten Katzenwelpen mit infektiösen L3 von paratenischen Wirten eine Präpatenzperiode von 24 Tagen ermittelt werden [16].
Wie oben erwähnt sind Katzen im Alter von unter einem Jahr mit Zugang ins Freie am empfänglichsten für T. brevior-Infektionen [13],[17]. Das klinische Bild umfasst eine Bronchitis mit signifikantem katarrhalischem Exsudat aus den Atemwegen, Niesen, Husten, Dyspnoe, Tachypnoe und Augenausfluss. Weitere unspezifische Symptome wie Anorexie, Hyperthermie oder Hypothermie und Dehydratation, aber auch schlechte Körperkondition, Apathie und Lethargie werden beschrieben [2],[13],[19]. Bei adulten Katzen kann die Infektion subklinisch verlaufen oder nur geringgradige klinische Symptome hervorrufen [2].
Der Katzenlungenwurm Aelurostrongylus abstrusus galt früher als eher selten und von geringer Pathogenität, er wird heute aber als der weltweit häufigste Nematode des Atemtraktes bei Hauskatzen betrachtet.
Diagnose und Behandlung
Bei Katzen mit respiratorischen Symptomen und Zugang ins Freie sollte der erste Schritt im diagnostischen Work-up eine Kotuntersuchung auf L1 mit Hilfe des Baermann-Verfahrens sein [13], wie oben im Abschnitt über A. abstrusus diskutiert. Adulte T. brevior sind etwa 14 mm lang und 0,4-0,5 mm breit und damit deutlich breiter als A. abstrusus. In endemischen Regionen Südeuropas sollten auch Mischinfektionen mit beiden Parasiten in Betracht gezogen werden, die oft zu hochgradigeren klinischen Bildern und substanzielleren Veränderungen in Röntgenaufnahmen führen als Monoinfektionen mit einem der beiden Parasiten [2].
In den meisten Ländern gibt es zurzeit nur ein zugelassenes topisches Produkt mit Eprinomectin zur Behandlung und Prävention der felinen Troglostrongylose mit monatlichen Applikationen [2],[4],[13],[20] (Tabelle 3). Bei Hauskatzen wird jedoch die hohe Wirksamkeit einer Kombination aus Fipronil, (S)-Methopren, Eprinomectin und Praziquantel nach einmaliger Applikation beschrieben [4]. Eine neuere kontrollierte Studie mit 5-6 Monate alten Katzenwelpen zeigt, dass der Wirkstoff zu 100 % wirksam ist gegen sich entwickelnde T. brevior-Larven und adulte Würmer, und bei einer Applikation während der Präpatenzzeit das Auftreten klinischer Symptome verhindert [16]. In Pilotstudien unter natürlichen Bedingungen scheinen auch Moxidectin und Emodepsid wirksam zu sein. So erwies sich Moxidectin 1 % Spot-on nach einer einzelnen Gabe bei natürlich infizierten Katzen als hochwirksam, was das Stoppen der Ausscheidung von T. brevior-Larven betrifft, und ein topisches Produkt mit Emodepsid war nach zwei Applikationen im Abstand von zwei Wochen zu 100 % wirksam bezüglich einer Reduzierung von Larven in den Fäzes und bezüglich des Erreichens einer klinischen Erholung [2]. Wenn der Parasit bei Katzenwelpen und jungen Katzen eine hochgradige Dyspnoe verursacht, einhergehend mit dem Risiko plötzlicher Todesfälle, sind zusätzlich geeignete unterstützende Maßnahmen entscheidend, ganz unabhängig von der Wahl des Anthelminthikums [13].
Capillaria aerophila
Zusammen mit A. abstrusus gilt C. aerophila als die wichtigste Ursache parasitärer Infektionen der Atemwege bei Feliden [4]. C. aerophila weist eine geringe Wirtsspezifität auf und infiziert sowohl Caniden als auch Feliden, wobei der Rotfuchs als Hauptreservoir gilt. Die Würmer besiedeln die Submukosa von Trachea, Bronchien und Bronchiolen. Der weibliche Wurm legt Eier, die herauf gehustet, abgeschluckt und mit den Fäzes ausgeschieden werden und nach 30-45 Tagen das infektiöse Stadium erreichen. Der Entwicklungszyklus ist direkt, das heißt, Katzen infizieren sich in der Regel durch orale Aufnahme larvenhaltiger Eier, sie können sich aber auch durch Aufnahme von Regenwürmern infizieren, die als paratenische Wirte dienen [6]. Nach dem Schlüpfen im Darm erreichen die Larven mit einer Präpatenzzeit von etwa 40 Tagen über das Zirkulationssystem die Lunge. Die Prävalenz von C. aerophila bei Katzen gilt als niedrig und hat bei europäischen Hauskatzen mit regelmäßigem Zugang ins Freie eine Spanne zwischen 0,6 und 10,8 % (Tabelle 2), wobei Infektionen am häufigsten bei Tieren im Alter zwischen 6 Monaten und zwei Jahren nachgewiesen werden [4].
Bei den meisten infizierten Katzen verursacht C. aerophila eine chronische Bronchitis mit klinischen Symptomen wie Husten, Niesen, Dyspnoe und Tachypnoe. Die Diagnose erfolgt mit Hilfe einer Standard-Kotflotation zum Nachweis der charakteristischen zitronenförmigen, leicht asymmetrischen Eier mit ihren zwei Polpfröpfen (Abbildung 4). Die intermittierende Ausscheidung der Eier kann die Diagnose jedoch erschweren, so dass Kotproben nach Möglichkeit immer an drei aufeinanderfolgenden Tagen untersucht werden sollten. Neben allen anderen Aspekten ist die Diagnose und Kontrolle von Infektionen mit diesem Parasiten bei Hunden und Katzen vor allem deshalb so wichtig, weil C. aerophila zoonotisches Potenzial besitzt [6].
Gegenwärtig ist in einigen Ländern nur ein topisches Präparat mit Moxidectin 1 % zur Behandlung der felinen Capillariose zugelassen [2],[21]. Bei natürlich infizierten Katzen hat sich jedoch eine einzige Applikation einer Kombination aus Fipronil, (S)-Methopren und Praziquantel als 100 % wirksam erwiesen [4], und in Feldstudien scheint der Parasit auch mit Emodepsid kontrolliert werden zu können [2].
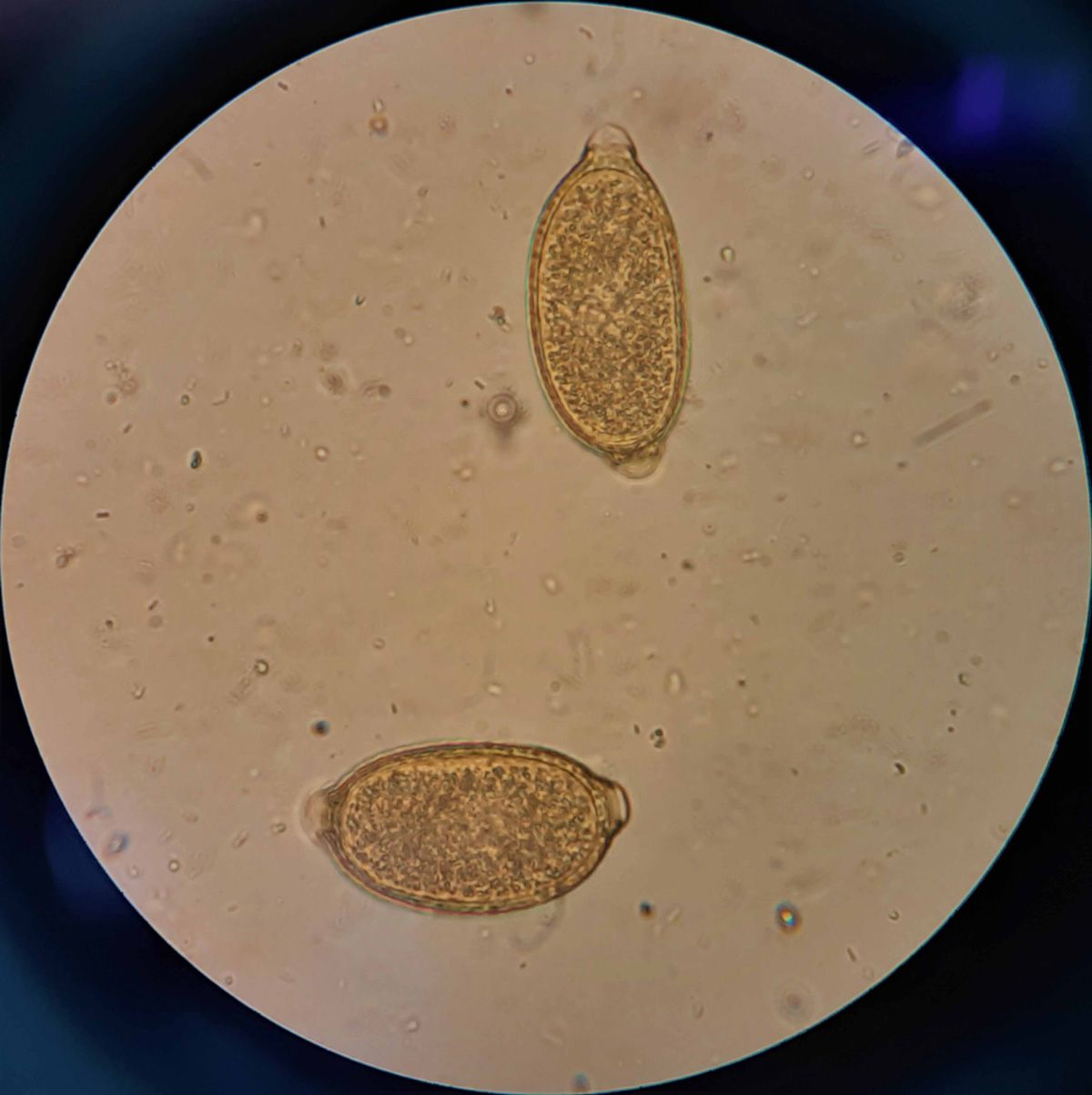
Courtesy of Dr Dawid Jańczak, ANIMALLAB Veterinary Laboratory, Warsaw
Prävention von Lungenwürmern
Verwilderte Katzen, streunende Katzen und Katzen mit Zugang ins Freie haben ein hohes Risiko für Infektionen mit A. abstrusus, T. brevior und C. aerophila. Die Indoor-Haltung von Katzen mit dem Ziel der Begrenzung des Zugangs zu paratenischen Wirten und Mollusken ist wahrscheinlich ein wirksames präventives Mittel gegen diese Infektionen, gilt aber nicht immer als praktikabel [6],[12] und kollidiert oft mit dem Tierwohl. Die am besten geeignete Prävention gegen feline Lungenwürmer besteht daher in der regelmäßigen Behandlung von Katzen mit entsprechenden Anthelminthika, wie sie auch für Hunde und Katzen empfohlen werden, die in für Herzwürmer endemischen Regionen leben. Monatliche Gaben von Emodepsid oder makrozyklischen Laktonen sind bei Katzen gerechtfertigt, die ein erwiesenermaßen erhöhtes Risiko für Aelurostrongylose und/oder Troglostrongylose haben, aber auch zur Verhinderung der Entwicklung chronischer Lungenveränderungen als Folge einer undiagnostizierten Lungenwurmerkrankung [6].
Herzwurm
Im Unterschied zu Hunden sind Katzen weniger empfänglich für eine Infektion mit D. immitis. Bei Katzen erreichen nur einige wenige Parasiten die Pulmonalarterie und entwickeln sich zum adulten Stadium. Abbildung 5 zeigt eine schematische Darstellung des Entwicklungszyklus von D. immitis bei der Katze. Die Präpatenz dauert bei Katzen (7-9 Monate) länger als bei Hunden (6-7 Monate), wobei sich Mikrofilarien nur bei etwa 20-50 % der betroffenen Katzen entwickeln und diese Entwicklung etwa 1-3 Monate andauert. Dadurch wird der Nachweis von Larven im Blut schwierig. Die Infektionsgebiete bei Katzen decken sich weitgehend mit den für Herzwürmer endemischen Gebieten bei Hunden (d. h., tropische und subtropische Zonen und angrenzende gemäßigte Zonen). In Europa werden D. immitis-Infektionen bei Hunden vorwiegend im Mittelmeerraum festgestellt, können aber durchaus auch weiter nördlich auftreten (Deutschland, Österreich, Ungarn, Tschechische Republik, Slowakei und Polen) [8],[22]. In den USA gilt der Herzwurm in den 48 zusammenhängenden Bundesstaaten und in den Überseeterritorien und Protektoraten (Hawaii, Puerto Rico, US Virgin Islands und Guam) als zumindest regional endemisch [23].
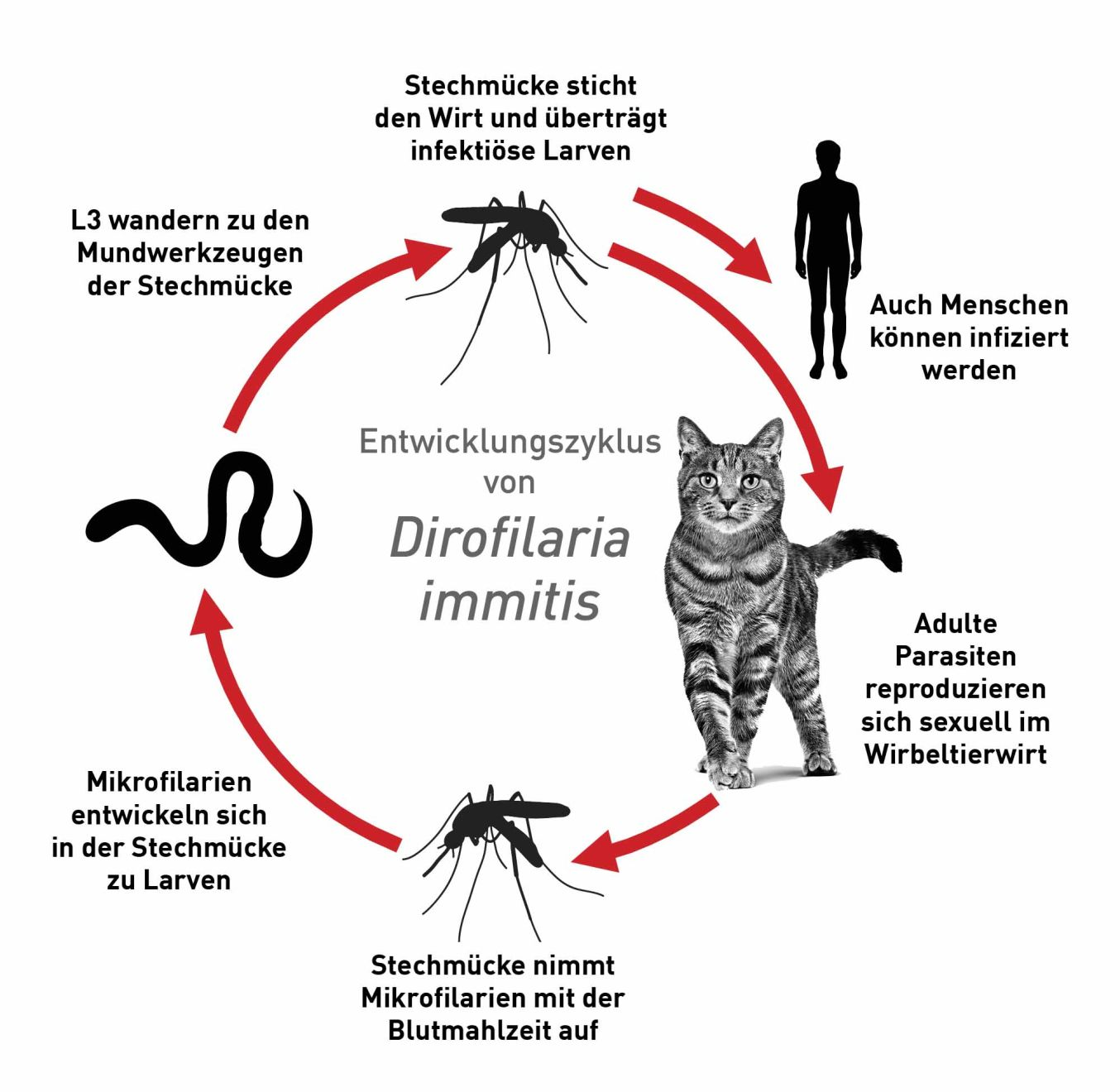
Courtesy ESSCAP
Klinische Symptome
Bei den meisten Katzen bleibt eine Herzwurminfektion über lange Zeit asymptomatisch und wird in vielen Fällen gar nicht diagnostiziert, wobei spontane Selbstheilungen nicht selten vorkommen. Hochgradige Symptome können insbesondere dann auftreten, wenn sich juvenile Herzwürmer in der Pulmonalarterie etablieren (3-4 Monate post infectionem) oder wenn es zu einem natürlichen Tod der adulten Parasiten kommt. Infizierte Katzen können eine akute Erkrankung mit Atemwegssymptomen (Husten, Dyspnoe, Hämoptysis) und Erbrechen entwickeln, es kann aber auch zu spontanen Todesfällen bei asymptomatischen Katzen kommen. Die feline Herzwurmerkrankung wird heute als ein bedeutendes pulmonales Syndrom anerkannt, das als „Heartworm Associated Respiratory Disease” (HARD) bezeichnet wird, und mit klinischen Symptomen wie Anorexie, Lethargie, Husten, Tachykardie, Erbrechen, Diarrhoe, Erblindung, Konvulsionen, Kollaps und plötzlicher Tod einhergeht [22]. Ektopische Lokalisationen infolge einer aberranten Wanderung von Larvenstadien in das Zentralnervensystem, in Körperhöhlen oder in die A. femoralis kommen selten vor (insgesamt aber häufiger als bei Hunden) und können neurologische Symptome (z. B. Erblindung, Ataxie, Parese) und Blutungen hervorrufen.
Diagnose
Der Nachweis von Mikrofilarien im Blut – ein diagnostischer Basistest für Herzwurminfektionen bei Hunden – ist bei Katzen aufgrund der kurzzeitigen und geringgradigen Mikrofilarämie sehr schwierig und wahrscheinlich nicht erfolgreich. Die zuverlässigsten Ergebnisse liefert daher eine Kombination verschiedener diagnostischer Methoden, einschließlich bildgebender Verfahren [8]. Serologische Tests zum Nachweis von Antigenen weiblicher D. immitis sind hochspezifisch, negative Testresultate können eine Infektion aber nicht ausschließen. So können falsch negative Resultate zum Beispiel dann entstehen, wenn nur männliche Würmer oder unreife Stadien vorhanden sind. Anti-D. immitis-Antikörper können 2-3 Monate nach der initialen Infektion zu finden sein, eine Langzeitpersistenz von Antikörpern bei Katzen mit selbst geheilter Erkrankung kann aber zu einer hohen Rate falsch positiver Ergebnisse führen.
Thoraxröntgenaufnahmen sind sowohl aus diagnostischer als auch aus prognostischer Sicht angezeigt, und eine Herzultraschalluntersuchung sollte bei allen Katzen mit Verdacht auf eine Herzwurminfektion durchgeführt werden, da sie eine hohe Sensitivität und eine hohe Spezifität aufweist und die Parasiten im rechten Ventrikel und in der Pulmonalarterie mit Hilfe der Sonographie direkt visuell nachgewiesen werden können [22].
Prävention
Eine Eliminierung adulter D. immitis ist bei Katzen aus mehreren Gründen nicht zu empfehlen. Zunächst gibt es kein zugelassenes Arzneimittel für die Eliminierung adulter D. immitis bei Katzen, und Melarsomin (die zur Behandlung von Herzwürmern bei Hunden eingesetzte Arsenverbindung) ist bei Katzen unsicher. Zum Zweiten besteht nach dem Absterben von Herzwürmern bei entsprechend behandelten Katzen ein hohes Risiko einer pulmonalen Thrombembolie und anaphylaktischer Reaktionen, und zum Dritten zeigen die meisten betroffenen Katzen keine Symptome einer Herzwurminfektion und unterliegen einer spontanen Selbstheilung. Bei Tieren mit hochgradigeren klinischen Symptomen wird jedoch eine unterstützende Therapie (z. B. Prednisolon) zur Linderung der Folgen von Atemnot empfohlen. Infizierte Katzen sollten entsprechend überwacht (Thoraxröntgen, Herzultraschall) und auf Antigene (und Antikörper) getestet werden, um über weitere Behandlungsmaßnahmen entscheiden zu können bzw. eine Selbstheilung zu bestätigen.
In für D. immitis endemischen Gebieten ist aufgrund des Risikos der Entstehung einer potenziell tödlichen HARD und in Anbetracht des Fehlens zugelassener adultizider Arzneimittel eine prophylaktische Anti-Larven-Behandlung bei Katzen zu empfehlen (Tabelle 3). Diese umfasst monatliche Gaben eines Spot-on-Präparates (Selamectin, Moxidectin, Eprinomectin) oder eines oralen Produktes (Milbemycinoxim) über die gesamte Stechmückensaison [8]. Katzen, die von einer nicht-endemischen in eine endemische Region umziehen, sollten innerhalb von 30 Tagen nach Ankunft im Risikogebiet prophylaktisch behandelt werden [22].
Schlussfolgerung
Die geographische Verteilung feliner Lungenwürmer ist regional geprägt mit endemischen Spots, die oft mit dem Vorkommen wilder Feliden assoziiert sind. In den Populationen verwilderter oder streunender Katzen kann eine hohe Prävalenz vorherrschen, und in einigen Lebensräumen dienen diese Tiere als Reservoir für Lungenwürmer bei Hauskatzen. Ein Verdacht auf Lungenparasiten besteht bei jeder Katze mit Atemwegserkrankungen, deren klinische Symptome sich unter einer antibiotischen Behandlung nicht bessern. Grundsätzlich sollten aber alle Katzen, die akute oder chronische respiratorische Symptome aufweisen und nach den Angaben des Vorberichts jagen und/oder regelmäßigen Zugang ins Freie haben, mit Hilfe von Kotproben auf Lungenwürmer getestet werden. Die Prognose sollte sich primär an der klinischen Untersuchung und dem Schweregrad der klinischen Symptome orientieren. Und schließlich sollte daran gedacht werden, dass das Erkennen von Katzen mit C. aerophila wichtig ist, da es sich um einen Zoonoseerreger handelt, der bei Menschen schwere Lungenerkrankungen hervorrufen kann.
Jakub Gawor
DVM, PhD, Faculty of Veterinary Medicine, University of Life Sciences, Warschau, Polen
Polen
Dr. Gawor schloss sein Tiermedizinstudium 1983 an der Veterinärmedizinischen Fakultät der Universität Warschau in Polen ab und ist zurzeit Professor an der Abteilung für Epidemiologie und Pathologie des Instituts für Parasitologie der polnischen Akademie der Wissenschaften in Warschau. Dr. Gawor ist seit 2010 Mitglied des European Scientific Counsel for Companion Animal Parasites (ESCCAP), und zurzeit Präsident von ESCCAP Polen.
Literatur
- Elsheikha HM, Schnyder M, Traversa D, et al. Updates on feline aelurostrongylosis and research priorities for the next decade. Parasit. Vectors 2016;9:389.
- Morelli S, Diakou A, Colombo M, et al. Cat respiratory nematodes: current knowledge, novel data and warranted studies on clinical features, treatment and control. Pathogens 2021;10:454.
- Traversa D, Morelli S, Di Cesare A, et al. Felid cardiopulmonary nematodes: dilemmas solved and new questions posed. Pathogens 2021;10:30.
- Giannelli A, Capelli G, Joachim A, et al. Lungworms and gastrointestinal parasites of domestic cats: a European perspective. Int. J. Parasitol. 2017;47:517-528.
- Veronesi F, Traversa D, Lepri E, et al. Occurrence of cardio-pulmonary nematodes in European wildcats (Felis silvestris silvestris) from Italy. J. Wildl. Dis. 2016;52:270-278.
- Pennisi MG, Hartmann K, Addie DD, et al. Lungworm disease in cats. ABCD guidelines on prevention and management. J. Feline Med. Surg. 2015;17:626-636.
- Schnyder M, Di Cesare A, Basso W, et al. Clinical, laboratory and pathological findings in cats experimentally infected with Aelurostrongylus abstrusus. Parasitol. Res. 2014;113:1425-1433.
- Schnyder M, Rehbein S, Deplazes P. Parasitosen. In: Lutz H, Kohn B, Forterre F (eds). Krankheiten der Katze. Stuttgart, Georg Thieme Velag KG. 2019;439-475.
- Carruth AJ, Buch JS, Braff JC, et al. Distribution of the feline lungworm Aelurostrongylus abstrusus in the USA based on fecal testing. J. Feline Med. Surgery Open Rep. 2019;5(2):2055116919869053.
- Giannelli A, Colella V, Abramo F, et al. Release of lungworm larvae from snails in the environment: potential for alternative transmission pathways. PLoS Negl. Trop. Dis. 2015;9;e0003722.
- Traversa D, Di Cesare A. Diagnosis and management of lungworm infections in cats: cornerstones, dilemmas and new avenues. J. Feline Med. Surg. 2016;18;7-20.
- Wright I. Is feline lungworm infection underestimated in the UK? Improve Veterinary Practice 2019. www.veterinary-practice.com/article/is-feline-lungworm-infection-underestimated-in-the-uk Accessed 27th Feb 2022.
- Crisi PE, Di Cesare A, Boari A. Feline troglostrongylosis: current epizootiology, clinical features, and therapeutic options. Front. Vet. Sci. 2018;5:1-7.
- Raue K, Rohdich N, Hauck D, et al. Efficacy of Bravecto Plus spot-on solution for cats (280 mg/mL fluralaner and 14 mg/mL moxidectin) for the prevention of aelurostrongylosis in experimentally infected cats. Parasit. Vectors 2021;14:110.
- Heuer L, Petry G, Pollmeier M, et al. Efficacy of imidacloprid 10% / moxidectin 1% spot-on formulation (Advocate) in the prevention and treatment of feline aelurostrongylosis. Parasit. Vectors 2020;13:65.
- Knaus M, Visser M, Mayr S, et al. Efficacy of a topical combination of eprinomectin, praziquantel, fiproni and (S)-methoprene against developing and adult Troglostrongylus brevior lungworms (Nematoda, Crenosomatidae) in cats. Vet. Parasitol. 2020;X4:100032.
- Cavalera MA, Iatta R, Colella V, et al. Troglostrongylus brevior: a feline lungworm of pediatric concern. Vet. Parasitol. 2018;253:8-11.
- Bezerra-Santos MA, Mendoza-Roldan JA, Abramo F, et al. Transmammary transmission of Troglostrongylus brevior feline lungworm: a lesson from our gardens. Vet. Parasitol. 2020;285:109215
- Giannelli A, Passantino G, Nascimento Ramos RA, et al. Pathological and histological findings associated with the feline lungworm Troglostrongylus brevior. Vet. Parasitol. 2014;204:416-419.
- Giannelli A, Brianti E, Varcasia A, et al. Efficacy of Broadline spot-on against Aelurostrongylus abstrusus and Troglostrongylus brevior lungworms in naturally infected cats from Italy. Vet. Parasitol. 2015;209:273-277.
- Di Cesare A, Veronesi F, Capelli G, et al. Evaluation of the efficacy and safety of an imidacloprid 10% / moxidectin 1% spot-on formulation (Advocate, AdvantageMulti) in cats naturally infected with Capillaria aerophila. Parasitol. Res. 2017;116:55-S64.
- ESCCAP Guideline 5: Control of Vector-Borne Diseases in Dogs and Cats. www.esccap.org/guidelines/gl5/. Accessed 27th Feb 2022.
- American Heartworm Society. Current Feline Guidelines for the Prevention, Diagnosis, and Management of Heartworm (Dirofilaria immitis) Infection in Cats. 2014.
- Barutzki D, Schaper R. Occurrence and regional distribution of Aelurostrongylus abstrusus in cats in Germany. Parasitol. Res. 2013;112:855-861.
- Szczepaniak K, Leśniak P, Studzińska M, et al. Occurrence of larvae of Metastrongyloidea in faeces of cats from southeastern Poland. Med. Weter. 2019;75:605-608.
- Penagos-Tabares F, Lange MK, Chaparro-Gutirrez JJ, et al. Angiostrongylus vasorum and Aelurostrongylus abstrusus: Neglected and underestimated parasites in South America. Parasit. Vectors 2018;11:208.