Disbioza microbiomului canin
Articol semnat de Jan Suchodolski
Este din ce în ce mai evident faptul că un microbiom intestinal disfuncțional poate fi cauza multor tulburări gastrointestinale; acest articol prezintă diagnosticul și opțiunile terapeutice pentru cazurile de disbioză.

Puncte cheie
Microbiomul intestinal este un organ metabolic care are un impact major asupra sănătății gazdei.
Disbioza este un marker timpuriu al unui mediu intestinal cu anomalii, fiind necesară tratarea bolii de fond pentru a ca rezolvarea să fie de lungă durată.
Adaptarea nutrițională ar trebui să fie tratamentul de primă linie în caz de disbioză asociată cu enteropatii cronice, deoarece adesea este eficientă din punct de vedere clinic și are efecte secundare minime.
Transplantul de microbiotă fecală (TMF) este o opțiune terapeutică care începe să fie folosită din ce în ce mai mult pentru tratarea disbiozei, însă utilizarea la câini este încă în etapa experimentală.
Introducere
Microbiomul intestinal este denumirea dată genomului colectiv al tuturor microorganismelor (adică bacterii, viruși, ciuperci și protozoare) din tractul gastrointestinal (GI), bacteriile fiind cele mai numeroase. Microbiomul poate fi văzut atât ca o componentă a sistemului imunitar, cât și ca o entitate metabolică, deoarece bacteriile produc metaboliți care afectează atât tractul gastrointestinal, cât și alte organe. Disbioza este denumirea dată modificărilor patologice care afectează microbiomul și include o reducere a diversității microbiomului (adică a numărului de bacterii diferite), modificări ale cantității de bacterii și modificări funcționale (de exemplu, perturbarea producției de metaboliți bacterieni). Disbioza apare adesea secundar unor patologii intestinale de fond și contribuie la simptomele clinice la unii pacienți [1]; din acest motiv, este un marker suplimentar pentru boala intestinală și ar trebui să fie evaluată împreună cu istoricul general al pacientului și cu tabloul clinic. Tratarea disbiozei ar trebui să urmărească gestionarea patologiei de bază, abordarea nutrițională fiind tratamentul de primă linie.
Funcția microbiomului
Bacteriile fie produc direct molecule (vitamine), fie transformă moleculele din hrană (fibre, proteine, grăsimi) sau ale gazdei (acizi biliari) în metaboliți bacterieni; prin urmare, microbiota exercită numeroase efecte benefice asupra gazdei. Printre metaboliții importanți se numără acizii grași cu lanț scurt (SCFA), indolii și acizii biliari secundari. Aceștia au efecte diverse, inclusiv antiinflamatorii, de modulare a motilității intestinale, de inhibare a enteropatogenilor, de îmbunătățire a funcției barierei intestinale și de stimulare a producției de mucină [2]. Disbioza, care este adesea secundară diverșilor factori luminali (Caseta 1), determină alterarea funcției microbiotei, ceea ce contribuie apoi la apariția semnelor clinice [1]. Acizii biliari intestinali prezintă un interes special pentru reglarea microbiotei intestinale. Pe scurt, acizii biliari primari (acidul colic și acidul chenodeoxicolic) sunt eliberați în intestinul subțire după consumul de alimente pentru a ajuta la digestia grăsimilor. Până la 95% din acizii biliari sunt reabsorbiți în ileon pentru circulația enterohepatică [3], iar restul ajung în colon, unde bacteriile (în principal Clostridium hiranonis la câini și pisici) îi transformă în acizi biliari secundari [4]. Această conversie are consecințe importante asupra sănătății, deoarece acizii biliari secundari au efecte benefice atunci când sunt în cantitate corectă. Aceștia acționează ca agoniști de semnalizare pentru diverși receptori din mai multe organe, inducând efecte antiinflamatorii și de scădere a glicemiei, precum și suprimarea enteropatogenilor [5].
Caseta 1. Condiții și factori asociați cu disbioza intestinală.
|
•
Insuficiență pancreatică exocrină (IPE), care determină prezența alimentelor nedigerate în lumenul gastrointestinal
• Enteropatii cronice, prin care inflamația intestinală favorizează condițiile aerobe și modificările pH-ului la nivelul mucoasei
• Antibiotice cu spectru larg (de exemplu tilozină, metronidazol), care reduc nivelurile normale de bacterii intestinale anaerobe
• Medicație pentru suprimarea acidității, care reduce producția de acid gastric
• Anomalii anatomice
• Tulburări de motilitate
|
Evaluarea microbiomului
Există diverse opțiuni pentru evaluarea microbiomului canin, dar unele sunt mai eficiente decât altele.
Cultura bacteriană
Deși această metodă este încă utilizată de mulți medici veterinari pentru diagnosticarea disbiozei, coprocultura bacteriană nu este utilă pentru evaluarea microbiomului, deoarece majoritatea bacteriilor intestinale sunt strict anaerobe și necesită medii de cultură speciale (Figura 1). Prin urmare, doar un mic procent din aceste specii bacteriene pot fi cultivate în laboratoare de diagnostic. Într-un studiu recent, mai multe alicote din probe de materii fecale prelevate de la câini sănătoși și câini cu diaree cronică au fost trimise la trei laboratoare veterinare de referință în vederea evaluării disbiozei [6]. Nu a existat nicio concordanță între aceste laboratoare în ceea ce privește rezultatele probelor, disbioza fiind de altfel raportată mai frecvent în grupul de câini sănătoși. Acest studiu demonstrează că metoda culturii bacteriene nu ar trebui utilizată pentru evaluarea microbiotei la câinii cu diaree cronică, cu excepția unor agenți patogeni specifici, cum ar fi Salmonella spp.

Credit: Shutterstock
Secvențierea moleculară a genelor ARNr 16S
Tehnicile moleculare bazate pe secvențierea genelor ARNr 16S oferă informații avansate despre compoziția microbiană a unei probe de fecale și sunt utilizate în activitatea de cercetare. Diverse companii realizează secvențierea pentru evaluarea microbiomului în regim comercial pentru pacienți individuali, însă în prezent nu există metode standardizate (de exemplu, în ceea ce privește extracția ADN-ului, primerii PCR utilizați) în aceste laboratoare. Deoarece nu sunt definite intervale de referință pentru animale și fiecare companie adoptă un mod de raportare diferit, interpretarea rezultatelor este dificilă. În plus, variabilitatea între teste este frecventă și nu au fost furnizate date de validare analitică pentru aceste teste. Ca atare, evaluarea microbiomului bazată pe secvențiere nu este recomandată în prezent pacienților individuali.
Indicele de disbioză a microbiotei canine (ID)
Indicele de disbioză (ID) este un test PCR cantitativ care în prezent este comercializat în America de Nord și Europa și este utilizat în multe studii clinice [4],[7]deoarece este singurul test validat pentru evaluarea disbiozei microbiomului canin*. Indicele de disbioză măsoară nivelurile a șapte bacterii prezente la nivel intestinal (Caseta 2) care sunt de obicei afectate la câinii cu enteropatii cronice (EC) sau cărora li se administrează antibiotice cu spectru larg (de exemplu, tilozină, metronidazol) [8],[9]. Testul oferă intervale de referință pentru aceste grupuri bacteriene și combină datele într-un număr unic care exprimă amploarea disbiozei (Figura 2); o valoare ID între 0 și 2 reprezintă un nivel moderat de modificare a microbiotei, iar un ID >2 indică o modificare majoră. Sensibilitatea și specificitatea acestei metode sunt prezentate în Caseta 3.
* https://tx.ag/DysbiosisGI
Caseta 2. Cele șapte grupe bacteriene incluse în indicele de disbioză canină și modul în care nivelurile acestora se modifică în disbioză.
| Grup bacterian | Modificare în disbioză |
|---|---|
| Faecalibacterium spp. | ↓ |
| Turicibacter spp. | ↓ |
| Blautia spp. | ↓ |
| Fusobacterium spp. | ↓ |
| C. hiranonis | ↓ |
| Streptococcus spp. | ↑ |
| E. coli | ↑ |
Caseta 3. Sensibilitatea și specificitatea indicelui de disbioză (ID) pentru enteropatiile cronice; o valoare ID în intervalul 0–2 reflectă o modificare moderată a microbiotei, în timp ce o valoare peste 2 indică o modificare majoră.
| Indice de disbioză | Sensibilitate | IC (95%) | Specificitate | IC (95%) |
|---|---|---|---|---|
| -1 | 0.82 | 0.73-0.88 | 0.91 | 0.84-0.96 |
| 0 | 0.74 | 0.65-0.82 | 0.95 | 0.89-0.98 |
| 2 | 0.63 |
0.53-0.72
|
1 | 0.96-1.00 |
Prin evaluarea concentrației C. hiranonis, ID oferă de asemenea predicții privind capacitatea microbiotei intestinale de a transforma acizii biliari primari în acizi biliari secundari [4]. Cantitățile normale de acizi biliari secundari exercită un efect antimicrobian și suprimă potențialii enteropatogeni, cum ar fi C. difficile, C. perfringens, și E. coli [10], așadar nivelurile scăzute de C. hiranonis și reducerea conversiei acizilor biliari sunt puternic corelate cu disbioza intestinală și cu proliferarea excesivă a enteropatogenilor la câini (Figura 2) [4],[7],[8],[11].Identificarea unora sau a tuturor acestor enteropatogeni la un câine cu diaree va sugera o proliferare excesivă cauzată de o disbioză secundară unei enteropatii cronice, mai degrabă decât prezența unei infecții primare. Până la 60% dintre câinii cu enteropatie cronică (EC) prezintă scăderea populației de C. hiranonis, și, ca urmare, reducerea acizilor biliari secundari. [12].
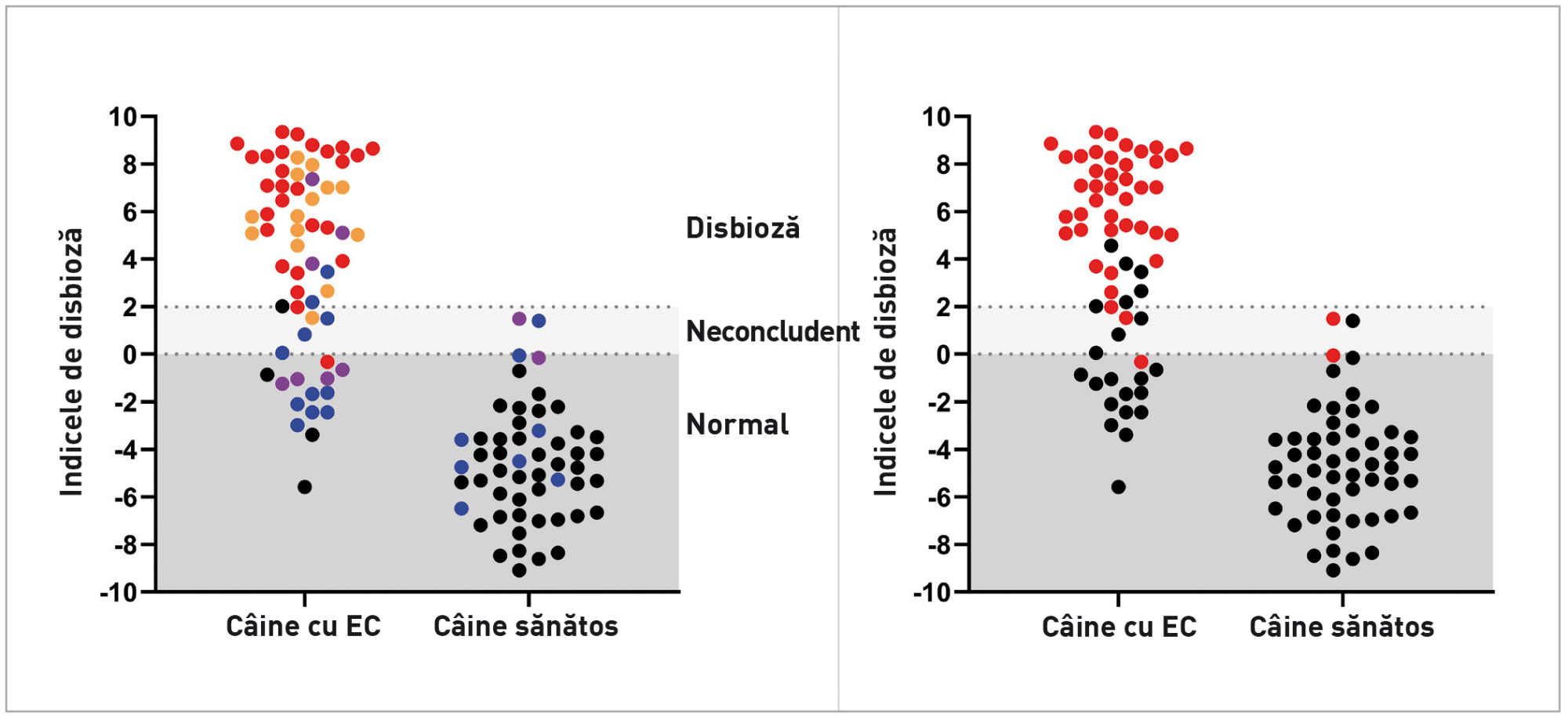
Datele din aceleași două cohorte ilustrează modul în care nivelurile de C. hiranonis au un efect major asupra microbiomului. Probele marcate în roșu denotă niveluri scăzute de bacterii și, implicit, o reducere a conversiei acizilor biliari intestinali primari în secundari, ceea ce determină o modificare anormală a microbiomului. (b)
Microbiomul în caz de boală
Tabelul 1 oferă o sinteză a modalităților diferite prin care bacteriile intestinale pot contribui la boală, deși patologiile de fond vor varia de la un pacient la altul în funcție de localizarea și gravitatea leziunilor intestinale. Microbiota este în contact cu mucoasa intestinală, cu sistemul imunitar și cu substraturile luminale, iar modificările survenite la nivelul unuia sau mai multora dintre aceste elemente vor afecta compoziția microbiotei; prin urmare, disbioza este adesea un marker precoce al unui mediu intestinal patologic (Figura 3).
Tabelul 1. Mecanismele prin care bacteriile contribuie la afecțiunile gastrointestinale.
| Principalele tipuri de disbioză | Consecințe posibile |
|---|---|
| Prezența unor substraturi anormale (de exemplu, nutrienți nedigerați, medicamente) în lumenul intestinal | Creșterea metaboliților bacterieni, cauzând diaree |
| Pierderea funcției microbiotei ca urmare a scăderii numărului bacteriilor comensale (de exemplu, C. hiranonis) |
Reducerea conversiei acizilor biliari primari în acizii biliari secundari, ducând la proliferarea excesivă a enteropatogenilor
Deficit de metaboliți antiinflamatori
|
| Creșterea încărcăturii bacteriene totale în intestinul subțire |
Creșterea metaboliților bacterieni, cauzând diaree
Amplificarea răspunsului imunitar inflamator
|
| Creșterea bacteriilor care aderă la mucoasă | Amplificarea răspunsului imunitar inflamator |
O disbioză limitată în principal la lumenul intestinal este adesea prezentă la pacienții cu insuficiență pancreatică exocrină (EPI) [13], după un tratament cu antibiotice cu spectru larg [8],[9], sau la animalele tinere din cauza sistemului imunitar imatur. Enteropatiile cronice sunt însoțite de inflamație și de distrugerea stratului de mucus și a structurii mucoasei, ceea ce duce la creșterea oxigenării suprafeței mucoasei, la creșterea numărului de bacterii aerobe (E. coli), și la reducerea florei anaerobe normale. Pierderea arhitecturii mucoasei, survenită în EC, generează un deficit de transportatori pentru carbohidrați, aminoacizi, acizi grași și acizi biliari, ceea ce duce la o malabsorbție a acestor compuși [14]. Creșterea cantităților acestor substraturi în lumenul gastrointestinal poate induce în mod direct diaree osmotică sau secretorie, precum și proliferare bacteriană excesivă.
Din cauza afectării stratului de mucus care acoperă epiteliul, câinii cu EC prezintă adesea un număr crescut de bacterii aderente la mucoasă [15]. Acest lucru este asociat cu o reducere a nivelurilor de C. hiranonis și, prin urmare, cu o conversie anormală a acizilor biliari, permițând proliferarea excesivă secundară a C. difficile și C. perfringens ceea ce poate duce la amplificarea răspunsurilor proinflamatorii ale gazdei.
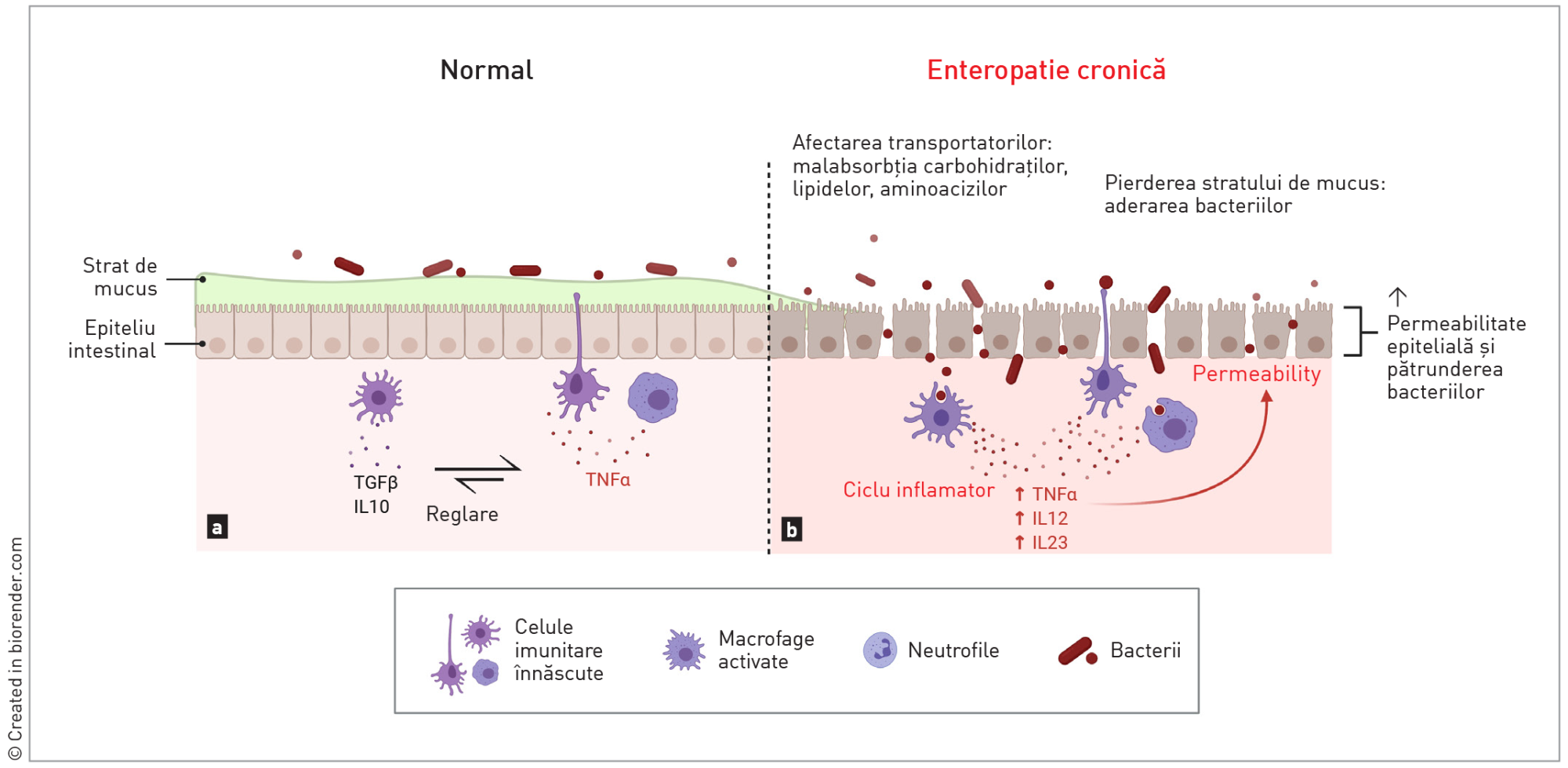
disbioza microbiomului;
pierderea mucoasei, permițând bacteriilor luminale să adere la celulele epiteliale, stimulând citokinele proinflamatorii;
ruperea barierei epiteliale, ducând la translocarea antigenelor alimentare și bacteriene, ceea ce activează de asemenea sistemul imunitar;
pierderea transportatorilor din marginea „în perie”, ceea ce duce la malabsorbția nutrienților, făcând posibilă proliferarea excesivă a bacteriilor.
Modificarea dietei este tratamentul de primă intenție în cazul afecțiunilor intestinale, deoarece nu are un impact negativ asupra microbiotei intestinale.
Abordarea diagnostică a disbiozei
Având în vedere că disbioza se dezvoltă în mod obișnuit ca urmare a unei modificări a mediului intestinal cauzată de o afecțiune intestinală și / sau de perturbarea factorilor de mediu, aceasta ar trebui evaluată împreună cu istoricul terapeutic și tabloul clinic al pacientului. Interpretarea rezultatului ID ar trebui realizată în corelație cu nivelurile taxonilor bacterieni individuali, în special C. hiranonis, deoarece scăderea acestora din urmă reprezintă un factor major care contribuie la anomaliile microbiomului. O valoare ID peste 2 indică disbioză cu o specificitate ridicată, în timp ce o valoare ID aflată în intervalul neconcludent reflectă o modificare minoră la nivelul microbiomului fecal. Unii câini cu EC pot avea o valoare ID <0, însă pot avea unii taxoni bacterieni în afara intervalelor de referință, ceea ce reprezintă o formă minoră de disbioză. În general, o valoare ID anormală sugerează o afecțiune intestinală de fond, prin urmare se impun investigații pentru EC.
Este important de reținut că unele medicamente pot influența ID. De exemplu, omeprazolul poate determina o creștere tranzitorie, dar cu menținerea nivelurilor normale de C. hiranonis, iar ID se normalizează la 1-2 săptămâni după încheierea tratamentului. Antibioticele cu spectru larg (de exemplu, metronidazol și tilozină) pot induce disbioză fecală severă (Figura 4), însă, din nou, microbiota se normalizează de obicei la majoritatea câinilor în 2-4 săptămâni după finalizarea administrării, deși unii pacienți individuali pot prezenta disbioză persistentă cu absența C. hiranonis timp de câteva luni [8],[11].
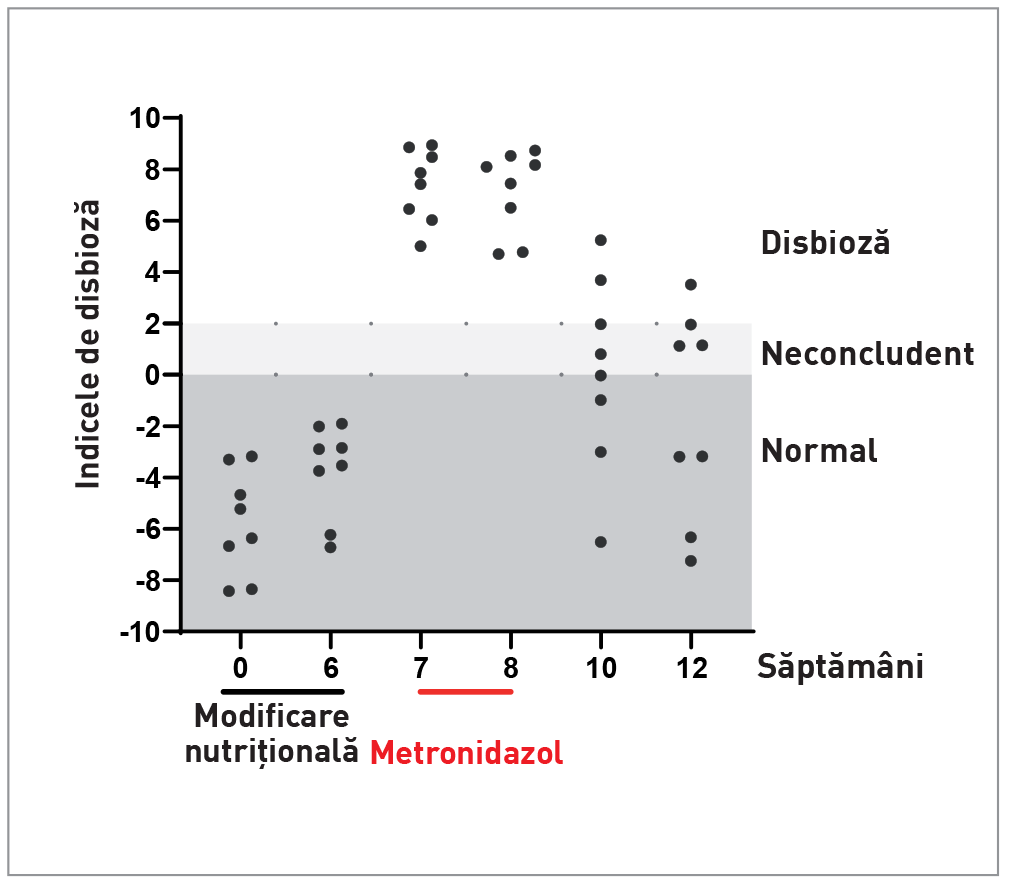
Modificările de compoziție ale microbiotei intestinului subțire vor duce adesea la modificări detectabile în microbiomul fecal evaluat prin ID. Cu toate acestea, la unii pacienți, o creștere a numărului de bacterii din intestinul subțire poate cauza boli. Disbioza intestinului subțire este suspectată atunci când examenul gastrointestinal indică creșterea concentrațiilor serice de folat și scăderea cobalaminei serice, dar trebuie ținut cont de nivelul scăzut de sensibilitate și specificitate al ambilor markeri.
Tratamentul disbiozei
Disbioza este adesea doar o componentă a bolii intestinale, fiind de obicei necesară o terapie multimodală care să gestioneze cauza de fond. În unele cazuri, cum ar fi la animalele cu EPI, suplimentarea cu enzime pancreatice duce la ameliorarea semnelor clinice, iar microbiomul intestinal se normalizează în general după câteva săptămâni [13], însă la câinii cu EC nu există markeri care să indice care este tratamentul optim pentru fiecare pacient individual, fiind adesea necesare încercări terapeutice succesive [16]. Abordările terapeutice ale disbiozei includ modificări nutriționale, administrarea de pre- și probiotice, agenți antimicrobieni și transplantul de microbiotă fecală (TMF), fiecare dintre aceste opțiuni abordând un mecanism diferit (Tabelul 2). Adesea, cel mai bun rezultat este obținut printr-o combinație de tratamente.
Tabelul 2. Opțiuni terapeutice pentru disbioză.
| Tratament | Mecanism probabil | Posibile efecte adverse |
|---|---|---|
| Modificări nutriționale |
|
|
| Prebiotice/ fibre |
|
|
| Probiotice |
|
|
| Antibiotice |
|
|
| Transplant de microbiotă fecală (TMF |
|
|
Modificările nutriționale ar trebui să fie întotdeauna prima opțiune de tratament la pacienții stabili. Studii diferite au arătat că între 50-70% dintre câinii cu EC răspund la hrană [16], cel mai frecvent fiind utilizate formulele cu digestibilitate ridicată și care conțin proteine hidrolizate sau surse noi de proteine. Majoritatea acestor diete sunt hipoalergenice și reduc cantitatea de nutrienți nedigerați din lumenul gastrointestinal, diminuând potențialul de proliferare bacteriană excesivă. În majoritatea cazurilor de enteropatie sensibilă la hrană, modificarea nutrițională este suficientă pentru a obține remiterea semnelor clinice, ducând la o ameliorare treptată a inflamației intestinale și a disbiozei pe parcursul mai multor luni [10],[17].
Probioticele pot fi administrate singure în cazuri ușoare sau în asociere cu modificări nutriționale. Deoarece numărul de bacterii administrate în orice tratament probiotic este mic comparativ cu microbiota intestinală existentă, impactul direct asupra compoziției microbiotei este minor. Totuși, acestea aderă la mucoasă și pot exercita efecte benefice, inclusiv scurtarea duratei diareii acute și diminuarea efectelor secundare digestive asociate administrării de antibiotice, cum ar fi vărsăturile sau diareea [18]. S-a demonstrat că probioticele foarte puternice cu tulpini multiple reduc cantitatea de C. perfringens la câinii cu diaree hemoragică acută [19] și întăresc bariera intestinală la câinii cu EC [20]. Cu toate acestea, deoarece multe produse comerciale nu sunt supuse unor teste adecvate pentru controlul calității, este important să alegeți un produs a cărui eficacitate a fost demonstrată într-un studiu clinic publicat.
Prebioticele sunt carbohidrați nedigerabili care favorizează creșterea microorganismelor benefice. Pot fi clasificate în fibre solubile/insolubile și fibre fermentabile/nefermentabile. Prebioticele fermentabile sunt transformate în SCFA de către bacteriile din colon. Majoritatea dietelor gastrointestinale din comerț conțin prebiotice, dar pentru unele boli (de exemplu, colita), ar putea fi benefice formulele de hrană cu conținut bogat de fibre. Tegumentele de psyllium sunt o sursă de fibre solubile, iar adaosul acestora în hrană într-o cantitate de 0,5-1 g/kg de greutate corporală pe zi poate să îmbunătățească scaunele la animalele cu afecțiuni ale intestinului gros.
Produsul trebuie introdus în doze mai mici, care vor fi crescute treptat pentru a obține consistența dorită a scaunului.Antibioticele, precum tirozina sau metronidazolul, au fost recomandate în mod tradițional pentru tratarea EC, dar utilizarea lor ca tratament de primă intenție este acum dezbătută. [16]. Deși pot duce la ameliorarea simptomelor clinice, probabil ca o consecință a reducerii încărcăturii bacteriene, pacienții recidivează adesea după tratament, odată cu reluarea proliferării excesive a bacteriilor, deoarece antibioticele rezolvă rareori procesul patologic de fond [15],[21],[22]. Opțiunile terapeutice utilizate frecvent includ metronidazol (10-15 mg/kg q12h) și tilozină (25 mg/kg q12h) timp de 4 – 6 săptămâni, însă, așa cum s-a menționat anterior, s-a demonstrat că ambele medicamente induc disbioza intestinului gros, care uneori poate dura luni de zile [8],[9],[11]. Conform unor studii, metronidazolul induce disbioza de lungă durată la câinii cu diaree acută [11], în timp ce combinația de amoxicilină și acid clavulanic poate favoriza creșterea rezistenței E. coli [23]. Antibioticele nu sunt în general recomandate ca tratament de primă intenție în EC din mai multe motive: doar 10 – 16% dintre câinii cu EC răspund la antibiotice, majoritatea cazurilor recidivează după încheierea tratamentului și există efecte negative asupra microbiomului. Cu toate acestea, tratamentul antibiotic ar trebui luat în considerare după abordarea nutrițională și antiinflamatorie eșuează sau la pacienții cu semne de inflamație sistemică [16] și invazie bacteriană persistentă la nivelul mucoasei intestinale (de exemplu, colită granulomatoasă asociată cu E. Coli ). O subcategorie restrânsă de câini cu EC ar putea să nu răspundă la niciun alt tratament, caz în care ar putea fi necesară administrarea pe termen lung, cu reducerea dozei până la cel mai mic nivel eficient.
Transplantul de microbiotă fecală (TMF) poate ajuta la restabilirea microbiotei normale și la ameliorarea semnelor clinice [11] în unele cazuri de disbioză. Această tehnică presupune transfer de fecale de la un donator sănătos în intestinul receptorului prin capsule orale, endoscopie sau clismă (Figurile 5 și 6). La om, rata de succes a TMF este ridicată (>90%) în cazurile de infecție recurentă cu C. difficile infection, dar mai redusă în cazuri de boală inflamatorie intestinală din cauza inflamației cronice de fond.

Credit: Ewan McNeill
Credit: Ewan McNeill
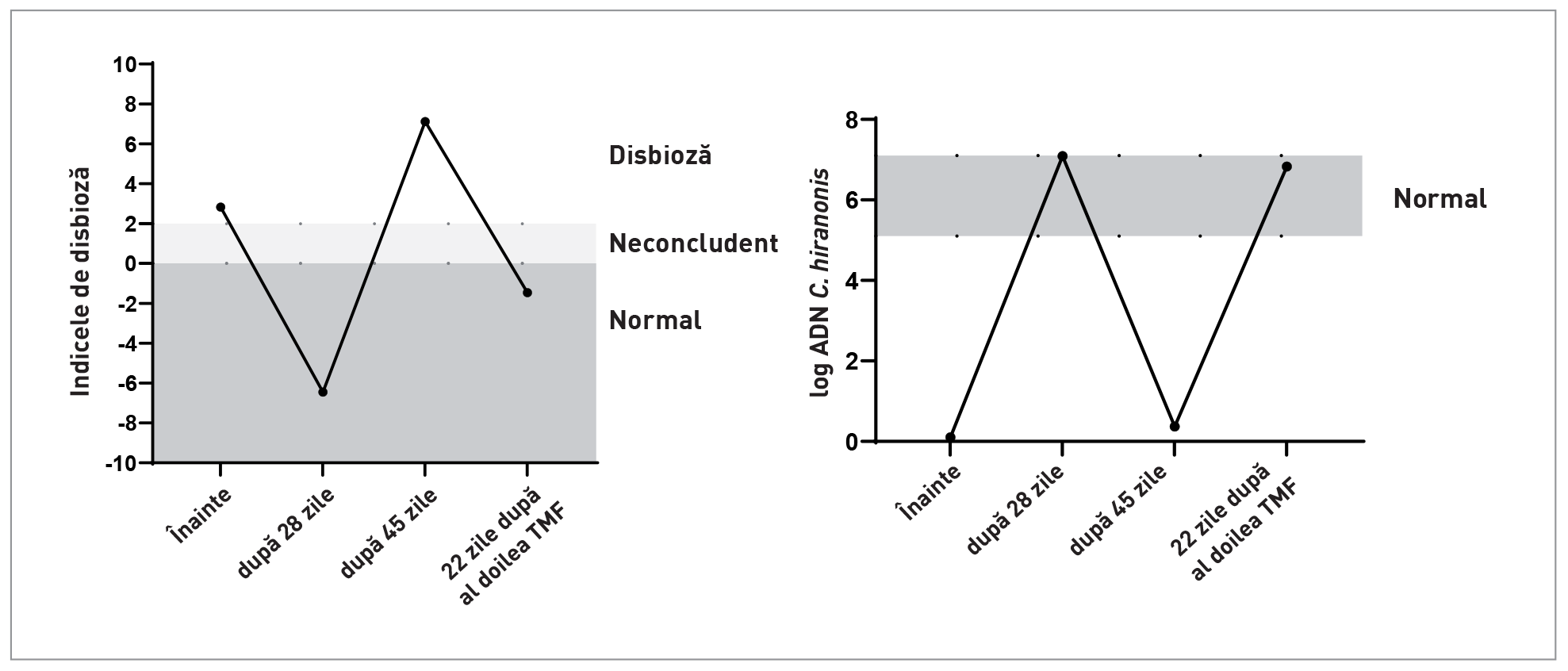
TMF este încă o terapie în curs de dezvoltare la animale. În Caseta 4 este prezentat un protocol simplu, însă până în prezent s-a raportat doar un număr mic de serii de cazuri, iar succesul pare să depindă de afecțiunea de fond [24]. Această tehnică restabilește metabolismul acizilor biliari prin susținerea nivelurilor de C. hiranonis (Figure 7), (Figura 7); prin urmare, ar putea fi utilă la câinii care prezintă anomalii de conversie a acizilor biliari în asociere cu proliferarea excesivă a enteropatogenilor, cum ar fi C. difficile sau C. perfringens și / sau la animalele cu disbioză indusă de antibiotice și leziuni minore de fond la nivelul mucoasei intestinale. De asemenea, s-a demonstrat că TMF îmbunătățește scorul fecal în cazurile de diaree acută și atunci când se utilizează în combinație cu tratamentul antimicrobian standard la cățeii cu parvoviroză și la câinii tineri cu diaree cronică cauzată de o infecție confirmată cu C. difficile [25].
Caseta 4. Protocolul TMF prin clismă (după [24]).
|
| Materiale necesare: soluție NaCl 0,9%, cateter din latex roșu de 12 sau 14 FG, seringi cu vârf de cateter de 60 ml, blender, scaunul donatorului, lubrifiant non-bacteriostatic. |
|
La câinii cu EC, disbioza este adesea un efect secundar al inflamației intestinale și al leziunilor structurale, astfel că disbioza și semnele clinice vor recidiva dacă patologia de fond nu este eliminată. Ca atare, TMF are o rată de succes foarte variabilă în cazul enteropatiilor cronice, iar datele empirice sugerează că mulți câini cu EC vor prezenta scoruri fecale îmbunătățite după 2-3 zile de tratament, dar vor recidiva și vor dezvolta diaree recurentă câteva săptămâni mai târziu. Prin urmare, la acești pacienți se impune un tratament nutrițional și antiinflamator adecvat care să vizeze procesul patologic de fond (a se vedea mai sus), iar TMF se poate lua în considerare ca tratament adjuvant la pacienții cu răspuns suboptimal (de exemplu, persistența scaunelor moi) în pofida terapiilor standard.
Conclusion
Microbiomul intestinal îndeplinește un rol crucial în sănătatea gazdei și multe animale cu afecțiuni gastrointestinale vor dezvolta disbioză, determinând disfuncție microbiană care poate contribui la simptomele clinice. Indicele de disbioză este un instrument util de diagnostic în multe cazuri, însă, având în vedere că pot exista diverse cauze de fond, este necesară o abordare terapeutică multimodală și adesea de lungă durată pentru a îmbunătăți structura microbiotei.
Precizare
Autorul este angajat al Laboratorului Gastrointestinal Texas A&M care oferă în regim comercial teste de evaluare a microbiomului.
Jan Suchodolski
DVM, PhD, DACVM
Statele Unite ale Americii
Dr. Jan Suchodolski este asistent universitar, director de cerecetare, și conducătorul șiințelor pivind microbiomul la Gasrointestinal Laboratory în Texas A&M University. A primit titlul de Dr. med. vet. la University Vienna, Austria iar doctoratul său în medicină veterinară pe tematica microbiologie la Texas A&M University. Este Diplomat al American College of Veterinary Microbiologists (ACVM). Cercetările sale se află în zona dezvoltării biomarkerilor bolilor gastrointestinale și abordările terapeutice pentru modularea microbiotei intestinale. Eset coautor al peste 270 de articole peer-reviewed în domeniul gastroenterologiei veterinare și cercetări privind microbiomul.
Referințe
- Ziese AL, Suchodolski JS. Impact of changes in gastrointestinal microbiota in canine and feline digestive diseases. Vet. Clin. North. Am. Small. Anim. Pract. 2021;51(1):155-169.
- Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. The microbiota-derived metabolite indole decreases mucosal inflammation and injury in a murine model of NSAID enteropathy. Gut. Microbes 2016;7(3):246-261.
- Giaretta PR, Suchodolski JS, Blick AK, et al. Distribution of bile acid receptor TGR5 in the gastrointestinal tract of dogs. Histol. Histopathol. 2019;34(1):69-79.
- Li Q, Larouche-Lebel E, Loughran KA, et al. Gut dysbiosis and its associations with gut microbiota-derived metabolites in dogs with myxomatous mitral valve disease. MSystems. 2021;in press.
- Pavlidis P, Powell N, Vincent RP, et al. Systematic review: bile acids and intestinal inflammation-luminal aggressors or regulators of mucosal defence? Aliment. Pharmacol. Ther. 2015;42(7):802-817.
- Werner M, Suchodolski JS, Lidbury JA, et al. Diagnostic value of fecal cultures in dogs with chronic diarrhea. J. Vet. Intern. Med. 2021;35(1):199-208.
- Al Shawaqfeh MK, Wajid B, Minamoto Y, et al. A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiol. Ecol. 2017;93(11): DOI: 10.1093/femsec/fix136
- Pilla R, Gaschen FP, Barr JW, et al. Effects of metronidazole on the fecal microbiome and metabolome in healthy dogs. J. Vet. Intern. Med. 2020;34(5):1853-1866.
- Manchester AC, Webb CB, Blake AB, et al. Long-term impact of tylosin on fecal microbiota and fecal bile acids of healthy dogs. J. Vet. Intern. Med. 2019;33(6):2605-2617.
- Wang S, Martins R, Sullivan MC, et al. Diet-induced remission in chronic enteropathy is associated with altered microbial community structure and synthesis of secondary bile acids. Microbiome 2019;7(1):126.
- Chaitman J, Ziese AL, Pilla R, et al. Fecal microbial and metabolic profiles in dogs with acute diarrhea receiving either fecal microbiota transplantation or oral metronidazole. Front. Vet. Sci. 2020;7:192.
- Blake AB, Guard BC, Honneffer JB, et al. Altered microbiota, fecal lactate, and fecal bile acids in dogs with gastrointestinal disease. PLOS One 2019;14(10):e0224454.
- Isaiah A, Parambeth JC, Steiner JM, et al. The fecal microbiome of dogs with exocrine pancreatic insufficiency. Anaerobe 2017;45:50-58.
- Giaretta PR, Rech RR, Guard BC, et al. Comparison of intestinal expression of the apical sodium-dependent bile acid transporter between dogs with and without chronic inflammatory enteropathy. J. Vet. Intern. Med. 2018;32(6):1918-1926.
- Giaretta PR, Suchodolski JS, Jergens AE, et al. Bacterial biogeography of the colon in dogs with chronic inflammatory enteropathy. Vet. Pathol. 2020;57(2):258-265.
- Procoli F. Inflammatory bowel disease, food-responsive, antibiotic-responsive diarrhoea, protein losing enteropathy. Advance Small Anim. Care 2020;1:127-141.
- Bresciani F, Minamoto Y, Suchodolski JS, et al. Effect of an extruded animal protein-free diet on fecal microbiota of dogs with food-responsive enteropathy. J. Vet. Intern. Med. 2018;32(6):1903-1910.
- Torres-Henderson C, Suchodolski J, Lappin MR. Effect of Enterococcus faecium strain SF68 on gastrointestinal signs and fecal microbiome in cats administered amoxicillin-clavulanate. Top. Companion Anim. Med. 2017;32(3):104-108.
- Ziese AL, Suchodolski JS, Hartmann K, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLOS One 2018;13(9):e0204691.
- White R, Atherly T, Guard B, et al. Randomized, controlled trial evaluating the effect of multi-strain probiotic on the mucosal microbiota in canine idiopathic inflammatory bowel disease. Gut Microbes 2017;8(5):451-466
- Westermarck E, Skrzypczak T, Harmoinen J, et al. Tylosin-responsive chronic diarrhea in dogs. J. Vet. Intern. Med. 2005;19(2):177-186.
- Westermarck E, Myllys V, Aho M. Effect of treatment on the jejunal and colonic bacterial flora of dogs with exocrine pancreatic insufficiency. Pancreas 1993;8:559-562.
- Werner M, Suchodolski JS, Straubinger RK, et al. Effect of amoxicillin-clavulanic acid on clinical scores, intestinal microbiome, and amoxicillin-resistant Escherichia coli in dogs with uncomplicated acute diarrhea. J. Vet. Intern. Med. 2020;34(3):1166-1176.
- Chaitman J, Gaschen F. Fecal microbiota transplantation in dogs. Vet. Clin. North. Am. Small Anim. Pract. 2021;51(1):219-233.
- Pereira GQ, Gomes LA, Santos IS, et al. Fecal microbiota transplantation in puppies with canine parvovirus infection. J. Vet. Intern. Med. 2018;32(2):707-711.
Alte articolele ale acestui număr
Distribuie pe rețelele sociale