Ascita la pisici
Articol semnat de Erin Anderson
Ascita este un termen utilizat pentru a descrie acumularea de lichid liber în cavitatea peritoneală. În funcție de numărul de celule, de cantitatea de proteine totale, de greutatea specifică și de conținutul celular, lichidul poate fi clasificat ca transudat (pur sau modificat) sau exsudat.
Article
Puncte cheie
Insuficiența cardiacă congestivă, neoplaziile, peritonita infecțioasă felină și bolile hepatice se numără printre cele mai frecvente cauze ale ascitei la pisici.
Abdominocenteza terapeutică poate fi o opțiune benefică pentru ameliorarea disconfortului în multe cazuri de ascită (dar nu în toate). Se recomandă tratament specific pentru cauza primară.
Ascita poate fi clasificată în mai multe tipuri de lichid, cel mai frecvent transudate pure sau modificate sau exsudate. Această clasificare contribuie la restrângerea listei foarte largi de diagnostice diferențiale pentru etiologia primară.
Lichidul ascitic ar trebui recoltat și analizat în vederea clasificării, dar acest lucru permite rareori stabilirea unui diagnostic cert fără o evaluare diagnostică suplimentară completă.
Introducere
Ascita este un termen utilizat pentru a descrie acumularea de lichid liber în cavitatea peritoneală. În funcție de numărul de celule, de cantitatea de proteine totale, de greutatea specifică și de conținutul celular, lichidul poate fi clasificat ca transudat (pur sau modificat) sau exsudat (Tabelul 1). Această clasificare poate fi utilă pentru identificarea etiologiei ascitei și ghidarea tratamentului adecvat. Efuziunile chiloase sau pseudochiloase, hemoragice, biliare, neoplazice și uro-abdomenul sunt exsudate specifice pe care mulți medici preferă să le diferențieze de ascita propriu-zisă [1].

Examenul fizic poate determina o varietate de alte constatări care contribuie la ghidarea suspiciunii medicului către etiologia primară. O atenție deosebită trebuie acordată prezenței potențiale a icterului (colorația gălbuie a sclerelor, mucoaselor sau tegumentelor), care indică hepatopatie sau coagulopatie. Edemul subcutanat poate însemna hipoproteinemie. Limfadenopatia periferică poate indica un limfom sau agenți infecțioși. Dovezile de boală cardiacă pot include un murmur cardiac auscultabil, aritmie sau zgomot de galop, deși este important de reținut că lipsa unor astfel de constatări nu exclude boala cardiacă. Distensia și / sau pulsația venei jugulare (Figura 2) sugerează creșterea presiunii venoase centrale secundară unei ICC drepte. Pierderea zgomotelor respiratorii auscultabile în unele sau în toate câmpurile pulmonare ar sugera o efuziune pleurală concomitentă, care poate apărea în cazul neoplaziei, hipoproteinemiei, ICC sau limfomului. Hepatomegalia palpabilă poate apărea secundar insuficienței cardiace congestive drepte sau cu patologie hepatică primară (colangiohepatită sau boală infiltrativă / neoplazică).
Teste diagnostice
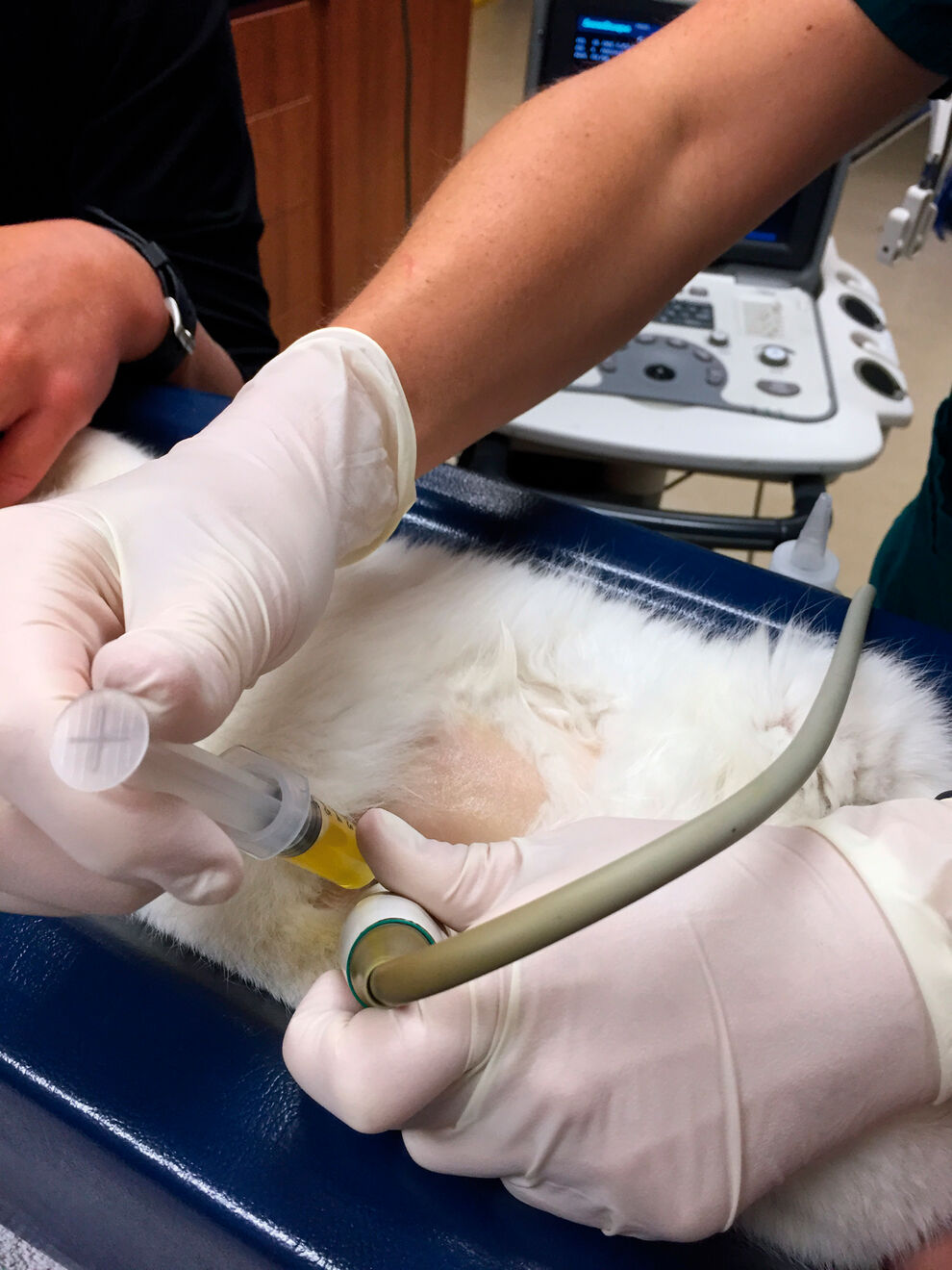
Investigațiile diagnostice nu trebuie să se limiteze la analiza lichidului peritoneal și la citologie, dar adesea acestea sunt testele care dau cele mai bune rezultate pentru a restrânge lista diagnosticelor diferențiale, fiind adesea prima investigație diagnostică efectuată. O probă de lichid peritoneal poate fi obținută prin abdominocenteză. Această procedură trebuie efectuată cât mai aseptic posibil. Pisicile pot fi imobilizate în decubit lateral, sternal sau dorsal, în funcție de poziția care limitează cel mai bine mișcarea pacientului și permite recoltarea netraumatică a unei probe de lichid. Părul trebuie îndepărtat pe o suprafață mică în jurul unei locații ventrale (adesea chiar ventral față de linia mediană pentru o pisică în decubit lateral). În mod ideal, se utilizează ghidarea ecografică pentru a identifica un buzunar de lichid anecoid În absența ultrasunetelor, se recomandă imobilizarea pisicii în decubit lateral și să se acceseze zona la aproximativ 2,5 cm ventral și caudal față de ombilic. Pielea se freacă ușor cu un agent de curățare pe bază de clorhexidină sau cu un agent de curățare similar și se șterge cu alcool izopropilic. Cu sau fără ghidare ecografică, se introduce un ac de 22 – 25 G, un cateter tip fluture sau un cateter over-the-needle (OTN) direct prin peretele abdominal în cavitatea peritoneală și se exercită o mișcare ușoară de aspirație la seringa atașată (Figura 3). O probă sterilă trebuie păstrată atât în eprubetele EDTA, cât și în eprubete simple pentru analiza de laborator. În mod ideal, abdominocenteza terapeutică (prelevarea unui volum mare de lichid ascitic) nu este efectuată până când nu s-a identificat etiologia, deoarece această intervenție poate fi contraproductivă în unele cazuri. Excepție fac pisicile cu tahipnee marcată sau alt disconfort, cazuri în care abdominocenteza poate îmbunătăți confortul și stabilitatea pacientului.

Analiza lichidelor și citologia
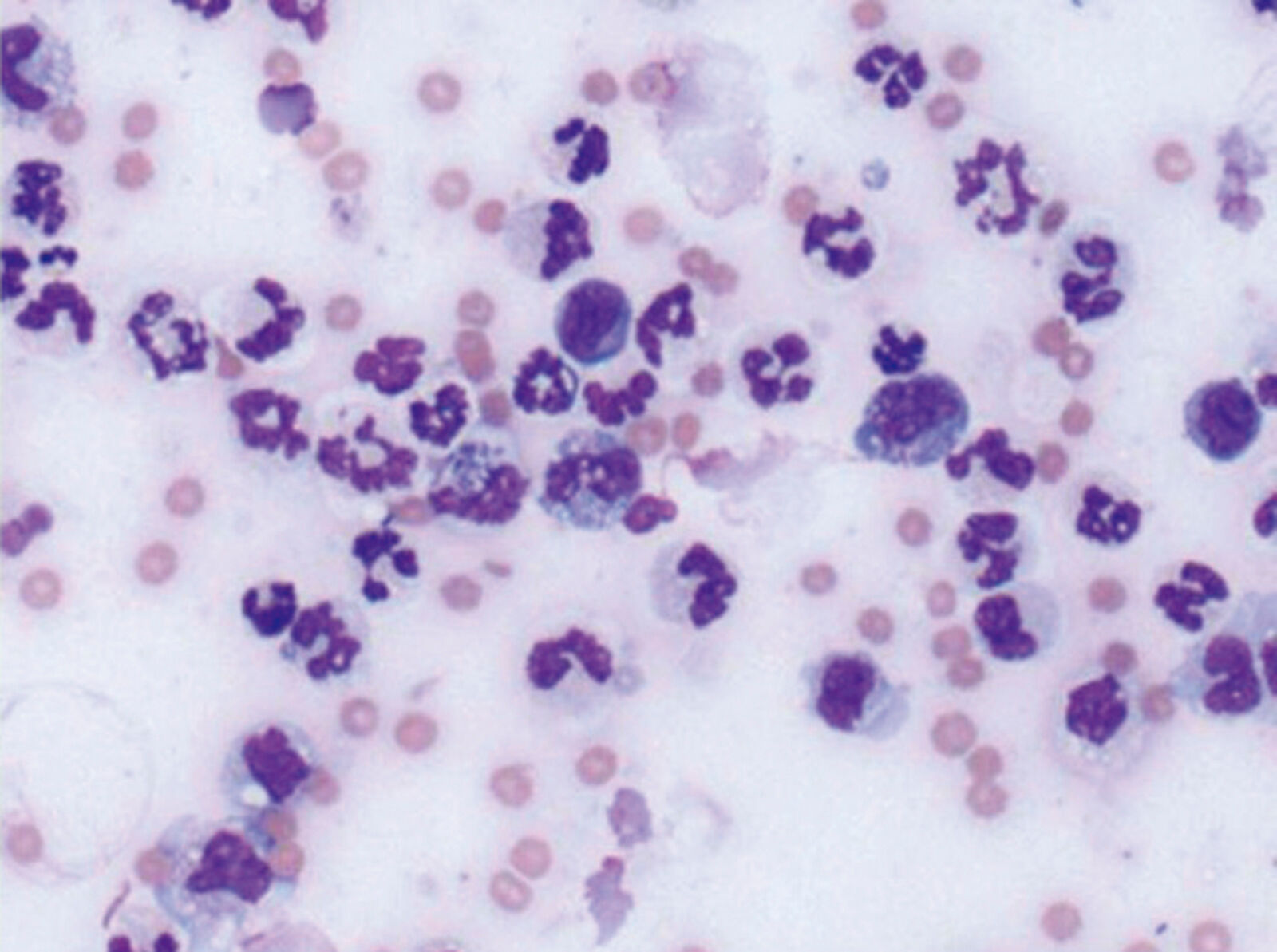
Proba de diagnostic se va analiza pentru a determina numărul total de celule și de celule nucleate, proteinele totale, greutatea specifică și se va efectua evaluarea microscopică a componentelor celulare (Figura 4). După cum se arată în Tabelul 1, clasificarea lichidului ascitic ca transudat pur sau modificat, ca exsudat sau ca unul dintre lichidele exsudative aseptice poate fi extrem de utilă în determinarea cauzei ascitei.
Transudatele pure apar cel mai frecvent în contextul hipoproteinemiei (secundară insuficienței hepatice, colangiohepatitei cronice, colangitei limfocitare, bolii renale) sau al creșterii presiunii hidrostatice (ICC dreapta) [4]. Numărul de celule și proteine totale poate fi însă comparabil cu cel al transudatelor modificate, deoarece ascita cronică poate inflama mucoasa mezotelială a peritoneului, crescând astfel numărul de celule [2]. Se creează astfel o „suprapunere” a cauzelor care generează transudate pure și modificate, motiv pentru care sunt utile investigațiile diagnostice suplimentare (descrise mai jos).
Transudatele modificate sunt cel mai des întâlnit tip de ascită la pisici, iar cauzele cele mai frecvente includ insuficiența cardiacă congestivă, neoplazia și hepatopatia [4]. În ceea ce privește hepatopatiile, colangiohepatita limfocitară are o probabilitate mai mare de a produce un transudat pur, în timp ce hipertensiunea portală și ciroza vor produce mai probabil transudate modificate, deoarece ultimele două cresc presiunea hidrostatică [2].
Fluidele exudative pot fi septice sau aseptice, iar un rezultat pozitiv al culturii bacteriene reprezintă testul de diagnostic definitiv pentru confirmarea unui exsudat septic. Astfel de cazuri impun inițierea promptă a tratamentului, însă, deoarece finalizarea culturii poate dura câteva zile, lichidul trebuie examinat citologic intern imediat după prelevare. Din punct de vedere citologic, exsudatele septice se caracterizează prin neutrofile modificate și bacterii intracelulare, putând fi prezent și material străin. Aceste efuziuni pot apărea ca urmare a PIF, a unui traumatism, a unei rupturi a viscerelor gastrointestinale sau în asociere cu alte cauze de peritonită. Exsudatele neseptice, în schimb, prezintă un număr mai mare de celule decât transudatele pure sau modificate, dar sunt lipsite de neutrofilele degenerate sau bacteriile care se întâlnesc la exsudatul septic. Cauzele exsudatelor aseptice includ PIF, colangita, pancreatita, ruptura tractului biliar sau urinar sau neoplazia. Efuziunea secundară unei rupturi biliare include adesea cristale biliare vizibile.
Mulți medici sunt tentați să pună diagnosticul de efuziune chiloasă dacă lichidul ascitic are aspect lăptos, opac, însă clasificarea reală a efuziunilor chiloase depinde de compararea nivelurilor de trigliceride și colesterol din lichid cu concentrațiile serice concomitente. În cazul efuziunilor chiloase limfatice, concentrația de trigliceride din efuziune este mai mare, iar concentrația de colesterol este mai mică decât concentrațiile serice. Efuziunile chiloase conțin în principal limfocite mici, mature. Unii medici recunosc și categoria efuziunilor pseudochiloase/ pseudolimfatice care au un aspect macroscopic similar, dar concentrații mai mari de colesterol și mai mici de trigliceride în comparație cu serul [1]. Efuziunea chiloasă poate fi cauzată de limfom, limfangectazie, insuficiență cardiacă congestivă sau ciroză; totodată, poate fi și de natură idiopatică.
Efuziunea hemoragică poate apărea la pisici secundar unui traumatism, coagulopatiei, rupturii unui vas sau a unei mase sau secundar unei intervenții chirurgicale recente. Spre deosebire de câini, pisicile sunt mai vulnerabile la rupturi de masă care implică ficatul, mai degrabă decât splina [5] . Lichidul aspirat în timpul abdominocentezei în aceste cazuri are un aspect similar sângelui proaspăt, iar valorile heamtocritului și ale concentrației totale de solide ar trebui să corespundă îndeaproape celor din sângele periferic.
Acumularea de urină în abdomen poate avea ca rezultat formarea unui transudat pur sau modificat sau a unui exsudat, cu o creștere a numărului de celule în cazurile care induc inflamație. Pentru o identificare certă a uroabdomenului, efuziunea trebuie să aibă o concentrație de creatinină de două ori mai mare decât cea din sângele periferic [6].În cazul în care concentrația de creatinină din revărsat este de 1 până la 2 ori mai mare decât cea din sângele periferic, acest lucru indică uroabdemon (dar nu cu certitudine). O concentrație de potasiu în revărsat mai mare decât nivelul de potasiu din sângele periferic indică de asemenea uroabdomen, dar nu în mod cert [6].
Alte investigații
Pe lângă analiza și citologia lichidului abdominal, următoarele teste diagnostice pot juca un rol important în evaluarea și tratamentul pisicilor cu ascită.
Hemoleucograma completă: Trebuie determinat numărul de celule sanguine (inclusiv numărul de reticulocite, dacă este cazul) pentru a determina dacă este prezentă o hemoragie acută sau anemie asociată cu o boală cronică. Neutrofilia sau o leucogramă de stres (neutrofilie matură, limfopenie, cu sau fără anomalii monocitare) poate ridica suspiciunea unei boli infecțioase sau inflamatorii, în special PIF. Examinarea unui frotiu de sânge poate ajuta de asemenea la identificarea neutrofilelor în bandă, a unei anomalii toxice sau a unei deplasări la stânga care ar putea indica o reacție inflamatorie acută sau rezistentă.
Biochimie serică: Nivelurile totale de proteine serice trebuie evaluate cu atenție. O creștere a proteinelor totale (în special hiperglobulinemia) poate indica un agent infecțios, cum ar fi PIF, în timp ce scăderea proteinelor totale poate să rezulte dintr-o insuficiență hepatică, enteropatie cu pierdere de proteine, nefropatie proteinurică sau neoplazie. Ipoteza unei hepatopatii poate fi susținută și de creșterea enzimelor hepatice (AST, ALT, gamma-GT), caz în care este necesară o evaluare a timpilor de coagulare deoarece proteinele coagulante sunt produse în ficat și pot sau nu să contribuie la ascită. Azotemia și / sau hiperkaliemia pot ridica suspiciunea de boală renală sau uroabdomen.
Examen de urină: Analiza urinei poate evidenția niveluri crescute de proteine, ceea ce ar indica o nefropatie cu pierdere de proteine ca o cauză a hipoproteinemiei. Proteinele din urină trebuie cuantificate utilizând un raport proteină/creatinină în urină, cu condiția ca rezultatele uroculturii să fie negative.
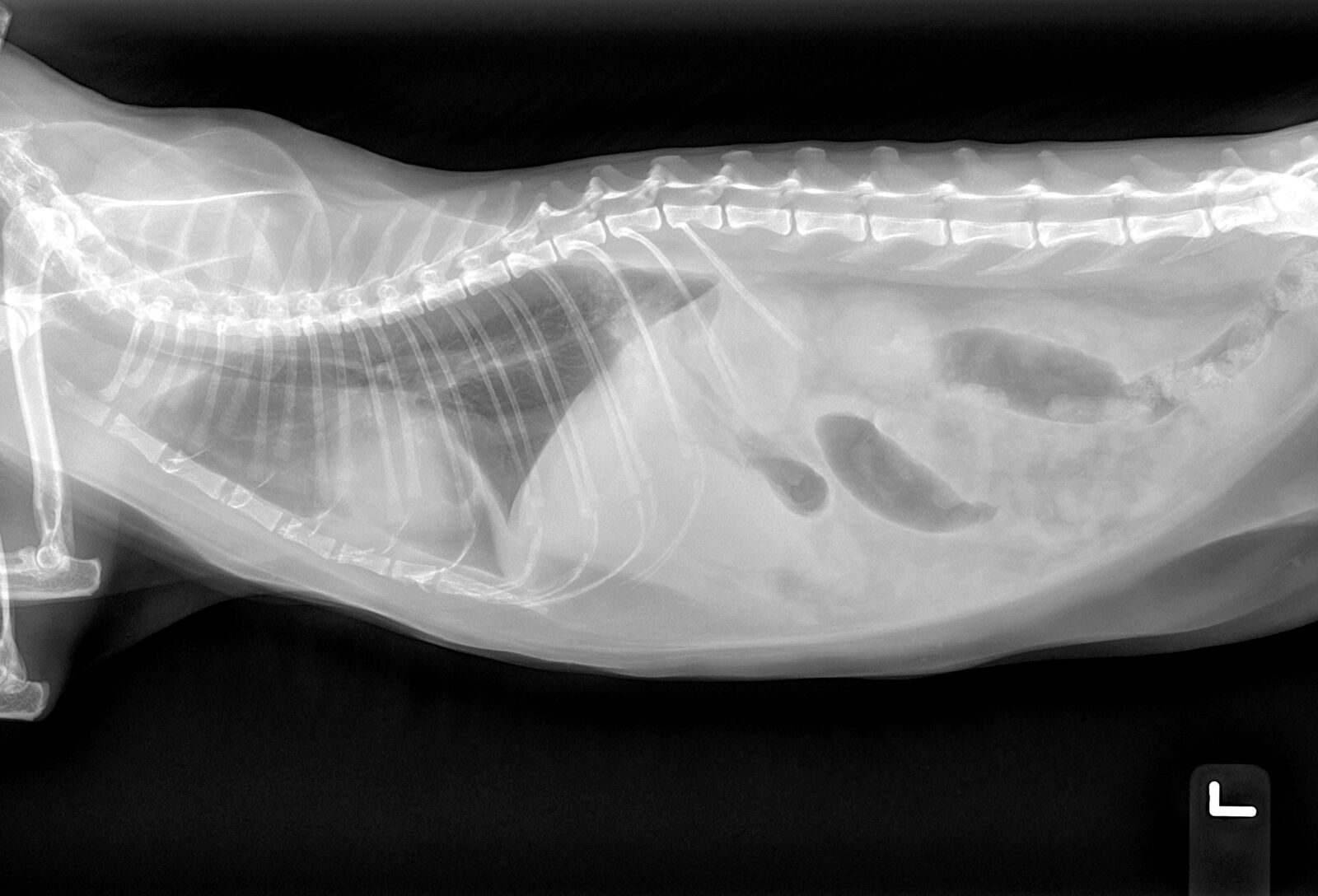
Imagistica abdominală: Pe baza rezultatelor analizelor de sânge inițiale, imagistica abdominală poate furniza informații specifice suplimentare privind etiologia. Radiografiile nu se remarcă prin sensibilitate sau specificitate în ceea ce privește identificarea prezenței, volumului sau cauzei ascitei (deoarece volumele mici pot să nu fie decelabile), însă volumele mari se manifestă de obicei prin pierderea nespecifică și macroscopică a detaliilor seroase (Figura 5). Radiografiile pot evidenția hepatomegalia (care se poate produce în cazul ICC dreaptă sau al hepatopatiei primare), în timp ce ficatul cirotic va avea un aspect micșorat. Așa numitul aspect de „sticlă șlefuită” al viscerelor abdominale poate indica peritonită. Investigațiile radiografice avansate cu substanță de contrast ar putea fi utile pentru evaluarea integrității vezicii urinare, a uretrei sau a vaselor limfatice.
Investigațiile imagistice abdominale mai specifice sunt realizate prin ecografie, care este mai utilă decât radiografia. Ultrasunetele pot identifica cu certitudine acumularea de lichid (care apare adesea ca un lichid anecoic sau, odată cu creșterea celularității lichidului, ca un ca un lichid parțial „pătat”), permit estimarea subiectivă a severității / volumului ascitei și ajută la evaluarea potențialelor etiologii. Hepatopatia primară poate fi reflectată de dimensiunea sau ecotextura anormală a ficatului sau de prezența unei mase hepatice sau a unei obstrucții biliare. Dilatarea venelor hepatice sugerează puternic o creștere a presiunii venoase centrale, care se produce secundar unei ICC drepte. Ganglionii limfatici intraabdominali pot fi observați și măsurați pentru a identifica dovezi de limfom sau obstrucție limfatică. Integritatea tractului urinar poate fi evaluată și, mai precis, se poate examina aspectul rinichilor pentru a constata eventualele modificări ale ecotexturii care ar putea indica o proteinurie care generează glomerulopatie.
Ecocardiografie: Ecocardiografia se efectuează atunci când tabloul clinic și diagnosticul sugerează că ascita ar fi cauzată de ICC pe partea dreaptă sau, mai rar, de revărsat pericardic. La pisici, cele mai frecvente boli care afectează partea dreaptă a inimii și care duc la insuficiență cardiacă congestivă includ cardiomiopatia restrictivă, displazia valvei tricuspide sau cardiomiopatia aritmogenă de ventricul drept (Figura 6). Revărsatul pericardic care cauzează tamponadă cardiacă este foarte rar la pisici. Cardiomiopatia hipertrofică este mai probabil să afecteze partea stângă a inimii, iar prevalența cândva ridicată a cardiomiopatiei dilatative a scăzut drastic de când hrana pentru pisici din comerț este suplimentată cu taurină.
În prezent, aceste două forme de cardiomiopatie cauzează rareori ascită la pisici.
Investigații diagnostice suplimentare: PIF este un diagnostic diferențial important al ascitei la pisici, dar poate fi o provocare reală de diagnostic pentru medicul veterinar. Diagnosticul definitiv se bazează pe detectarea prin imunofluorescență sau colorare imunohistochimică a ARN-ului viral sau a proteinelor din macrofagele prezente în țesutul sau lichidul bolnav.
O combinație frecventă de rezultate de laborator care sugerează o probabilitate ridicată de PIF include leucocitoză (neutrofilie și limfopenie), hiperproteinemie serică cu concentrații relativ ridicate de globulină și scăzute de albumină, hiperbilirubinemie și hiperbilirubinurie și, uneori, anemie neregenerativă [7][8]. Lichidul peritoneal recoltat de la pisicile cu forma „umedă” sau efuzivă a PIF are un conținut total de proteine ridicat, caracteristic pentru un exsudat (mai mare de 3,5 g/dl), iar globulinele pot să reprezintă mai mult de 50 % din aceste proteine [9].
Titrările anticorpilor serici pentru coronavirusul felin cauzal, un agent patogen comun și omniprezent în rândul pisicilor, au o sensibilitate ridicată dar o specificitate scăzută, deoarece doar aproximativ 10 % dintre pisicile expuse la virus dezvoltă PIF cu exprimare clinică [10]. Mai mult, un rezultat negativ al testului de anticorpi nu exclude PIF.
S-a raportat că testul Rivalta are o sensibilitate de 91 %, o specificitate de 66 %, o valoare predictivă pozitivă de 58 % și o valoare predictivă negativă de 93 % pentru diagnosticul de PIF [11]. Această metodă constă în adăugarea unei picături de lichid ascitic la o soluție de acid acetic și evaluarea amestecului pentru a detecta un material alb cu aspect pufos (care apare ca urmare a concentrațiilor ridicate de proteine și mediatori inflamatori).
Dacă este disponibil, un test convențional de reacție în lanț a polimerazei (PCR) poate identifica virusul în sânge, dar nu face diferența între pisicile expuse și cele care suferă de PIF. A fost dezvoltat un nou test bazat pe tehnica PCR pentru detectarea virusului mutant însă valoarea sa clinică încă nu a fost pe deplin clarificată, deși rezultatele preliminare sunt promițătoare [12].
Tratament
Tratamentul ascitei la pisici depinde în totalitate de cauza identificată. În general, abdominocenteza terapeutică poate fi utilă dacă îmbunătățește confortul pacientului. La fel ca în cazul recoltării probelor diagnostice, pisicile care necesită această procedură trebuie imobilizate în decubit lateral, sternal sau dorsal, iar locul puncției abdominale trebuie pregătit aseptic. Se poate utiliza un cateter tip fluture de 22-25 G sau un cateter OTN pentru a intra în abdomen percutanat, aplicându-se o aspirație lentă și atentă într-o seringă atașată pentru a extrage lichidul. Autoarea preferă un cateter OTN (eventual atașat la două seturi de extensie conectate prin intermediul unui robinet cu 3 căi) pentru a elibera un volum mare de ascită. În acest fel, stiletul poate fi îndepărtat, lăsând în același timp cateterul fixat în poziție, evitându-se astfel plasarea unui ac ascuțit în cavitatea abdominală pentru o perioadă prelungită de timp.
La pacienții cu insuficiență cardiacă dreaptă, este important de reținut că diureticele nu vor mobiliza sau evacua rapid ascita, prin urmare trebuie gestionat mai întâi disconfortul acut prin efectuarea abdominocentezei terapeutice. Este necesară inițierea terapiei cu diuretice (furosemid 0,5-2 mg/kg p.o. la 12 ore) și a terapiei cu inhibitori ECA (enalapril sau benazepril 0,25–0,5 mg/kg p.o. la 12 – 24 ore) pentru managementul cronic, cu scopul de a preveni sau de a reduce acumularea recurentă a lichidului. În mod ideal, electroliții serici și valorile renale, precum și tensiunea arterială sistemică, ar trebui evaluate înainte și după inițierea acestor terapii.
Erin Anderson
VMD, MSc, Dip. ACVIM (cardiology)
Statele Unite ale Americii
Dr. Anderson a absolvit studiile de medicină veterinară la Universitatea din Pennsylvania, apoi a efectuat un stagiu medical interdisciplinar la Pittsburgh Veterinary Specialty and Emergency Center din Pittsburgh, Pennsylvania. În anul 2013 și-a finalizat atât rezidențiatul în cardiologie, cât și masteratul la Atlantic Veterinary College din Prince Edward Island, Canada, iar în prezent se ocupă de cardiologia animalelor mici în cadrul unui cabinet privat din Pennsylvania.
Referințe
- Hartmann K. Feline Infectious Peritonitis. In: Ct E (ed). Clinical Veterinary Advisor Dogs and Cats. 3rd ed. St. Louis: Elsevier, 2015;348-350.
- Stafford JR, Bartges JW. A clinical review of pathophysiology, diagnosis, and treatment of uroabdomen in the dog and cat. J Vet Emerg Crit Care 2013;23:216-229.
- Wright KN, Gompf RE, DeNovo RC. Peritoneal effusion in cats: 65 cases (1981-1997). J Am Vet Med Assoc 1999;214:375-381.
- Addie D, Belk S, Boucraut-Baralon C, et al. Clinical review: feline infectious peritonitis. ABC guidelines of prevention and management. J Feline Med Surg 2009;11:594-604.
- Pedersen NC, Allen CE, Lyons LA, et al. Pathogenesis of feline enteric coronavirus infection. J Feline Med Surg 2008;10:529-541.
- Sparkes AH, Gruffydd-Jones TJ, Harbour DA. Feline infectious peritonitis: a review of clinicopathological changes in 65 cases, and a critical assessment of their diagnostic value. Vet Rec 1991;129:209-212.
- Dreschler Y, Alcaraz A, Bossong FJ, et al. Feline coronavirus in multicat environments. Vet Clin North Am Small Anim 2011;41:1133-1169.
- Collette SA, Allstadt SD, Chon EM, et al. Treatment of feline intermediate- to high-grade lymphoma with a modified University of Wisconsin-Madison protocol: 119 cases (2004-2012). Vet Comp Oncol 2015; Jun 25. doi:10.1111/vco.12158. (Epub ahead of print; accessed 29th Jan 2016).
- Chambers G. Abdominal distention, ascites, and peritonitis. In: Ettinger SJ, Feldman ED (eds). Textbook of Veterinary Internal Medicine. 7th ed. St. Louis: Elsevier, 2010;144-148.
- Fischer Y, Sauter-Louis C, Hartmann K. Diagnostic accuracy of the Rivalta test for feline infectious peritonitis. Vet Clin Path 2012;41:558-567.
- Mandell DC, Drobatz K. Feline hemoperitoneum 16 cases (1986-1993). J Vet Emerg Crit Care 1995;5:93-97.
- Pedersen NC. An update on feline infectious peritonitis: Diagnostics and Therapeutics. Vet J 2014;201:133-141.
- Tasker S, Gunn-Moore D. Differential diagnosis of ascites in cats. In Pract 2000;22:472-479.
Distribuie pe rețelele sociale