ปฏิกิริยาไม่พึงประสงค์จากอาหารที่ผิวหนัง
เขียนโดย Marconi Rodrigues de Farias, Vanessa Cunningham Gmyterco
ปฏิกิริยาไม่พึงประสงค์จากอาหารที่ผิวหนังที่เกิดขึ้นในสุนัขยังคงไม่เป็นที่เข้าใจอย่างสมบูรณ์ บทความนี้จะทบทวนสิ่งที่สัตวแพทย์ควรรู้เกี่ยวกับภาวะดังกล่าวและวิธีการที่อาจเชื่อมโยงกับโรคผิวหนังอักเสบจากภูมิแพ้ (atopic dermatitis)
Article
ประเด็นสำคัญ
โรคผิวหนังอักเสบจากภูมิแพ้ในสุนัข (canine atopic dermatitis) เป็นกลุ่มของอาการโรคที่เกิดจากหลายปัจจัยหลายประการ (multifactorial clinical syndrome) โดยเชื่อกันว่าเป็นผลมาจากการรวมกันของปัจจัยหลายปัจจัยที่มีความซับซ้อน
ความชุกของโรคผิวหนังอักเสบจากภูมิแพ้ที่เกิดจากอาหาร (food-induced atopic dermatitis) นั้นมีรายงานสูงถึงร้อยละ 9-50 ของสุนัขที่ป่วยเป็นโรคผิวหนังอักเสบจากภูมิแพ้ทั้งหมด
ปฏิกิริยาไม่พึงประสงค์จากอาหาร (adverse food reactions) ในสุนัขส่วนใหญ่นั้นมักเกี่ยวข้องกับสารก่อภูมิแพ้ที่มีโปรตีนเป็นส่วนประกอบ (protein-based allergens) ซึ่งพบได้ในเนื้อวัว ผลิตภัณฑ์ที่ทำจากนมและข้าวสาลี แต่ก็อาจเกิดจากแหล่งอื่นก็ได้
การตอบสนองของการอักเสบ (inflammatory responses) ทั้งประเภทที่ 1 และประเภทที่ 2 สามารถเกิดขึ้นได้ในสุนัขที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้อาหาร (food-induced atopic dermatitis)
บทนำ
โรคผิวหนังอักเสบจากภูมิแพ้หรือ Atopic dermatitis (AD) เป็นโรคผิวหนังอักเสบ เรื้อรังที่ก่อให้เกิดอาการคันซึ่งมักส่งผลต่อสุนัขสายพันธุ์ที่มีความเสี่ยง (genetically predisposed dogs) ความก้าวหน้าในการทำความเข้าใจสาเหตุของโรคนี้บ่งชี้ว่าโรคนี้เป็นกลุ่มอาการทางคลินิกที่เกิดจากปัจจัยที่ซับซ้อนหลายอย่างรวมกัน เช่น ความผิดปกติแต่กำเนิด (abnormalities) ความผิดปกติของระบบภูมิคุ้มกัน (immune response dysfunctions) ภาวะตอบสนองเกินของระบบประสาท (neurogenic hyperreactivity) ซึ่งจะนำไปสู่การติดเชื้อซ้ำ (recurrent infections) และภาวะภูมิไวเกิน (hypersensitivity) ต่อสารก่อภูมิแพ้ในสิ่งแวดล้อม อาหารและ/หรือจุลชีพต่างๆ (microorganisms) [1] มีรายงานพบว่าสุนัขที่เป็น AD การแพ้สารก่อภูมิแพ้ในสิ่งแวดล้อมนั้นจะพบได้มากกว่าสารก่อภูมิแพ้ในอาหารและอาจเกิดการแพ้ได้มากถึงร้อยละ 50 ของสัตว์ป่วยที่เป็น AD [2] ทั้งนี้สัตวแพทย์ควรพิจารณาให้การรักษาเมื่อพบว่าสัตว์มีอาการคันเรื้อรัง ไม่ว่าจะมีอาการทางระบบทางเดินอาหารร่วมด้วยหรือไม่ก็ตาม กรณีดังกล่าวมักเกิดขึ้นในสุนัขอายุน้อยและมักจะรักษาหรือควบคุมอาการได้ยาก [3] นอกจากนี้ยังอาจเกี่ยวข้องกับปฏิกิริยาที่เป็นผลจากการกระตุ้นระบบภูมิของร่างกายผ่าน IgE (IgE-dependent reactions) หรือปฏิกิริยาการอักเสบที่อาศัยเซลล์ (cell-mediated inflammatory reactions) ต่อสารก่อภูมิแพ้ในอาหารหรือส่วนประกอบในอาหาร [4] บทความนี้จะกล่าวถึงสารก่อภูมิแพ้ในอาหารหลักและทบทวนกลไกทางภูมิคุ้มกัน (immunological mechanisms) และลักษณะทางคลินิกของสุนัขที่มีอาการคันเรื้อรัง (chronic pruritus) จากโรคผิวหนังอักเสบจากภูมิแพ้ที่เกิดจากอาหาร (food-induced atopic dermatitis (FIAD))
สารก่อภูมิแพ้ในอาหาร
คือโมเลกุลที่เมื่อรับประทานเข้าไปอาจจะกระตุ้นให้เกิดปฏิกิริยาไวเกินหรือ hypersensitivity reactions ได้ ทั้งนี้โปรตีนนั้นดูเหมือนจะเป็นสารก่อภูมิแพ้ในอาหารหลัก แต่คาร์โบไฮเดรตและไขมันก็อาจเป็นสารก่อภูมิแพ้ในอาหารได้เช่นกันโดยเฉพาะอย่างยิ่งเมื่อจับกับโปรตีน (conjugated to proteins) (ไลโปโปรตีน (lipoproteins) หรือ ไกลโคโปรตีน (glycoproteins)) [5] ปกติแล้วขนาดสูงสุด (maximum size) ของสารก่อภูมิแพ้จะเกี่ยวข้องกับความสามารถในการดูดซึมโปรตีนของเยื่อบุลำไส้ (enteric mucosa) ในมนุษย์สารก่อภูมิแพ้ในอาหารเกือบทั้งหมดจะเป็นไกลโคโปรตีนที่ทนต่อความร้อนได้ดี (heat-stable) ละลายน้ำได้ (water-soluble) และทนต่อการย่อยของเอนไซม์โปรตีเอส (digestive proteases) โดยจะมีน้ำหนักโมเลกุล (molecular weight (MW)) 10-70 กิโลดัลตัน (kDa) [6].
มีรายงานพบว่าร้อยละ 78 ของสุนัขที่มีปฏิกิริยาไม่พึงประสงค์จากอาหาร (AFRs) จะเกี่ยวข้องกับสารก่อภูมิแพ้ที่พบในเนื้อวัว ผลิตภัณฑ์นมและข้าวสาลี แต่ปฏิกิริยาต่อเนื้อไก่ เนื้อหมูและถั่วเหลืองก็พบได้ทั่วไปเช่นกัน [4] นอกจากนี้ยังมีการศึกษาวิจัยที่แสดงให้เห็นว่าสุนัขที่มีปฏิกิริยาไม่พึงประสงค์จากอาหารจะตอบสนองต่อ IgG ฟอสโฟกลูโคมิวเตส (phosphoglucomutase) และอัลบูมินในซีรั่ม (serum albumin) จากเนื้อวัวเป็นหลัก ถึงแม้ว่าปฏิกิริยาข้ามกัน (cross-reactions) อาจเกิดขึ้นได้เนื่องจากความคล้ายคลึงกันระหว่างสารภูมิต้านทาน (immunoglobulins) ของแกะและวัวก็ตาม [5],[7]. นมวัวมีส่วนประกอบของโปรตีนประมาณ 20 ชนิด โดยที่เบต้า-แลคโตโกลบูลิน (β-lactoglobulin) เคซีน (casein) แลคตัลบูมิน (lactalbumin) และอัลบูมินในซีรั่มนั้นดูเหมือนจะก่อให้เกิดอาการแพ้มากที่สุดในสุนัข [8],[9] สารก่อภูมิแพ้หลักที่พบได้ในเนื้อไก่ ได้แก่ อัลบูมินในซีรั่มร่วมกับไพรูเวตไคเนส M1/M2 (pyruvate kinase M1/M2) อีโนเลส (enolase) 3. ครีเอทีนไคเนสชนิด M (creatine kinase type M) อัลโลเดส (aldolase) กลีเซอราลดีไฮด์ 3 ฟอสเฟตดีไฮโดรจีเนส (glyceraldehyde-3-phosphate dehydrogenase) แลคเตตดีไฮโดรจีเนส (lactate dehydrogenase) และไตรโอสฟอสเฟตไอโซเมอเรส 1 (triose phosphate isomerase 1) [10],[11]
ในไข่ โปรตีนหลัก (prominent proteins) ได้แก่ โอโวมิวคอยด์ (ovomucoid) โอวัลบูมิน (ovalbumin) ร่วมกับโอโวทรานสเฟอร์ริน (ovotransferrin) โอโวมิวซิน (ovomucin) ไลโซไซม์ (lysozyme) อัลบูมิน (albumin) (จากไข่ขาว) และไลโปวิเทลลิน (lipovitellin) (ไลโปโปรตีนความหนาแน่นต่ำจากไข่แดง) [5]
อัลบูมินในซีรั่ม (serum albumin) อาจเกี่ยวข้องกับปฏิกิริยาไม่พึงประสงค์จากอาหารต่อเนื้อหมู รวมถึงอัลฟา-แกล (alpha-gal) ซึ่งเป็นโอลิโกแซ็กคาไรด์ (oligosaccharide) ที่แสดงออกในไกลโคโปรตีนในมนุษย์ แต่อย่างไรก็ตามเนื่องจากร่างกายของสุนัขนั้นผลิตอัลฟา-แกลได้ ดังนั้นจึงไม่เกิดภาวะไวเกินต่อแอนติเจน (antigen) นี้ในสัตว์สปีชีส์นี้ [12] ในบรรดาสารก่อภูมิแพ้จากปลา (fish allergens) ที่กระตุ้นปฏิกิริยาไม่พึงประสงค์จากอาหารในสุนัขนั้น พบว่าอีโนเลสและอัลโดเลสเป็นสารก่อภูมิแพ้ที่สำคัญที่สุด [10] และปฏิกิริยาข้ามกันระหว่างโปรตีนอีโนเลสและอัลโดเลสจากปลากับไก่นั้นสามารถพบได้ การประเมินทางเซรุ่มวิทยา (serological evaluations) ในสุนัขยังช่วยระบุถึงปฏิกิริยาข้ามกันระหว่างสารต่างๆ (ไพรูเวตไคเนส ครีเอทีนไคเนส อัลฟาแอกติน (alpha-actin) ดีไฮโดรจีเนส (dehydrogenase) บีต้า-อีโนเลส (beta-enolase) มาเลตดีไฮโดรจีเนส (malate dehydrogenase) แลคเตตดีไฮโดรจีเนส ไตรโอสฟอสเฟตไอโซเมอเรสและกลีเซอราลดีไฮด์ 3 ฟอสเฟต) ที่มีอยู่ในเนื้อไก่และเนื้อปลา [10] นอกจากนี้การศึกษาในสุนัขโดยใช้ A-RISC (Allergens Relative Identity, Similarity, and Cross-reactivity) ยังแสดงให้เห็นความเสี่ยงทางทฤษฎี (theoretical risk) ที่สูงของปฏิกิริยาข้ามกันระหว่างโปรตีนในอาหารจากโปรตีนตระกูลเดียวกันในสัตว์สปีชีส์ต่างกัน (เช่น แอล แลคเตตดีไฮโดรจีเนส (l-lactate dehydrogenase) จากเนื้อไก่ เป็ด ไก่งวง นกกระจอกเทศ วัว แกะ ม้า หมู กระต่าย ปลาค็อด ปลาแซลมอนและจระเข้) [13].
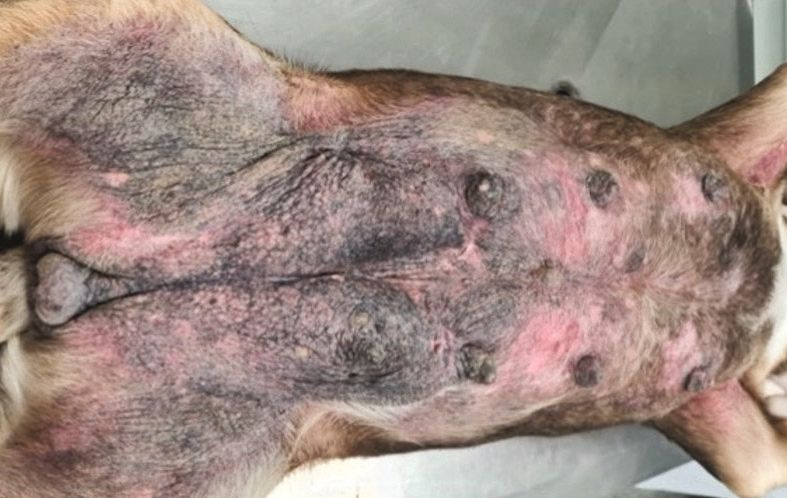
การสัมผัสกับสารก่อภูมิแพ้ในอาหารอย่างต่อเนื่องและเรื้อรังอาจเกี่ยวข้องกับโรคผิวหนังอักเสบจากภูมิแพ้ (atopic dermatitis) ระดับปานกลางถึงรุนแรง (moderate to severe) ซึ่งมักส่งผลต่อพื้นผิวของร่างกาย (body surface) เป็นบริเวณกว้างและส่งผลอย่างมากต่อคุณภาพชีวิตของสัตว์ป่วย
ปฏิกิริยาไม่พึงประสงค์จากอาหาร
ได้แก่ ภาวะแพ้อาหาร (food hypersensitivity (FH)) และภาวะที่ไม่สามารถย่อยอาหาร (food intolerance (FI)) [9] โดยภาวะที่ไม่สามารถย่อยอาหารหรือ FI นั้นจัดเป็นการตอบสนองที่ไม่เกี่ยวข้องกับภูมิคุ้มกัน (non-immunological response) และอาจเกิดจากสารออกฤทธิ์ทางเภสัชกรรม (pharmacologically active ingredient) ปฏิกิริยาต่อสารเมตาบอไลต์ของส่วนประกอบบางชนิด ความผิดปกติของร่างกายที่ตอบสนองต่ออาหาร (food idiosyncrasy) หรือการแพ้อาหารเทียม (pseudo-allergy) [14] ส่วนภาวะแพ้อาหารหรือ FH นั้นจะถูกจัดอยู่ในกระเภทการตอบสนองทางระบบภูมิคุ้มกัน (immune response) ต่อสารก่อภูมิแพ้ในอาหารหรือส่วนประกอบในอาหารและสามารถเกี่ยวข้องกับ IgE ซึ่งจะนำไปสู่ปฏิกิริยาไวเกินทันทีแบบที่ 1 (immediate hypersensitivity reactions type 1 (FA)) ปฏิกิริยาที่เกี่ยวข้องกับคอมเพล็กซ์ภูมิคุ้มกัน (immune complexes) (ปฏิกิริยาไวเกินแบบที่ 3 (type 3 hypersensitivity)) หรือการอักเสบเรื้อรังที่เกิดจากเซลล์ (chronic cell-mediated inflammation) (ปฏิกิริยาไวเกินแบบที่ 4 (type 4 hypersensitivity)) [14],[15] ภาวะแพ้อาหารที่พบได้บ่อยที่สุดในมนุษย์คือปฏิกิริยาที่เกิดจาก IgE (IgE-mediated reactions) แบบทันที (แบบที่ 1) ทั้งนี้แม้จะมีการสัมผัสกับแอนติเจนของอาหารต่างๆเป็นจำนวนมาก แต่บุคคลเพียงจำนวนน้อยเท่านั้นที่จะพัฒนาเป็นภาวะแพ้อาหาร ทั้งนี้เป็นเพราะการตอบสนองของภูมิคุ้มกันตามปกติต่อโปรตีนในอาหารนั้นจะสัมพันธ์กับการเหนี่ยวนำความทนต่ออาหาร (oral tolerance) อย่างเหมาะสมอีกด้วย [9]
ปัจจัยที่รบกวนเยื่อเมือกกั้น (mucosal barrier) (เช่น ไวรัส แบคทีเรีย ปรสิต สารพิษ) สามารถนำไปสู่การพัฒนาเป็นภาวะแพ้อาหารได้ เนื่องจากปัจจัยต่างๆเหล่านี้อาจทำให้แอนติเจนของอาหารแทรกซึมเข้าสู่เนื้อเยื่อน้ำเหลืองที่เกี่ยวข้องกับลำไส้ (gut-associated lymphoid tissue (GALT)) ได้มากขึ้นหรือนำเสนอแอนติเจนของอาหารที่ผิดปกติต่อ GALT มากขึ้น ซึ่งรวมถึงกลุ่มก้อนน้ำเหลืองขนาดเล็กหรือพีเยอร์แพตช์ (Peyer's patches) ที่เป็นเนื้อเยื่อน้ำเหลืองที่กระจายตัวอยู่ในชั้นลามินาพรอเพรีย (lamina propria) เซลล์ดูดซึมของลำไส้ (enterocytes) และลิมโฟไซต์ภายในเยื่อบุผิวของลำไส้ (intraepithelial lymphocytes) [9]. สารก่อภูมิแพ้ในอาหารอาจมีความทนต่อเอนไซม์ย่อยอาหารและความร้อน คุณสมบัติเหล่านี้จึงทำให้สารก่อภูมิแพ้สามารถแทรกซึมผ่านแนวป้องกันทางสรีรวิทยา (physiological barrier) ได้มากขึ้น [9] ปัจจัยอื่นๆที่อาจเชื่อมโยงกับการเกิดภาวะแพ้อาหาร ได้แก่ ค่าความเป็นกรดด่างในกระเพาะอาหารที่สูงขึ้น การบีบตัวของลำไส้ที่ลดลง (peristalsis) รวมถึงการเปลี่ยนแปลงของเยื่อบุผิวลำไส้ชั้นบน (superficial enteric mucosa) ส่วนเชื่อมระหว่างเซลล์ (tight junctions) ของเซลล์ดูดซึมของลำไส้หรือ IgA ในโพรงลำไส้ (intraluminal IgA) [9]
ปฏิกิริยาไม่พึงประสงค์จากอาหารและโรคผิวหนังอักเสบจากภูมิแพ้
โรคผิวหนังอักเสบจากภูมิแพ้หรือ Atopic dermatitis เป็นโรคผิวหนังอักเสบเรื้อรังที่ก่อให้เกิดอาการคันซึ่งเกิดจากปฏิสัมพันธ์ที่ซับซ้อนระหว่างการลดลงของเกราะป้องกันผิวชั้นหนังกำพร้า (physical barrier of the epidermis) และการตอบสนองทางภูมิคุ้มกันที่มากเกินไป (immunological hyperreactivity) โดยส่วนใหญ่มาจากการตอบสนองของการอักเสบที่เกี่ยวข้องกับเซลล์ทีเฮลเปอร์ชนิดที่ 2 (type 2 helper T lymphocytes (Th2)) (การตอบสนองต่อการอักเสบชนิดที่ 2 (type 2 inflammatory response)) [1]
อาการแสดงทางคลินิกของโรคอาจเกิดจากสารก่อภูมิแพ้ในสิ่งแวดล้อม (environmental allergens) สารพิษของแบคทีเรีย (microbial toxins) และสารระคายเคืองทางกายภาพหรือเคมีปฐมภูมิ (and primary physical or chemical irritants) ที่สามารถดูดซึมเข้าสู่ผิวหนังได้ โดยประมาณร้อยละ 25-50 ของสัตว์ป่วยที่มีอาการแสดงทางคลินิกของโรคผิวหนังอักเสบจากภูมิแพ้นั้นอาจเกิดขึ้นจากหรือรุนแรงขึ้นจากสารก่อภูมิแพ้ในอาหารซึ่งสามารถดูดซึมผ่านระบบย่อยอาหารได้ อย่างไรก็ตามมีการพิสูจน์แล้วว่าสารก่อภูมิแพ้ในอาหารสามารถดูดซึมผ่านผิวหนัง (percutaneous penetration) ได้เฉพาะในมนุษย์เท่านั้น เมื่อปัจจัยที่กระตุ้นในเกิดอาการแสดงทางคลินิกของโรคผิวหนังอักเสบจากภูมิแพ้มีต้นกำเนิดจากสิ่งแวดล้อม (environmental origin) โรคนี้จะถูกเรียกว่าโรคผิวหนังอักเสบจากภาวะภูมิแพ้หรือ atopic dermatitis แต่เมื่อปัจจัยกระตุ้นมีต้นกำเนิดจากอาหารเราจะเรียกว่าโรคผิวหนังอักเสบจากภูมิแพ้อาหารหรือ food-induced atopic dermatitis (FIAD) [1],[2],[16] (รูปภาพที่ 1)
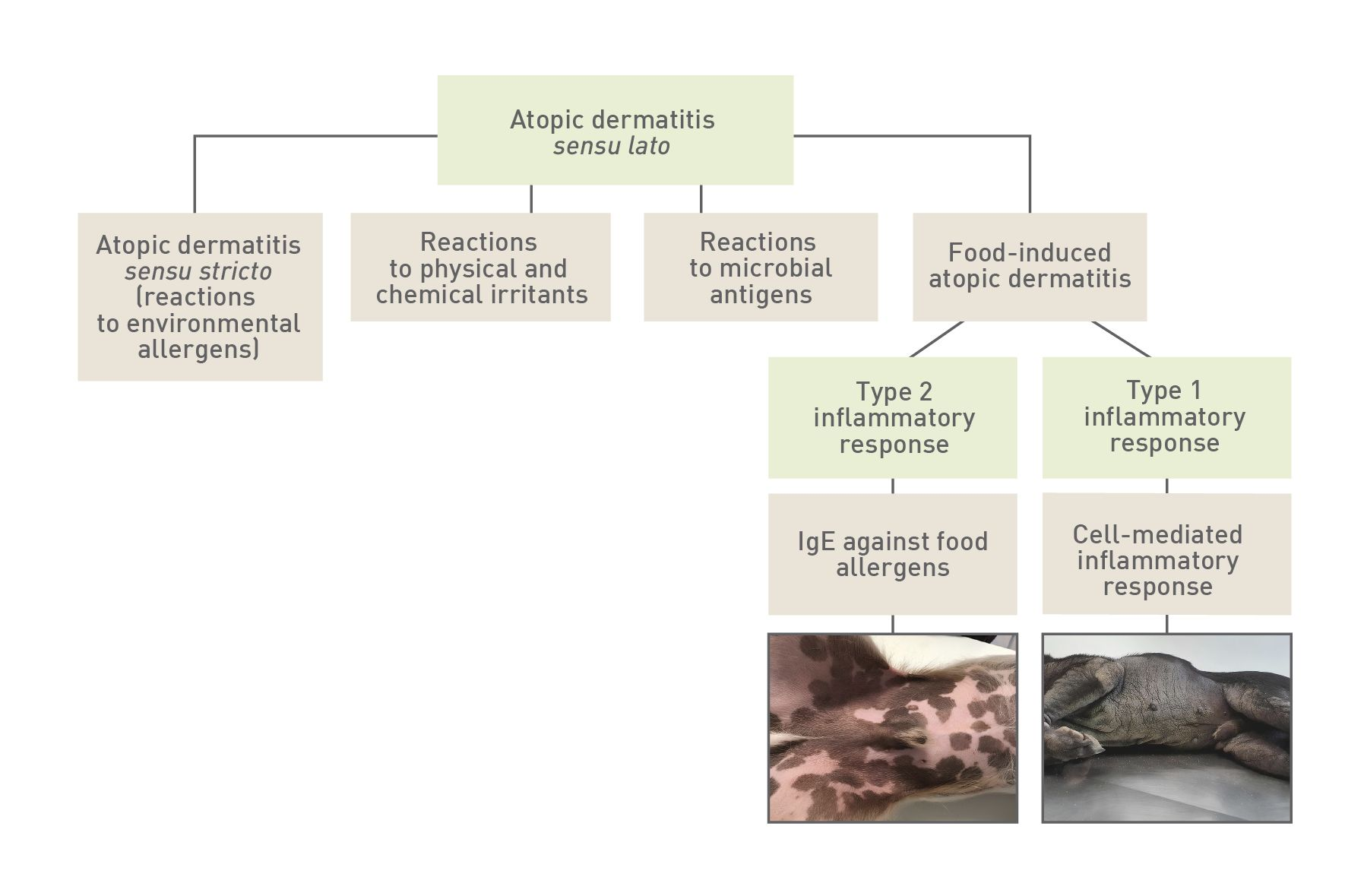
กลไกในการพัฒนาปฏิกิริยาไม่พึงประสงค์จากอาหาร (AFR) ในสุนัขแต่ละตัวที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้นั้นยังไม่ชัดเจน ในมนุษย์มีรายงานเบื้องต้นที่บ่งชี้ว่าข้อบกพร่องในการทำงานของเกราะป้องกันผิวชั้นหนังกำพร้า (epidermal barrier) ซึ่งเกี่ยวข้องกับการกลายพันธุ์ของยีนฟิลากริน (filaggrin gene) ซึ่งมีความสัมพันธ์กับความเสี่ยงที่สูงขึ้นของการไวต่อสารก่อภูมิแพ้ในสิ่งแวดล้อมและสารก่อภูมิแพ้ในอาหารในสัตว์ที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้รุนแรง (severe atopic dermatitis) อาการภูมิแพ้ (sensitization) สามารถเกิดขึ้นได้ไม่เพียงแต่ผ่านลำไส้ (intestinal route) เท่านั้นแต่ยังเกิดขึ้นผ่านทางผิวหนัง (percutaneous route) ด้วย [17]
จากการศึกษาวิจัยในสุนัขพบว่าการที่ลูกสุนัขกินอาหารดิบที่ทำมาจากสัตว์ (raw animal-origin foods) นั้นดูเหมือนว่าจะมีผลในการป้องกันการเกิดอาการแพ้/โรคผิวหนังอักเสบจากภูมิแพ้ในวัยโตเต็มวัย แต่ในทางกลับกันการที่ลูกสุนัขกินอาหารแปรรูปที่ผ่านความร้อน (heat-processed foods) อาหารเสริมที่ทำจากน้ำมันหลายชนิด (mixed-oil supplements) และน้ำตาลจากผลไม้ (fruit sugars) นั้นดูเหมือนจะส่งเสริมการเกิดอาการแสดงทางผิวหนัง (cutaneous signs) ของอาการแพ้/โรคผิวหนังอักเสบจากภูมิแพ้ในวัยโตเต็มวัย [18].
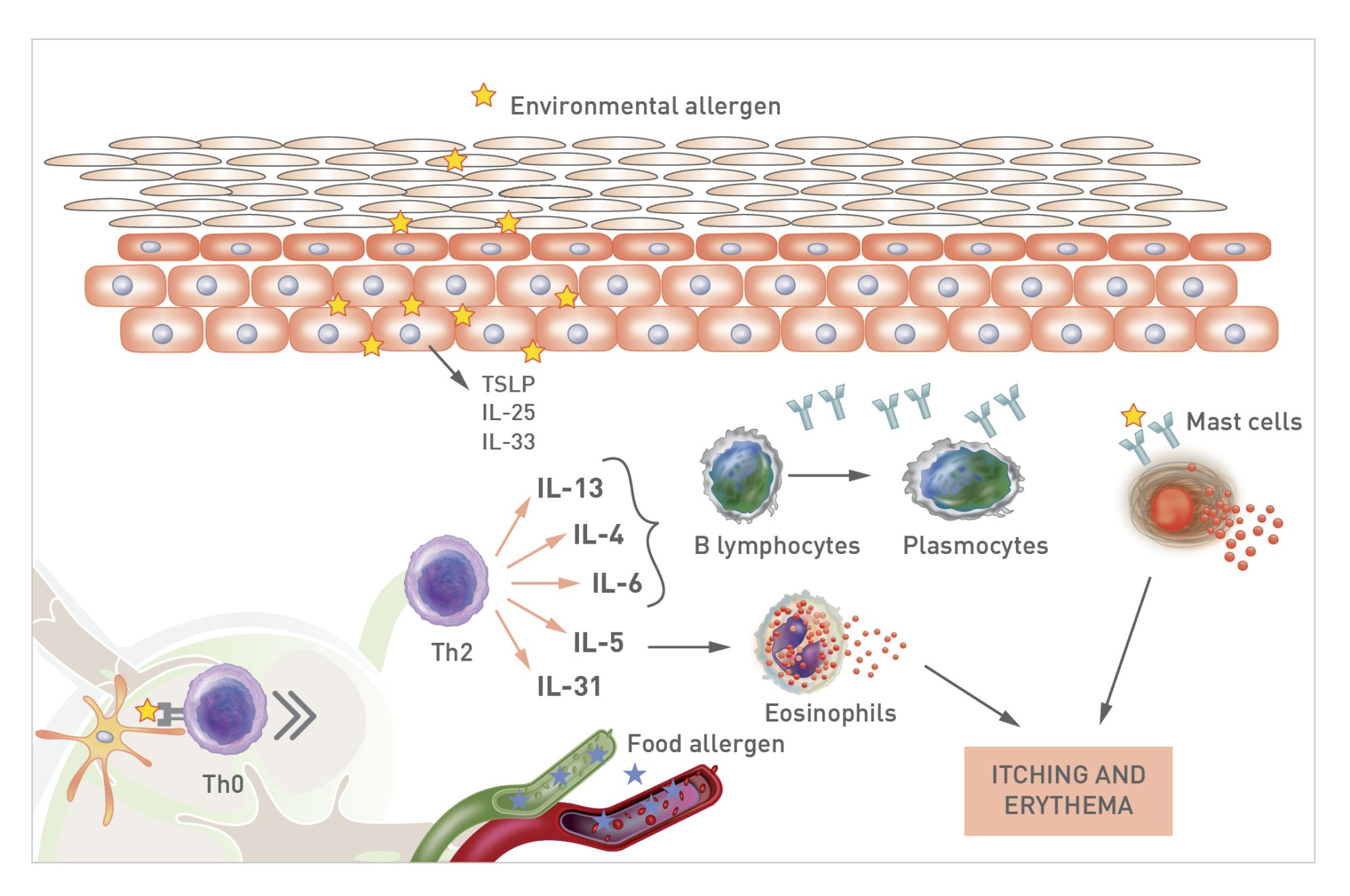
ปฏิกิริยาของผิวหนัง (skin reactions) ต่อสารก่อภูมิแพ้ในอาหารที่เกิดขึ้นในสุนัขที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้นั้นสามารถเกิดได้หลายแบบเช่นเดียวกับในมนุษย์ โดยสารก่อภูมิแพ้ในอาหารจะถูกจับโดยเซลล์เดนไดรต์ที่ก่อให้เกิดการอักเสบ (pro-inflammatory dendritic cells) ผ่านกระบวนการต่างๆและเปปไทด์ (peptides) ของสารก่อภูมิแพ้เหล่านี้ก็จะถูกนำเสนอต่อเซลล์ทีเฮลเปอร์ชนิดที่ 0 (Th0 cells) และปลดปล่อยไซโตไคน์ (cytokines) ออกมา เช่น IL-4, IL-5, IL-6, IL-13 และ IL-31 (การตอบสนองต่อการอักเสบชนิดที่ 2) โดย IL-4 และ IL-3 จะกระตุ้นการแบ่งตัวของลิมโฟไซต์บี (B lymphocytes) การสร้างเซลล์พลาสมาและปลดปล่อย IgE เฉพาะออกมา ซึ่งจะทำให้เกิดกระบวนการที่ก่อให้เกิดอาการแพ้ (sensitization process) [15],[19] IgE ที่หลั่งออกมานี้จะจับกับตัวรับเฉพาะของแมสต์เซลล์ (mast cells) เบโซฟิล (basophils) เซลล์เดนไดรต์ (dendritic cells) และเคอราติโนไซต์ (keratinocytes) และจะกระตุ้นตัวรับต่างๆเหล่านี้เมื่อใดก็ตามที่พบสารก่อภูมิแพ้เฉพาะและกระตุ้นให้เกิดกระบวนการอักเสบของผิวหนัง (integumentary inflammatory process) [15],[19]. นอกจากนี้ IL-5 ยังมีฤทธิ์เรียก (chemotactic) อีโอซิโนฟิล (eosinophils) และ IL-31 ก็มีฤทธิ์ก่อให้เกิดอาการคันอย่างมีนัยสำคัญ (รูปภาพที่ 2)
นอกจากการตอบสนองต่อการอักเสบชนิดที่ 2 นี้แล้ว เมื่อเซลล์เดนไดรต์จับกับสารก่อภูมิแพ้ในอาหารก็จะเริ่มกระบวนการตอบสนองต่อการอักเสบที่อาศัยเซลล์ (cell-mediated inflammatory response) และกระตุ้นให้เกิดการสร้างลิมโฟไซต์ทีเฮลเปอร์ชนิดที่ 1 (Th1) หลังจากสัมผัสกับอาหารเป็นเวลา 12 ชั่วโมงหรือนานกว่านั้น [19],[20] เซลล์ทีเฮลเปอร์ชนิดที่ 1 จะปล่อยไซโตไคน์ที่ก่อให้เกิดการอักเสบ (inflammatory cytokines) เช่น IL-2, IL-6, interferon-gamma (IFN-γ) และ TNF-α ซึ่งจะกระตุ้นให้เกิดการอพยพ (migration) ของลิมโฟไซต์ทีที่เป็นพิษต่อเซลล์ (cytotoxic T lymphocytes) นิวโทรฟิล (neutrophils) แมคโครฟาจ (macrophages) และอีโอซิโนฟิล (eosinophils) [14] เซลล์ที (T cells) เหล่านี้สามารถกระตุ้นให้เกิดผลกระทบที่เป็นพิษโดยตรง (direct toxic effects) ทำให้เกิดการตายของเซลล์อย่างเป็นระบบ (cell apoptosis) หรืออาจออกฤทธิ์โดยการปล่อยไซโตไคน์เพิ่มเติมเพื่อกระตุ้นการตอบสนองทางภูมิคุ้มกันที่อาศัยเซลล์ (cell-mediated immune response) [19],[20] (รูปภาพที่ 3) เหตุการณ์ที่กล่าวถึงในช่วงหลังนี้จะกระตุ้นให้เกิดการอักเสบของผิวหนัง (cutaneous inflammation) และอาการคันเรื้อรังตลอดทั้งปี (chronic, perennial pruritus) ที่เกี่ยวข้องกับโรคผิวหนังแข็งผิดปกติ (dyskeratosis) และภาวะผิวหนังหยาบ ขรุขระ หนาตัวขึ้น (lichenification) ในสัตว์ที่ได้รับผลกระทบ [20] การสัมผัสกับสารก่อภูมิแพ้ในอาหารอย่างต่อเนื่องและเรื้อรังอาจเกี่ยวข้องกับโรคผิวหนังอักเสบจากภูมิแพ้ (atopic dermatitis) ระดับปานกลางถึงรุนแรง (moderate to severe) ซึ่งมักส่งผลต่อพื้นผิวของร่างกาย (body surface) เป็นบริเวณกว้างและส่งผลอย่างมากต่อคุณภาพชีวิตของสัตว์ป่วย”
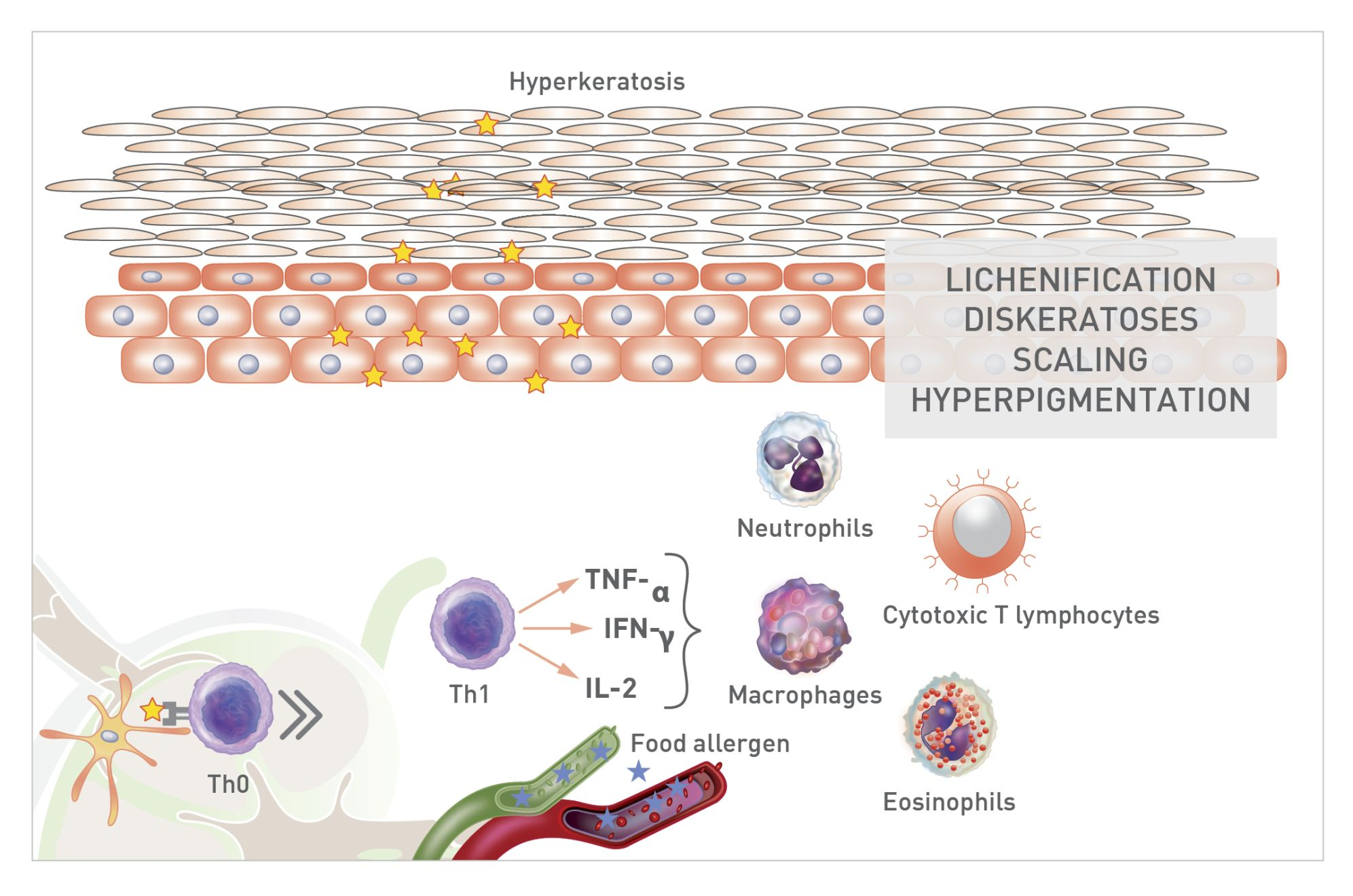
การกระตุ้นการตอบสนองต่อการอักเสบชนิดที่ 2 อย่างต่อเนื่องผ่าน IL-6 อาจทำให้เซลล์ทีเฮลเปอร์ชนิดที่ 0 (Th0) ถูกเปลี่ยนเป็นเซลล์ทีเฮลเปอร์ชนิดที่ 22 (Th22) นอกจากนี้รอยโรคเรื้อรัง (chronic lesion) มักเกี่ยวข้องกับการเพิ่มขึ้นของไซโตไคน์เซลล์ทีเฮลเปอร์ชนิดที่ 22 (Th22 cytokines) โดยมีความสัมพันธ์ในเชิงบวก (positive correlation) ระหว่างระดับของ IL-22 mRNA และความรุนแรงของอาการแสดงทางคลินิก มีรายงานระบุว่าการเพิ่มขึ้นของระดับเซลล์ทีเฮลเปอร์ชนิดที่ 22 นั้นมีความเกี่ยวข้องกับการเพิ่มจำนวนของเคอราติโนไซต์ (keratinocyte proliferation) ภาวะผิวชั้นหนังกำพร้าหนาตัวผิดปกติ (epidermal hyperplasia) และความผิดปกติของเกราะป้องกันผิวอื่นๆ [20]
การตอบสนองต่อการอักเสบ (inflammatory response) สามารถทำให้ความผิดปกติของเกราะป้องกันผิวปฐมภูมิ (primary skin barrier disorders) รุนแรงขึ้น ลดการผลิตเซราไมด์ (production of ceramides) และเปปไทด์ต้านจุลินทรีย์(antimicrobial peptides) อีกทั้งอาจทำให้สารก่อภูมิแพ้ในสิ่งแวดล้อมแทรกซึมเข้าไปได้อย่างต่อเนื่อง ส่งผลให้เกิดอาการแพ้เพิ่มขึ้นและเกิดการติดเชื้อซ้ำ (recurrent infections) เป็นเวลานาน [15]
ลักษณะทางคลินิก
ในมนุษย์มักจะพบอาการแพ้อาหาร (food allergy) ในทารก (infants) มากกว่า อีกทั้งความเสี่ยงทางพันธุกรรม (genetic predisposition) ต่อการพัฒนาให้เกิดอาการแพ้นั้นก็มีความเกี่ยวข้องในเด็กที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้ (atopic dermatitis) [21] นอกจากนี้ยังพบว่าประเภทของอาหารที่กระตุ้นให้เกิดโรคผิวหนังอักเสบจากภูมิแพ้นั้นอาจแตกต่างกันไปตามอายุของผู้ป่วย ในโลกตะวันตกนั้นสารก่อภูมิแพ้ที่ทำให้เกิดโรคผิวหนังอักเสบจากภูมิแพ้ในทารกมักพบได้ในนมวัว ไข่และถั่วลิสง รวมถึงสารก่อภูมิแพ้ (trophallergens) ในข้าวสาลี ถั่วและปลาก็มักจะเป็นตัวกระตุ้นอาการของโรคผิวหนังอักเสบผื่นแพ้ (eczema) ในผู้ป่วยสูงอายุ [21]
มีการศึกษาฉบับหนึ่งในสุนัขที่ได้รับการวินิจฉัยว่าเป็นโรคผิวหนังอักเสบจากภูมิแพ้อาหาร (food-induced atopic dermatitis (FIAD)) พบว่าร้อยละ 48 ของสัตว์ป่วยจะเริ่มมีอาการแสดงทางคลินิกก่อนอายุ 1 ปี และร้อยละ 83 ของสัตว์ป่วยจะเริ่มแสดงอาการก่อนอายุ 3 ปี โดยไม่พบความเกี่ยวข้องกับฤดูกาล [3] สุนัขพันธุ์เวสต์ ไฮแลนด์ ไวท์ เทอร์เรียร์ (West Highland White Terriers) พันธุ์บ็อกเซอร์ (ฺBoxer) พันธุ์โรดีเชียน ริดจ์แบ็ก (Rhodesian Ridgebacks) พันธุ์ปั๊ก (Pugs) และพันธุ์เยอรมันเชพเพิร์ด (German Shepherd) จะมีความเสี่ยงในการเกิดโรคนี้สูง [3] แต่ก็มีการศึกษาฉบับอื่นที่รายงานว่าสุนัขพันธุ์ปั๊ก พันธุ์เฟรนช์บูลด็อก (French Bulldog) พันธุ์ลาซา แอปโซ (Lhasa Apso) พันธุ์ชิสุ (Shih Tzu) พันธุ์ยอร์คเชียร์ เทอร์เรีย (Yorkshire Terrier) พันธุ์ลาบราดอร์ รีทรีฟเวอร์ (Labrador Retriever) และพันธุ์มอลทีส (Maltese Terrier) เป็นพันธุ์ที่พบได้บ่อยที่สุด [4]
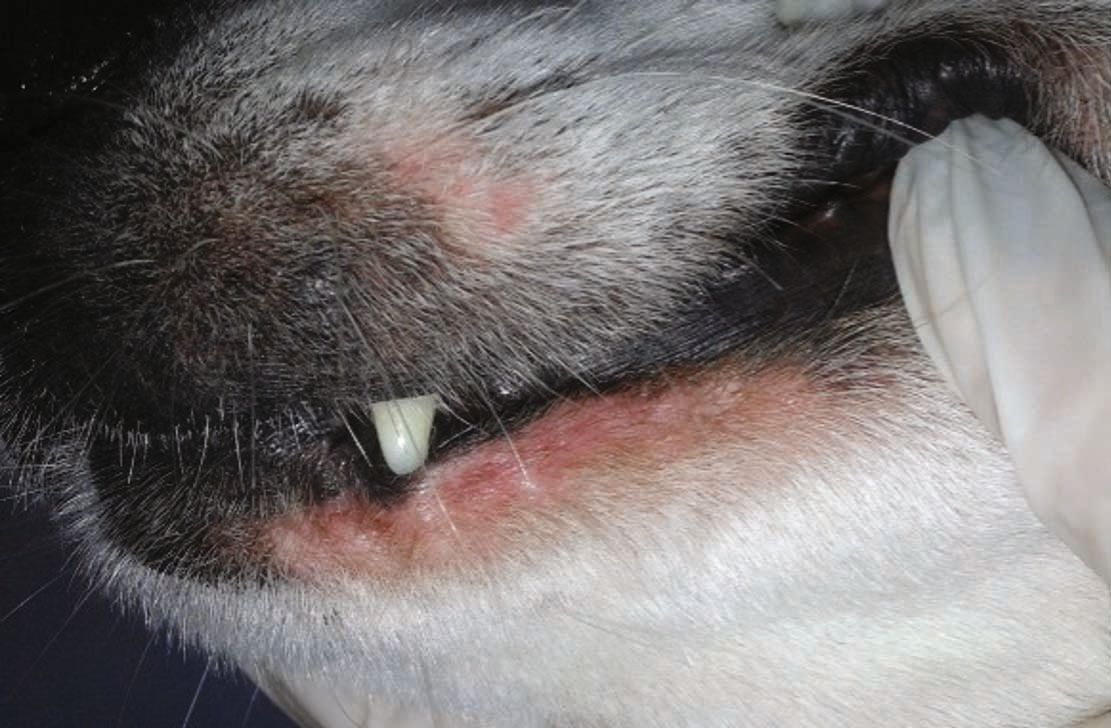
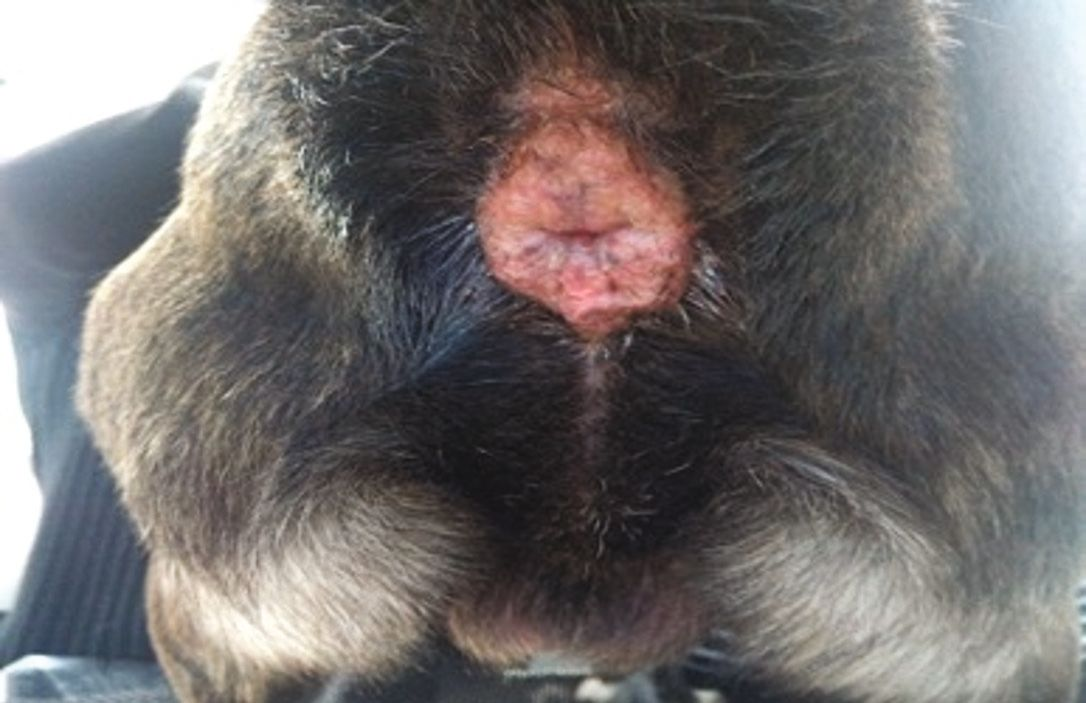
อาการแสดงทางคลินิกของปฏิกิริยาไม่พึงประสงค์จากอาหารในสุนัขที่เป็นและไม่เป็นโรคผิวหนังอักเสบจากภูมิแพ้นั้นจะแตกต่างกันไป โดยอาจแสดงอาการผิวหนังแดง (erythema) และมีอาการคันเรื้อรังที่เริ่มเป็นตั้งแต่อายุยังน้อยและไม่ตอบสนองต่อการรักษาทั่วไปรวมถึงไม่เกี่ยวข้องกับฤดูกาล (chronic, early-onset, recalcitrant, and non-seasonal pruritus) โดยจะพบที่บริเวณปลายขา (distal limbs) รักแร้ (axillae) ขาหนีบ (inguinal regions) และบริเวณที่มีการพับงอ (flexural regions) อีกทั้งยังสามารถพบภาวะหูอักเสบที่สัมพันธ์กับภาวะขนร่วงจากอาการคัน (self-induced alopecia) และการถลอกของผิวหนัง (excoriations) [3]. นอกจากนี้ยังพบอาการคันรอบปากและรอบก้น (perioral and perianal pruritus) ได้อีกด้วย ในกรณีที่เป็นเรื้อรัง สัตวแพทย์มักจะพบภาวะหนังหนา (hyperkeratosis) ภาวะผิวหนังช้าง (acanthosis) และภาวะผิวหนังหยาบ ขรุขระ หนาตัวขึ้น (lichenification) ซึ่งสัมพันธ์กับกระบวนการอักเสบ [4]. สุนัขที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้ที่เกี่ยวข้องกับอาหารจะมีภาวะหูอักเสบมากกว่าสัตว์ที่ไม่เป็นโรคถึง 3 เท่า [20] โดยจะเกิดขึ้นร้อยละ 26-80 ของกรณีสัตว์ป่วย [22],[23] ทั้งนี้การติดเชื้อที่หูที่เชื่อมโยงกับปฏิกิริยาไม่พึงประสงค์จากอาหารในสุนัขที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้นั้นสุนัขมักจะมีปัญหาที่หูทั้ง 2 ข้างและกลับมาเป็นซ้ำได้บ่อย และมีแนวโน้มจะกลายเป็นภาวะเรื้อรัง รวมถึงสัมพันธ์กับภาวะผิวหนังหยาบ ขรุขระ หนาตัวขึ้น (lichenification) ภาวะผิวชั้นหนังกำพร้าหนาตัวผิดปกติ (epidermal hyperplasia) ช่องหูตีบ (stenosis of the ear canals) การเสียสมดุลของจุลินทรีย์ในช่องหู (aural dysbiosis) และการติดเชื้อที่หูชั้นกลาง (middle ear infections) [3],[4] นอกจากนี้ยังมีรายงานว่าสุนัขที่เป็น FIAD มักเป็นโรคผิวหนังอักเสบแบบมีหนองชนิดกลับมาเป็นอีก (recurrent pyoderma) และติดเชื้อยีสต์ (yeast infections) [1],[3]
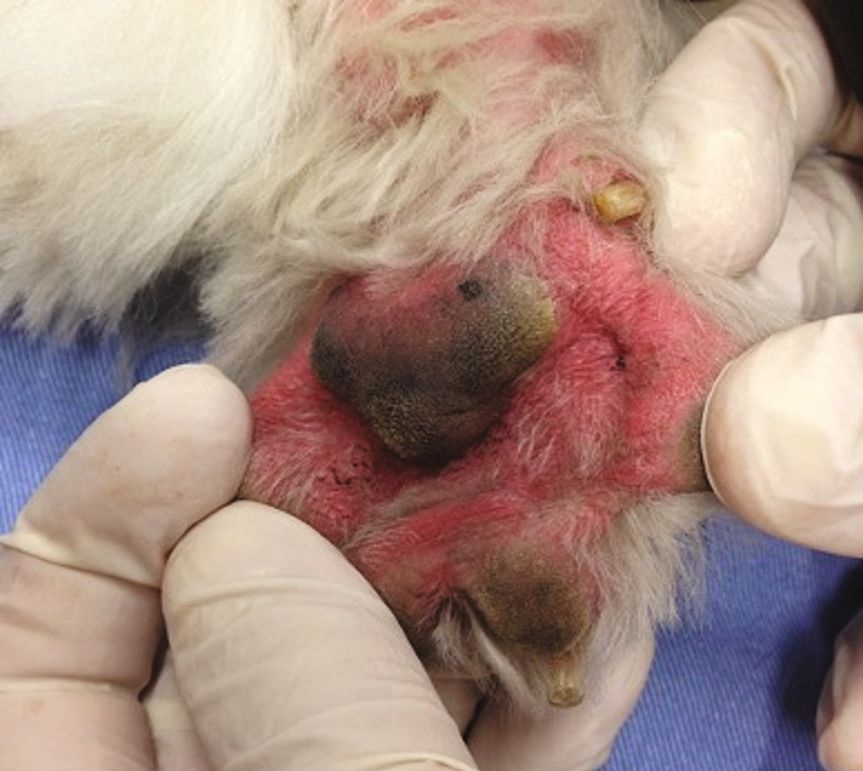

ร้อยละ 20-83 ของสุนัขที่มีปฏิกิริยาไม่พึงประสงค์จากอาหารจะมีอาการทางระบบทางเดินอาหารและอาการทางผิวหนังพร้อมกัน ได้แก่ อาเจียน (ร้อยละ 82.2) ท้องเสีย ท้องอืด (flatulence) (ร้อยละ 86.7) ท้องร้อง (borborygmus) (ร้อยละ 64.4) ปวดเบ่งอุจจาระ (tenesmus) ท้องกาง (abdominal distension) ปวดท้อง (visceral colic) และลำไส้มีการบีบตัวเพิ่มมากขึ้น (increased peristaltic movements) (ร้อยละ 8.8) [24],[25].
สุดท้ายนี้แม้ว่าปฏิกิริยาไวเกินแบบที่ 1 หรือ 4 (hypersensitivity reactions of type 1 or 4) จะเกี่ยวข้องกับปฏิกิริยาไม่พึงประสงค์จากอาหารในสุนัข แต่ปฏิกิริยาไวเกินแบบอื่นๆและการตอบสนองต่อการอักเสบเรื้อรัง (chronic inflammatory responses) ก็ได้รับการบันทึกไว้ในสัตว์สปีชีส์นี้และเป็นสาเหตุที่ทำให้เกิดอาการแสดงทางคลินิกที่ผิดปกติ (atypical clinical presentations) เช่น หลอดเลือดอักเสบ (vasculitis) และเล็บอักเสบ (onychitis) [26].
ปัจจัยที่รบกวนเยื่อเมือกกั้น (mucosal barrier) สามารถนำไปสู่การพัฒนาเป็นภาวะแพ้อาหารได้ เนื่องจากปัจจัยต่างๆเหล่านี้อาจทำให้แอนติเจนของอาหารแทรกซึมเข้าสู่เนื้อเยื่อน้ำเหลืองที่เกี่ยวข้องกับลำไส้
สรุป
ปฏิกิริยาไม่พึงประสงค์ที่ผิวหนังจากสารก่อภูมิแพ้ในอาหาร (adverse skin reactions to food allergens) อาจเกี่ยวข้องกับการกำเริบและการกระตุ้นของภาวะอักเสบของโรคผิวหนังอักเสบจากภูมิแพ้ในสุนัขซึ่งจะทำให้เกิดอาการคันเรื้อรังรุนแรงโดยไม่เกี่ยวข้องกับฤดูกาล (chronic, intense and non-seasonal pruritus) ภาวะผิวหนังหยาบ ขรุขระ หนาตัวขึ้น (lichenification) ภาวะหูอักเสบ (otitis) และเกิดการติดเชื้อซ้ำ (recurrent infections) ซึ่งอาจทำให้โรคไม่ตอบสนองต่อการรักษาทั่วไป (disease recalcitrant) และควบคุมอาการแสดงทางคลินิกได้ยาก เพราะฉะนั้นการลดการสัมผัสกับสารก่อภูมิแพ้ในอาหารในสุนัขที่เป็นโรคผิวหนังอักเสบจากภูมิแพ้อาหาร (food-induced atopic dermatitis) จึงมีความจำเป็นสำหรับการควบคุมโรคด้วยวิธีผสมผสาน (multimodal control)
Marconi Rodrigues de Farias
DVM, MSc, PhD, The Pontifical Catholic University of Paraná (PUCPR), Curitiba, Brazil
สหพันธ์สาธารณรัฐบราซิล
Dr. Farias graduated from the Federal University of Uberlândia and completed the Residency Program and Master’s Degree in Small Animal Veterinary Clinic at the State University of São Paulo, Brazil. He then obtained his doctorate in Allergy and Clinical Immunology at the Faculty of Medicine – Federal University of Paraná and is currently an affiliate of both the European and Brazilian Society of Veterinary Dermatology, associate professor of veterinary dermatology and permanent researcher in the Postgraduate Program in Animal Science at Pontifical Catholic University of Paraná, Brazil, with his main areas of research being immunopathology and dermatological infectology.
Vanessa Cunningham Gmyterco
DVM, MSc, The Pontifical Catholic University of Paraná (PUCPR), Curitiba, Brazil
สหพันธ์สาธารณรัฐบราซิล
Dr. Gmyterco gained her veterinary degree from the PUCPR and remained there to do a residency in Small Animal Medical Clinic and to study for a Master’s in animal science. She is currently a PhD student at PUCPR with an emphasis on veterinary dermatology and allergology.
References
- Nuttall TJ, Marsella R, Rosenbaum MR, et al. Update on pathogenesis, diagnosis, and treatment of atopic dermatitis in dogs. J. Am. Vet. Med. Assoc. 2019;254:11.
- Fischer N, Spielhofer L, Martini F, et al. Sensitivity and specificity of a shortened elimination diet protocol for the diagnosis of food-induced atopic dermatitis (FIAD) Vet. Dermatol. 2021;32:247-e65. DOI: 10.1111/vde.12940
- Picco F, Zini E, Nett C, et al. A prospective study on canine atopic dermatitis and food-induced allergic dermatitis in Switzerland. Vet. Dermatol. 2008;19(3):150-155. Doi: 10.1111/j.1365-3164.2008.00669.x
- Possebom J, Cruz A, Gmyterco VC, et al. Combined prick and patch tests for diagnosis of food hypersensitivity in dogs with chronic pruritus. Vet. Dermatol. 2022;33(2):124-36. Doi: 10.1111/vde.13055.
- Mueller RS, Olivry T, Prlaud P. Critically appraised topic on adverse food reactions of companion animals (2): Common food allergen sources in dogs and cats. BMC Vet. Res. 2016;12:9.
- Verlinden A, Hesta M, Millet S, et al. Food allergy in dogs and cats: a review. Crit. Review Food Sci. Nutr.: 2006;46(3):259-273. Doi: 10.1080/10408390591001117.
- Martín A, Sierra MP, González JL, et al. Identification of allergens responsible for canine cutaneous adverse food reactions to lamb, beef and cows milk. Vet. Dermatol. 2004;15:349-356.
- Shimakura H, Nasukawa T, Uchiyama J, et al. IgE reactivity to milk components in dogs with cutaneous adverse food reactions. J. Vet. Med. Sci. 2021;2:83(10):1509-1512. Doi: 10.1292/jvms.21-0162.
- Pali-Schll I, De Lucia M, Jackson H, et al. Comparing immediate-type food allergy in humans and companion animals-revealing unmet needs. Allergy 2017;72(11):1643-1656. Doi: 10.1111/all.13179.
- Bexley J, Kingswell N, Olivry T. Serum IgE cross-reactivity between fish and chicken meats in dogs. Vet. Dermatol. 2019;30(1):25-e8. Doi: 10.1111/vde.12691.
- Pucheu-Haston CM, Mougeot I. Serum IgE and IgG responses to dietary antigens in dogs with and without cutaneous adverse food reactions. Vet. Dermatol. 2020;(2):116-127. Doi: 10.1111/vde.12810
- Baumann SA, Fritz C, Mueller RS. Food antigen-specific IgE in dogs with suspected food hypersensitivity. Tierarztl. Prax. 2020;48(6):395-402. Doi: 10.1055/a-1274-9210.
- Olivry T, OMalley A, Chruszcz M. Evaluation of the theoretical risk of cross-reactivity among recently identified food allergens for dogs. Vet. Dermatol. 2022;33(6):523-526. Doi: 10.1111/vde.13110.
- Bhagat R, Sheikh AA, Wazir VS, et al. Food allergy in canines: A review. J. Entomol. Zool. Stud. 2017:5(6):1522-1525.
- Pucheu-Haston CM, Bizikova P, Eisenschenk MN, et al. Review: The role of antibodies, autoantigens and food allergens in canine atopic dermatitis. Vet. Dermatol. 2015;26(2):115-e30. Doi: 10.1111/vde.12201.
- Tsakok T, Marrs T, Mohsin M, et al. Does atopic dermatitis cause food allergy? A systematic review. Lancet 2017;389:S95
- Tham EH, Leung DYM. Mechanisms by which atopic dermatitis predisposes to food allergy and the atopic march. Allergy Asthma Immunol. Res. 2018;10:e24.
- Hemida MBM, Salin S, Vuori KA, et al. Puppyhood diet as a factor in the development of owner-reported allergy/atopy skin signs in adult dogs in Finland. J. Vet. Intern. Med. 2021;35(5):2374-2383. Doi: 10.1111/jvim.16211.
- Mueller RS, Unterer S. Adverse food reactions: Pathogenesis, clinical signs, diagnosis and alternatives to elimination diets. Vet. J. 2018;236:89-95. Doi: 10.1016/j.tvjl.2018.04.014.
- Czarnowicki T, He H, Krueger JG, et al. Atopic dermatitis endotypes and implications for targeted therapeutics. J. Allergy Clin. Immunol. 2019:143(1):1-8.
- Mavroudi A, Karagiannidou A, Xinias I, et al. Assessment of IgE- mediated food allergies in children with atopic dermatitis. Allergol. Immunopathol. 2017;45(1):77-81.
- Favrot C, Steffan J, Seewald W, et al. A prospective study on the clinical features of chronic canine atopic dermatitis and its diagnosis. Vet. Dermatol. 2010;21:23-31.
- Proverbio D, Perego R, Spada E, et al. Prevalence of adverse food reactions in 130 dogs in Italy with dermatological signs: a retrospective study. J. Small Anim. Pract. 2010;51(7):370-374. Doi: 10.1111/j.1748-5827.2010.00951.x.
- Mueller RS, Olivry T. Critically appraised topic on adverse food reactions of companion animals (6): prevalence of noncutaneous manifestations of adverse food reactions in dogs and cats. BMC Vet. Res. 2018;14:341.
- Tinsley J, Griffin C, Sheinberg G, et al. An open-label clinical trial to evaluate the efficacy of an elemental diet for the diagnosis of adverse food reactions in dogs. Vet. Dermatol. 2023: published online ahead of print. Doi: 10.1111/vde.13198
- Bethlehem S, Bexley J, Mueller RS. Patch testing and allergen-specific serum IgE and IgG antibodies in the diagnosis of canine adverse food reactions. Vet. Immunol. Immunopathol. 2012;15:145(3-4):582-589. Doi: 10.1016/j.vetimm.2012.01.003.
แบ่งปันบนโซเชียลมีเดีย