ภาวะต่อมหมวกไตชั้นนอกทำงานน้อยผิดปกติในสุนัข
เขียนโดย Romy M. Heilmann
ต่อมหมวกไตทำงานน้อยกว่าปกติ (Hypoadreno-corticism) หรือ โรค Addison’s disease มักไม่ใช่โรคที่นึกถึงเมื่อทำการวินิจฉัยการป่วยในสุนัขที่มีอาการความผิดปกติในระบบทางเดินอาการ ซึ่งคุณ Romy Heilmann ผู้เขียนบทความนี้ ได้แนะนำว่าไม่ควรมองข้ามความเป็นไปได้นี้เช่นกัน

ประเด็นสำคัญ
สุนัขที่มีภาวะ typical hypoadrenocorticism มักจะมีการแสดงอาการทางคลินิกที่ชัดเจน และการตรวจทางคลินิกพยาธิวิทยาอาจช่วยให้การวินิจฉัยเป็นไปอย่างตรงไปตรงมา
สุนัขที่มีภาวะ Atypical hypoadrenocorticism มักเกี่ยวข้องกับอาการความผิดปกติของระบบทางเดินอาหารเรื้อรังที่เป็นๆ หายๆ ซึ่งอาจถูกกระตุ้นหรือทำให้อาการป่วยแสดงอาการได้จากความเครียด และจะตอบสนองต่อการรักษาตามอาการ
การประเมินความผิดปกติของสุนัขที่มีภาวะ atypical hypoadrenocorticism จำเป็นต้องได้รับการวินิจฉัยสืบสวน (detective approach) เพื่อให้สุนัขได้รับการวินิจฉัยที่ถูกต้อง
ทั้งภาวะ Atypical hypoadrenocorticism และ typical hypoadrenocorticism
บทนำ
ภาวะ typical hypoadrenocorticism หรือ Addison’s disease มักอาการทางคลินิกที่แสดงออกอย่างชัดเจน และรอยโรคทางพยาธิวิทยาที่แสดงออกให้เห็นได้อย่างชัดเจน อีกทั้งยังมีความเชื่อมโยงกับประวัติ และข้อมูลเบื้องต้นของสัตว์ที่ป่วยได้เป็นอย่างดี ดังนั้นสัตวแพทย์ผู้เชี่ยวชาญด้านระบบทางเดินอาหาร (gastroenterologist ) จึงควรพิจารณาความผิดปกติที่อาจเกิดขึ้นได้นี้เมื่อทำการตรวจวินิจฉัย อย่างไรก็ตามภาพทางคลินิกของสุนัขที่มีความผิดปกติ โดยเฉพาะอย่างยิ่งสุนัขที่มีภาวะ spontaneous atypical hypoadrenocorticism อาจไม่แสดงอาการอย่างเฉพาะเจาะจง อาจรวมไปถึงสัญญาณความผิดปกติของทางเดินอาหารที่เป็นๆ หายๆ ที่อาจถูกกระตุ้นให้แสดงอาการได้จากสถาณการณ์ที่ก่อให้เกิดความเครียด ซึ่งจะมีการตอบสนองต่อสารน้ำ และการรักษาตามอาการ ดังนั้น ภาวะ atypical hypoadrenocorticism สามารถแสดงอาการทางคลินิกคล้ายกับอาการของโรคระบบทางเดินอาหาร สัตวแพทย์จึงไม่ควรละเลยวินิจฉัยแยกโรค (differential diagnosis) เหล่านี้ในสุนัขรายที่แสดงอาการทางคลินิกแบบคลุมเครือ และไม่เฉพาะเจาะจง
Hypoadrenocorticism in its typical form (Addison’s disease) is often a straightforward diagnosis when the classic signs and clinicopathological changes are obvious and tie in nicely with the patient’s history and signalment – so it may seem odd that a gastroenterologist should need to consider this condition when doing an examination. However, the clinical picture of affected dogs – particularly those with spontaneous atypical hypoadrenocorticism – may be nonspecific. These can include chronic gastrointestinal signs that wax and wane and which can be triggered or exacerbated by stressful events, and often respond to fluid therapy and symptomatic treatment. Thus, hypoadrenocorticism – particularly its atypical form – can mimic primary gastrointestinal diseases and should not be omitted from the differential diagnosis list in dogs presenting with vague and nonspecific gastrointestinal signs.
ข้อมูลพื้นฐาน
คำจำกัดความ
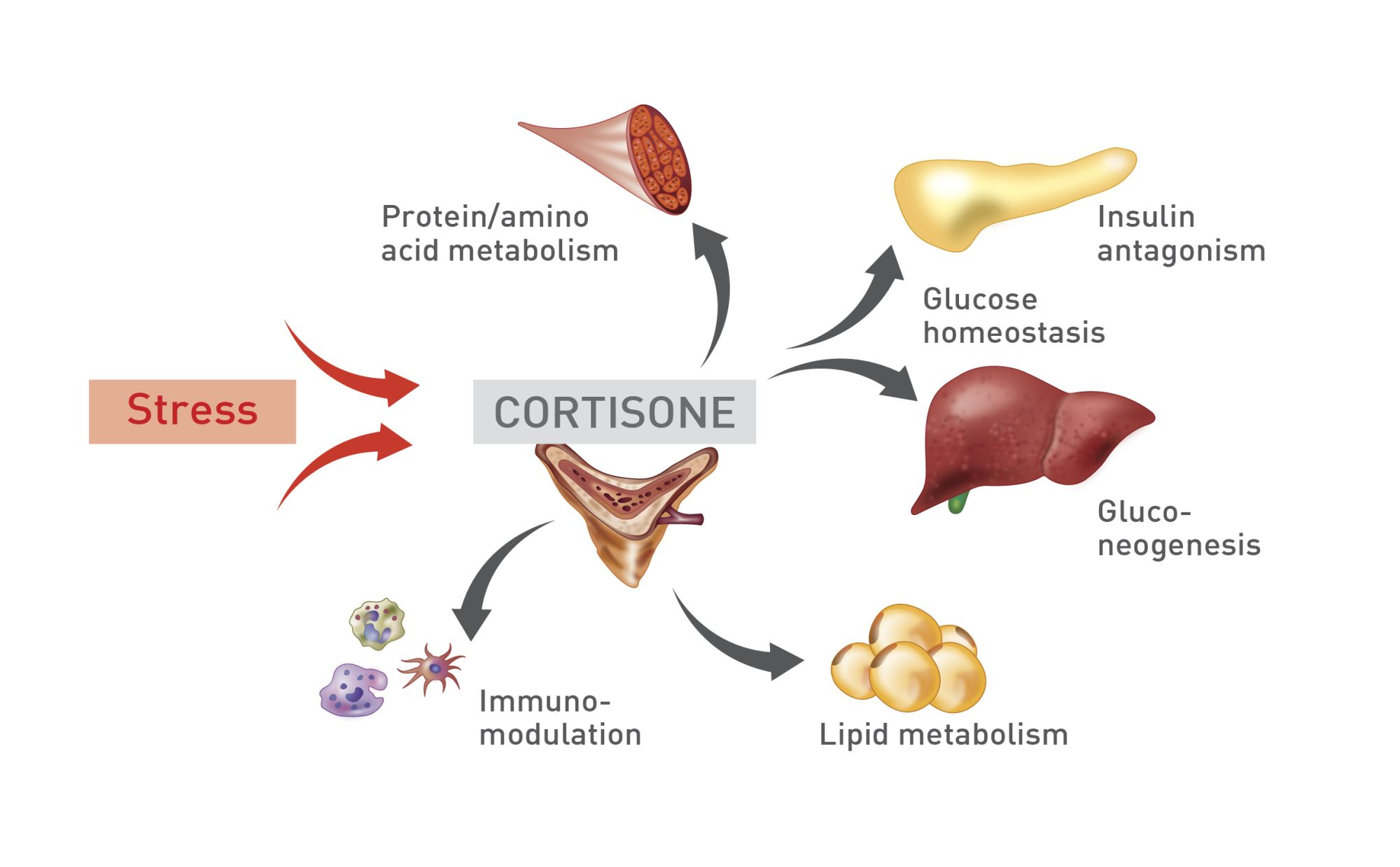
ภาวะ Hypoadrenocorticism หรืออีกชื่อ Addison’s disease เป็นภาวะความผิดปกติที่เป็นผลจากการที่ต่อมหมวกไตชั้นนอก (adrenal cortex) ไม่สามารถผลิตและหลั่งฮอร์โมน glucocorticoids ได้ตามปริมาณที่เพียงพอต่อร่างกาย ในรูปแบบความผิดปกติทั่วไปอาจรวมไปถึง mineralocorticoids ด้วย (แสดงในรูปภาพที่ 1) [1] ในทางตรงกันข้าม ภาวะ typical hypoadrenocorticism ที่แสดงอาการทางคลินิกและรอยโรคที่มีสาเหตุเกิดจากการขาด glucocorticoid และ mineralocorticoid พร้อมกัน มีความต่างจากภาวะ atypical hypoadrenocorticism ในสุนัขมีความท้าทายในการวินิจฉัยมากกว่า ไม่เพียงแต่พบความผิดปกติของการทำงานของต่อมหมวกไตชั้นนอกน้อยกว่า แต่ยังมีอาการทางคลินิกที่ซับซ้อน และไม่จำเพาะเจาะจงมากกว่าด้วย [1],[2]. ภาวะ atypical hypoadrenocorticism นั้นสามารถเปลี่ยนแปลงไปเป็นภาวะ typical hypoadrenocorticism ดังนั้นจึควรมีการตรวจติดตามผลอย่างต่อเนื่อง [2] สำหรับสุนัขที่มีภาวะ typical presentation ในกรณีที่ร่างกายไม่สามารถปรับตัว (decompensation) จากภาวะขาดน้ำ และช็อคจากการขาดน้ำ หรือการเสียเลือด (hypovolemic shock) หรือที่เรียกว่าภาวะวิกฤติต่อมหมวกไต (Addisonian crisis) อาจเป็นผลตามมาจากการขาดฮอร์โมน glucocorticoid เพียงอย่างเดียว ซึ่งสันนิษฐานได้จากการตรวจสอบผลย้อนหลังของพัฒนาโรคอย่างช้าๆ ประกอบกับอาการทางคลินิกที่แสดงออก อย่างไรก็ตามการพัฒนาไปของภาวะ typical hypoadrenocorticism ยังเป็นเรื่องยากในการพิสูจน์ มีการรายงานสายพันธุ์โน้มนำ ได้แก่ Standard Poodles, Portuguese Water dogs, Nova Scotia Duck-tolling Retrievers, Soft-Coated Wheaten Terriers และ Bearded Collies ทั้งนี้สุนัขทุกสายพันธุ์ และทุกช่วงวัยมีความเสี่ยงที่จะเกิดปัญหานี้ในรูปแบบใดรูปแบบหนึ่ง [2],[3],[4],[5] และเมื่อเทียบสุนัขที่มีภาวะ atypical hypoadrenocorticism จะมีอายุที่ยาวนานกว่าสุนัขที่จัดอยู่ในประเภท typical hypoadrenocorticism

สาเหตุการเกิดโรค
ภาวะ hypoadrenocorticism นั้นมีสาเหตุจากสาเหตุใดก็ตามที่ทำให้เกิดการลดลงของการสร้างและหลั่งฮอร์โมนที่สร้างจากต่อมหมวกไตชั้นนอก (adrenal cortex) โดยส่วนมากมักเกี่ยวข้องกับกระบวนการทางระบบภูมิคุ้มกัน (immune-mediated process) ที่จะไปลดการสร้างฮอร์โมนของต่อมหมวกไตชั้นนอก (hormone-producing adrenal cortex) โดยเฉพาะชั้นล่างถึงชั้นในที่ทำหน้าที่สร้างฮอร์โมน glucocorticoid (middle-to-inner glucocorticoid-producing portion) หรือที่เรียกว่าชั้น zona fasciculata [5],[6],[7] ภาวะต่อมหมวกไตชั้นนอกทำงานน้อยกว่าปกติ ชนิดปฐมภูมิ (primary hypoadrenocorticism) ที่อาจพบได้ หรือพบได้น้อย ได้แก่ ภาวะ granulomatous เช่น จากการติดเชื้อรา ปัญหาเกี่ยวกับหลอดเลือด เช่น เลือดออก (hemorrhage) หรือ การขาดเลือด (ischemia) การสะสม amyloid (โดยเฉพาะในบางสายพันธุ์โน้มนำให้เกิด amyloidosis) การเกิดเนื้อตาย (necrosis) หรือ การแพร่กระจายของมะเร็ง (metastatic neoplasia) [8],[9],[10] ส่วนภาวะต่อมหมวกไตทำงานน้อยกว่าปกติ ชนิดทุติยภูมิ (Secondary หรือ central hypoadrenocorticism) ซึ่งเป็นผลจากความผิดปกติที่ต่อมใต้สมองซึ่งส่งผลต่อการผลิตและหลั่งฮอร์โมน hypothalamic corticotropin-releasing hormone (CRH) และ/หรือ adrenocorticotrophic hormone (ACTH) ให้ไปกระตุ้นต่อมหมวกไตชั้นนอกให้สร้างฮอร์โมน ซึ่งอาจเกิดได้จากการอักเสบ การติดเชื้อ การบาดเจ็บ และการเกิดเนื้องอก [1],[11].
พยาธิสรีรวิทยา
ภาวะ typical hypoadrenocorticism ที่ไม่มีการชดเชยฮอร์โมน glucocorticoid และ mineralocorticoid ที่ขาดหายไป ส่งผลให้เกิดการเปลี่ยนแปลงอิเล็กโทรไลต์ในพลาสมา (plasma electrolyte shifts) เช่น การเกิด hyperkalemia หรือ hyponatremia [1] ในทางกลับกันสำหรับชนิด atypical hypoadrenocorticism จะเกิดการขาดฮอร์โมน glucocorticoid เพียงอย่างเดียว หรือขาดกลุ่มฮอร์โมน corticosteroid (ขาดฮอร์โมน glucocorticoid ร่วมกับ mineralocorticoid) โดยที่ไม่มีการเปลี่ยนแปลงของอิเล็กโทรไลต์ เนื่องจากมีกลไกการชดเชย aldosterone-independent เช่น กระบวนการ renal compensation [1],[2]
การตรวจวินิจฉัยภาวะ hypoadrenocorticism
อาการทางคลินิก
การหลั่งฮอร์โมน glucocorticoids มีผลต่อระบบต่างๆของร่างกาย (แสดงในรูปที่ 2) รวมถึงระบบหัวใจ และทางเดินอาหาร [12],[13] อาการทางคลินิกในสุนัขที่มีภาวะ atypical hypoadrenocorticism มักเป็นอาการทางคลินิกที่คลุมเครือ เป็นๆ หายๆ แบบไม่จำเพาะเจาะจง (waxing and waning non-specific signs) เช่น กิจกรรมลดลง (เช่น ความคล่องตัวลดลง) ซึม (lethargy) อ่อนเพลีย (weakness) ไม่อยากอาหาร (inappetence) น้ำหนักลด (weight loss) หรือสภาพร่างกายผอมเพรียว (lean body condition) (แสดงในรูปที่ 3) มีการอาเจียน (vomiting) อาจมีการอาเจียนเป็นเลือดร่วมด้วย (hematemesis) หรือ การสำรอก (regurgitation) อาการท้องเสีย (diarrhea) อาจร่วมกับการถ่ายเป็นเลือด (hemorrhagic) อาการปวดท้อง (abdominal pain) และการปัสสาวะกระปริบกระปรอย (incontinence) [1],[2],[13],[14]
Romy Heilmann/redrawn by Sandrine Fontgne

Ms Wendler, Bischofswerda, SN, Germany
การตรวจทางห้องปฏิบัติการ
ในการเก็บข้อมูลมีความจำเป็นต้องทำการตรวจวิเคราะห์เลือด (complete blood count) วิเคราะห์ค่าเคมีในซีรัม (serum biochemistry) และการตรวจวิเคราะห์ปัสสาวะ (urinalysis) ร่วมกับการประเมินตะกอน และการเพาะเชื้อแบคทีเรียและหาความไวยาปฏิชีวนะ และการหาอัตราส่วน protein ต่อ creatine โดยหากมีการระบุไว้ การตรวจเหล่านี้จะแสดงให้เห็นถึงการเปลี่ยนแปลงอย่างไม่จำเพาะเจาะจงในสุนัขที่มีภาวะ atypical hypoadrenocorticism อย่างไรก็ตามภาวะ mild non-regenerative anemia สามารถพบได้ เนื่องจากฮอร์โมน cortisol จะเพิ่มกระบวนการสร้างเม็ดเลือด (erythropoiesis) และลดการสลายเม็ดเลือดแดงเพื่อหมุนเวียน (erythrocyte turnover) แต่จะไม่พบการเปลี่ยนของเม็ดเลือดขาวชนิด stress leukogram หรือ reverse stress leukogram ซึ่งอาจเป็นตัวบ่งชี้ที่มีความเข้าใจยาก และก่อให้เกิดความผิดพลาดในการแปลผลได้หากไม่มีความเชี่ยวชาญ (แสดงในตารางที่ 1) หากพิจารณาผลของฮอร์โมน glucocorticoids ต่อเม็ดเลือดขาวชนิด neutrophil และ lymphocyte หากอัตราส่วนของเม็ดเลือดขาว neutrophil ต่อ lymphocyte น้อยกว่าหรือเท่ากับ 2.3 ควรตั้งข้อสงสัยเกี่ยวกับภาวะ hypoadrenocorticism [15]
ตารางที่ 1 ผลการตรวจเลือดของสุนัข อายุ 6 ปี เพศเมีย ที่มีภาวะ hypoadrenocorticism แสดงให้เห็นถึงการเกิด reverse stress leukogram ที่ประกอบไปด้วยเม็ดเลือดขาว lymphocyte สูงเล็กน้อย (mild lymphocytosis) eosinophil สูง (eosinophilia) และมีอัตราส่วน neutrophil ต่อ lymphocyte (N/L-R) อยู่ที่ 1.31 ซึ่งหาก N/L-R มีค่าน้อยกว่าหรือเท่ากับ 2.3 ควรพิจารณาการเกิดภาวะ hypoadrenocorticism
| พารามิเตอร์ | ผลการตรวจ | หน่วยวัด | ช่วงค่ามาตรฐาน |
|---|---|---|---|
| ตรวจวิเคราะห์เม็ดเลือดแดง | |||
| Hematocrit | 33.8 | % | 37.3-61.7 |
| MCV | 61.2 | fL | 61.6-73.5 |
| MCH | 22.3 | pg | 21.2-25.9 |
| ตรวจวิเคราะห์เม็ดเลือดขาว | |||
| Neutrophil count | 7.53* | x 109/L | 2.95-11.64 |
| Lymphocyte count | 5.75* | x 109/L | 1.05-5.10 |
| Monocyte count | 0.67 | x 109/L | 0.16-1.12 |
| Eosinophil count | 1.25 | x 109/L | 0.06-1.23 |
| Basophil count | 0.07 | x 109/L | 0.00-0.10 |
| ตรวจวิเคราะห์เกล็ดเลือด | |||
| Platelet count | 368 | K/µl | 148-484 |
| MPV | 9.7 | fL | 8.7-13.2 |
*อัตราส่วน neutrophil ต่อ lymphocyte (N/L-R) อยู่ที่ 1.31
ภาวะน้ำตาลในเลือดต่ำ (Hypoglycemia) ภาวะโปรตีนในเลือดต่ำ (hypoalbuminemia) ภาวะไขมันในเลือดต่ำ (hypocholesterolemia) อาจร่วมกับการมีความผิดปกติของเซลล์ตับทำให้มีเอนไซม์ตับในเลือดเพิ่มสูงขึ้น (hepatocellular pattern of enzyme increase) เช่น การเพิ่มขึ้นของเอนไซม์ ALT ในซีรัมสูงกว่าการเพิ่มขึ้นของ ALP และการเกิดภาวะ prerenal azotemia ระดับเล็กน้อยถึงปานกลาง อาจพบได้ในสุนัขที่เกิดภาวะ hypoadrenocorticism [1]. อย่างไรก็ตามการแยกความแตกต่างระหว่าง renal azotemia เป็นเรื่องที่ยาก เนื่องจากสุนัขที่มีภาวะ hypoadrenocorticism มักมีความสามารถในการเจือจางปัสสาวะลดลง โดยความถ่วงจำเพาะของปัสสาวะจะมีค่าน้อยกว่า 1.030 การพบอาการทางคลินิกเหล่านี้บางส่วน หรือทั้งหมดนำไปสู่การตั้งข้อสงสัยการเกิดภาวะ hypoadrenocorticism หรืออย่างน้อยควรจะเป็นเหตุที่ไม่ละทิ้งข้อสงสัยต่อความเป็นไปได้ในการเกิดภาวะนี้ก่อนที่จะทำการประเมินลำดับถัดไปเพื่อวินิจฉัยแยกโรคอื่น เช่น โรคตับเรื้อรัง (chronic hepatopathy) ด้วยวิธีการวินิจฉัย invasive diagnostic approach และจำเป็นต้องได้รับการดมยาสลบ ซึ่งเป็นจุดสำคัญหากต้องมีการวินิจฉัยด้วยวิธีที่ invasive ซึ่งอาจทำให้สุนัขที่ไม่สามารถปรับตัวกับภาวะต่อมหมวกไตชั้นนอกทำงานน้อยกว่าปกติ (decompensated hypoadrenocorticism) เกิดความเครียด และนำไปสู่อันตรายถึงชีวิตได้ การเกิดภาวะ Hyperkalemia และ hyponatremia จะเห็นได้จากอัตราส่วนของ sodium ต่อ potassium ที่ลดลงน้อยกว่า 27 เป็นลักษณะที่พบได้ใน typical form of hypoadrenocorticism (แสดงในตารางที่2) [4] การใช้เครื่องมือที่ทันสมัยมาช่วยในการตรวจสุขภาพ โดยเฉพาะ algorithms ที่ช่วยผสานผลการตรวจหลายๆอย่างเข้าด้วยกัน อาจช่วยในการค้นหาการเกิด atypical hypoadrenocorticism ในอนาคตได้มากขึ้น [16]
ตารางที่ 2 วิเคราะห์ค่าเคมี และอิเล็กโทรไลต์ในซีรัม จากสุนัขพันธุ์ Boxer (ในรูปที่ 3) จากผลการตรวจส่วนมากไม่พบความผิดปกติ มีเพียงการเกิดภาวะ hypoalbuminemia และระดับไขมัน (serum cholesterol) และน้ำตาล (glucose concentrations) ในเลือดอยู่ในระดับขอบล่างของระดับปกติ ซึ่งตั้งข้อสงสัยว่าอาจมีการเกิด protein-losing enteropathy
| พารามิเตอร์ | ผลการตรวจ | หน่วยวัด | ช่วงค่ามาตรฐาน |
|---|---|---|---|
| Glucose | 97 | mg/dL | 57-126 |
| Cholesterol | 167 | mg/dL | 139-398 |
| SDMA | 11 | µg/dL | 0-14 |
| Creatinine | 1.1 | mg/dL | 0.5-1.5 |
| BUN | 21 | mg/dL | 9-29 |
| Phosphate | 1.1 | mmol/L | 0.9-1.7 |
| Calcium | 2.3 | mmol/L | 2.1-2.9 |
| ALT | 72 | U/L | 25-122 |
| ALP | 37 | U/L | 14-147 |
| Total protein | 5.9 | g/dL | 5.4-7.6 |
| Albumin | 2.3 | g/dL | 2.8-4.3 |
| Bilirubin | 0.2 | mg/dL | 0-0.4 |
| Sodium | 145 | mmol/L | 142-153 |
| Potassium | 4.2 | mmol/L | 3.9-5.8 |
การทดสอบระบบต่อมไร้ท่อ
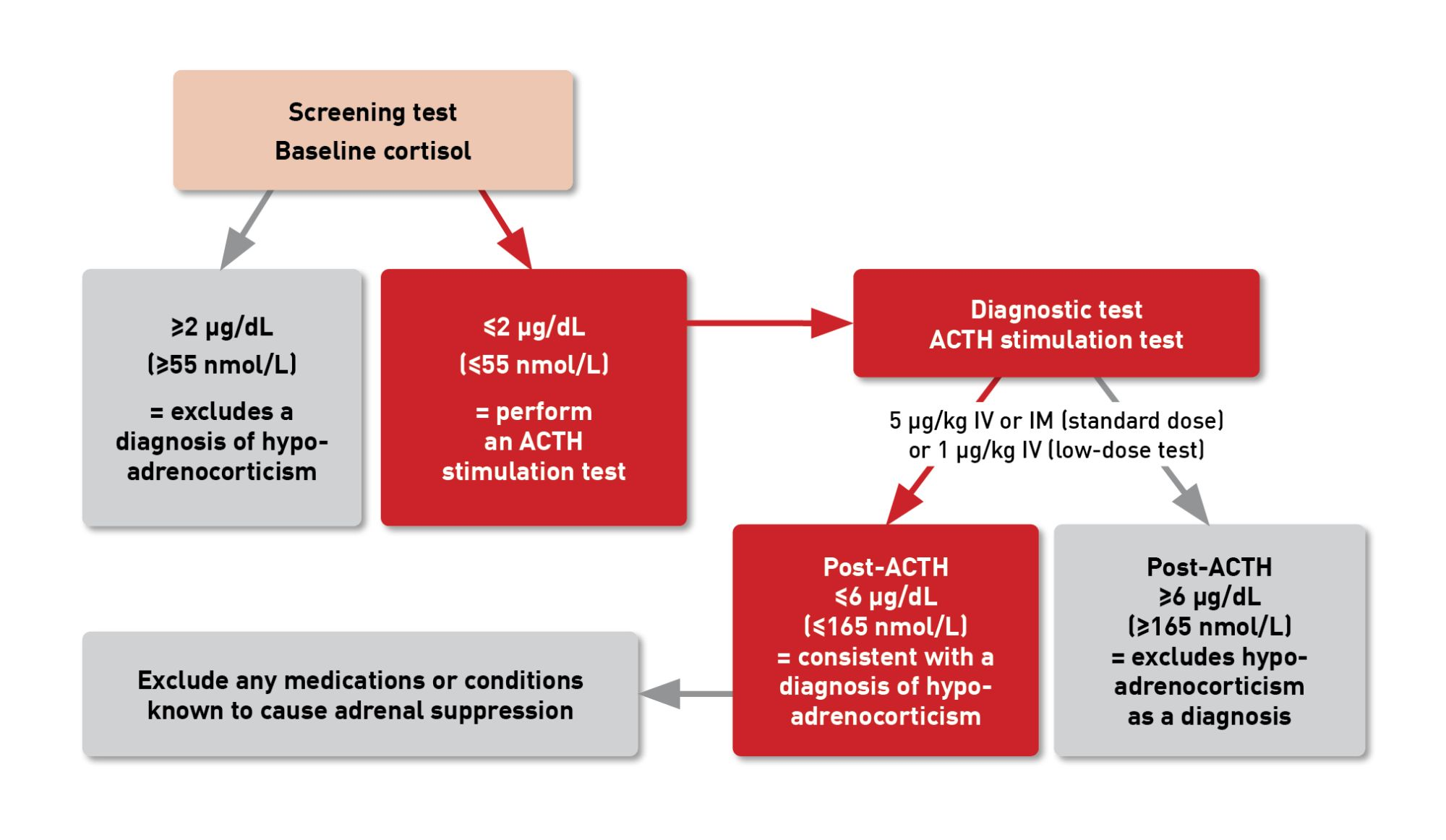
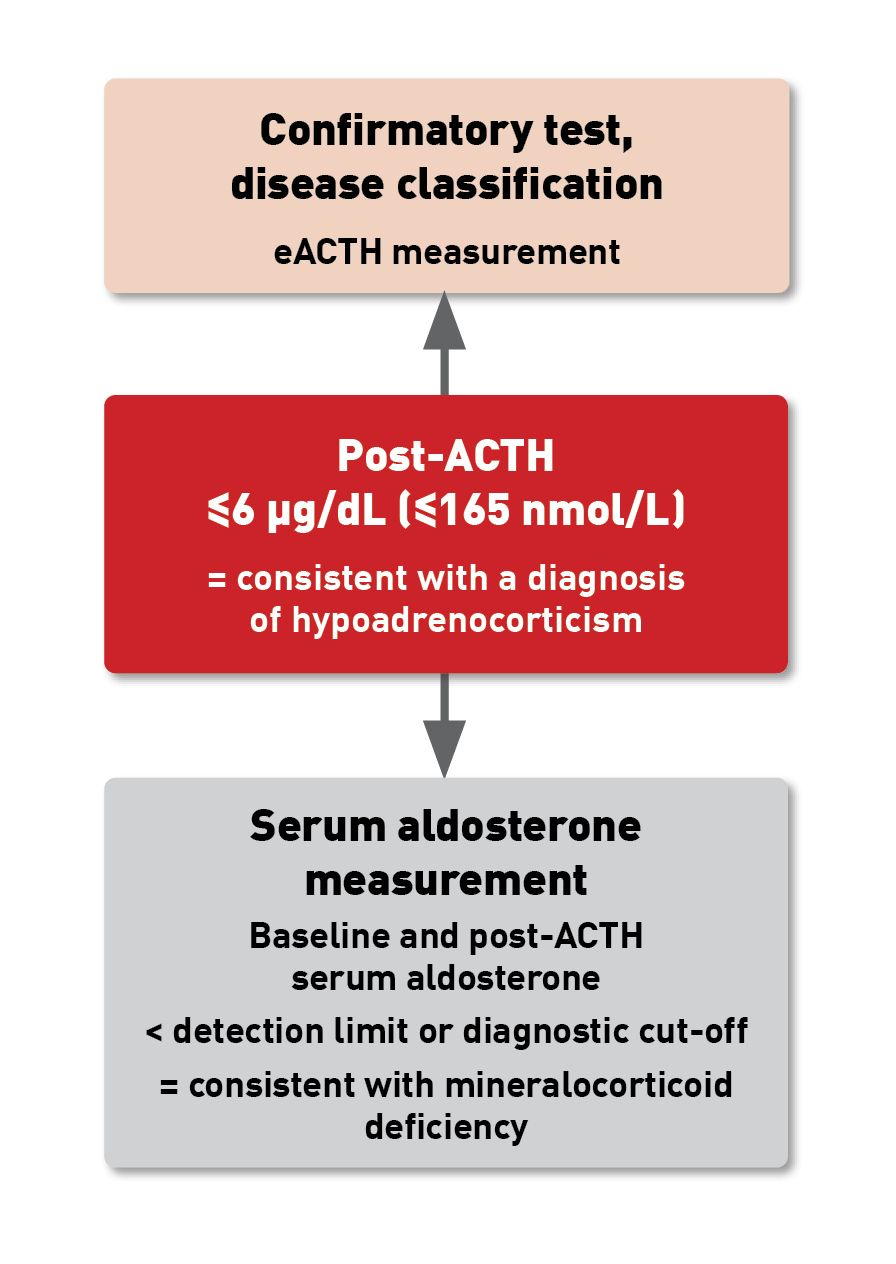
การตรวจวัดความเข้มข้นของฮอร์โมน Cortisol ระดับปกติในซีรัม (serum baseline cortisol concentration) มีประโยชน์อย่างมากในการคัดกรองเบื้องต้น (แสดงในตารางที่ 3) การ cut-off ของค่าพื้นฐานที่ 2 µg/dL หรือ 55 nmol/L จะช่วยในการตัดความเป็นไปได้ของการเกิดภาวะ hypoadrenocorticism ออกไปได้ ซึ่งการทำเช่นนี้จะมีความไวอยู่ที่ 100% และมีความจำเพาะ 63-78% (แสดงในตารางที่ 4) [17],[18] แต่ถ้าค่าพื้นฐานน้อยกว่า 2 µg/dL จำเป็นต้องมีการทำ ACTH stimulation test เพิ่มเติม เพื่อวินิจฉัยแยกโรคอื่นและตัดภาวะ hypoadrenocorticism ออกไปได้ [1],[17],[18] ขณะที่ถ้ามีค่ามากกว่า 6 µg/dL จะถูกตั้งข้อสงสัยเป็นพิเศษสำหรับการเกิดภาวะ hypoadrenocorticism ส่วนการทดสอบ Low-dose ACTH-stimulation testing ด้วยการใช้ cosyntropin ขนาดยา 1 µg/kg บริหารยาเข้าเส้นเลือดดำ (ขนาดยาที่ใช้กันโดยทั่วไป 5 µg/kg) ซึ่งเป็นขนาดยาที่มีประสิทธิภาพในการวินิจฉัยภาวะ hypoadrenocorticism ในสุนัข [19] การวัดความเข้มข้นของ endogenous ACTH (eACTH) สามารถใช้เพื่อยืนยัน และจำแนกภาวะ hypoadrenocorticism ว่าเป็นประเภทปฐมภูมิ หรือทุติยภูมิได้ (แสดงในตารางที่ 5) [1],[15] ซึ่งจะแยกภาวะ hypoadrenocorticism แบบปฐมภูมิ (ต้นกำเนิดความผิดปกติมาจากต่อมหมวกไต) ได้จากความสัมพันธ์กับความเข้มข้นของ eACTH ในระดับปกติหรือสูง ในขณะที่ภาวะ hypoadrenocorticism แบบทุติยภูมิ (ต้นกำเนิดความผิดปกติมาจากสมองส่วน hypothalamus และ/หรือต่อมใต้สมอง) จะตรวจพบ eACTH ในระดับต่ำ หรือตรวจไม่พบเลย
ตารางที่ 3 ผลการตรวจฮอร์โมนจากต่อมไทรอยด์ และระบบทางเดินอาหารของสุนัขสายพันธุ์ Boxer ที่มีภาวะ atypical hypoadrenocorticism (จากรูปภาพที่ 3) พบความเข้มข้นของ total thyroxine และ free thyroxine อยู่ในระดับต่ำ พบภาวะ hypercobalaminemia โดยไม่มีการเสริมก่อนการตรวจ และพบภาวะ hypocortisolemia (ต่ำกว่าจุด cut-off ที่ใช้สำหรับการทดสอบ ณ ความเข้มข้น 55 nmol/L)
| พารามิเตอร์ | ผลการตรวจ | หน่วยวัด | ช่วงค่ามาตรฐาน |
|---|---|---|---|
| ฮอร์โมนจากต่อมไทรอยด์ | |||
| Total T4 | 0.8 | µg/dL | 1.0-4.0 |
| Free T4 | < 0.3 | ng/dL | 0.6-3.7 |
| ฮอร์โมนและเอนไซม์จากระบบทางเดินอาหาร | |||
| Spec cPL | 142 | µg/dL | 0-200 |
| cTLI | 37 | µg/dL | 8.5-35 |
| Cobalamin | 1 355 | pmol/L | 173-599 |
| Folate | 25.9 | nmol/L | 21.1-54 |
| Cortisol (baseline) |
6.5
|
nmol/L | 25-125 |
อัตราส่วนคอร์ติซอลต่อครีเอตินีนในปัสสาวะ (UCCR) ได้รับความสนใจในการวินิจฉัยภาวะต่อมหมวกไตอักเสบในสุนัข และค่า UCCR ต่ำ (≤ 2 วัดโดยการตรวจด้วยวิธีกัมมันตภาพรังสีหรือ ≤ 10 โดยการตรวจด้วยวิธีเคมีบำบัด) มีความไวสูงและเฉพาะเจาะจงในการแยกแยะสุนัขที่ได้รับผลกระทบจากสุนัขเหล่านั้น มีโรคที่เลียนแบบภาวะต่อมหมวกไตทำงานผิดปกติ [20]
ภาวะขาดแร่ธาตุคอร์ติคอยด์ (Mineralocorticoid) โดยไม่มีภาวะโพแทสเซียมสูง (hyperkalemia) และ/หรือภาวะโซเดียมในเลือดต่ำ (hyponatremia) ซึ่งสันนิษฐานว่าได้รับการชดเชยเป็นหลักผ่านกลไกของไต สามารถตรวจพบได้โดยการวัดการกระตุ้นด้วยฮอร์โมนอัลโดสเตอโรนก่อนและหลัง ACTH (แสดงในตารางที่ 6) การทดสอบนี้สามารถช่วยแยกแยะกรณีภาวะ atypical hypoadrenocorticism ซึ่งมีภาวะพร่องกลูโคคอร์ติคอยด์จากสุนัขที่มีภาวะพร่องคอร์ติโคสเตียรอยด์รวมกัน (combined corticosteroid deficiency) แต่ไม่มีการเปลี่ยนแปลงของอิเล็กโทรไลต์ [21]. โปรไฟล์ของต่อมไทรอยด์ในสุนัขที่มีภาวะ hypoadrenocorticism อาจเผยให้เห็นระดับ TSH ในซีรั่มที่เพิ่มขึ้น และในบางกรณี ระดับไทรอกซีน (thyroxine) ลดลง (แสดงในตารางที่ 3); ผลเหล่านี้ไม่ได้สะท้อนถึงภาวะต่อมไทรอยด์ทำงานเกินจริง และระดับจะเป็นปกติภายในไม่กี่สัปดาห์ (นานถึง 4 เดือน) หลังจากเริ่มการรักษาภาวะต่อมหมวกไตเสื่อม [22]
ตารางที่ 6 ระดับคอร์ติซอลและอัลโดสเตอโรนในซีรั่มก่อนและหลัง ACTH จากสุนัขพันธุ์ Boxer ในรูปที่ 3 ความเข้มข้นของคอร์ติซอลและอัลโดสเตอโรนในซีรั่มไม่เพิ่มขึ้นหลังการกระตุ้น ACTH ซึ่งยืนยันทั้งการขาดกลูโคคอร์ติคอยด์และ (ชดเชย) การขาดแร่ธาตุคอร์ติคอยด์ในสุนัขตัวนี้
| พารามิเตอร์ | ผลการตรวจ | หน่วยวัด | ค่ามาตรฐาน |
|---|---|---|---|
| ACTH stimulation test (serum cortisol) | |||
| Cortisol (baseline) | < 2.8 | nmol/L | 25-125 |
| Cortisol (post-ACTH) |
< 2.8
|
nmol/L |
> 165
|
| ACTH stimulation test (serum aldosterone) | |||
| Aldosterone (baseline) | < 20 | pmol/L | 0-393 |
| Aldosterone (post-ACTH) | < 20 | pmol/L | 82-859 |
ภาพวินิจฉัย
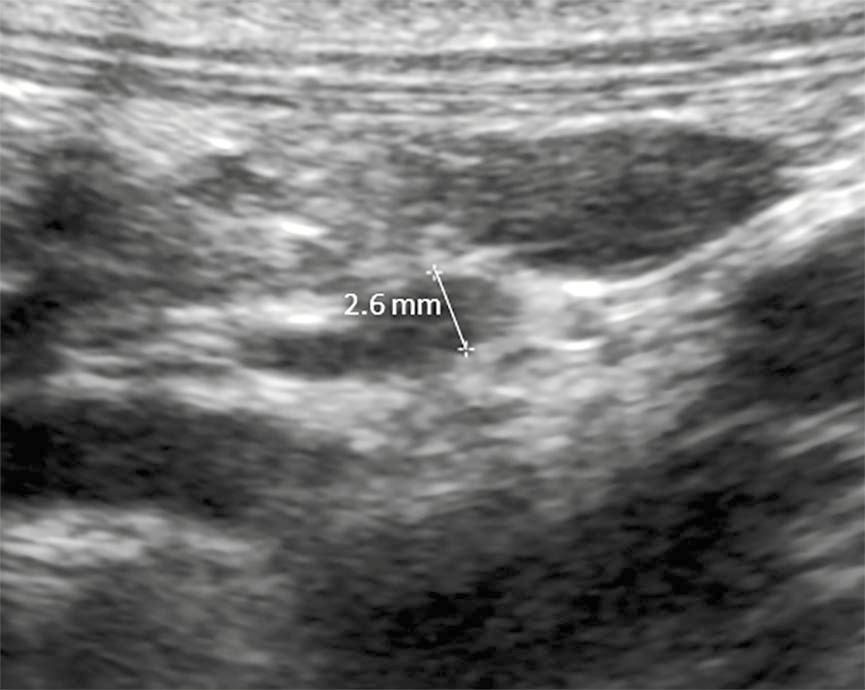
การถ่ายภาพรังสีบริเวณทรวงอกและช่องท้อง มักไม่ค่อยมีประโยชน์ในสุนัขที่มีภาวะ hypoadrenocorticism ยกเว้นสุนัขได้รับการจะประเมินว่ามีภาวะต่อมหมวกไตโตที่เกี่ยวข้องกับภาวะโรคหลอดอาหารขยายใหญ่ (hypoadrenocorticism-associated megaesophagus) ซึ่งอาจได้รับการพิจารณาเพื่อวินิจฉัยแยกโรค การอัลตราซาวนด์ช่องท้องซึ่งรวมถึงการประเมินต่อมหมวกไตทั้งสองอย่างละเอียด มักไม่มีนัยสำคัญเช่นกัน แต่อาจบ่งบอกถึงภาวะ hypoadrenocorticism หากเส้นผ่านศูนย์กลางของต่อมหมวกไตมีขนาดเล็ก (แสดงในรูปที่ 4) แนะนำให้ใช้อัลตราซาวนด์ในกรณีที่ต้องสงสัยเพื่อวินิจฉัยหรือวินิจฉัยเนื้องอกในต่อมหมวกไต (adrenal neoplasia) กล้ามเนื้อหัวใจตาย(infarction) หรือภาวะเลือดออก (hemorrhage) [1]
Texas AM University
การรักษาภาวะ atypical hypoadrenocorticism
การเริ่มต้นการรักษา
สุนัขที่มีภาวะ atypical hypoadrenocorticism มักจะมีอาการทางคลินิกและสามารถรักษาได้แบบผู้ป่วยนอก อย่างไรก็ตาม หากพบว่ามีภาวะขาดน้ำ (dehydration) ระหว่างการตรวจเบื้องต้นควรที่จะดูแลด้วยการรักษาโดยสารน้ำทดแทน (โดยใช้สารละลายอิเล็กโทรไลต์) และการรักษาตามอาการเพิ่มเติม (เช่น ยาแก้อาเจียนและยาป้องกันทางเดินอาหาร) ตามที่ระบุไว้ ภาวะน้ำตาลในเลือดต่ำควรได้รับการแก้ไขโดยการบริหารกลูโคสทางหลอดเลือดดำ (สารละลายเดกซ์โทรส) และควรตรวจสอบระดับน้ำตาลในเลือด
Prednisolone หรือ prednisone เป็นยาที่ได้รับการเลือกใช้เพื่อทดแทนการขาดกลูโคคอร์ติคอยด์ภายนอก [1],[2],[3] กลูโคคอร์ติคอยด์ที่ออกฤทธิ์เร็ว (เช่น เดกซาเมทาโซน, ไฮโดรคอร์ติโซน) มักใช้ในการบำบัดทดแทนกลูโคคอร์ติคอยด์แบบเฉียบพลันในผู้ป่วยที่มีภาวะวิกฤติต่อมหมวกไต(Addisonian crisis) การให้ Prednisolone ในระยะเริ่มต้นควรเริ่มด้วยขนาดในต้านการอักเสบต่ำ (0.3-0.5 มก./กก. รับประทานทุกๆ 12-24 ชม.) เป็นเวลาสองสามวัน [1],[2] ระยะการชักนำ (induction phase) ระยะสั้นนี้ตามด้วยการค่อยๆ ลดขนาดยาลงให้เหลือระดับต่ำที่สุดที่เป็นไปได้ (“ทางสรีรวิทยา”) ซึ่งยังคงรักษาภาวะพร่องกลูโคคอร์ติคอยด์จากภายนอก (endogenous glucocorticoid deficiency) ได้อย่างมีประสิทธิภาพ โดยไม่ก่อให้เกิดผลข้างเคียง และดำเนินการต่อไปเป็นการบำบัดแบบบำรุงรักษา (maintenance therapy) โดยการหาขนาดยาที่เหมาะสมที่สุดสำหรับสุนัขแต่ละตัวจะต้องใช้เวลาสักระยะ รวมถึงต้องการความอดทนจากเจ้าของ แต่โดยปกติจะอยู่ระหว่าง 0.05-0.2 มก./กก. รับประทานทุก 24 ชม. ขึ้นอยู่กับขนาดและอายุของสุนัข (กล่องข้อความที่ 7) ขึ้นอยู่กับลักษณะและอารมณ์ของสุนัข อาจพิจารณาเพิ่มขนาดยา Prednisolone หรือ prednisone ในระยะสั้นในช่วงเวลาที่คาดว่าจะเกิดความเครียด [1],[2]
กล่องที่ 7 การปรับขนาดยากลูโคคอร์ติคอยด์ที่แนะนำโดยพิจารณาจากอาการทางคลินิกและความสงสัยว่าใช้ยาเกินขนาดหรือให้ยาเกินขนาด
|
• Noticeable glucocorticoid side effects → dose reduction (by approx. 10-25%) • Recurrence of clinical signs (lethargy, anorexia, diarrhea) → dose increase (by approx. 50%) |
|
• Anticipated significant stress (e.g., agility trial, holiday fireworks, elective surgery)
→ consider briefly increasing the dose (by approx. 100-200%) in individual dogs |
การบำบัดทดแทนมิเนอรัลโลคอร์ติคอยด์ระบุไว้ในกรณีภาวะต่อมหมวกไตปกติ (เช่น สุนัขที่มีการเปลี่ยนแปลงของอิเล็กโทรไลต์ซึ่งสะท้อนถึงภาวะขาดแร่ธาตุคอร์ติคอยด์ไปพร้อมๆ กัน) แต่ควรพิจารณาอย่างรอบคอบในสุนัขที่ได้รับการวินิจฉัยว่ามีภาวะต่อมหมวกไตผิดปกติ โดยขึ้นอยู่กับสถานะของมิเนอรัลโลคอร์ติคอยด์ภายนอก หากความเข้มข้นของอัลโดสเตอโรนในเลือดต่ำหรือตรวจไม่พบ ควรติดตามอิเล็กโทรไลต์ในซีรั่มอย่างใกล้ชิด อีกทางหนึ่ง อาจพิจารณาการเสริมมิเนอรัลโลคอร์ติคอยด์ขนาดต่ำ (เดสออกซีคอร์ติโคสเตอโรน พิวาเลตที่ขนาดเริ่มต้น 1.5 มก./กก. เซาท์แคโรไลนา ทุก ๆ 25-28 วัน) [23] อาจได้รับการพิจารณา ขณะนี้ อย่างน้อยในทางทฤษฎีสามารถบรรเทากลไกที่ชดเชย (วัดได้) การขาดแร่ธาตุคอร์ติคอยด์ การบำบัดทดแทนมิเนอรัลโลคอร์ติคอยด์ในระยะยาวยังต้องมีการตรวจสอบผู้ป่วยอย่างระมัดระวัง (อิเล็กโทรไลต์ในซีรั่ม ความดันโลหิตทั่วร่างกาย) และอาจมีความเสี่ยงต่อผลข้างเคียงที่อาจเกิดขึ้น [24] สุนัขที่ได้รับการวินิจฉัยว่ามีภาวะต่อมหมวกไตไม่ปกติโดยมีระดับความเข้มข้นของอัลโดสเตอโรนในซีรัมที่ปกติและ/หรือกระตุ้น ACTH ต้องการเพียงการทดแทนกลูโคคอร์ติคอยด์เท่านั้น แต่ควรตรวจสอบอิเล็กโทรไลต์ในซีรั่มในสุนัขเหล่านี้เป็นประจำ
การติดตามการรักษา
ผลข้างเคียงของกลูโคคอร์ติคอยด์ (เช่น ภาวะกินน้ำมาก (polydipsia)/ภาวะปัสสาวะบ่อย (polyuria), ภาวะกินบ่อย (polyphagia), น้ำหนักที่เพิ่มขึ้น, การสูญเสียกล้ามเนื้อไร้ไขมัน, การหอบ, การเปลี่ยนแปลงของผิวหนังและขน, การเปลี่ยนแปลงพฤติกรรม) อาจยังคงเกิดขึ้นกับขนาดยา prednisone/prednisolone ที่ต่ำมาก และจำเป็นต้องลดขนาดยาลงประมาณ 10-15 % (กล่องข้อความที่ 7) ไฮโดรคอร์ติโซน (hydrocortisone) อาจเป็นทางเลือกที่ดีสำหรับการเสริมกลูโคคอร์ติคอยด์ในสุนัขบางตัวหรือไม่ จำเป็นต้องได้รับการตรวจสอบเพิ่มเติม โดยความง่วง ความอ่อนแอ ภาวะขาดออกซิเจนหรือเบื่ออาหาร การอาเจียน และท้องเสีย อาจบ่งบอกถึงการทดแทนกลูโคคอร์ติคอยด์ที่ต่ำกว่าปกติในสุนัขที่มีภาวะต่อมหมวกไตเสื่อม และจะต้องเพิ่มขนาดยาประมาณ 50% [1],[2],[3]
สุนัขที่มีภาวะ atypical hypoadrenocorticism และได้รับการทดแทนมิเนอรัลโลคอร์ติคอยด์ (mineralocorticoid substitution) ควรได้รับการตรวจซ้ำทุกๆ 2-4 สัปดาห์ (ปกติคือ 10-14 วัน และอีกครั้ง 25-28 วันหลังจากเริ่มเสริมด้วย desoxycorticosterone pivalate) [23] การประเมินผลข้างเคียงที่อาจเกิดขึ้นจากการรักษาอย่างรอบคอบคือ รับประกันในสุนัขที่มีภาวะต่อมหมวกไตต่ำ Polyuria และ polydipsia ซึ่งโดยทั่วไปจะตีความว่าเป็นผลข้างเคียงของการเสริม predniso(lo)ne (มากเกินไป) ยังสามารถสะท้อนถึงแร่ธาตุคอร์ติคอยด์ (เช่น desoxycorticosterone) ที่ให้ยาเกินขนาด [23]. สุนัขที่ได้รับการวินิจฉัยว่ามีภาวะ atypical hypoadrenocorticism ซึ่งมีความเข้มข้นของอัลโดสเตอโรนในซีรั่มที่พื้นฐานปกติและ/หรือกระตุ้น ACTH ต้องการเพียงการทดแทนกลูโคคอร์ติคอยด์เท่านั้น แต่ควรตรวจสอบอิเล็กโทรไลต์ในซีรั่มในสุนัขเหล่านี้เป็นประจำอีกด้วย [1],[23]
สุนัขที่ได้รับการวินิจฉัยว่ามีภาวะต่อมหมวกไตไม่ปกติโดยมีระดับความเข้มข้นของอัลโดสเตอโรนในซีรัมที่ปกติและ/หรือกระตุ้น ACTH ต้องการเพียงการทดแทนกลูโคคอร์ติคอยด์เท่านั้น แต่ควรตรวจสอบอิเล็กโทรไลต์ในซีรั่มในสุนัขเหล่านี้เป็นประจำ
การพยากรณ์โรคสำหรับกรณีภาวะต่อมหมวกไตต่ำ (hypoadrenocorticism)
ด้วย glucocorticoid ที่เพียงพอ และหากมีการระบุหรือเลือก การเสริม mineralocorticoid และการประเมินติดตามผลของผู้ป่วยเป็นระยะๆ ภาวะ atypical hypoadrenocorticism มักจะมีการพยากรณ์โรคในระยะยาวที่ดีมาก (รูปที่ 5) [1],[2],[25] การติดตามการลุกลามของภาวะ typical hypoadrenocorticism (เช่น การพัฒนาของภาวะโพแทสเซียมสูงและ/หรือภาวะโซเดียมในเลือดต่ำ) เป็นสิ่งสำคัญในการจัดการระยะยาวของสุนัขที่มีภาวะ atypical hypoadrenocorticism ซึ่งได้รับการบำบัดด้วย glucocorticoid เพียงอย่างเดียว [2],[21] ผู้เขียนแนะนำให้ตรวจสอบซีรั่มอิเล็กโทรไลต์อีกครั้งในกรณีเหล่านี้ทุก 3-6 เดือน ในปัจจุบันยังไม่มีแนวทางเกี่ยวกับความถี่ของการติดตามหรือการเริ่มเสริมมิเนอรัลโลคอร์ติคอยด์ในสุนัขที่มีภาวะขาดฮอร์โมนอัลโดสเตอโรนโดยไม่มีการเปลี่ยนแปลงอิเล็กโทรไลต์ใดๆ ที่ชัดเจน

บทสรุป
เจ้าของมักจะรับรู้ย้อนหลังถึงการเกิดภาวะ hypoadrenocorticism และมักจะกี่ยวข้องกับอาการทางคลีนิกที่เปลี่ยนไปเมื่อสัตว์เลี้ยงของพวกเขาแสดงการพัฒนาอย่างรวดเร็วและคุณภาพชีวิตที่ดีขึ้นในการตอบสนองต่อการรักษา โรคนี้จำเป็นต้องได้รับการบำบัดและการจัดการตลอดชีวิต และมักถูกมองว่าเป็นการเพิ่มความผูกพันระหว่างสัตว์เลี้ยงและมนุษย์ แต่เจ้าของบางคนกลัวว่าจะเกิดภาวะวิกฤติต่อมหมวกไต (Addisonian crisis) และไม่เต็มใจที่จะปล่อยสุนัขไว้โดยไม่ได้รับการดูแล อย่างไรก็ตาม เจ้าของส่วนใหญ่รู้สึกสบายใจที่จะจัดการกับสุนัขที่มีภาวะ hypoadrenocorticism เองที่บ้านทุกรูปแบบ และจะรู้หรือเรียนรู้สิ่งที่ควรสังเกตสำหรับการเปลี่ยนแปลงคุณภาพชีวิตที่จำเป็นต้องได้รับการดูแลจากสัตวแพทย์เพิ่มเติม
Romy M. Heilmann
Prof. Dr. med. vet., Dip. ACVIM (SAIM), Dip. ECVIM-CA, MANZCVS (Small Animal Medicine), Ph.D., Department for Small Animals, Veterinary Teaching Hospital, College of Veterinary Medicine, University of Leipzig, Germany
สหพันธ์สาธารณรัฐเยอรมนี
Professor Heilmann is an ACVIM- and ECVIM-boarded certified small animal internist, with a special interest in gastroenterology, hepatology, clinical immunology, and interventional radiology and endoscopy. After graduating in 2005 she worked in a small animal practice in Germany before returning to academia to gain her postgraduate doctoral degree. She then completed a rotating small animal internship in Switzerland before moving to Texas A&M University for a combined Small Animal Internal Medicine (ACVIM-SAIM)/Ph.D. program. She returned to Europe in 2015 as head internist at a Swiss veterinary specialist and referral center before being appointed to her current post as Professor and Head of the Small Animal Internal Medicine service at Leipzig University in 2016. Her research involves novel routes to the diagnosis and treatment of chronic gastroenteropathies in dogs and cats as well as other primary inflammatory disorders.
- Kalenyak K, Heilmann RM. Canine hypoadrenocorticism an update on pathogenesis, diagnosis and treatment. Tierarztl Prax. Ausg. K. Kleintiere Heimtiere 2018;46(3):163-175.
- Thompson AL, Scott-Moncrieff JC, Anderson JD. Comparison of classic hypoadrenocorticism with glucocorticoid-deficient hypoadrenocorticism in dogs: 46 cases (1985-2005). J. Am. Vet. Med. Assoc. 2007;230:1190-1194.
- Schofield I, Woolhead V, Johnson A, et al. Hypoadrenocorticism in dogs under UK primary veterinary care: frequency, clinical approaches and risk factors. J. Small Anim. Pract. 2021;62(5):343-350.
- Gershony LC, Belanger JM, Hytnen MK, et al. Genetic characterization of Addisons disease in Bearded Collies. BMC Genomics 2020;21(1):833.
- Treeful AE, Rendahl AK, Friedenberg SG. DLA class II haplotypes show sex-specific associations with primary hypoadrenocorticism in Standard Poodle dogs. Immunogenetics 2019;71(5-6):373-382.
- Boag AM, Short A, Kennedy LJ, et al. Polymorphisms in the CTLA4 promotor sequence are associated with canine hypoadrenocorticism. Canine Med. Genet. 2020;7:2.
- Boag AM, Christie MR, McLaughlin KA, et al. Autoantibodies against cytochrome P450 side-chain cleavage enzyme in dogs (Canis lupus familiaris) affected with hypoadrenocorticism (Addisons disease). PLoS One 2015;10(11):e0143458.
- Labelle P, DeCock HEV. Metastatic tumors to the adrenal glands in domestic animals. Vet. Pathol. 2005;42:52-58.
- Buckley ME, Chapman PS, Walsh A. Glucocorticoid-deficient hypoadrenocorticism secondary to intravascular lymphoma in the adrenal glands of a dog. Aust. Vet. J. 2017;95(3):64-67.
- Lee N, Choi J, Yoon J. Presumptive nontraumatic adrenal hemorrhage preceding hypoadrenocorticism in a dog. J. Vet. Intern. Med. 2022;DOI: 10.1111/jvim.16531.
- Polledo L, Oliveira M, Adamany J, et al. Hypophysitis, panhypopituitarism, and hypothalamitis in a Scottish Terrier dog. J. Vet. Intern. Med. 2017;31(5):1527-1532.
- Gunasekaran T, Sanders RA. Ventricular systolic dysfunction in dogs diagnosed with hypoadrenocorticism. J. Vet. Cardiol. 2022;41:231-235.
- Hauck C, Schmitz SS, Burgener IA, et al. Prevalence and characterization of hypoadrenocorticism in dogs with signs of chronic gastrointestinal disease: a multicenter study. J. Vet. Intern. Med. 2020;34(4):1399-1405.
- Gallego AF, Gow AG, Boag AM. Evaluation of resting cortisol concentration testing in dogs with chronic gastrointestinal signs. J. Vet. Intern. Med. 2022;36(2):525-531.
- Zeugswetter FK, Schwendenwein I. Diagnostic efficacy of the leukogram and the chemiluminometric ACTH measurement to diagnose canine hypoadrenocorticism. Tierarztl. Prax. Ausg. K. Kleintiere Heimtiere 2014;42(2):223-230.
- Reagan KL, Reagan BA, Gilor C. Machine learning algorithm as a diagnostic tool for hypoadrenocorticism in dogs. Domest. Anim. Endocrinol. 2020;72:106396.
- Lennon EM, Boyle TE, Hutchins RG, et al. Use of basal serum or plasma cortisol concentrations to rule out a diagnosis of hypoadrenocorticism in dogs: 123 cases (2000-2005). J. Am. Vet. Med. Assoc. 2007;231(3):413-416.
- Bovens C, Tennant K, Reeve J, et al. Basal serum cortisol concentration as a screening test for hypoadrenocorticism in dogs. J. Vet. Intern. Med. 2014;28(5):1541-1545.
- Botsford A, Behrend EN, Kemppainen RJ, et al. Low-dose ACTH stimulation testing in dogs suspected of hypoadrenocorticism. J. Vet. Intern. Med. 2018;32(6):1886-1890.
- Moya MV, Refsal KR, Langlois DK. Investigation of the urine cortisol to creatinine ratio for the diagnosis of hypoadrenocorticism in dogs. J. Am. Vet. Med. Assoc. 2022;260(9):1041-1047.
- Baumstark ME, Sieber-Ruckstuhl NS, Mller C, et al. Evaluation of aldosterone concentrations in dogs with hypoadrenocorticism. J. Vet. Intern. Med. 2014;28(1):154-159.
- Reusch CE, Fracassi F, Sieber-Ruckstuhl NS, et al. Altered serum thyrotropin concentrations in dogs with primary hypoadrenocorticism before and during treatment. J. Vet. Intern. Med. 2017;31(6):1643-1648.
- Sieber-Ruckstuhl NS, Reusch CE, Hofer-Inteeworn N, et al. Evaluation of a low-dose desoxycorticosterone pivalate treatment protocol for long-term management of dogs with primary hypoadrenocorticism. J. Vet. Intern. Med. 2019;33(3):1266-1271.
- Casado Diaz JI, Sieber-Ruckstuhl NS, Boretti FS, et al. Evaluation of symmetric dimethylarginine and creatinine in dogs with primary hypoadrenocorticism receiving long-term mineralocorticoid replacement therapy. Vet. Rec. 2022;190(1):e242.
- Hupfeld J, Dlle M, Volk H, et al. Effect of long-term management of hypoadrenocorticism on the quality of life of affected dogs and their owners. Vet. Rec. 2022;8:e1977.
บทความอื่นๆ ในประเด็นนี้
แบ่งปันบนโซเชียลมีเดีย