ภาวะแคลเซียมในเลือดสูงที่เกี่ยวข้องกับพยาธิวิทยา
เขียนโดย Jordan M. Hampel และ Timothy M. Fan
บทความนี้จะพิจารณาถึงการวินิจฉัยแยกโรค (differential diagnoses) และตัวเลือกในการจัดการการรักษาเมื่อพบว่าสุนัขมีระดับแคลเซียมในเลือดสูง (แปลโดย น.สพ. พีระ มานิตยกุล)
Article
ประเด็นสำคัญ
การควบคุมระดับของแคลเซียมให้คงที่ (Calcium homeostasis) ถูกควบคุมอย่างเข้มงวดโดยฮอร์โมนพาราไธรอยด์ แคลซิโทนิน และวิตามินดี ซึ่งส่วนใหญ่ส่งผลต่อการเคลื่อนย้ายการขับออก และการดูดซึมของแคลเซียมที่บริเวณกระดูก ไตและลำไส้ตามลำดับ
สาเหตุที่พบได้บ่อยที่สุดของภาวะแคลเซียมในเลือดสูงในสุนัข ได้แก่ มะเร็ว ภาวะฮอร์โมนพาราไธรอยด์สูงแบบปฐมภูมิและภาวะต่อมหมวกไตชั้นนอกทำงานได้น้อยกว่าปกติ ภาวะแคลเซียมในเลือดสูงโดยไม่ทราบสาเหตุ พบได้บ่อยในแมว และพบได้น้อยในสุนัข
อาการแสดงทางคลินิกของภาวะแคลเซียมในเลือดสูง ได้แก่ ภาวะปัสสาวะมากชนิดปฐมภูมิร่วมกับภาวะดื่มน้ำมากชนิดทุติยภูมิ อ่อนแรง ซึม รบกวนระบบทางเดินอาหารและมีน้ำหนักลดลง
การแทรกแซงทางการแพทย์อย่างทันที เพิ่มการขับออกแคลเซียมออกมาในปัสสาวะ ร่วมกับการระบุสาเหตุและการรักษาสาเหตุที่แท้จริงของภาวะแคลเซียมในเลือดสูงนั้นมีความสำคัญอย่างยิ่งต่อการจัดการกับสัตว์ป่วยอย่างเหมาะสมเพื่อให้ได้ผลลัพธ์ที่น่าพึงพอใจ
บทนำ
แคลเซียมเป็นแร่ธาตุที่มีมากในร่างกายเป็นอันดับ 5 โดยมีอยู่ในรูปไอออนที่มีประจุบวกที่จำเป็น (essential cation) ซึ่งพบได้ในของเหลวภายในร่างกายและยังเก็บไว้ในออร์แกเนลล์ของเซลล์ (cellular organelles) อีกด้วย โดยแคลเซียมมีหน้าที่รับผิดชอบการทำงานที่สำคัญภายในเซลล์และนอกเซลล์ (intracellular and extracellular functions) รวมไปถึงการส่งสัญญาณประสาทไปยังกล้ามเนื้อ (neuromuscular transmission) ปฏิกิริยาที่เกี่ยวข้องกับเอนไซม์ (enzymatic reactions) การแข็งตัวของเลือด (blood coagulation) ความตึงตัวของหลอดเลือด (vasomotor tone) การหลั่งฮอร์โมน (hormone secretion) และการเมตาบอลิซึมของกระดูก (bone metabolism) ถึงแม้ว่าแคลเซียมจะกระจายไปทั่วเนื้อเยื่อเซลล์ (cellular tissues) แต่ความผันผวนอย่างรวดเร็วของระดับแคลเซียมภายในเซลล์ (intracellular calcium) จะทำหน้าที่เป็นตัวควบคุมหลัก (primary regulator) ของการตอบสนองของเซลล์ภายหลังจากการกระตุ้นที่ตัวรับบริเวณเยื่อหุ้มเซลล์ (plasma membrane receptor activation) และยังทำหน้าที่เป็นโมเลกุลส่งสัญญาณที่สอง (secondary messenger) ที่รับผิดชอบหน้าที่ในการขยายสัญญาณภายนอก (external signals) เข้าสู่เซลล์เพื่อประสานการทำงานของหน้าที่ทางชีวภาพ (biologic functions) [1]
ทั้งนี้แม้ว่าแคลเซียมภายในเซลล์ (intracellular calcium) จะมีความสำคัญอย่างยิ่งต่อกิจกรรมของเซลล์ตามปกติ (normal cellular activities) แต่การตรวจวัดทางคลินิก (clinical measurement) ของแคลเซียมนั้นจำกัดอยู่เพียงการมีอยู่ของแคลเซียมในของเหลวภายในร่างกายซึ่งมีอยู่ 3 รูปแบบที่แตกต่างกันคือ รูปอิสระ (ionized) รูปที่จับกับโปรตีน (protein-bound) และเชิงซ้อน (complexed) ด้วยไอออนที่มีประจุลบ (anions) กับกรดอินทรีย์ (organic acids) แคลเซียมรูปอิสระ (Ionized calcium; iCa) คือแคลเซียมที่อยู่ในรูปที่ร่างกายสามารถนำไปใช้ได้ทันที (biologically active form) โดยสามารถผ่านเยื่อหุ้มเซลล์ผ่านทางช่องไอออน (ion channels) ตัวขนส่งแบบใช้พลังงาน (active transporters) และตัวแลกเปลี่ยนที่มีไอออนประจุบวก (cation exchangers) [2] ซึ่งถือเป็นร้อยละ 50 ของระดับแคลเซียมในเลือดทั้งหมด (total serum calcium) ส่วนที่เหลือประมาณร้อยละ 40 จะเป็นแคลเซียมที่อยู่ในรูปที่จับกับโปรตีนและอีกร้อยละ 10 เป็นแคลเซียมเชิงซ้อน เมื่อพิจารณาถึงความสำคัญในการทำงานของเซลล์ ระดับความเข้มข้นของ iCa จะต้องได้รับการควบคุมอย่างเข้มงวดเพื่อให้แน่ใจว่ามีกิจกรรมทางสรีรวิทยา (physiologic activities) อย่างเหมาะสมของเซลล์ เนื้อเยื่อและระบบอวัยวะต่างๆผ่านการทำงานร่วมกันของฮอร์โมนพาราไธรอยด์ (parathyroid hormone; PTH) 1,25-dihydroxycholecalciferol (วิตามินดี 3 รูปแบบออกฤทธิ์ (active vitamin D3) หรือแคลซิไทรออล (calcitriol)) และแคลซิโทนิน (calcitonin) [3] เช่นเดียวกับความสำคัญของแคลเซียมต่อการส่งสัญญาณภายในเซลล์ (intracellular signaling) แคลเซียมภายในของเหลวภายนอกเซลล์ (calcium within extracellular fluid) ยังควบคุมการทำงานของเซลล์ (cellular functions) ของเนื้อเยื่อต่อมและเนื้อเยื่อบุผิวที่สำคัญ (vital glandular and epithelial tissues) หลายชนิด รวมไปถึงต่อมพาราไธรอยด์ (parathyroid gland) เซลล์ต่อมไทรอยด์ซี (thyroid C cells) และไต
การควบคุมระดับของแคลเซียมให้คงที่
สารสื่อกลาง (mediators) หลักสามชนิด ได้แก่ ฮอร์โมนพาราไธรอยด์ (PTH) แคลซิโทนินและแคลซิไทรออลนั้นมีหน้าที่รับผิดชอบในการปรับสมดุลระดับความเข้มข้นของแคลเซียมทั้งร่างกายผ่านการเสริมกิจกรรม (complementary) และ/หรือการเสริมฤทธิ์ (synergistic) ของกิจกรรมทางชีววิทยา (biologic activities) ในอวัยวะเป้าหมาย (target organ) ทั้ง 3 ส่วน ได้แก่ ไต ลำไส้เล็กและเนื้อกระดูกอนินทรีย์ (inorganic bone matrix) (hydroxyapatite) [3] (รูปภาพที่ 1)
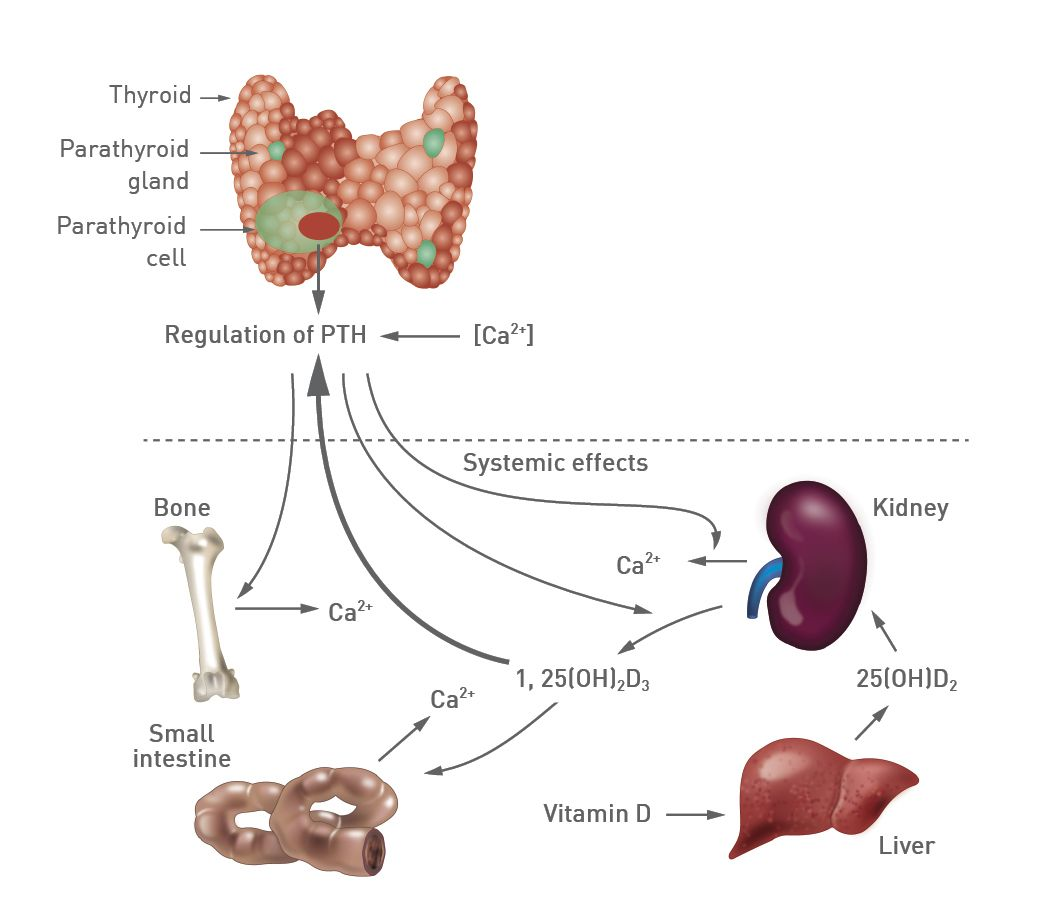
Redrawn by Sandrine Fontgne
PTH หรือฮอร์โมนพาราไธรอยด์ ทำหน้าที่เป็นตัวควบคุมหลัก โดยควบคุมความผันผวนของระดับแคลเซียมภายในร่างกายแบบนาทีต่อนาที หากระดับแคลเซียมเพิ่มสูงขึ้น การหลั่งฮอร์โมน PTH ก็จะลดลง ส่งผลให้สูญเสียแคลเซียมผ่านหลอดไตส่วนปลาย (distal tubules) ในไต ลดการดูดซึมแคลเซียมในลำไส้ (intestinal absorption) และลดการสลายกระดูก (bone resorption) ด้วยการยับยั้งการทำงานของ osteoclast [4]. ในทางตรงกันข้ามหากระดับแคลเซียมในเลือดลดลง ต่อมพาราไธรอยด์จะหลั่งฮอร์โมน PTH ที่ออกฤทธิ์ที่หลอดไตส่วนปลายเพื่อทำให้เกิดการดูดซึมแคลเซียมกลับคืน (calcium reabsorption) และขับฟอสฟารัส (phosphorus) ออกจากไต นอกจากนี้ PTH ยังมีส่วนช่วยในการดูดซึมแคลเซียมที่บริเวณลำไส้เล็กทางอ้อม (indirect) โดยการเปลี่ยนวิตามินดีไปเป็นวิตามินดี 3 รูปแบบออกฤทธิ์สูง (highly active vitamin D3) หรือแคลซิไทรออล (calcitriol) ที่หลอดไตส่วนต้น (proximal renal tubules) ผ่านการควบคุมกิจกรรมของ 1-alpha- hydroxylase [4] นอกจากนี้ PTH จะออกฤทธิ์บนเนื้อเยื่อโครงร่าง (skeletal tissue) เพื่อกระตุ้นการเพิ่มจำนวนของเซลล์สร้างกระดูก (bone-forming cells) ที่มีอยู่หรือก็คือ osteoblasts ซึ่งเห็นนผลในระยะแรก (early effect) นอกจากนี้ยังช่วยเพิ่มความหนาแน่นของมวลกระดูก (bone mineral density) [5] แต่อย่างไรก็ตามการส่งสัญญาณ PTH อย่างต่อเนื่องเป็นระยะเวลานาน (chronic PTH signaling) จะสามารถควบคุมการแสดงออกของ osteoblast RANKL ซึ่งส่งผลให้เกิดการกระตุ้น osteoclast และเพิ่มกิจกรรมการสลายของกระดูกตามมาได้ [6]
Calcitriol มีส่วนร่วมในการควบคุมแคลเซียม (calcium regulation) ผ่านการสังเคราะห์โปรตีน Calbindin-D ที่เพิ่มขึ้น ซึ่งโปรตีนนี้จะช่วยเพิ่มการดูดซึมแคลเซียมในอาหาร (dietary calcium) ที่บริเวณลำไส้เล็กและปล่อยเข้าสู่กระแสเลือดในภายหลัง [7] นอกจากนี้แคลซิไทรออลยังทำหน้าที่เป็นตัวควบคุมการหลั่งฮอร์โมนแบบยับยั้งย้อนกลับ (negative feedback regulator) ของตัวมันเองโดยการเปลี่ยน (conversion) เป็น 24,25-dihydroxycholecalciferiol ซึ่งมีฤทธิ์น้อยกว่า รวมถึงควบคุมแคลเซียมแบบยับยั้ง (negatively regulating calcium) โดยการลดการถอดรหัส (transcription) ของ PTH mRNA
Calcitonin ไม่ใช่ปัจจัยหลักที่ควบคุมแคลเซียมแบบนาทีต่อนาทีแต่ทำหน้าที่เป็นฮอร์โมนฉุกเฉิน (emergency hormone) ในการลดระดับของแคลเซียมในเลือดเมื่อระดับของแคลเซียมเพิ่มสูงขึ้นอย่างรวดเร็ว แคลซิโทนินถูกปล่อยออกมาจากเซลล์ซี (C cells) ของต่อมไทรอยด์เมื่อถูกกระตุ้นโดยภาวะแคลเซียมในเลือดสูง (hypercalcemia) และการรับประทานอาหารที่มีแคลเซียมสูง ส่งผลให้มีการหลั่งฮอร์โมนของระบบทางเดินอาหาร (enteric hormones) (เช่น gastrin และ cholecystokinin) อีกทั้งกิจกรรมทางชีววิทยาของมันยังทำหน้าที่เป็นตัวกลางในการยับยั้งกระบวนการสลายของกระดูก [8]
ปัญหาภาวะแคลเซียมในเลือดสูงพบได้ในกระบวนการเกิดโรคที่หลากหลาย ส่งผลให้ความรุนแรงของอาการ การรักษา และการพยากรณ์โรคขึ้นอยู่กับกระบวนการเกิดพยาธิสภาพของโรคนั้นๆ
การวินิจฉัยแยกโรค
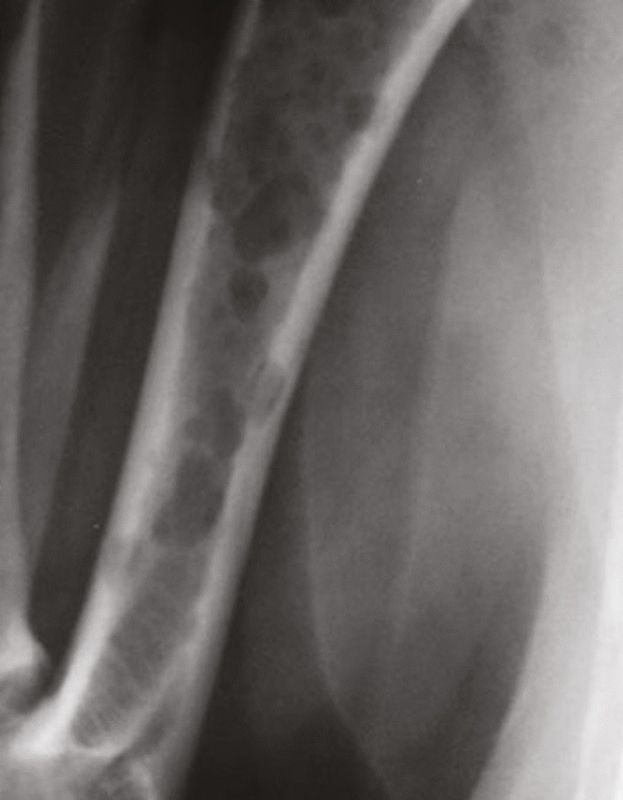
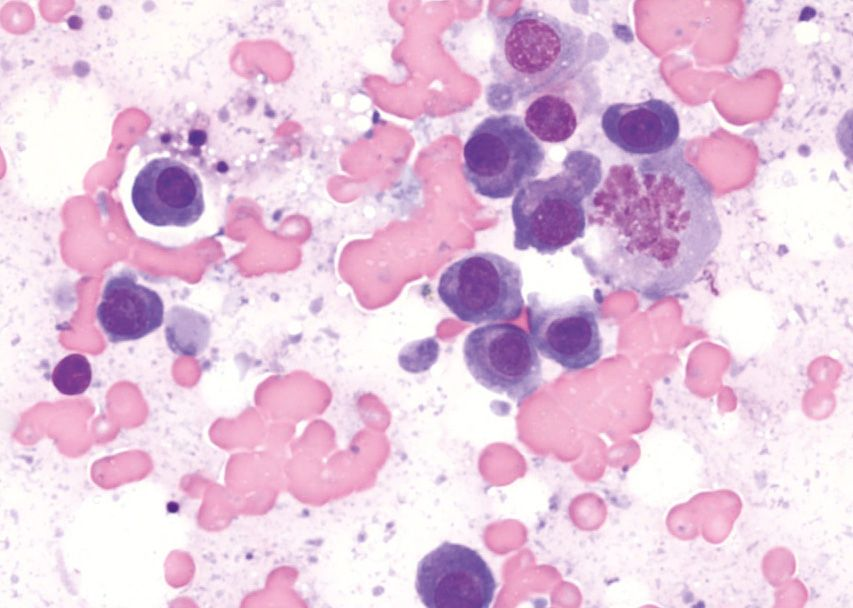
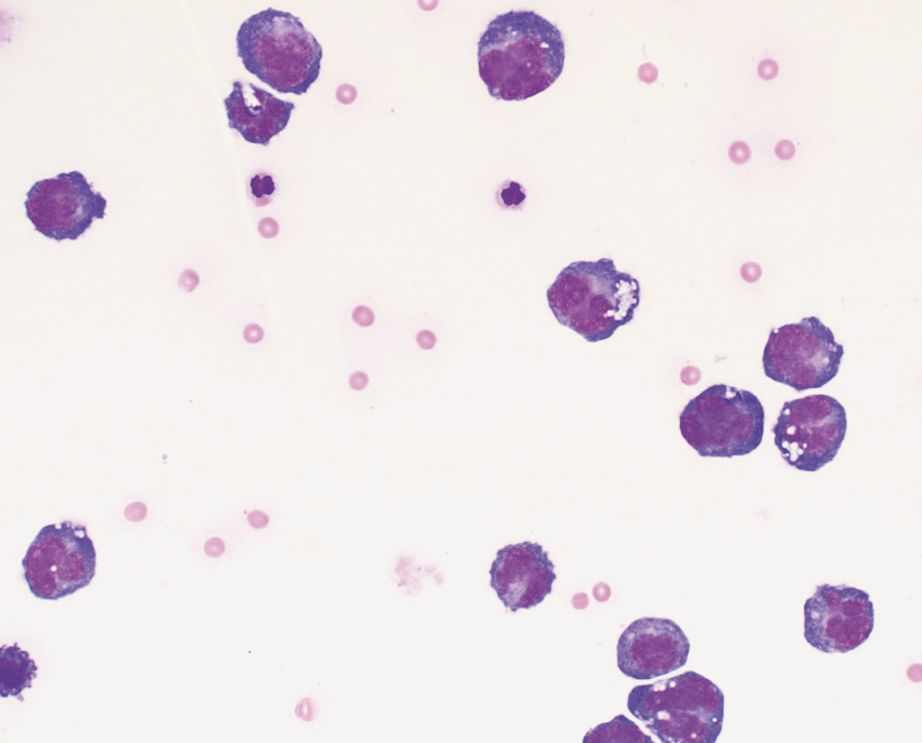
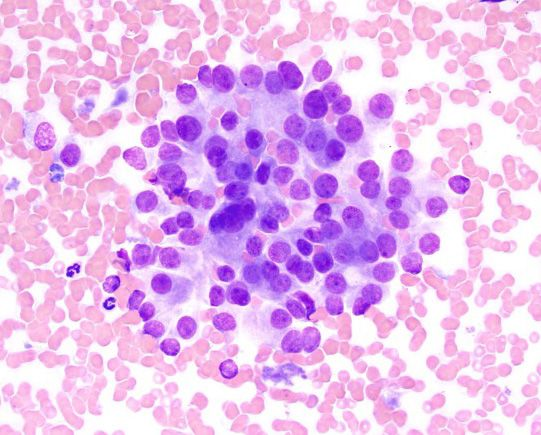
ภาวะแคลเซียมในเลือดสูง (hypercalcemia) สัมพันธ์กับภาวะทางสรีรวิทยา (physiologic) และพยาธิวิทยา (pathologic) ที่หลากหลายทั้งในสุนัขและแมว โดยอาจแบ่งได้กว้างๆคือ ขึ้นอยู่กับฮอร์โมนพาราไธรอยด์ (parathyroid-dependent) และไม่ขึ้นอยู่กับฮอร์โมนพาราไธรอยด์ (parathyroid-independent) สาเหตุของ parathyroid-dependent ได้แก่ ภาวะฮอร์โมนพาราไธรอยด์สูงแบบปฐมภูมิ (primary hyperparathyroidism) และ (พบได้ไม่บ่อย) ภาวะฮอร์โมนพาราไธรอยด์สูงแบบทุติยภูมิจากสารอาหารหรือไต (secondary nutritional or renal hyperparathyroidism) สาเหตุอื่นๆของภาวะแคลเซียมในเลือดสูงที่ไม่ขึ้นกับฮอร์โมนพาราไธรอยด์นั้นรวมไปถึงโรคต่างๆ เช่น โรคที่เกี่ยวข้องกับมะเร็ง (cancer-associated) (รูปภาพที่ 2 และ 3) สารพิษ (toxic) ไม่ทราบสาเหตุ (idiopathic) โรคทางเมตาบอลิซึม (metabolic) โรคกระดูก (skeletal) และ โรคอักเสบแบบแกรนูโลมาตัส (granulomatous diseases) [9] จากการศึกษาล่าสุดที่ประเมินสัตว์เลี้ยงจำนวนมากพบว่าสาเหตุทางพยาธิวิทยาที่พบได้บ่อยที่สุดของภาวะแคลเซียมรูปอิสระในเลือดสูง (ionized hypercalcemia) ในสุนัขนั้นได้แก่ เนื้องอก (neoplasia) ภาวะฮอร์โมนพาราไธรอยด์สูงแบบปฐมภูมิ (primary hyperparathyroidism) และภาวะต่อมหมวกไตชั้นนอกทำงานน้อยผิดปกติ (hypoadrenocorticism) (หากเปรียบเทียบกับแมว สาเหตุที่พบได้บ่อยที่สุดในแมวคือมะเร็ง (เช่น squamous cell carcinoma ในช่องปาก) โรคไตวายเรื้อรัง ภาวะแคลเซียมในเลือดสูงโดยไม่ทราบสาเหตุ (idiopathic hypercalcemia) (เกิดต่อเนื่องมาจากความผิดปกติของการตรวจจับแคลเซียมหรือ calcium-sensing apparatus) และ (พบได้น้อยมาก) อาการเป็นพิษเนื่องจากได้รับวิตามินดีเกิน (Hypervitaminosis D)) [10],[11],[12],[13],[14] โดยรวมแล้วสาเหตุที่พบได้บ่อยที่สุดในสัตว์เลี้ยงก็คือมะเร็ง ร้อยละ 60 ของสุนัข (และร้อยละ 30 ของแมว) ถูกวินิจฉัยว่ามีภาวะแคลเซียมในเลือดสูงที่เกี่ยวข้องกับมะเร็ง [11],[12],[13] (รูปภาพที่ 4 และ 5) ทั้งนี้มีตัวช่วยจำหรือตัวย่อมากมายที่จะช่วยให้สัตวแพทย์นึกถึงสถานการณ์ทางคลินิกต่างๆที่เกี่ยวข้องกับภาวะแคลเซียมในเลือดสูง เนื่องจากจะทำให้สัตวแพทย์สามารถระบุพยาธิวิทยาของโรคพื้นเดิมได้ล่วงหน้าอย่างมีนัยสำคัญ หนึ่งในการช่วยจำที่เหมาะสมคือ “GOSH DARN IT” (ตารางที่ 1)
Photomicrograph courtesy of Dr. Louis-Philippe de Lorimier
Photomicrograph courtesy of Dr. Michael Rosser
แม้ว่าการเพิ่มขึ้นของแคลเซียมจากมะเร็งจะเป็นเรื่องปกติซึ่งเกิดจากกลไกต่างๆที่แยกจากกันอย่างชัดเจน [15],[16] แต่สาเหตุแรกและสาเหตุที่พบได้บ่อยที่สุดของภาวะแคลเซียมในเลือดสูงคือการผลิตปัจจัยที่ละลายน้ำได้ (soluble factors) จากเซลล์มะเร็ง (tumor cells) ซึ่งส่งผลให้เกิดการสลายของกระดูกหรือที่เรียกกันว่าภาวะแคลเซียมในเลือดสูงจากมะเร็งหรือ humoral hypercalcemia of malignancy (HHM) กลไกที่สองคือการลุกลามโดยตรงของเซลล์มะเร็ง (direct invasion of tumor cells) เข้าไปในกระดูกทำให้เกิดการทำลายเนื้อเยื่อกระดูก (osteolysis) โดยมักพบในมะเร็งคาร์ซิโนมา (carcinomas) หรือมะเร็งร้ายของไขกระดูก (hematopoietic bone marrow malignancies) เช่น มะเร็งเม็ดเลือดขาว (leukemias) มะเร็งต่อมน้ำเหลือง (lymphoma) และมะเร็งไขกระดูกมัยอิโลมา (multiple myeloma) สุดท้ายที่พบได้น้อยที่สุดคือการผลิตวิตามินดีในรูปแบบออกฤทธิ์ (active form of vitamin D) โดย 1-α-hydroxylase-expressing cells จะช่วยเพิ่มการดูดซึมแคลเซียมในลำไส้

Photomicrograph courtesy of Dr. Louis-Philippe de Lorimier
ตารางที่ 1 GOSH DARN IT – ตัวช่วยจำและตัวย่อที่มีประโยชน์สำหรับสาเหตุของภาวะแคลเซียมในเลือดสูง
|
ภาวะแคลเซียมในเลือดสูงจากมะเร็งหรือ Humoral hypercalcemia of malignancy (HHM)
Humoral hypercalcemia of malignancy อาจเกี่ยวข้องกับการหลั่งสารเปบไทด์ที่ออกฤทธิ์คล้ายฮอร์โมนพาราไธรอยด์ (parathyroid hormone-related peptide (PTHrp)) ซึ่งมีโครงสร้างคล้ายกับฮอร์โมนพาราไธรอยด์ [17] และไซโตไคน์ (cytokines) เช่น IL-1 IL-6 หรือ tumor necrosis factor [15] ปัจจัยทางร่างกายเหล่านี้จะนำไปสู่การสลายของกระดูกแบบแพร่กระจายไปทั่ว (generalized and diffuse osteoclastic resorption) โดยไม่มีรอยโรคกระดูกที่สามารถมองเห็นได้ด้วยรังสี ทั้งนี้เนื่องจาก PTHrp นั้นเป็นโปรตีนที่ส่งออกไปนอกเซลล์ (secreted protein) ดังนั้นเซลล์ชนิดใดก็ตามที่หลั่งสารตัวนี้ออกมาได้โดยธรรมชาติและอยู่ในกระบวนการการเปลี่ยนแปลงเป็นมะเร็ง (malignant transformation) ก็จะสามารถปล่อยฮอร์โมนออกมาในปริมาณที่มากเกินไปได้
มะเร็งต่อมน้ำเหลือง (Lymphoma; LSA) เป็นสาเหตุที่พบบ่อยที่สุดของ HHM โดยเฉพาะอย่างยิ่งมะเร็งต่อมน้ำเหลืองบริเวณเมดิแอสตินัม (mediastinal lymphoma) อย่างไรก็ตามมะเร็งอื่นๆที่ทำให้เกิดภาวะแคลเซียมในเลือดสูงในสุนัข (และแมว) ได้แก่ apocrine gland anal sac adenocarcinoma (AGASACA), thyroid carcinoma, multiple myeloma, multiosseous bone tumors, thymoma, squamous cell carcinoma, mammary gland carcinoma/adenocarcinoma, melanoma, primary lung tumor, chronic lymphocytic leukemia, renal angiomyxoma และ parathyroid gland tumors ตามกฎทั่วไปภาวะแคลเซียมในเลือดสูงสามารถพบเห็นได้ในสุนัขร้อยละ 10-35 ที่เป็นมะเร็งต่อมน้ำเหลือง มากกว่าร้อยละ 25 ของสุนัขที่เป็นมะเร็ง AGASACA และประมาณร้อยละ 20 ของสุนัขที่เป็นมะเร็งไขกระดูกมัยอิโลมา
อาการแสดงทางคลินิก (Clinical signs)
เมื่อพิจารณาถึงการทำงานทางสรีรวิทยา (physiological functions) ที่หลากหลายของแคลเซียมไอออน (calcium ions) ภาวะแคลเซียมในเลือดสูง (hypercalcemia) และภาวะแคลเซียมในเลือดต่ำ (hypocalcemia) ก็ล้วนทำให้เกิดผลกระทบต่อหลายระบบภายในร่างกาย (multisystemic effects) [10],[11] ระดับของแคลเซียมในเลือดที่เพิ่มสูงขึ้นทำให้การทำงานของเซลล์ (cellular function) ลดลงโดยการเปลี่ยนแปลงความสามารถในการซึมผ่านของเยื่อหุ้มเซลล์ (cell membrane permeability) และการทำงานของปั๊มที่เยื่อหุ้มเซลล์ (cell membrane pump activities) การเพิ่มขึ้นของ iCa ภายในเซลล์สามารถทำให้การทำงานของเซลล์ผิดปกติไปจากเดิมและลดการผลิตพลังงานซึ่งส่งผลให้เซลล์ตาย (cell death) และนำไปสู่ภาวะหินปูนจับในเนื้อเยื่อที่มีเซลล์ตายชนิดดิสโทรฟิกและ/หรือชนิดเมทาสเตซิส (dystrophic and/or metastatic mineralization) ถึงแม้ว่าเนื้อเยื่อหลายชนิดอาจได้รับผลกระทบจากภาวะแคลเซียมในเลือดสูง แต่ผลกระทบต่อระบบประสาทส่วนกลาง ระบบทางเดินอาหาร หัวใจและไตนั้นก็มีความสำคัญทางคลินิกมากแช่นเดียวกัน หากไม่คำนึงถึงสาเหตุ การทำงานของไตที่ลดลงถือเป็นลักษณะทางคลินิกที่สำคัญของภาวะแคลเซียมในเลือดสูงโดยเฉพาะอย่างยิ่งในการเกิดเนื้องอก [18] อาการแสดงทางคลินิกอื่นๆที่สัมพันธ์กับภาวะแคลเซียมในเลือดสูงนั้นอาจไม่เฉพาะเจาะจง (nonspecific) หลบซ่อนอาการ (insidious) และมีความรุนแรงแตกต่างกันไป แต่สัญญาณทั่วไปอาจรวมไปถึงภาวะปัสสาวะมากชนิดปฐมภูมิ (primary polyuria) ที่ทำให้เกิดภาวะดื่มน้ำมากชดเชย (compensatory polydipsia) ตามมา (PU/PD) อาการเบื่ออาหาร ง่วงซึม อ่อนแรง ซึม กล้ามเนื้อกระตุก (muscle twitching) หัวใจเต้นผิดจังหวะ (cardiac arrhythmias) และอาการชัก [9] โดยเมื่อเปรียบเทียบกับภาวะแคลเซียมในเลือดสูงในแมวมักจะพบอาการทางระบบทางเดินอาหาร โดยเฉพาะอย่างยิ่งอาการเบื่ออาหารและอาเจียนนั้นจะเป็นอาการที่พบได้บ่อยที่สุด [19]
วิธีวินิจฉัยสัตว์ป่วยที่มีภาวะแคลเซียมในเลือดสูง (Diagnostic approach to the hypercalcemic patient)
ในสัตว์เลี้ยงการวัดระดับ iCa นั้นมีความแม่นยำมากกว่าระดับแคลเซียมรวมหรือ total calcium สิ่งที่น่าสนใจก็คือระดับความเข้มข้นของแคลเซียมที่เพิ่มขึ้นมีแนวโน้มที่จะเพิ่มสูงมากในกรณีภาวะแคลเซียมในเลือดสูงจากมะเร็งเมื่อเทียบกับสาเหตุอื่นๆ [12],[13] เมื่อสัตวแพทย์สงสัยว่าสัตว์ป่วยมีภาวะแคลเซียมในเลือดสูง การซักประวัติและการตรวจร่างกายอย่างละเอียดซึ่งรวมไปถึงการประเมินต่อมน้ำเหลืองบริเวณภายนอก (peripheral lymph nodes) อย่างรอบคอบและการตรวจทางทวารหนัก (rectal palpation) (เพื่อตรวจหา AGASACA) (รูปภาพที่ 6-8) ควรทำเป็นขั้นตอนแรก จากนั้นจึงค่อยดำเนินการตรวจวินิจฉัยเพิ่มเติม (รวมถึงการตรวจความสมบูรณ์ของเม็ดเลือด (complete blood count) การตรวจสารเคมีในเลือด (chemistry panel) การตรวจปัสสาวะ การถ่ายภาพรังสีช่องอก (thoracic radiographs) และการอัลตราซาวด์ช่องท้อง (abdominal ultrasound)) เพื่อระบุผลตรวจอื่นๆซึ่งอาจช่วยยืนยันข้อสงสัยทางคลินิกเพิ่มเติมได้หรืออาจช่วยให้สัตวแพทบ์ค้นพบโรคทางพยาธิวิทยาที่ไม่สามารถระบุได้ในระหว่างการตรวจร่างกาย
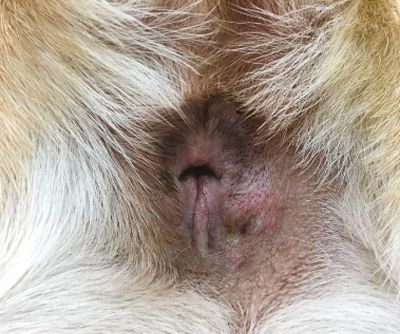
Photograph courtesy of Dr. Louis-Philippe de Lorimier


การแปรปรวนของแคลเซียม (Calcium disturbances) อาจเกิดขึ้นได้ในภาวะที่ร้ายแรงและเป็นอันตรายถึงชีวิตโดยไม่ต้องคำนึงถึงสาเหตุที่แท้จริงของภาวะนี้ ภาวะแคลเซียมในเลือดสูงสามารถนำไปสู่ภาวะแทรกซ้อนอื่นๆที่ทำให้เสียชีวิตได้ (life-limiting complications) หากปล่อยทิ้งไว้โดยไม่ได้รับการรักษา [20] การวัดระดับ iCa จำเป็นต้องใช้เครื่องวิเคราะห์ที่มีความเฉพาะ (specialized analyzers) ซึ่งสัตวแพทย์อาจไม่พร้อมเสมอไป ดังนั้นเพื่อบรรเทาข้อจำกัดนี้ สัตวแพทย์มักจะอาศัยการแยกความแตกต่างในแคลเซียมรวม (total calcium (tCa)) ซึ่งแบ่งเป็นแคลเซียมใน 3 รูปแบบ แต่น่าเสียดายที่การตีความที่ถูกต้องแม่นยำอาจเป็นเรื่องที่ยาก เนื่องจากแคลเซียมรวมนั้นไม่ได้สะท้อนสถานะของ iCa ในสัตว์ป่วยรายใดรายหนึ่งอย่างแท้จริง แม้ว่าจะมีการเสนอสูตรใหม่ที่ถูกแก้ไขแล้วเพื่อหาแคลเซียมรวมโดยใช้อัลบูมิน (albumin) และโปรตีนรวม (total protein) แต่สูตรเหล่านี้ก็ไม่ถือว่าเป็นสูตรที่เชื่อถือได้ อีกทั้งยังล้มเหลวในการตรวจสอบและยังต้องปรับปรุงความแตกต่างในการวินิจฉัยระหว่างแคลเซียมรวมและ iCa [20],[21] ด้วยเหตุนี้ผู้เขียนขอแนะนำว่าหากเจอความผิดปกติในการวัดระดับแคลเซียมรวมให้ทำการตรวจวินิจฉัยเพิ่มเติมเพื่อหาระดับความเข้มข้นของ iCa ที่แท้จริงโดยตรง


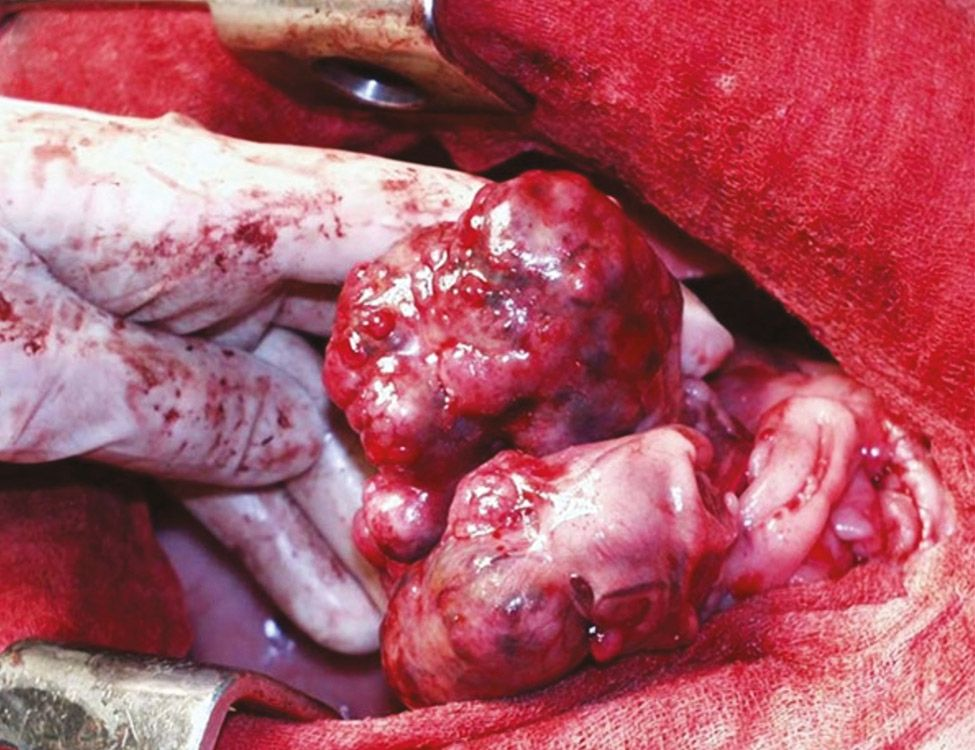
Photograph courtesy of Dr. Louis-Philippe de Lorimier
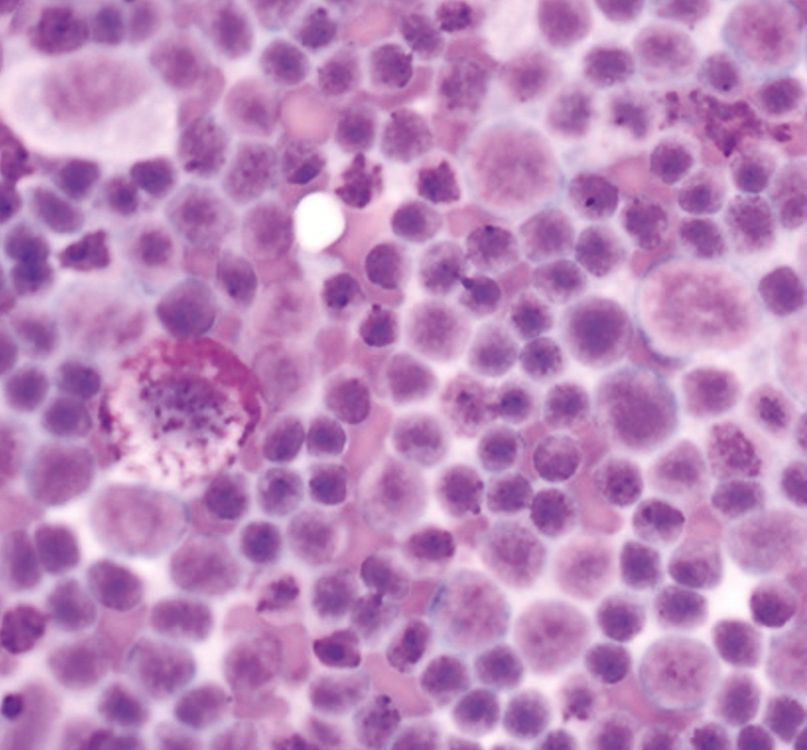
Photomicrograph courtesy of Dr. Louis-Philippe de Lorimier
การรักษา (Treatment)
เนื่องจากภาวะแคลเซียมในเลือดสูงสามารถเกิดขึ้นได้จากกระบวนการของโรคที่หลากหลาย ดังนั้นการรักษาที่เหมาะสม ความรุนแรงของอาการแสดงทางคลินิกและการพยากรณ์โรคโดยรวมจึงขึ้นอยู่กับสาเหตุที่แท้จริง (underlying etiopathogenesis) ทั้งนี้ไม่มีการรักษาแบบใดแบบหนึ่งที่มีประสิทธิภาพดีเหมาะสมกับทุกสาเหตุ แต่การกระตุ้นให้มีการขับแคลเซียมออกมาในปัสสาวะ (calciuresis) จะสามารถให้ประโยชน์ทางคลินิกได้ทันทีในสัตว์ป่วยส่วนใหญ่ การจัดการกับภาวะแคลเซียมในเลือดสูงที่เหมาะสมที่สุดทำได้โดยการระบุและรักษาสาเหตุที่แท้จริงของภาวะนี้ ถึงแม้ว่าการระบุกระบวนการของโรคบางอย่างแม่นยำนั้นอาจมีความซับซ้อนและเข้าใจได้ยากก็ตาม ทั้งนี้สถานะทางคลินิกของสัตว์ป่วยจะเป็นตัวกำหนดว่าการรักษาจะเป็นไปไหนทิศทางใด
การรักษาที่มีประสิทธิภาพมากที่สุดสำหรับภาวะแคลเซียมในเลือดสูงจากมะเร็งคือการกำจัดมะเร็งที่เป็นสาเหตุโดยการผ่าตัดหากเป็นไปได้ การทำเคมีบำบัด (chemotherapy) เพื่อบรรเทาอาการทางคลินิก (ใช้ได้กับภาวะแคลเซียมในเลือดสูงที่เกี่ยวข้องกับ LSA) หรือการทำรังสีรักษา (radiation therapy) ในทางปฏิบัติจะแนะนำว่าหากระดับความเข้มข้นของแคลเซียมในเลือดอยู่ที่ 16 มิลลิกรัม/เดซิลิตร (4 มิลลิโมล/ลิตร) หรือมากกว่านั้นสัตวแพทย์ควรเริ่มการรักษาแบบรุนแรง (aggressive therapy) อย่างไรก็ตามความเข้มข้นของการจัดการสัตว์ป่วย (intensity of patient management) นั้นควรพิจารณาเป็นรายตัวและควรวางแนวทางจากผลการประเมินและผลการวินิจฉัย ณ ขณะนั้น ทั้งนี้สัตวแพทย์ควรคาดการณ์การพยากรณ์โรคไม่ดี (unfavorable prognosis) ในสัตว์ป่วยที่มีอาการดังต่อไปนี้:
- สัตว์ป่วยที่แสดงอาการทางคลินิกจากภาวะแคลเซียมในเลือดสูงเกิน 16 มิลลิกรัม/เดซิลิตร (4 มิลลิโมล/ลิตร)
- สัตว์ป่วยที่มีภาวะไตวายที่มีสาเหตุเกิดมาจากตัวของไตเอง (renal azotemia) อย่างรุนแรง
- สัตว์ป่วยที่มีผลิตภัณฑ์แคลเซียมและฟอสฟอรัสมากกว่า 60 และส่งผลให้เกิดการแพร่กระจายของภาวะหินปูนจับในเนื้อเยื่อที่มีเซลล์ตาย (metastatic mineralization)
- สัตว์ป่วยที่มีภาวะแคลเซียมในเลือดสูงจากมะเร็งที่สัมพันธ์กับมะเร็งก้อน (solid tumors) ที่ไม่สามารถผ่าตัดเอาออกได้
การรักษาเบื้องต้นควรประกอบไปด้วยการรักษาด้วยสารน้ำอย่างรุนแรง (aggressive fluid therapy) โดยใช้สารละลายชนิด isotonic (0.9%) sodium chloride เพื่อแก้ไขภาวะขาดน้ำ (dehydration) ที่สัตว์ป่วยเผชิญอยู่ซึ่งเป็นผลสืบเนื่องที่ได้พบได้บ่อยจากภาวะปัสสาวะมากแบบปฐมภูมิที่เกิดจากภาวะแคลเซียมในเลือดสูง (hypercalcemia-induced primary polyuria) (หรือเรียกว่าโรคเบาจืดแบบทุติยภูมิที่เกิดจากความผิดปกติของไต (secondary nephrogenic diabetes insipidus)) เลือดเข้มข้น (hemoconcentration) ที่ผ่านกระบวนการกรองของไต (glomerular filtration) ที่ลดลงจะนำไปสู่การกักเก็บแคลเซียม (calcium retention) เพิ่มเนื่องจากไตพยายามรักษาโซเดียมไว้ทำให้ลดการขับแคลเซียมออกทางปัสสาวะ (urinary calcium excretion) [9] การให้น้ำเกลือเข้าทางหลอดเลือดดำอย่างรอบคอบไม่เพียงแต่จะช่วยคืนความชุ่มชื้นให้กับร่างกายเท่านั้น แต่ยังมีประโยชน์เพิ่มเติมในการเพิ่มปริมาตรน้ำในร่างกาย (volume expansion) และเพิ่มอัตราการกรองของไต (glomerular filtration rate) โดยผลที่ตามมาคือการเพิ่มการขับแคลเซียมออกมาในปัสสาวะ น้ำเกลือที่ไม่ได้มีแคลเซียมเสริมและมีปริมาณโซเดียมสูงจะแข่งขันกับแคลเซียมในการดูดซึมที่ท่อไต (renal tubular absorption) ซึ่งก็จะยิ่งส่งเสริมให้เกิดการขับออกของแคลเซียมมากขึ้น [22] เมื่อร่างกายได้รับน้ำอย่างเพียงพอแล้ว แนะนำให้ใช้ยาขับปัสสาวะในกลุ่ม loop diuretics (เช่น furosemide ที่ขนาดยา 2-4 มก./กก. วันละ 2-3 ครั้ง เข้าทางหลอดเลือดดำ/ชั้นใต้ผิวหนัง/การกิน) ร่วมกับการให้น้ำเกลืออย่างต่อเนื่องเพื่อส่งเสริมการขับแคลเซียมออกทางปัสสาวะเพิ่มเติม นอกจากนี้ยังช่วยลดโอกาสที่จะเกิดภาวะปริมาตรเลือดมากที่แทรกซ้อนจากการรักษา (iatrogenic hypervolemia) อย่างไรก็ตามจำเป็นต้องมีการดูแลสัตว์ป่วยเหล่านี้ไม่ให้มีภาวะขาดน้ำเนื่องจากเลือดที่เข้มข้นมากจะลดการขับแคลเซียมออกมาในปัสสาวะตามที่ต้องการได้
โคคอร์ติคอยด์ (Glucocorticoids) สามารถให้ประโยชน์ในการรักษาสาเหตุบางประการของภาวะแคลเซียมในเลือดสูงได้อย่างรวดเร็ว อย่างไรก็ตามสาเหตุที่แท้จริงควรได้รับการวินิจฉัยก่อนที่จะให้ยาเนื่องจากการใช้ยากลุ่มกลูโคคอร์ติคอยด์โดยขาดการพิจารณาอย่างรอบคอบมีแนวโน้มที่จะทำให้การวินิจฉัยขั้นสุดท้าย (definitive diagnosis) เกิดความสับสน (เช่น ปกปิดมะเร็งที่มีต้นกำเนิดมาจากเซลล์ต้นกำเนิดของเม็ดเลือด (hematopoietic neoplasia) ที่ซ่อนอยู่) หรือแม้แต่มีข้อห้ามทางการแพทย์ (medically contraindicated) (เช่น โรคอักเสบแบบแกรนูโลมาตัสที่เกิดจากการติดเชื้อ (infectious granulomatous disease)) ยาในกลุ่มกลูโคคอร์ติคอยด์จะช่วยลดระดับแคลเซียมในเลือดโดยลดการสลายของกระดูก (bone resorption) ขัดขวางการดูดซึมของแคลเซียมในลำไส้ และเพิ่มการขับแคลเซียมออกที่ไต [22] ซึ่งถือว่ามีประโยชน์อย่างยิ่งในการรักษาภาวะแคลเซียมในเลือดสูงจากมะเร็ง เช่น มะเร็งต่อมน้ำเหลือง, AGASACA, มะเร็งไขกระดูกมัยอิโลมา, เนื้องอกต่อมไทมัส (thymoma), ภาวะต่อมหมวกไตชั้นนอกทำงานมากผิดปกติหรืออาการเป็นพิษเนื่องจากได้รับวิตามินดีเกิน (hypervitaminosis D) ตัวเลือกที่ใช้บ่อยที่สุดคือ prednisone (0.1-0.22 มก./กก. วันละ 2 ครั้ง เข้าทางหลอดเลือดดำ/ชั้นใต้ผิวหนัง/การกิน) และ/หรือ dexamethasone (0.1-0.22 มก./กก. วันละ 2 ครั้ง) โดยยาทั้ง 2 ชนิดนี้มีราคาไม่แพงและมีจำหน่ายทั่วไป สัตวแพทย์ควรค่อยๆลดขนาดยาเหล่านี้อย่างเหมาะสมและไม่ควรให้สัตว์ป่วยได้รับยาในขนาดยาที่สูงแบบนี้เป็นเวลานาน)
บิสฟอสโฟเนต (Bisphosphonates) เป็นอีกทางเลือกหนึ่งในการรักษาภาวะแคลเซียมในเลือดสูง โดยยากลุ่มนี้ถูกพัฒนาขึ้นเพื่อยับยั้งการสลายของกระดูกทางพยาธิวิทยา (pathologic bone resorption) ที่เกี่ยวข้องกับโรคกระดูกพรุน (osteoporosis) และการแพร่กระจายของมะเร็งลุกลามมาที่กระดูก (skeletal metastases) ในมนุษย์ ยา zoledronate และ pamidronate เป็นยาที่ใช้บ่อยที่สุดในทางการแพทย์ของมนุษย์และสามารถทำให้ระดับแคลเซียมเป็นปกติได้ภายใน 4-10 วัน และมีผลคงอยู่ประมาณ 1-4 สัปดาห์ [23] และในปัจจุบันได้มีข้อมูลเพิ่มเติมเกี่ยวกับการใช้ยา pamidronate และ zoledronate ที่แสดงให้เห็นว่ามีประสิทธิภาพในการควบคุมภาวะแคลเซียมในเลือดสูงเฉียบพลันในสุนัข [24] ขนาดยา (dosages) ของยาในกลุ่มบิสฟอสโฟเนตแต่ละตัวนั้นแตกต่างกันไปตามความแตกต่างด้านประสิทธิภาพในการต้านการดูดซึม (antiresorptive) และผลข้างเคียงที่อาจเกิดขึ้น (รูปภาพที่ 12) โดยขนาดยาที่แนะนำสำหรับ zoledronate คือ 0.1-0.25 มก./กก. เจือจางในน้ำเกลือและให้เข้าทางหลอดเลือดดำอย่างต่อเนื่องด้วยอัตราคงที่ (constant-rate infusion) เป็นเวลา 15-20 นาที ในขณะที่ขนาดยาที่แนะนำสำหรับ pamidronate คือ 1.0-2.0 มก./กก. เจือจางในน้ำเกลือแล้วให้ต่อเนื่องเป็นเวลา 2-4 ชั่วโมง ข้อควรพิจารณาที่สำคัญในการบริหารยาเหล่านี้คือการให้ยาเข้าทางหลอดเลือดดำโดยตรงอย่างรวดเร็ว (bolus infusion) ในขนาดยาที่สูงนั้นมีการศึกษาพบว่ามีแนวโน้มที่จะทำให้เกิดภาวะไตวายเฉียบพลัน (acute kidney injury) ในขณะที่แนวทางปฏิบัติในการใช้ยาที่แนะนำในข้างต้นนั้นใช้ระยะเวลาในการบริหารยาที่นานกว่าเพราะฉะนั้นจึงช่วยลดโอกาสที่จะเกิดความเสียหายที่ไตได้อย่างมาก แต่ทั้งนี้ยังคงแนะนำให้สัตวแพทย์ติดตามการทำงานของไตของสัตว์ป่วยอย่างใกล้ชิดในระหว่างการรักษา เป็นที่น่าสังเกตว่ายา alendronate ซึ่งเป็นยาในกลุ่มบิสฟอสโฟเนตแบบรับประทานได้รับการตรวจสอบเพื่อใช้ในแมวที่มีภาวะแคลเซียมในเลือดสูงโดยไม่ทราบสาเหตุแบบถาวร (persistent idiopathic hypercalcemia) อีกทั้งยังดูเหมือนว่าแมวจะสามารถทนต่อยาได้ดี [14],[25] แต่อย่างไรก็ตามจำเป็นต้องมีการตรวจสอบเพิ่มเติมเพื่อประเมินประสิทธิภาพของยานี้เนื่องจากยามีชีวปริมาณออกฤทธิ์ทางการกิน (oral bioavailability) ต่ำมากและเป็นยาที่ควรแนะนำในสัตว์สปีชีส์นี้นอกเหนือจากยาในกลุ่มบิสฟอสโฟเนตอื่นๆ


มิธรามัยซิน (mithramycin) แคลซิโทนิน (calcitonin) และแกลเลียมไนเตรต (gallium nitrate) เป็นวิธีการรักษาทางทฤษฎี (theoretical therapies) อื่นๆที่จะช่วยจัดการกับภาวะแคลเซียมในเลือดสูงในทางการแพทย์ แต่สิ่งเหล่านี้มีประโยชน์ที่ค่อนข้างจำกัดเนื่องจากต้นทุน ผลข้างเคียงและตารางการบริหารยา (administration schedules) ยา mithramycin (plicamycin) เป็นยาปฏิชีวนะต้านมะเร็ง (antitumor antibiotic) ที่ยับยั้งการสังเคราะห์ RNA ในเซลล์ทำลายกระดูกหรือ osteoclasts โดยนำไปสู่การยับยั้งการสลายกระดูกได้อย่างรวดเร็ว [22] ยานี้ไม่ได้รับความนิยมทั้งในด้านการแพทย์ของสัตว์และของมนุษย์เนื่องจากทำให้เกิดภาวะเกล็ดเลือดต่ำ (thrombocytopenia) เนื้อตายในไตและตับ (renal and hepatic necrosis) และภาวะแคลเซียมในเลือดต่ำ (hypocalcemia) ได้ แคลซิโทนินเป็นอีกหนึ่งทางเลือกในการรักษาเพราะจะลดการสลายของกระดูกโดยการยับยั้งกิจกรรมและการสร้างของเซลล์ทำลายกระดูกเป็นผลให้ระดับความเข้มข้นของแคลเซียมในเลือดลดลงอย่างรวดเร็วภายในไม่กี่ชั่วโมงหลังจากการให้ยาซึ่งเร็วกว่ากลยุทธ์ในการรักษาอื่นๆ แต่ผลของยานี้ค่อนข้างสั้นเนื่องจากเกิดภาวะจำนวนตัวรับสัญญาณลดลงเพื่อชดเชย (compensatory receptor down- regulation) ส่วนแกลเลียมไนเตรตเป็นสารต้านมะเร็ง (antineoplastic agent) ที่ยับยั้งเซลล์ทำลายกระดูกและลดความสามารถในการละลายเพื่อดูดซึมกลับ (resorptive solubility) ของ hydroxyapatite โดยการจับกับผลึก hydroxyapatite crystals ซึ่งโดยทั่วไปแล้วยาตัวนี้จะใช้ก็ต่อเมื่อในกรณีที่ดื้อต่อยาบิสฟอสโฟเนต อีกทั้งการศึกษาบางฉบับยังแสดงให้เห็นว่ายานี้มีประสิทธิภาพมากกว่ายาในกลุ่มบิสฟอสโฟเนตในการลดระดับแคลเซียมในเลือดในกรณีที่มีสาเหตุมาจากมะเร็ง อย่างไรก็ตามมันไม่ใช่การรักษาลำดับแรก (first-line treatment) เนื่องจากสามารถทำให้เกิดพิษต่อไตได้ (nephrotoxicity)
สมดุลย์แคลเซียมในร่างกายถูกควบคุมอย่างเข้มงวดด้วยกระบวนการทางสรีรวิทยาเพื่อรักษาระดับความเข้มข้นของแคลเซียมอิสระ(ionized calcium) ซึ่งเป็นรูปแบบที่พร้อมใช้งานของอิเล็กโทรไลต์ให้คงที่
สรุป (Conclusion)
ระดับความเข้มข้นของแคลเซียมรูปอิสระ (ionized calcium) จะถูกควบคุมอย่างเข้มงวดภายในร่างกายและการเปลี่ยนแปลงอาจนำไปสู่ผลกระทบต่อระบบอวัยวะหลายอย่างอย่างมีนัยสำคัญและเป็นอันตราย ภาวะแคลเซียมในเลือดสูงจากพารานีโอพลาสติก (paraneoplastic hypercalcemia) จัดเป็นภาวะแทรกซ้อนที่ร้ายแรงและพบได้ค่อนข้างบ่อยในสุนัข มีมะเร็งหลายชนิดที่สามารถกระตุ้นให้เกิดภาวะแคลเซียมในเลือดสูงผ่านกลไกการเปลี่ยนแปลงกระบวนการควบคุมระดับของแคลเซียมให้คงที่ (calcium homeostasis) และนำไปสู่อาการเจ็บป่วยทางคลินิก มะเร็งในสุนัขที่พบได้บ่อยที่สุดที่สามารถทำให้เกิดภาวะแคลเซียมในเลือดสูงก็คือมะเร็งต่อมน้ำเหลืองชนิดทีเซลล์ (T-cell lymphoma) แต่ก็ควรพิจารณามะเร็งชนิดอื่นๆและโรคที่ไม่ใช่มะเร็ง (non-neoplastic diseases) ทุกครั้งที่สัตว์ป่วยมีภาวะแคลเซียมในเลือดสูง ถึงแม้ว่าอาการแสดงทางคลินิกที่เกี่ยวข้องกับภาวะแคลเซียมในเลือดสูงนั้นมักจะเป็นแบบไม่เฉพาะเจาะจง แต่การตรวจหาสาเหตุที่แท้จริงตั้งแต่เนิ่นๆก็ถือว่ามีความสำคัญ เพราะเมื่อระบุสาเหตุของภาวะนี้ได้แล้ว การให้การรักษาขั้นสุดท้าย (definitive treatment) และการจัดการแบบสนับสนุน (supportive management) จะช่วยลดภาวะแทรกซ้อนที่อาจคุกคามถึงชีวิตและเพิ่มโอกาสในการบรรลุผลลัพธ์ที่น่าพึงพอใจ
Jordan M. Hampel
DVM, Department of Veterinary Clinical Medicine, University of Illinois at Urbana-Champaign (UIUC), Illinois, USA
สหรัฐอเมริกา
Dr. Hampel received her Doctor of Veterinary Medicine from the University of Illinois in 2020 and then went on to complete a rotating small animal internship at Michigan State University. She returned to the UIUC to further advance her training as an oncology-dedicated clinical trial intern, and is currently a resident in Medical Oncology and pursuing a Master of Science degree that focuses on targeted strategies to amplify the cytotoxic activities of ionizing radiation therapy.
Timothy M. Fan
DVM, PhD, Dip. ACVIM (Oncology, Internal Medicine), Department of Veterinary Clinical Medicine, University of Illinois at Urbana-Champaign, Illinois, USA
สหรัฐอเมริกา
Dr. Fan received his DVM from the Virginia-Maryland Regional College of Veterinary Medicine in 1995 and continued training to become board-certified in Small Animal Internal Medicine and Oncology at Cornell University and UIUC, respectively. He then completed a PhD focusing on tumor immunology at Illinois, and joined the faculty where he is professor, a core member in the Anticancer Discovery from Pets to People theme, and a program leader for the Cancer Center at Illinois that includes companion animals as sophisticated models to study cancer.
References
- Clapham DE. Calcium signaling. Cell. 2007;131(6):1047-1058.
- Hajdu S, Leonard EJ. A calcium transport system for mammalian cells. Life Sci. 1975;17(10);1527-1533.
- Matikainen N, Pekkarinen T, Ryhnen EM, et al. Physiology of calcium homeostasis: an overview. Endocrinol. Metab. Clin. North Am. 2021;50(4):575-590.
- Potts JT. Parathyroid hormone: past and present. J. Endocrinol. 2005;187(3):311-325.
- Silva BC, Bilezikian JP. Parathyroid hormone: anabolic and catabolic actions on the skeleton. Curr. Opin. Pharmacol. 2015;22:41-50.
- Huang JC, Sakata T, Pfleger LL, et al. PTH differentially regulates expression of RANKL and OPG. J. Bone Miner. Res. 2004;19(2):235-244.
- Christakos S, Li S, de la Cruz J, et al. Vitamin D and the intestine: review and update. J. Steroid. Biochem. Mol. Biol. 2020;196:105501.
- Xie J, Guo J, Kanwal Z, et al. Calcitonin and bone physiology: in vitro, in vivo, and clinical investigations. Int. J. Endocrinol. 2020;2020:3236828.
- Daniels E, Sakakeeny C. Hypercalcemia: pathophysiology, clinical signs, and emergent treatment. J. Am. Anim. Hosp. Assoc. 2015;51(5):291-299.
- Coady M, Fletcher DJ, Goggs R. Severity of ionized hypercalcemia and hypocalcemia is associated with etiology in dogs and cats. Front. Vet. Sci. 2019;6;276.
- Elliott J, Dobson JM, Dunn JK, et al. Hypercalcemia in the dog a study of 40 cases. J. Small Anim. Pract. 1991;32(11):564-571.
- Messinger JS, Windham WR, Ward CR. Ionized hypercalcemia in dogs: a retrospective study of 109 cases (1998-2003). J. Vet. Intern. Med. 2009;23(3):514-519.
- Savary KCM, Price GS, Vaden SL. Hypercalcemia in cats: a retrospective study of 71 cases (1991-1997). J. Vet. Intern. Med. 2000;14(2):184-189.
- Hardy BT, de Brito Galvao JF, Green TA, et al. Treatment of ionized hypercalcemia in 12 cats (2006-2008) using PO-administered alendronate. J. Vet. Intern. Med. 2015;29(1):200-206.
- Goldner W. Cancer-related hypercalcemia. J. Oncol. Pract. 2016;12(5):426-432.
- Mirrakhimov AE. Hypercalcemia of malignancy: an update on pathogenesis and management. N. Am. J. Med. Sci. 2015;7(11):483-493.
- de Papp AE, Stewart AF. Parathyroid hormone-related protein a peptide of diverse physiologic functions. Trends Endocrinol. Metab. 1993;4(6):181-187.
- Weller RE, Hoffman WE. Renal function in dogs with lymphosarcoma and associated hypercalcemia. J. Small Anim. Pract. 1992;33(2):61-66.
- Galvao JFD, Parker V, Schenck PA, et al. Update on feline ionized hypercalcemia. Vet. Clin. North. Am. Small Anim. Pract. 2017;47(2);273-292.
- Lebastard M, Cuq B, Sharman MJ, et al. Diagnostic performance of predicted ionized calcium in dogs with total hypercalcemia and total hypocalcemia. Vet. Clin. Pathol. 2021;50(4):515-524.
- Groth EM, Chew DJ, Lulich JP, et al. Determination of a serum total calcium concentration threshold for accurate prediction of ionized hypercalcemia in dogs with and without hyperphosphatemia. J. Vet. Intern. Med. 2020;34(1):74-82.
- Schaer M. Therapeutic approach to electrolyte emergencies. Vet. Clin. North Am. Small Anim. Pract. 2008;38(3):513-533.
- Schenk A, Lux C, Lane J, et al. Evaluation of zoledronate as treatment for hypercalcemia in four dogs. J. Am. Anim. Hosp. Assoc. 2018;54(6);e54604
- Repasy AB, Selmic LE, Kisseberth WC. Canine apocrine gland anal sac adenocarcinoma: a review. Top. Companion Anim. Med. 2022;50;100682
- Kurtz M, Desquilbet L, Maire J, et al. Alendronate treatment in cats with persistent ionized hypercalcemia: a retrospective cohort study of 20 cases. J. Vet. Intern. Med. 2022;36(6):1921-1930.
บทความอื่นๆ ในประเด็นนี้
แบ่งปันบนโซเชียลมีเดีย