Cómo abordar el acicalamiento excesivo en gatos
Escrito por Kate Griffiths
El acicalamiento forma parte del comportamiento normal del gato y consiste en lamerse y mordisquear el pelo y la piel, además de frotarse la cara con las patas delanteras. Su finalidad es la limpieza, la eliminación de parásitos y la termorregulación.
Article
Puntos clave
Se debe diferenciar entre la alopecia por acicalamiento excesivo y la alopecia por prdida de pelo espontnea, siendo necesario realizar una investigacin ordenada y sistemtica para determinar la causa subyacente.
La mayora de las veces el acicalamiento excesivo est causado por el prurito asociado a ectoparasitosis e hipersensibilidades.
Antes de diagnosticar alopecia psicgena se deben descartar todas las causas de prurito.
¿Qué es el acicalamiento excesivo?
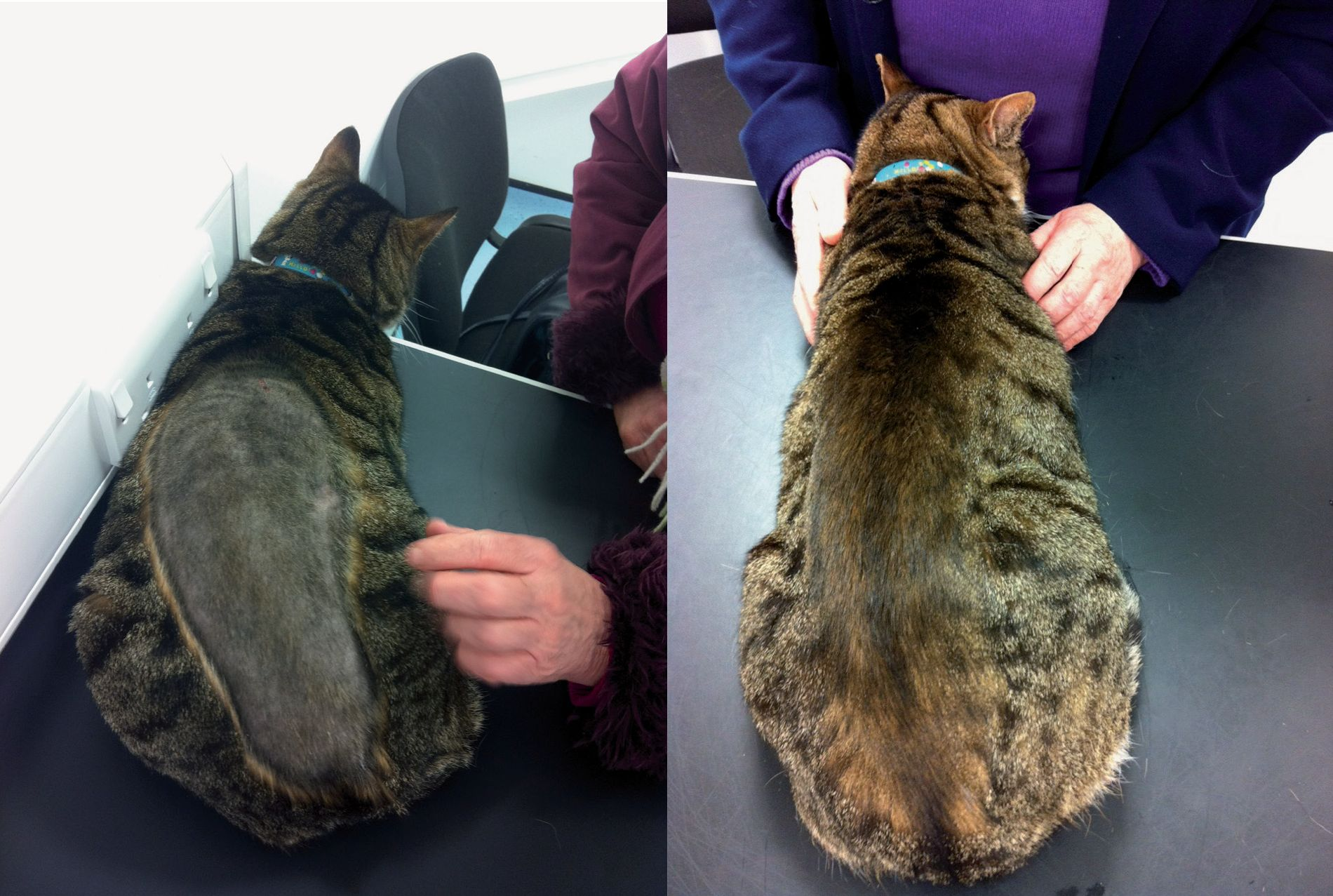
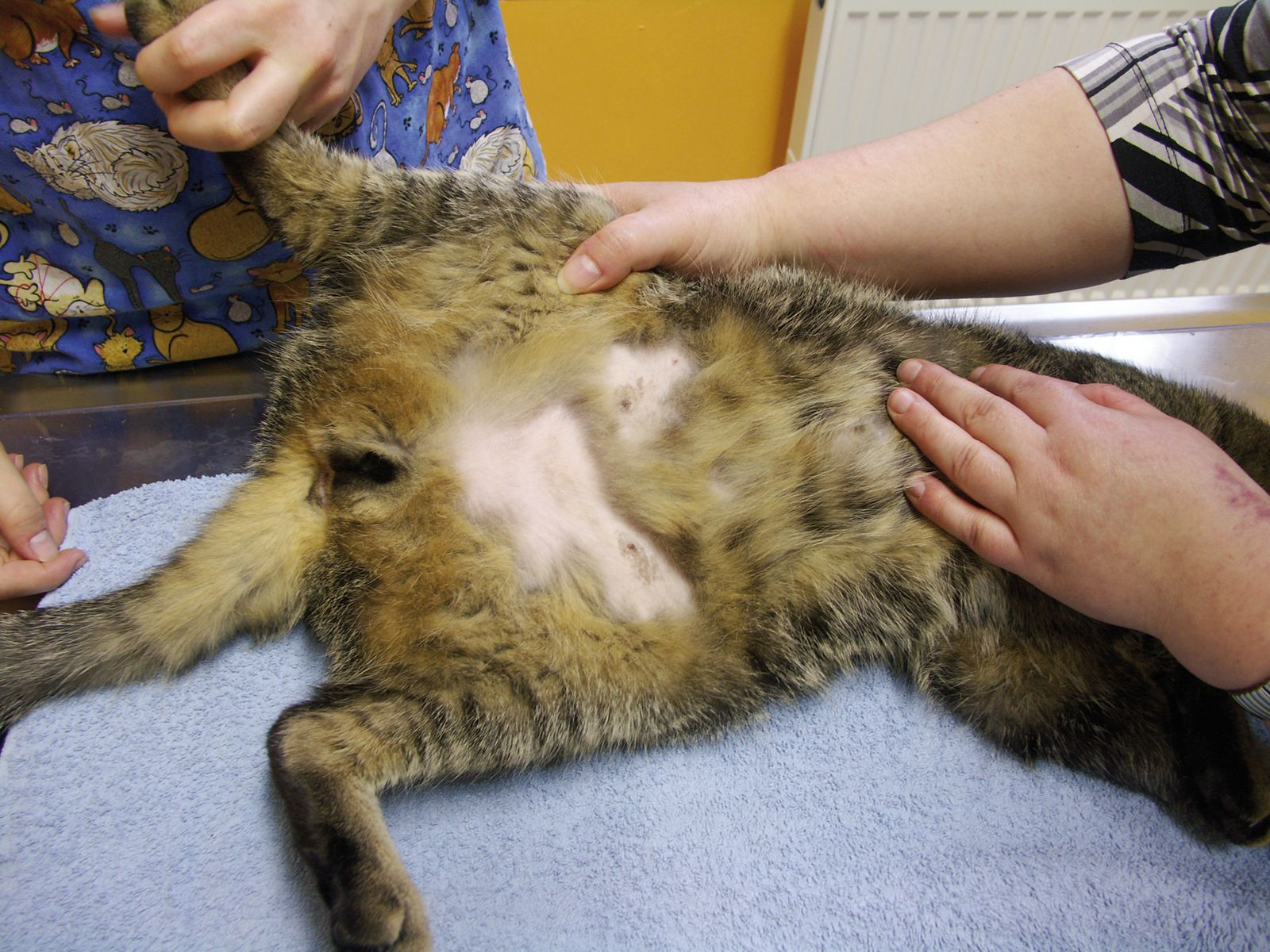
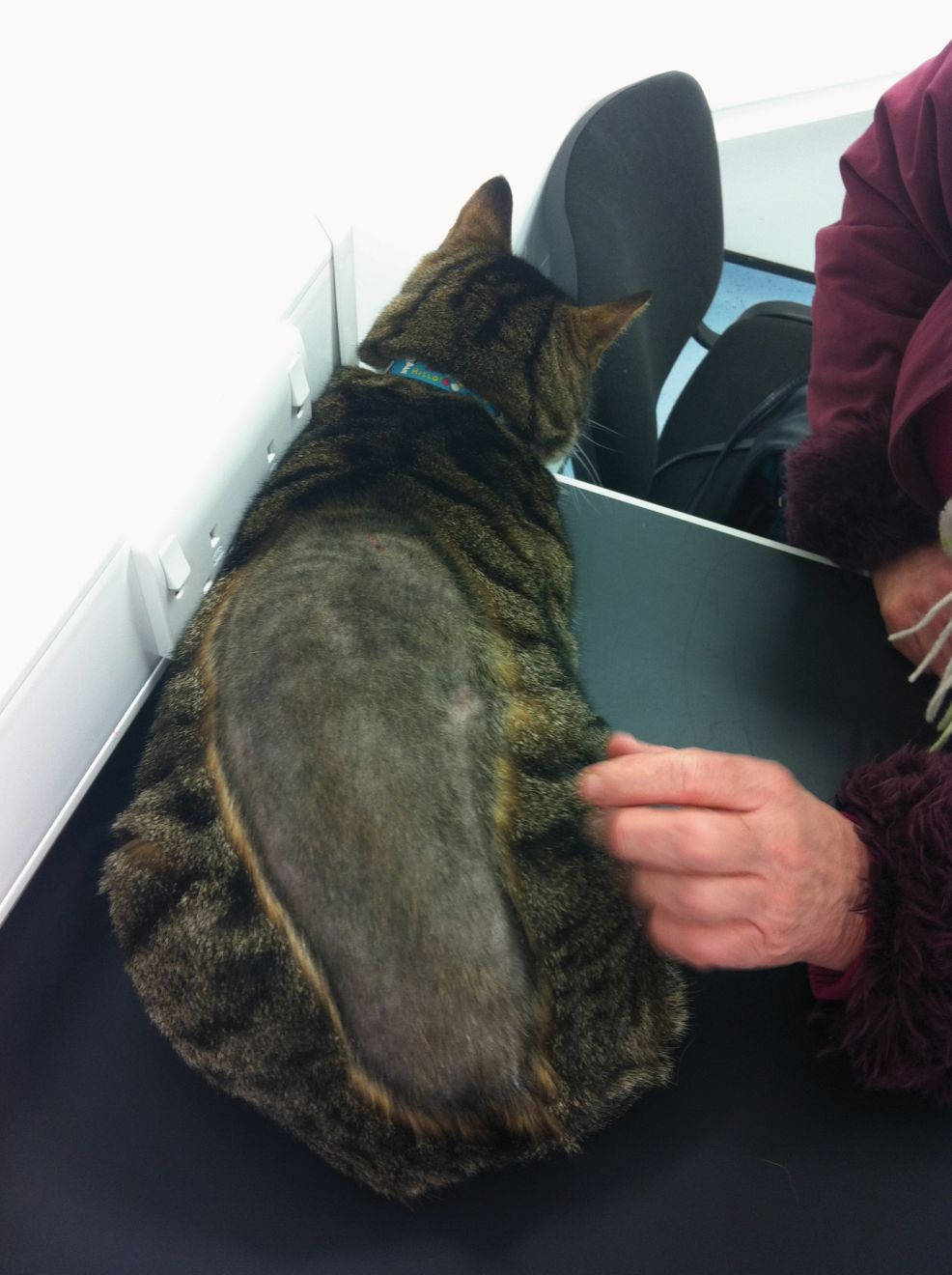
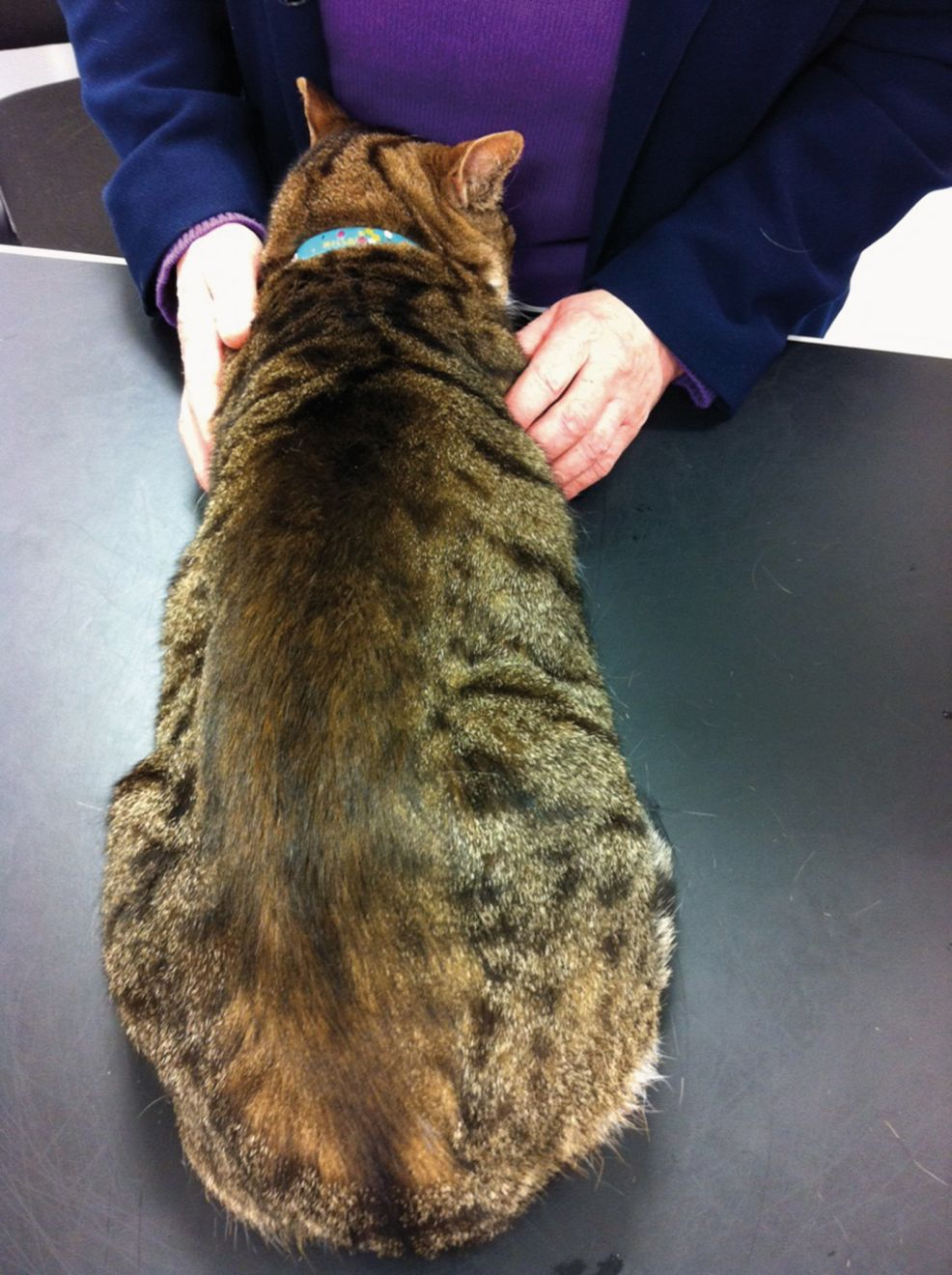
El acicalamiento forma parte del comportamiento normal del gato y consiste en lamerse y mordisquear el pelo y la piel, además de frotarse la cara con las patas delanteras. Su finalidad es la limpieza, la eliminación de parásitos y la termorregulación [1]. Sin embargo, el acicalamiento excesivo es un problema frecuente y adquirido que provoca la pérdida de pelo como consecuencia del lamido y aseo excesivos. Generalmente se observa una alopecia simétrica bilateral en el abdomen ventral, en la región caudal y medial de las extremidades posteriores y en el perineo (Figura 1), aunque también puede afectar a la parte lateral del abdomen y a otras áreas del cuerpo [2] (Figura 2).
El acicalamiento excesivo es la causa más frecuente de alopecia simétrica felina (ASF), la cual representa uno de los cuatro patrones de reacción cutánea descritos en el gato. Los otros tres patrones son: prurito de cabeza y cuello, complejo granuloma eosinofílico y dermatitis miliar. Todos estos patrones pueden estar causados por gran variedad de enfermedades [3] (Tabla 1). Aunque la ASF antes se denominaba “alopecia endocrina felina”, en la actualidad se sabe que la ASF se debe, en la mayoría de los casos, al acicalamiento excesivo como respuesta al prurito [4].
| Acicalamiento excesivo (pérdida de pelo autoinducida) | Pérdida de pelo espontánea |
|---|---|
|
Prurito
• Parásitos
Pulgas
Piojos
Ácaros de Demodex (D. gatoi)
Ácaros de Cheyletiella
Ácaros otodécticos
Ácaros notoédricos/sarcópticos
Neotrombicula (ácaro de la cosecha)
• Dermatofitosis
• Hipersensibilidades
Hipersensibilidad a la picadura de la pulga
Hipersensibilidad alimentaria
Hipersensibilidad ambiental
Reacción medicamentosa
• Hipertiroidismo
Alopecia psicógena
Dolor, neurodermatitis, neuralgia (raro)
|
Endocrinopatías
• Hiperadrenocorticismo
• Diabetes mellitus
• Hipotiroidismo
Alopecia paraneoplásica
Neoplasia
• Linfoma epiteliotropo de células T
Infecciones/ectoparásitos
• Dermatofitosis
• Ácaros de Demodex
Otros
• Tricorrexis nodosa
• Foliculitis mural mucinótica degenerativa
• Efluvio telógeno
• Pseudopelada
• Alopecia areata
• Muda fisiológica excesiva
|
¿Presenta el gato acicalamiento excesivo?
Cuando se presenta un gato con alopecia simétrica es esencial mantener un enfoque sistemático y exhaustivo para establecer, en primer lugar, si se trata de acicalamiento excesivo o, menos frecuentemente, de pérdida espontánea de pelo. Para ello es necesario obtener una historia clínica detallada, realizar una exploración clínica general y dermatológica completas, así como utilizar ciertas herramientas diagnósticas básicas.
En este artículo se describe detalladamente la aproximación clínica de la autora en los casos de acicalamiento excesivo en el gato. Para más información sobre los diferentes trastornos que pueden causar la pérdida de pelo espontánea, incluyendo la histopatología y pruebas de laboratorio necesarias para su diagnóstico, se remite al lector a textos de dermatología general.
Historia clínica y reseña
Obtener una historia clínica completa es el primer paso importante para la aproximación del gato con acicalamiento excesivo. Lamentablemente, el gato es un animal muy discreto y es posible que los propietarios no vean al gato acicalándose, o bien no reconozcan si es un comportamiento excesivo o anormal. Sin embargo, la presencia de pelo en heces, los vómitos o regurgitación de bolas de pelo o la presencia de pelos caídos por la casa, son datos de la historia clínica muy sugestivos de pérdida de pelo autoinducida.
Otros datos que se deben obtener en la historia clínica incluyen:
• Estilo de vida del gato y posibles vías de contagio;
¿Tiene el propietario otras mascotas?, y de ser así, ¿presentan también problemas cutáneos?
¿Tiene el gato acceso al exterior? ¿Existe algún tipo de contacto directo o indirecto con otros gatos, perros, erizos o conejos?
¿Entra el gato en otras casas o criaderos? ¿En la casa entran otras mascotas?
• Control de ectoparásitos;
¿Existe un control medioambiental adecuado?
¿Se utiliza un producto efectivo y con la frecuencia adecuada en todos los animales que están en contacto con el gato?
• Trastornos cutáneos concomitantes o previos y su respuesta al tratamiento;
¿Parece que el gato tiene picor?
• Estado de salud del gato;
• ¿Existe algún otro comportamiento que indique estrés, como por ejemplo, micción o defecación inapropiadas?
• ¿Existe algún causa obvia que pueda generar estrés: hogar con varios gatos, cambios en la casa (p.ej., nueva mascota en casa o vecindario, llegada de un bebé)?
La reseña también proporciona información útil. Por ejemplo, los trastornos de hipersensibilidad suelen aparecer en el adulto joven, aunque las alergias alimentarias pueden presentarse a cualquier edad. Las neoplasias y las enfermedades sistémicas son más frecuentes en el animal de edad avanzada. El gato Persa está predispuesto a la dermatofitosis y el Oriental a la alopecia psicógena [6].
Exploración física
Se debe realizar una exploración física general completa para detectar cualquier evidencia de enfermedad sistémica, en particular orientada a aquellas patologías que puedan cursar con pérdida de pelo espontánea.
La presencia de pelo quebradizo y áspero (de tacto similar al pelo rasurado) puede ser indicativa de acicalamiento excesivo. También se puede sospechar acicalamiento excesivo cuando se observan lesiones asociadas a procesos pruríticos, alergias o ectoparasitosis (escoriaciones, lesiones de dermatitis miliar o de granuloma eosinofílico) (Figura 3) o si se observan directamente ectoparásitos, como pulgas, piojos o ácaros. Sin embargo, se puede sospechar una pérdida de pelo espontánea cuando la alopecia afecta a áreas donde el gato no puede lamerse, o cuando el pelo se puede arrancar fácilmente (es decir, cuando se desprende fácilmente al tirar de él dando lugar a parches alopécicos).
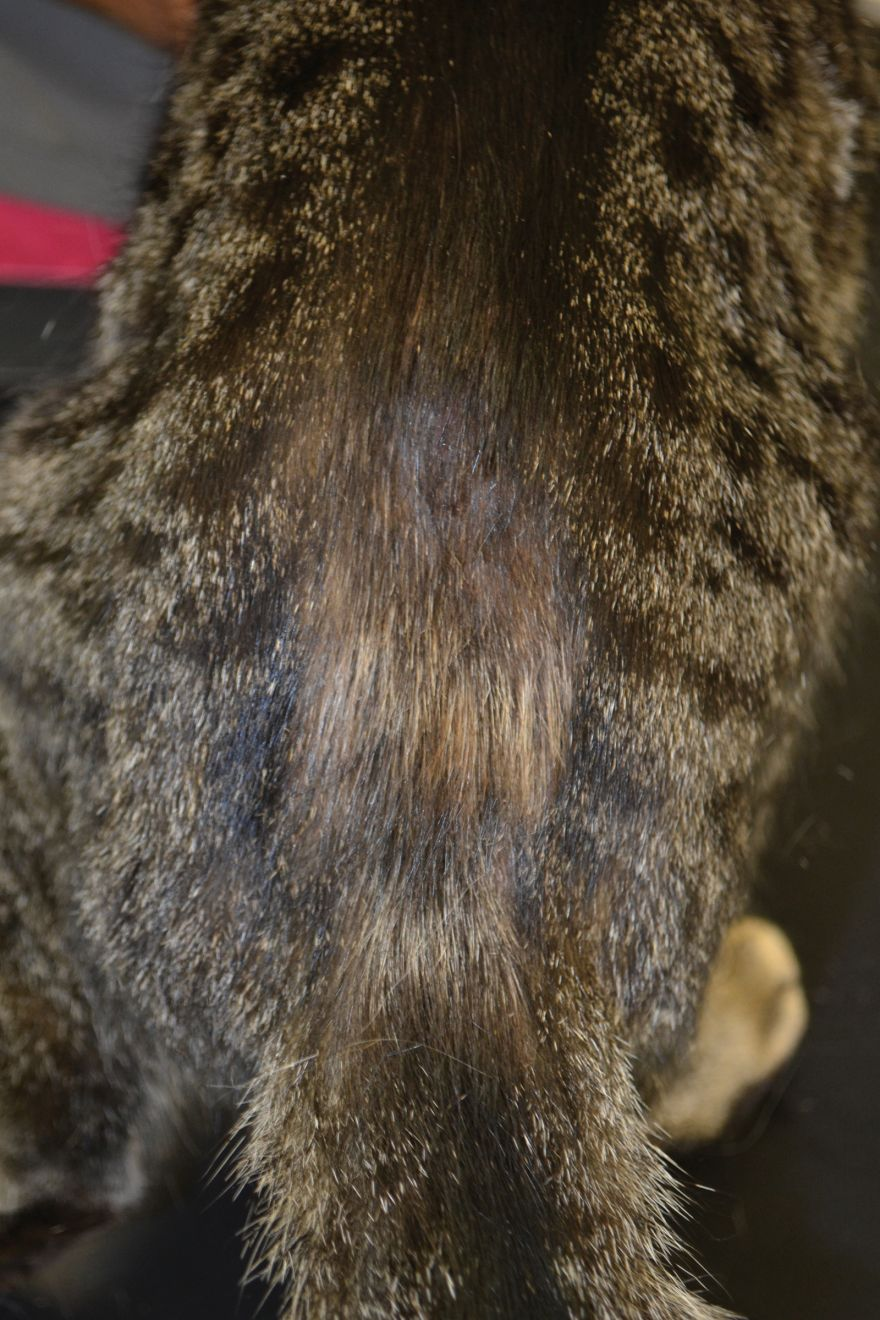
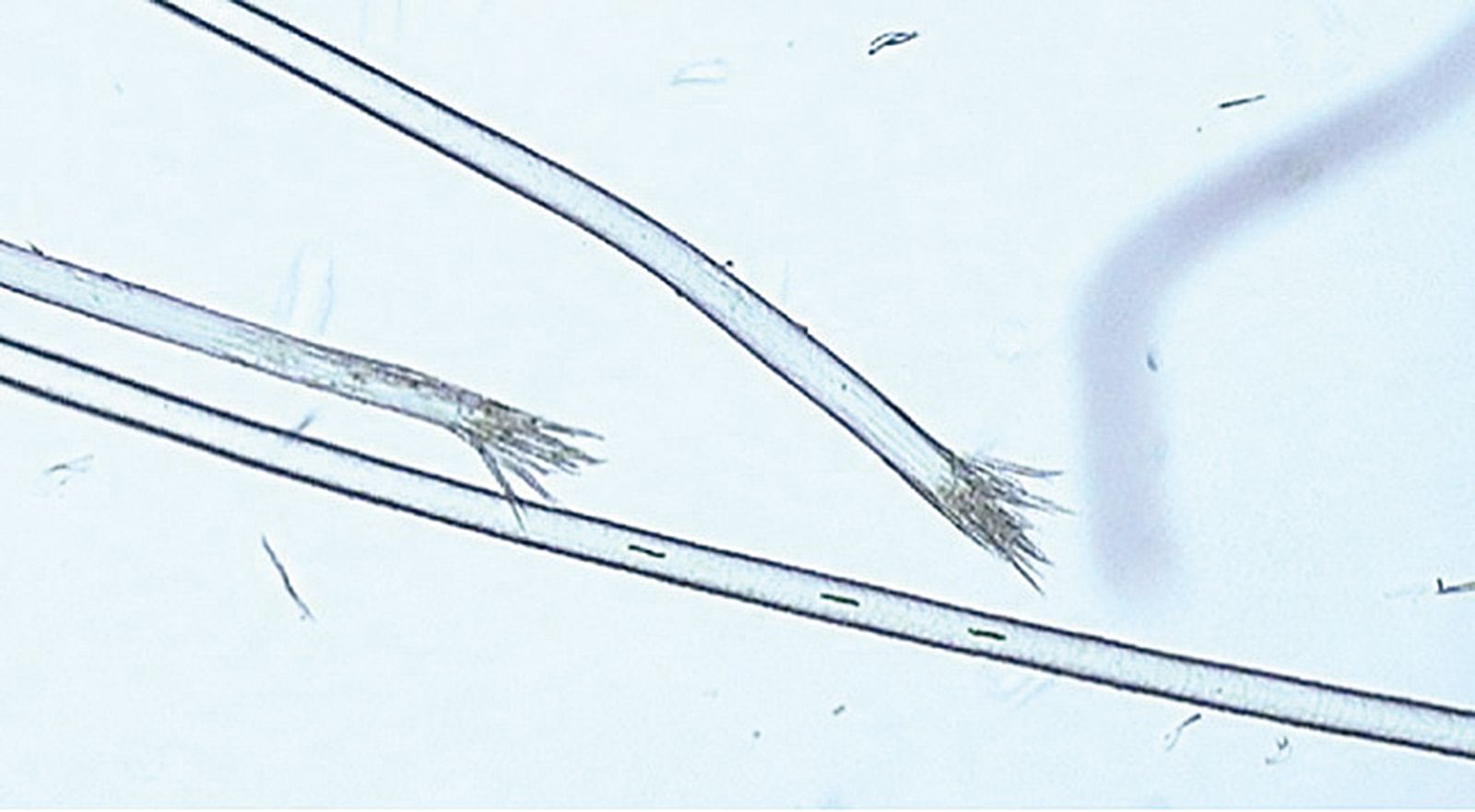
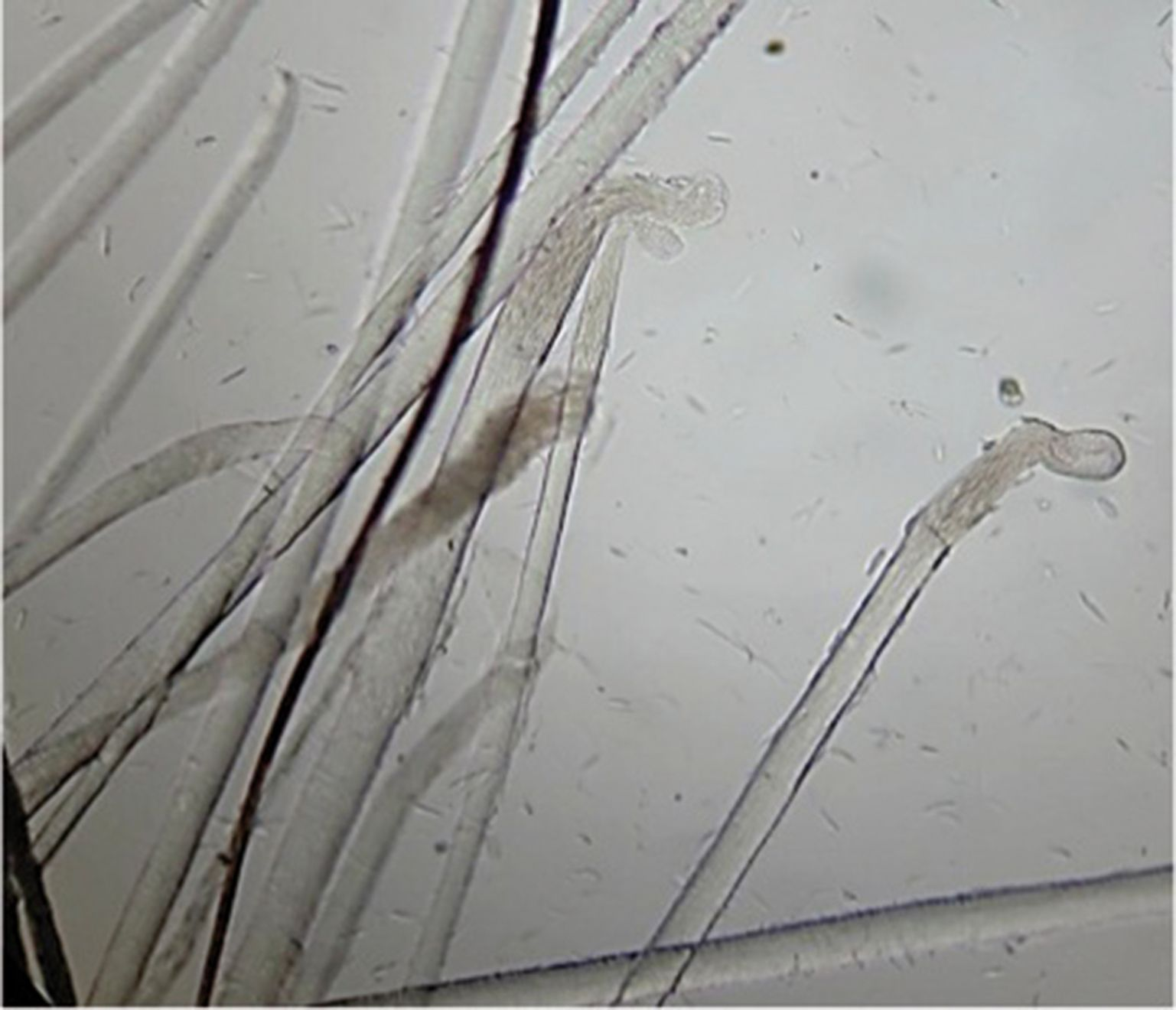
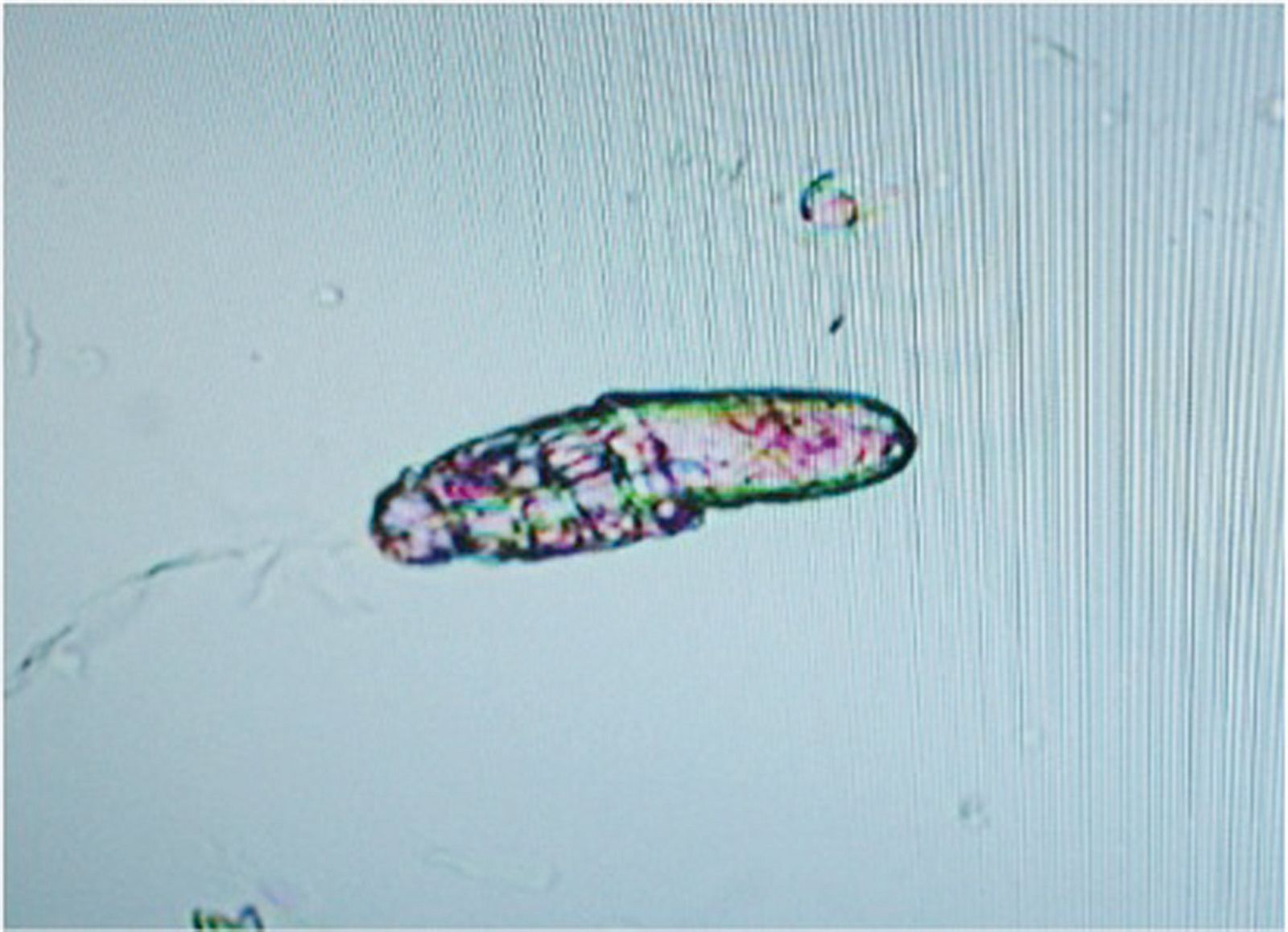
El tricograma proporciona más información al respecto; además, esta prueba es útil para convencer al propietario de que la pérdida de pelo se debe al exceso de acicalamiento y no a la caída espontánea. Para realizar el tricograma se arrancan pelos de la zona afectada con unas pinzas, se colocan bien alineados en un portaobjetos con parafina líquida (aceite mineral) y se pone encima un cubreobjetos. Se examina la muestra con el microscopio, tanto a pequeños como a grandes aumentos. En el caso de lamido excesivo las puntas aparecen irregulares y fragmentadas (Figura 4), mientras que cuando la pérdida de pelo es espontánea las puntas están intactas. La evaluación del bulbo piloso también proporciona información útil. En condiciones normales, el 10-20% de los bulbos pilosos se encuentran en fase anagén (crecimiento activo) y el 80-90% restante, en fase telogén (descanso) (Figura 5 y 6); pero si en varias muestras se observa que el 100% de los bulbos pilosos están en fase telogén se debe sospechar de una pérdida de pelo espontánea debido a una enfermedad subyacente, como una enfermedad endocrina, el efluvio telógeno o una enfermedad sistémica.
¿Cómo se debe investigar el exceso de acicalamiento?
Una vez que se ha confirmado el problema de acicalamiento excesivo es importante determinar su causa para instaurar el tratamiento más adecuado.
Investigación de ectoparásitos e infecciones
Es esencial realizar una investigación exhaustiva, puesto que la hipersensibilidad a la picadura de pulga es la causa de prurito más frecuente en el gato [7].
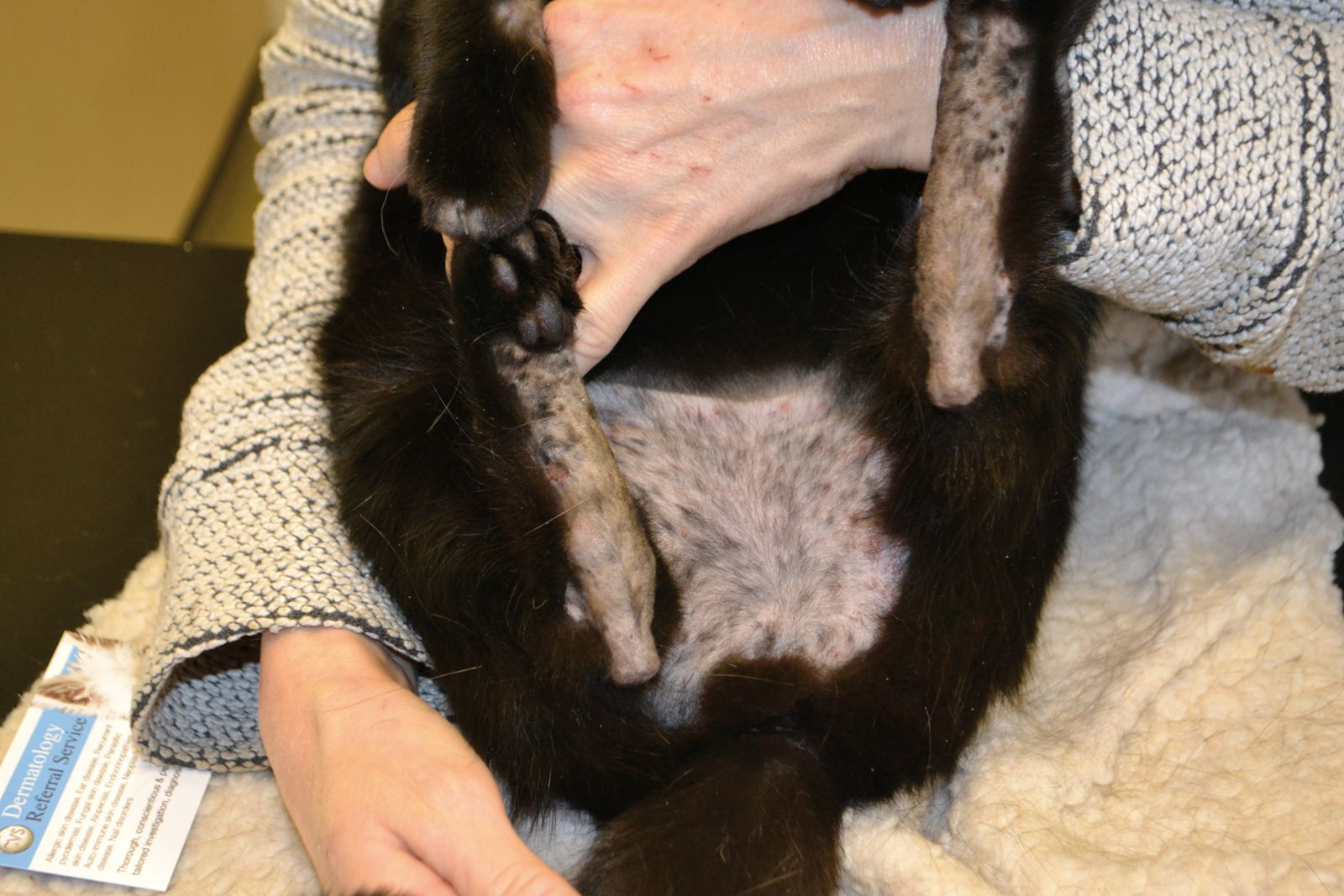
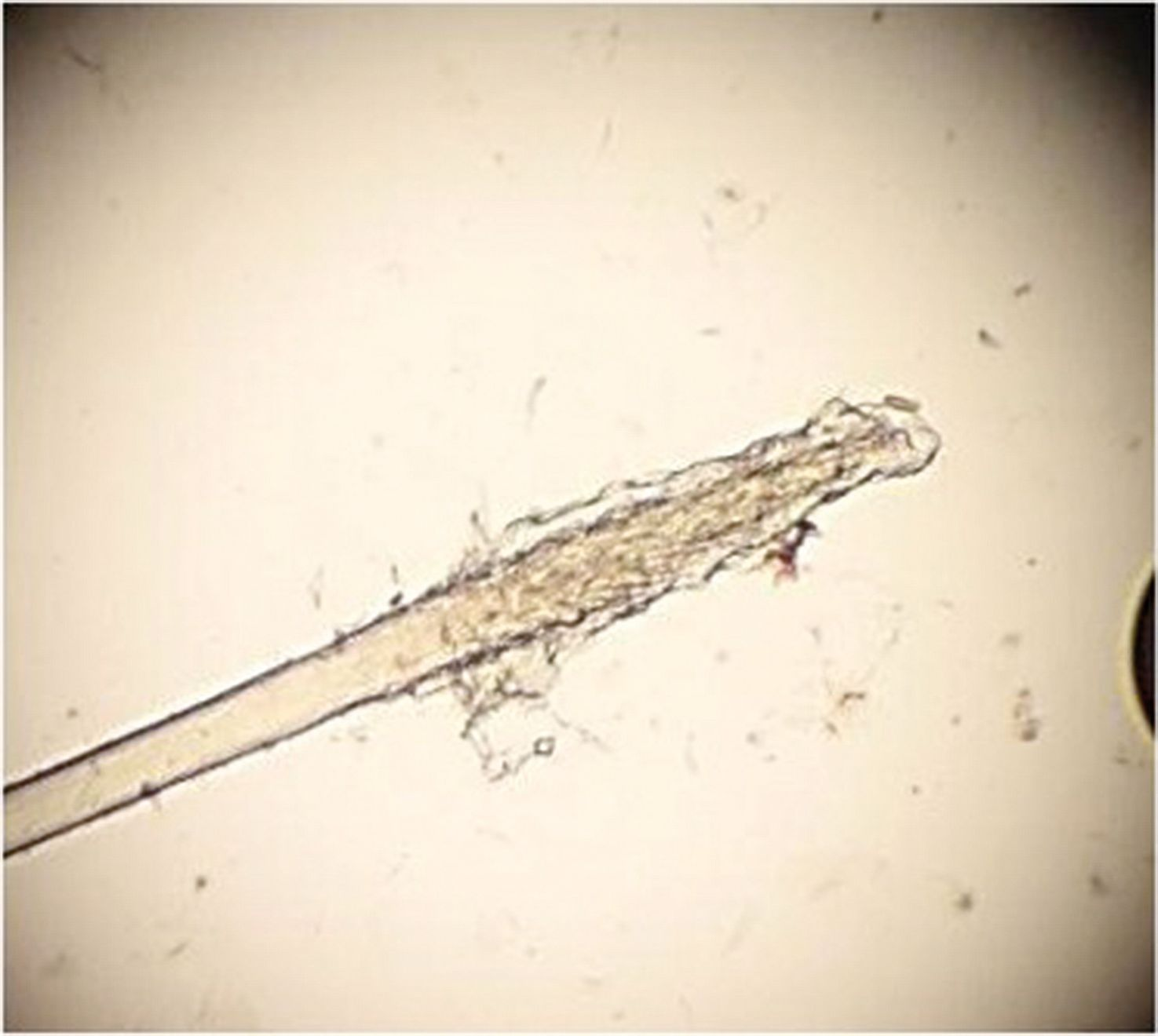
Ectoparásitos: El manto del gato se debe peinar y cepillar colocando un papel blanco para recoger posibles pulgas, heces de pulgas y piojos. También se debe examinar al microscopio una muestra de pelo obtenida mediante cepillado, así como una muestra de raspado cutáneo en parafina líquida para detectar Cheyletiella, Otodectes, Demodex y, menos frecuentemente, Notoedres o Sarcoptes. En el tricograma también se pueden observar huevos adheridos al tallo del pelo en caso de infestación por piojos y Cheyletiella (Figura 7).
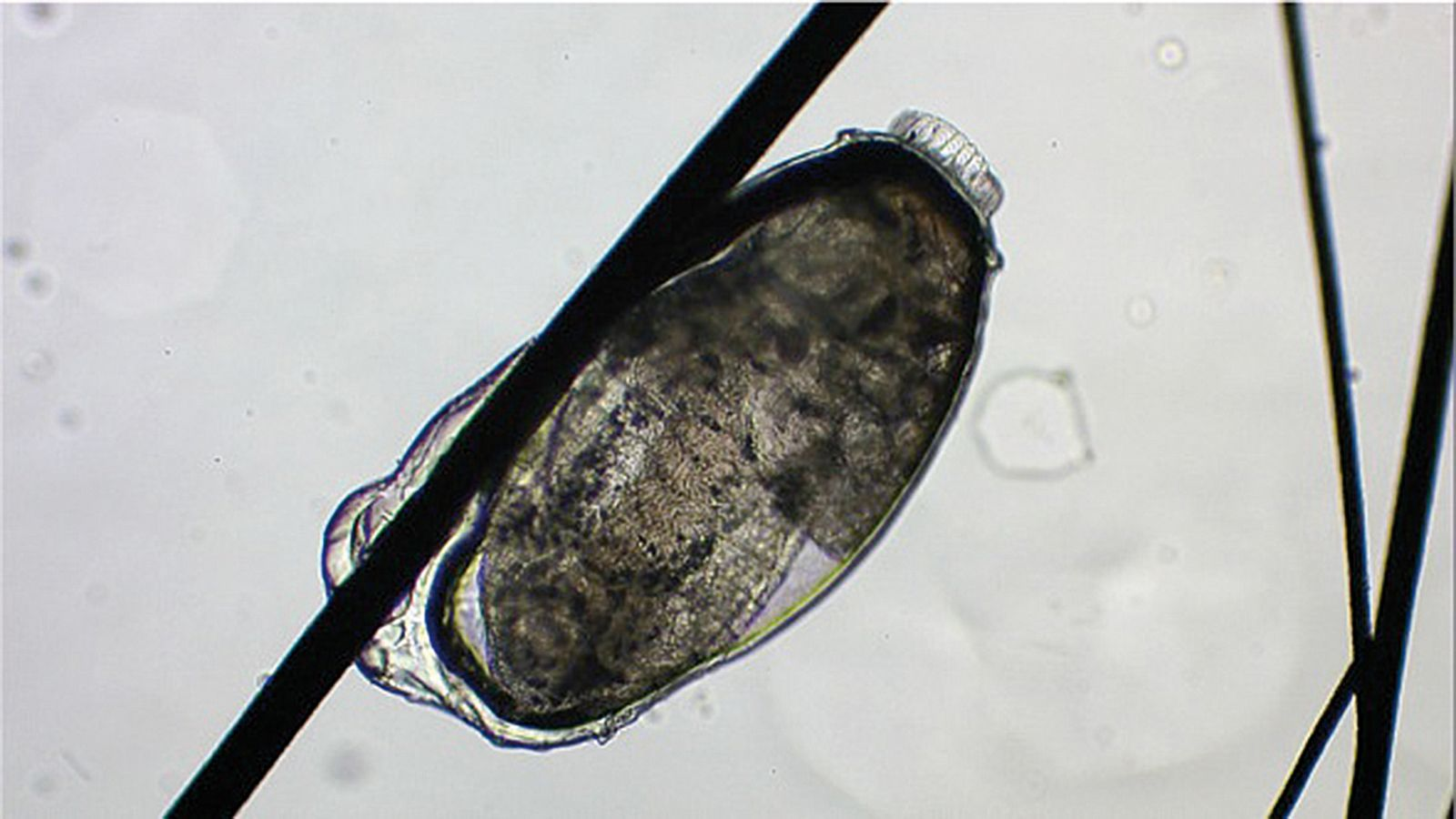
Demodex gatoi, es un tipo de Demodex de abdomen ancho y romo (Figura 8) presente en algunas regiones geográficas y que puede dar lugar a acicalamiento excesivo en el gato. A diferencia de D.cati, este ácaro se localiza en las capas superficiales de la piel, pudiéndose identificar en una muestra obtenida con cinta adhesiva o raspado cutáneo superficial. Este ácaro es translúcido y de pequeño tamaño por lo que puede pasar desapercibido; para evitarlo, es necesario examinar la muestra con un objetivo de 10x aumentos y a baja intensidad de luz. Aun así, se pueden dar falsos negativos ya que el lamido arrastra también a los ácaros y, por tanto, se deben realizar también raspados de zonas aparentemente sanas e inaccesibles al lamido. Además, dada su naturaleza contagiosa, puede ser útil evaluar a otros gatos asintomáticos en contacto con el paciente. Estos ácaros, al ser ingeridos mediante el lamido, también se pueden detectar en el análisis coprológico. Si se sospecha D. gatoi pero no se ha podido confirmar su presencia se puede instaurar un tratamiento de prueba, que incluya a los gatos en contacto con el paciente, con baños de cal sulfurada al 2% una vez a la semana y durante tres semanas. Si no se dispone de este producto se puede administrar ivermectina vía oral (0,2-0,3 mg/kg cada 24-48 h), pero su uso no está registrado en gatos y existe el riesgo de neurotoxicidad [8] [9] [10] .
Antes de realizar estas pruebas diagnósticas es recomendable explicar al propietario la posibilidad de obtener falsos negativos. Por tanto, aunque no se encuentren parásitos, también se debe instaurar durante un mínimo de 12 semanas un tratamiento de prueba frente a pulgas y ácaros no demodécicos. Para ello se pueden utilizar pipetas con selamectina o imidacloprid/moxidectina, aplicándolas a todos los perros y gatos en contacto con el paciente, aunque normalmente estos fármacos no están registrados como antiácaros en el gato.
A pesar de que muchas veces se pasa por alto, es esencial tratar el ambiente con un aerosol que contenga un adulticida y un regulador del crecimiento de insectos. También se deben incluir otras áreas distintas al propio hogar donde el gato pase tiempo, como el coche, transportín o edificios contiguos. El tratamiento se debe repetir a las 4-8 semanas, dependiendo de la duración del efecto del adulticida utilizado. Dado que la fase de pupa puede durar hasta tres meses, y durante este tiempo son resistentes al tratamiento, es necesario repetir regularmente el tratamiento con un adulticida para asegurar la eliminación de las nuevas pulgas adultas antes de que estas comiencen a picar al gato. Es importante tener en cuenta que cada vez que el gato sale al exterior se puede infestar de nuevo, particularmente por pulgas, siendo imposible evitarlo, especialmente cuando entra en contacto con otros animales o ambientes no tratados. No obstante, también hay que valorar las ventajas e inconvenientes de la situación, puesto que la vida estrictamente de interior puede causar estrés al gato.
Si se observa una mejoría se debe mantener regularmente el control de pulgas; preferiblemente administrando productos sistémicos al gato, puesto que el lamido dificulta el control total. Para facilitar el seguimiento del tratamiento se pueden enviar recordatorios a los propietarios utilizando mensajes de texto o de correo electrónico [11].
Infecciones: Los dermatofitos se pueden detectar examinando el pelo con una lámpara de luz ultravioleta; antes de usar la lámpara es necesario esperar cinco minutos para que se caliente. Sin embargo, con este examen es frecuente obtener falsos negativos, por lo que siempre que se sospechen dermatofitos se debe tomar además una muestra para cultivo. La mejor manera de tomar la muestra es con un cepillo de dientes estéril, el cual se debe enviar al laboratorio después de haber cepillado al paciente junto con pelos arrancados (con pinzas estériles) del área periférica de la lesión.
También se puede realizar un estudio citológico de la superficie de la piel, especialmente cuando se sospechan infecciones bacterianas o por Malassezia. La muestra se puede obtener por impronta o con cinta adhesiva, tiñéndola para su posterior evaluación. Cualquier infección que se identifique, aunque probablemente sea secundaria a una causa subyacente, se debe tratar adecuadamente.
Es importante señalar que cuando el prurito es intolerable y no se ha podido identificar una infección o una demodicosis se pueden administrar glucocorticoides durante la fase inicial del tratamiento antiparasitario de prueba, utilizando idealmente prednisolona (1-2 mg/kg cada 24 h). Esta dosis se puede ir disminuyendo hasta conseguir la dosis mínima eficaz en días alternos, dejándose de administrar al final del tratamiento de prueba para poder observar el efecto del tratamiento frente a ectoparásitos.
Reacciones a fármacos
En la historia clínica se deben identificar las posibles causas relacionadas con la administración de algún fármaco, retirándolo si es posible en caso de sospecha. Además, se deben tomar las medidas indicadas anteriormente.
Investigación de hipersensibilidades
Si el lamido excesivo persiste después de descartar causas infecciosas y ectoparasitarias se debe investigar la posibilidad de hipersensibilidad al alimento o a los alérgenos ambientales. Aunque se puede sospechar una hipersensibilidad alimentaria cuando en la historia clínica se indican problemas digestivos, estos no siempre están presentes y, además, la presentación clínica no permite diferenciar estos trastornos.
Hipersensibilidad alimentaria: Dado que los test in vitro tienen una fiabilidad cuestionable para el diagnóstico de alergia alimentaria [12], se debe realizar la prueba de administrar una dieta de eliminación durante un mínimo de 6-8 semanas. Tradicionalmente se utilizaban dietas caseras con una fuente novel de proteína y de carbohidratos, pero actualmente se utilizan con más frecuencia dietas comerciales formuladas con ingredientes noveles puesto que están equilibradas nutricionalmente y son más cómodas de usar. Sin embargo, se debe prestar especial atención a la hora de elegir la dieta, puesto que debe estar formulada específicamente para alergias y de ben estar especificados todos sus ingredientes para comprobar que son noveles, lo cual no siempre ocurre con otros alimentos, incluyendo los que se anuncian como “hipoalergénicos” pero no son de prescripción veterinaria [13]. También se pueden utilizar dietas comerciales con proteína hidrolizada. Sin embargo, dado que existe la preocupación de que el paciente reaccione a la proteína nativa, se ha sugerido utilizar una dieta hidrolizada cuya composición sea lo más novel posible [14] [15] .
En el gato puede resultar complicado realizar la prueba de la dieta de eliminación, siendo necesario que el propietario mantenga cierto nivel de compromiso. Si el gato rechaza una dieta en particular, la autora sugiere utilizar más de una dieta para ofrecer mayor variedad. Además, muchos gatos ingieren pequeñas porciones de alimento a lo largo del día, por lo que si el gato convive con otros gatos es necesario proporcionar a todos la misma dieta. Al igual que ocurre con el control de ectoparásitos, lo ideal es mantener al gato en el interior de la casa para evitar que cace o ingiera cualquier otro alimento. Si esto no es posible, por el estrés asociado o por otras cuestiones prácticas, se deben adoptar todas las medidas de control posibles (p.ej., dando a los vecinos que alimenten al gato la dieta que este deba consumir), pero en este caso, también habrá que asumir las limitaciones de la prueba.
Si a las 6-8 semanas de iniciar la dieta de eliminación se resuelve el prurito se puede continuar un mes más con la misma dieta y con el control estricto de ectoparásitos, comprobando así si la mejoría se mantiene. En caso de mantenerse, el siguiente paso consiste en reintroducir el alimento que se utilizaba antes de la dieta de eliminación. Si el gato vuelve a presentar acicalamiento excesivo con este alimento se confirma el diagnóstico de hipersensibilidad alimentaria y, de nuevo, se debe proporcionar la dieta de eliminación hasta que el prurito se resuelva, eligiendo posteriormente una dieta adecuada de mantenimiento a largo plazo. Dicha dieta puede ser la misma dieta de eliminación, en caso de estar nutricionalmente equilibrada, o una dieta específica para alergias alimentarias cuya composición sea lo más parecida a la dieta de eliminación.
Otra opción consiste en identificar a los alérgenos alimentarios reintroduciendo cada ingrediente uno a uno (uno cada 7-14 días). En este caso se administrará al gato una dieta que no contenga los alérgenos identificados.
Si al reintroducir el alimento habitual no se produce una reaparición de los signos clínicos, hay que considerar que el prurito podría estar causado por un alérgeno al cual ya no está expuesto el gato. Esto puede ocurrir en particular cuando los alérgenos son estacionales, por lo que el gato no tendrá signos hasta el año siguiente cuando vuelva a tener contacto con el alérgeno.
Al igual que con el tratamiento de prueba frente a ectoparásitos, también puede ser necesario administrar glucocorticoides inicialmente para controlar el lamido intenso, aunque se deben suspender hacia el final de la prueba de la dieta de eliminación para comprobar el efecto único de dicha dieta. Si no se observa mejoría solo con la dieta, es probable que el gato presente una hipersensibilidad ambiental.
Hipersensibilidad ambiental (atopia): Esta es la segunda causa más frecuente de prurito en el gato [7] y solo se puede diagnosticar correctamente una vez que se han realizado todos los pasos anteriores, siendo por tanto un diagnóstico clínico por exclusión. Las pruebas intradérmicas y la serología de IgE, al igual que en el caso del perro, no son pruebas suficientes como para diagnosticar hipersensibilidad ambiental en un paciente, puesto que se pueden obtener falsos positivos y negativos [16] [17] [18]. Además, en el gato la interpretación de las pruebas intradérmicas puede resultar complicada y la determinación de IgE in vitro, aunque es una prueba sencilla, no se ha validado de la misma manera que en el perro [19] [20] .
Una vez confirmado el diagnóstico de hipersensibilidad ambiental existen varias opciones terapéuticas, cuya elección depende de la gravedad de los signos clínicos, preferencia del propietario y carácter del paciente. Aunque en el gato se puede utilizar la inmunoterapia alérgeno específica, existen menos evidencias que en el perro [18] [21]. La elección de los alérgenos a incluir en la inmunoterapia se basa en los resultados de las pruebas intradérmicas o serológicas de IgE, con las limitaciones mencionadas anteriormente. Por lo demás, el tratamiento es sintomático, teniendo como objetivo controlar el prurito así como los factores que pueden exacerbar los signos (p.ej., presencia de pulgas e infecciones microbianas secundarias). También se debe intentar evitar la exposición al alérgeno, pero esto muchas veces no es posible.
¿Qué tratamientos antipruríticos existen?
El prurito se puede controlar utilizando glucocorticoides, ciclosporina y, posiblemente, antihistamínicos. Antes también se utilizaban otro tipo de fármacos como el acetato de megestrol, pero actualmente es preferible evitarlos puesto que existen otras alternativas más seguras [22].
Glucocorticoides
Cuando se administran glucocorticoides es preferible utilizar la vía oral para poder reducir la dosis y frecuencia hasta alcanzar el mínimo eficaz necesario para el manejo a largo plazo (Tabla 2). En el gato se recomienda utilizar la prednisolona antes que la prednisona, puesto que esta no se puede metabolizar eficazmente. En gatos que no toleran la vía oral se pueden utilizar inyecciones depot de glucocorticoides (p.ej., acetato de metilprednisolona), aunque se debe advertir a los propietarios de los posibles efectos secundarios iatrogénicos asociados a su uso prolongado.
| Glucocorticoides orales | Dosis inicial | Dosis reducida |
|---|---|---|
| Prednisolona o metilprednisolona | 1-2 mg/kg cada 24 h | 0,5-1,0 mg/kg cada 48 h |
| Dexametasona | 0,1-0,2 mg/kg cada 48-72 h | 0,05-0,1 mg/kg cada 48-72 h o menos |
| Triamcinolona | 0,1-0,2 mg/kg cada 24 h | 0,05-0,1 mg/kg cada 48-72 h |
Ciclosporina
La ciclosporina está autorizada en muchos países para su uso en gatos con dermatitis alérgica. Antes de utilizarla se debe valorar el estado infeccioso del gato frente a FeLV, FIV y Toxoplasma. La dosis iniciales de 7 mg/kg cada 24 h durante 4-6 semanas, a partir de las cuales, en muchos casos, se puede reducir la dosis a días alternos e incluso, en algunos pacientes, a dos veces por semana (Figura 9 y 10).
Cuando se presenta un gato con alopecia simétrica es esencial mantener un enfoque sistemático y exhaustivo para establecer, en primer lugar, si se trata de acicalamiento excesivo o, menos frecuentemente, de pérdida espontánea de pelo.
Antihistamínicos
Oclacitinib
¿Qué más puede causar acicalamiento excesivo?
Resumen
Kate Griffiths
BVSc, CertVD, MRCVS
Reino Unido
La Dra. Griffiths se licenció en Veterinaria por la Universidad de Bristol en 1984 y, durante los siguientes 18 años, se dedicó a la clínica general de Pequeños Animales. En el 2000 obtuvo el Certificado en Dermatología Veterinaria por el RCVS, y actualmente trabaja como especialista en Dermatología en dos hospitales privados de Reino Unido. Además, desde el 2007 es profesora asistente de Dermatología Veterinaria en la Facultad de Veterinaria de la Universidad de Nottingham, enseñando esta especialidad a los estudiantes e impartiendo cursos de formación continuada a veterinarios.
Bibliografía
- Eckstein R, Hart B. The organization and control of grooming in cats. App Animal Behav Sci 2000;68:131-140.
- Hill P. A practical approach to feline symmetrical alopecia. In Pract 1998;20(9):478-484.
- Favrot C. Feline allergic skin disease. In: Jackson H and Marsella R (eds)BSAVA Manual of Small Animal Dermatologia, 3rded. Gloucester; BSAVA 2012;141-145.
- Miller W, Griffin C, Campbell K. Congenital and hereditary defects. In:Muller Kirks Small Animal Dermatologia.7thed. St Louis Missouri: Elsevier Mosby. 2013;567.
- Auxilia, S, Sinke J. An approach to feline alopecia. In: Jackson H and Marsella R (eds) BSAVA Manual of Small Animal Dermatologia, 3rd ed. Gloucester; BSAVA 2012;76-85.
- Alhaidari Z. Diagnostic approach to alopecia. In: Guagure E and Prlaud P (eds).A practical guide to feline dermatologia. Oxford; Merial Publications. 1999;19.1-19.7.
- Hobi S, Linek M, Marignac G,et al. Clinical characteristics and causes of pruritus in cats: a multicentre study on feline hypersensitivity-associated dermatoses.Vet Dermatol2011;22(5):406-413.
- Beale K. Feline demodicosis: a consideration in the itchy or overgrooming cat.J Feline Med Surg2012;14(3):209-213.
- Saari S, Juuti K, Palojarvi J,et al.Demodex gatoi-associated contagious pruritic dermatosis in cats – a report from six households in Finland.Acta Vet Scand2009;51:40.
- Cerundolo R. Diagnostic and therapeutic approach to common ectoparasitoses in small animal practice. In Pract 2013;35(Suppl 1):18-23.
- Cadiergues M. Feline Allergy; Therapy, in Noli C, Foster A, Rosenkrantz W (eds). Veterinary Allergy, Chichester; Wiley Blackwell 2014;259-264.
- Hardy J, Hendricks A, Loeffler A, et al. Food-specific serum IgE and IgG reactivity in dogs with and without skin disease: lack of correlation between laboratories. Vet Dermatol 2014;25(5):447-e70.
- Raditic D, Remillard R, Tater, K. ELISA testing for common food antigens in four dry dog foods used in dietary elimination trials. J Anim Physio Anim Nutr(Berl), 2011;95(1):90-97.
- Oldenhoff W, Moriello K. Diagnostic investigation of the allergic feline. In: Noli C, Foster A, Rosenkrantz W (eds). Veterinary Allergy. Chichester; Wiley Blackwell 2014;223-227.
- Ricci R, Hammerburg B, Paps J, et al. A comparison of the clinical manifestations of feeding whole and hydrolysed chicken to dogs with hypersensitivity to the native protein. Vet Dermatol 2010;21(4):358-366.
- Schleifer S, Willemse T. Evaluation of skin test reactivity to environmental allergens in healthy cats and cats with atopic dermatitis. Am J Vet Res 2003;64(6):773-778.
- Belova S, Wilhelm S, Linek M, et al. Factors affecting allergen-specific IgE serum levels in cats. Can J Vet Res 2012;76(1):45.
- Ravens P, Xu B, Vogelnest L. Feline atopic dermatitis: a retrospective study of 45 cases (2001-2012). Vet Dermatol 2014;25(2):95-e28.
- Diesel A. Allergen-specific immunotherapy. In: Noli C, Foster A, Rosenkrantz W (eds). Veterinary Allergy. Chichester; Wiley Blackwell 2014;234-236.
- Roosje P, Thepen T, Rutten V, et al. Feline atopic dermatitis. In: Thoday K, Foil C, Bond R (eds) Advances in Veterinary DermatologiaVol. 4. Oxford; Blackwell Sciences 2002;178-187.
- Halliwell R. Efficacy of hyposensitization in feline allergic diseases based upon results of in vitro testing for allergen-specific immunoglobulin E. J Am Anim Hosp Assoc 1996;33(3):282-288.
- Diesel A. Symptomatic treatments. In: Noli C, Foster A, Rosenkrantz W (eds). Veterinary Allergy, Wiley Blackwell: Chichester 2014;228-233.
- Ortalda C., Noli C., Colombo S, et al. Oclacitinib in feline nonflea-, nonfood-induced hypersensitivity dermatitis: results of a small prospective pilot study of client-owned cats. Vet Dermatol 2015;26:235-238.
- Sawyer L, Moon-Fanelli A, Dodman N. Psychogenic alopecia in cats: 11 cases (1993-1996). J Am Vet Med Assoc 1999;214(1):71-74.
- Mills D, Karagiannis C, Zulch H. Stress its effects on health and behavior: a guide for practitioners. Vet Clin North Am Small Anim Pract2014;44(3):525- 541.
- Miller W, Griffin C, Campbell K. Psychogenic skin diseases. In: Muller Kirks Small Animal Dermatologia. 7th ed. St Louis Missouri: Elsevier Mosby 2013;657.
- Waisglas S, Landsberg G, Yager J, et al. Underlying medical conditions in cats with presumptive psychogenic alopecia. J Am Vet Med Assoc 2006;11:1705- 1709.
- Tapp T, Virga V. Behavioural disorders. In: Jackson H, Marsella R (eds). BSAVA Manual of Canine and Feline Dermatologia, 3rd ed. Gloucester; BSAVA 2012;256-262.
- Virga V. Behavioral Dermatologia. Vet Clin North Am Small Anim Pract2003; 33(2):231-251.
Otros artículos de este número
Compartir en las redes sociales