Hipercalcemia patológica en el perro
Escrito por Jordan M. Hampel y Timothy M. Fan
En este artículo se revisan los diagnósticos diferenciales y las opciones de tratamiento para el perro que presenta una concentración sérica de calcio elevada.
Article
Puntos clave
La homeostasis del calcio est regulada por la PTH, la calcitonina y la vit. D mediante su movilizacin, excrecin y absorcin en el tejido seo, renal e intestinal, respectivamente.
Las causas ms frecuentes de hipercalcemia en el perro son: cncer, hiperparatiroidismo primario e hipoadrenocorticismo; la hipercalcemia idioptica, a diferencia del gato, es rara.
Los signos clnicos incluyen poliuria con polidipsia compensatoria, debilidad generalizada, letargia, alteraciones gastrointestinales y prdida de peso.
Promover precozmente la calciuresis, as como identificar y tratar la causa subyacente es esencial para el manejo ptimo del paciente y el pronstico favorable.
Introducción
El calcio es el quinto elemento más abundante en el organismo. Es un catión esencial que se encuentra tanto en líquidos corporales como almacenado en orgánulos celulares. El calcio participa en muchas funciones intracelulares y extracelulares vitales, como la transmisión neuromuscular, las reacciones enzimáticas, la coagulación sanguínea, el tono vasomotor, la secreción hormonal y el metabolismo óseo. Aunque el calcio se encuentra ampliamente distribuido por los tejidos celulares, la rápida fluctuación de calcio intracelular regula la respuesta celular a la activación de los receptores de la membrana plasmática, además de actuar como mensajero secundario para perpetuar las señales externas en las células y modular las funciones biológicas derivadas [1].
Aunque el calcio intracelular es fundamental para la actividad celular normal, solo se puede determinar el nivel de calcio presente en los líquidos corporales, donde se encuentra en tres formas diferentes: libre o iónico, unido a proteínas y formando complejos con aniones o ácidos orgánicos. El calcio iónico (iCa) es la forma biológicamente activa que puede atravesar la membrana plasmática a través de canales iónicos permeables al calcio, transportadores activos e intercambiadores de cationes [2] y constituye el 50% del calcio sérico total. La parte restante se distribuye aproximadamente en un 40% unido a proteínas y un 10% formando complejos. Dada su importancia en las funciones celulares, la concentración de iCa debe estar estrechamente regulada para garantizar las adecuada actividad fisiológica de numerosos sistemas celulares, tisulares y orgánicos; esto se consigue gracias a las acción coordinada de la hormona paratiroidea (PTH), el 1,25-dihidroxicolecalciferol (vitamina D3 activa o calcitriol) y la calcitonina [3]. Al igual que su importancia en la señalización intracelular, el calcio del líquido extracelular también es esencial para regular las funciones celulares de muchos tejidos glandulares y epiteliales vitales, como la glándula paratiroides, las células C de la glándula tiroides y el riñón.
Homeostasis del calcio
La PTH, la calcitonina y el calcitriol son los principales responsables de mantener el equilibrio de la concentración de calcio en todo el organismo mediante acciones biológicas complementarias y/o sinérgicas en tres órganos diana: los riñones, el intestino delgado y la matriz ósea inorgánica (hidroxiapatita) [3] (Figura 1).
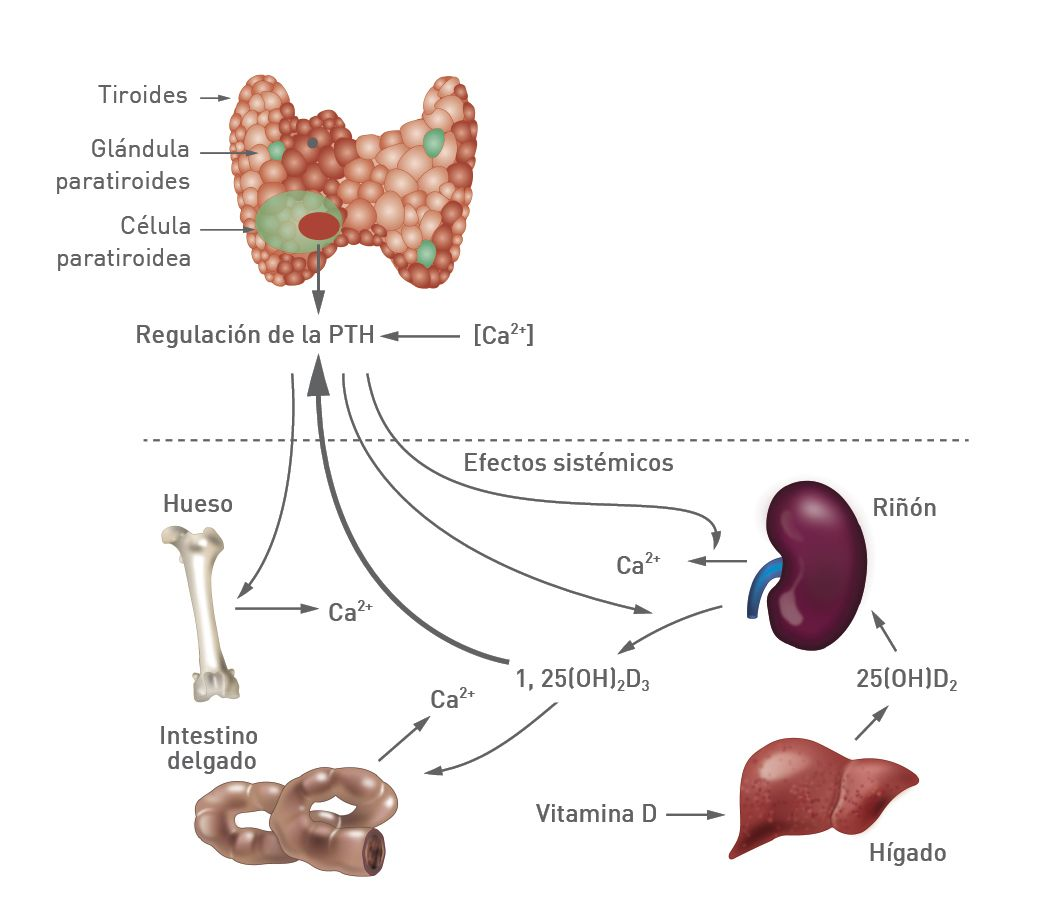
La PTH desempeña un papel principal regulando minuto a minuto las fluctuaciones de calcio en el organismo. Si la concentración de calcio aumenta, la concentración de PTH disminuye, lo que provoca la pérdida neta de calcio a través de los túbulos distales renales, la reducción de la absorción intestinal de calcio y la disminución de la reabsorción ósea osteoclástica [4]. A la inversa, si la concentración de calcio disminuye, la concentración de PTH aumenta para favorecer la reabsorción de calcio en los túbulos renales distales y la excreción de fósforo por el riñón. La PTH también contribuye indirectamente a la absorción de calcio en el intestino delgado al aumentar la actividad de la 1-alfa-hidroxilasa, lo que favorece la conversión de la vitamina D en su forma activa, vitamina D3 (calcitriol), en los túbulos renales proximales [4]. Además, la PTH actúa sobre el tejido esquelético estimulando la proliferación de las células formadoras de hueso (osteoblastos), consiguiendo un efecto rápido y una mayor densidad mineral ósea [5]. Sin embargo, la señalización crónica puede aumentar la expresión de RANKL por los osteoblastos, dando lugar a la activación y la supervivencia de los osteoclastos, con el consiguiente aumento de la reabsorción ósea [6].
El calcitriol participa en la regulación del calcio, principalmente, aumentando la síntesis de la proteína ligadora de calcio, calbindina-D, que permite la absorción del calcio del alimento en el intestino delgado con la consiguiente liberación al torrente sanguíneo [7]. El calcitriol también puede tener un efecto de retroalimentación negativa sobre sí mismo convirtiéndose en 24,25-dihidroxicolecalciferiol, que es menos activo, así como de regulación negativa del calcio disminuyendo la transcripción del ARNm de la PTH.
La calcitonina no es un factor principal que controle minuto a minuto la calcemia, pero actúa como hormona de urgencia disminuyendo los niveles séricos de calcio cuando se produce un aumento rápido. Las células C de la glándula tiroides liberan calcitonina al ser estimuladas por la hipercalcemia y por la ingesta de alimentos ricos en calcio que provocan la secreción de hormonas entéricas (gastrina y colecistoquinina), cuya acción biológica está mediada principalmente por la inhibición de la reabsorción ósea osteoclástica [8].
La hipercalcemia puede ser la consecuencia de una amplia variedad de procesos patológicos y la gravedad de los signos clínicos, el tratamiento adecuado y el pronóstico general se basan en la etiopatogenia subyacente.
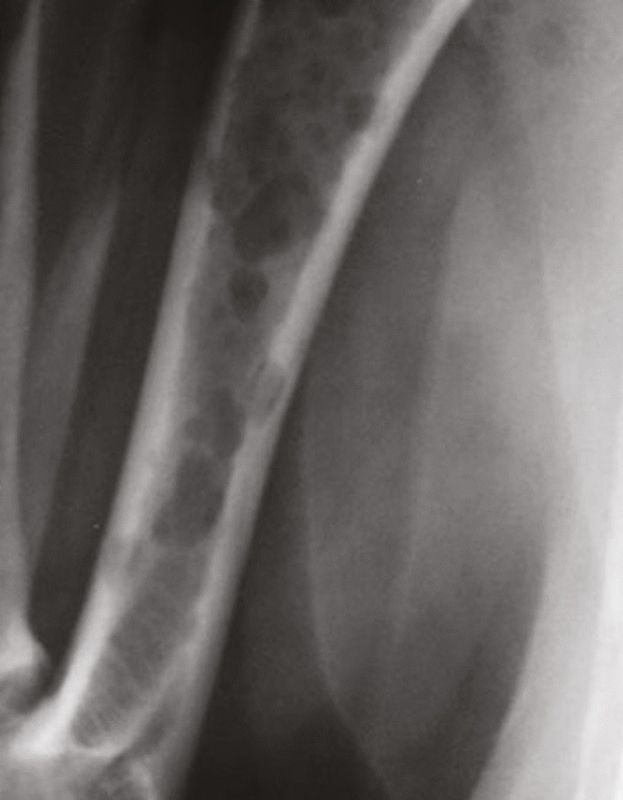
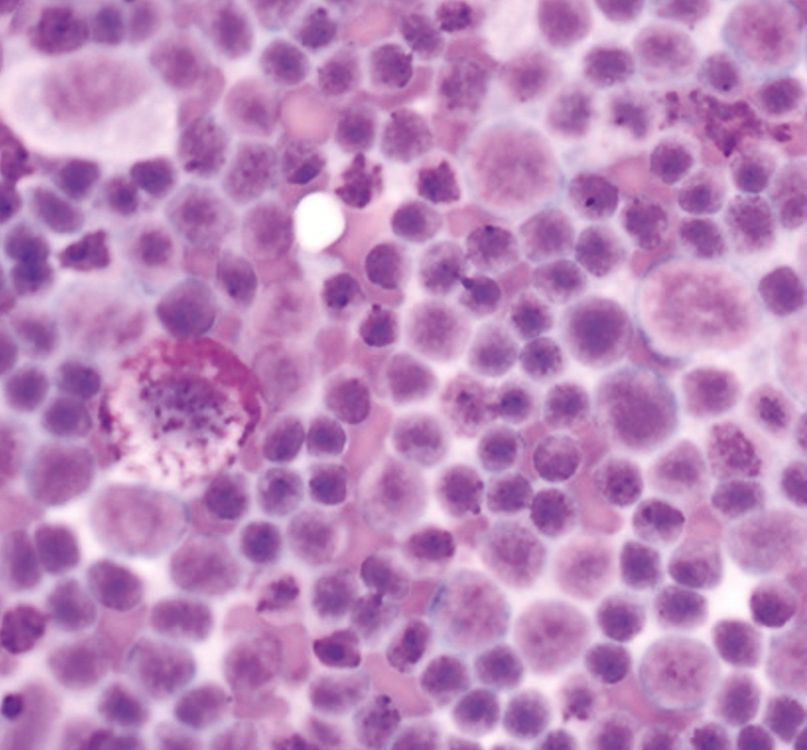
Existen varios mecanismos que pueden ser responsables del aumento de calcio secundario a neoplasias [15],[16]. La hipercalcemia se produce en primer lugar y, más frecuentemente, como consecuencia de la liberación de factores solubles producidos por las células tumorales que estimulan la reabsorción ósea, dando lugar a la denominada hipercalcemia humoral maligna (HHM). El segundo mecanismo implicado es la osteolisis debida a la invasión directa del hueso por las células tumorales y se suele observar en carcinomas o neoplasias hematopoyéticas de la médula ósea como la leucemia, el linfoma y el mieloma múltiple. Por último, el mecanismo implicado con menos frecuencia es la síntesis de la forma activa de la vitamina D por las células que expresan la 1-alfa-hidroxilasa, promoviendo la absorción intestinal de calcio.

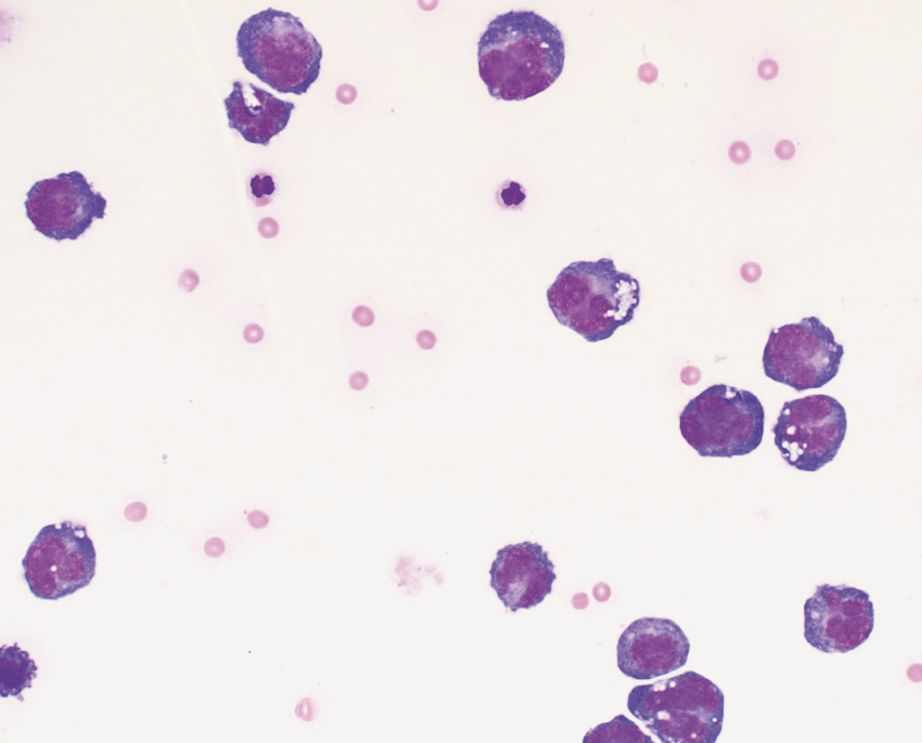
Tabla 1. GOSH DARN IT – Acrónimo útil para recordar las causas de hipercalcemia.
|
Hipercalcemia humoral maligna (HHM)
En la hipercalcemia humoral maligna pueden estar implicados el péptido relacionado con la hormona paratiroidea (PTHrp), que es estructuralmente similar a la PTH [17] y algunas citoquinas como la IL-1, la IL-6 o el factor de necrosis tumoral [15]. Estos factores humorales provocan la reabsorción osteoclástica generalizada y difusa sin que se observen lesiones óseas en las radiografías. Como el PTHrp es un péptido secretado por células tumorales, cualquier tipo celular de naturaleza secretora que sufra una transformación maligna tiene el potencial de liberar cantidades excesivas de PTHrp.
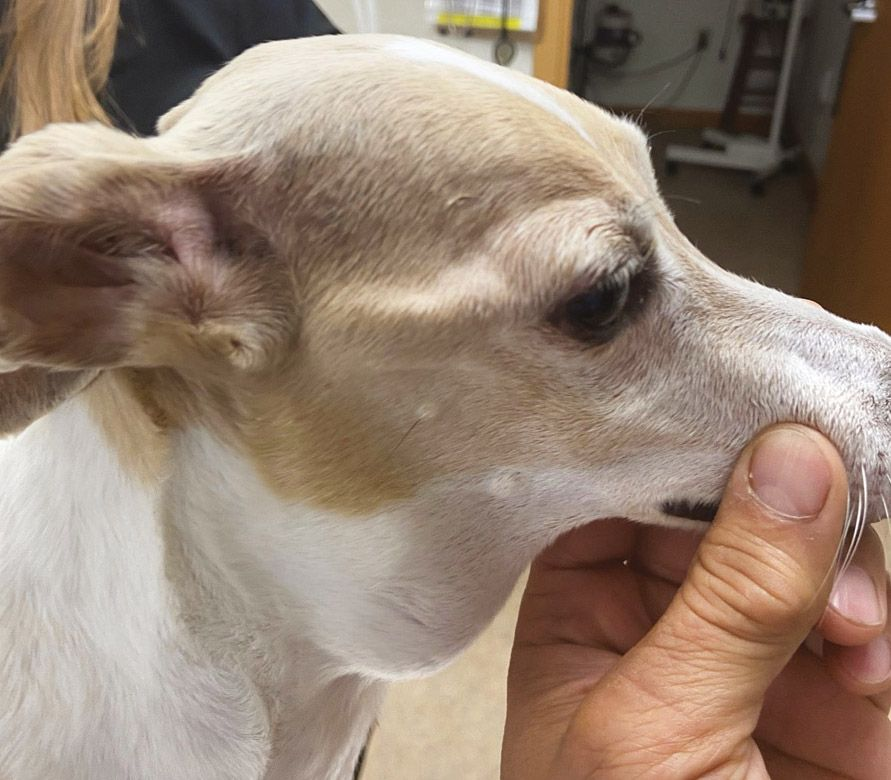
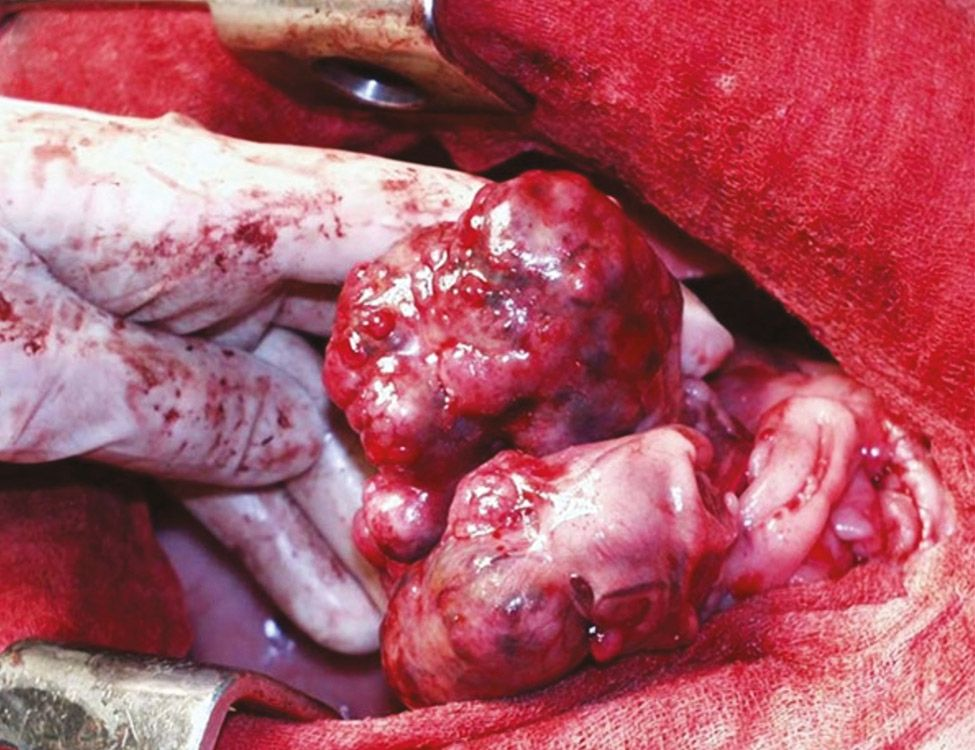
La causa más frecuente de HHM es el linfoma (LSA), particularmente el linfoma mediastínico. Sin embargo, otros tumores que también pueden ser responsables de la hipercalcemia en perros (y gatos) son el adenocarcinoma de sacos anales, el carcinoma tiroideo, el mieloma múltiple, los tumores óseos, el timoma, el carcinoma de células escamosas, el carcinoma/adenocarcinoma mamario, el melanoma, el tumor pulmonar primario, la leucemia linfocítica crónica, el angiomixoma renal y los tumores de la glándula paratiroides. Como regla general, se puede observar hipercalcemia en el 10-35% de los perros con LSA, en el ≥ 25% de los perros con adenocarcinoma de sacos anales y en aproximadamente el 20% de los perros con mieloma múltiple.
Signos clínicos
Dada la amplia variedad de funciones fisiológicas de los iones de calcio, los efectos tanto de la hipercalcemia como de la hipocalcemia son multisistémicos [10],[11]. El aumento de la concentración sérica de calcio provoca una disminución de la función celular, alterando la permeabilidad de la membrana celular y la función de las bombas de las membranas celulares. El aumento de iCa intracelular puede alterar la función celular y reducir la producción de energía, lo que puede provocar la muerte celular y la mineralización distrófica y/o metastásica. Aunque la hipercalcemia puede afectar a muchos tejidos, los efectos sobre el sistema nervioso central, el tracto gastrointestinal, el corazón y los riñones son los de mayor importancia clínica. Independientemente de la causa, un hallazgo clínico significativo de la hipercalcemia es el compromiso de la función renal, especialmente en el caso de neoplasias [18]. Los signos clínicos asociados a la hipercalcemia pueden ser inespecíficos, de naturaleza insidiosa y de diferente gravedad, pero los más frecuentes incluyen poliuria primaria con polidipsia compensatoria (PU/PD), anorexia, letargia, debilidad, vómitos, depresión, fasciculaciones musculares, arritmias cardiacas y convulsiones [9]. En el gato la presentación clínica es diferente ya que los signos gastrointestinales, en particular la anorexia y los vómitos, son los más frecuentes [19].
Enfoque diagnóstico del paciente con hipercalcemia
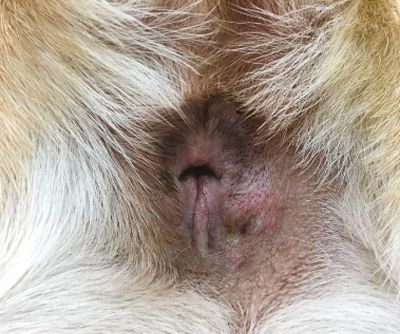
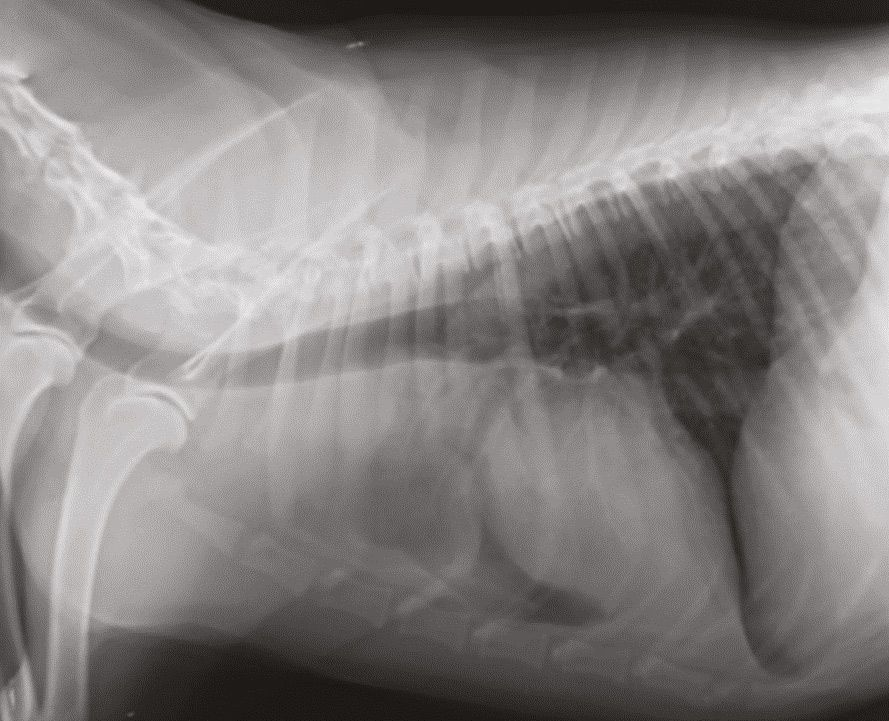
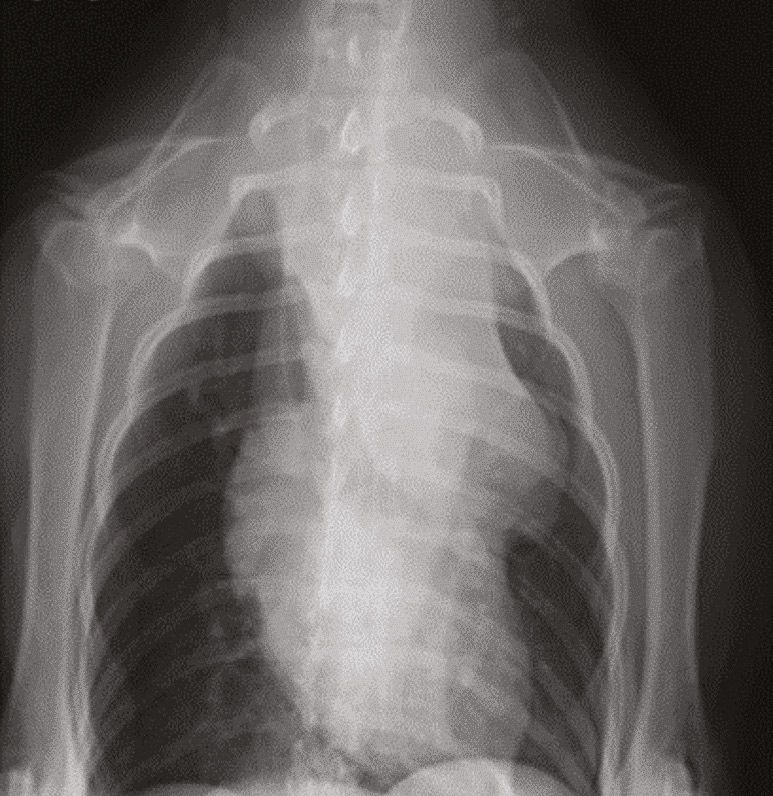
En los animales de compañía la determinación del iCa es más precisa que la del calcio total. Es interesante señalar que en los casos de hipercalcemia maligna el aumento de la concentración de calcio suele ser de mayor magnitud que en otros casos [12],[13]. Cuando en un paciente se sospecha hipercalcemia, el primer paso que se debe dar es la obtención de una historia clínica detallada y la realización de una exploración física completa, incluyendo la evaluación cuidadosa de los ganglios linfáticos periféricos y la palpación rectal (en busca de un posible adenocarcinoma de sacos anales) (Figuras 6-8). En función de los hallazgos encontrados, se pueden realizar pruebas diagnósticas adicionales (incluyendo el hemograma completo, la bioquímica sanguínea, el análisis de orina, las radiografías torácicas y la ecografía abdominal) para identificar otros posibles hallazgos que confirmen la sospecha clínica o la presencia de alguna patología no identificada durante la exploración física.
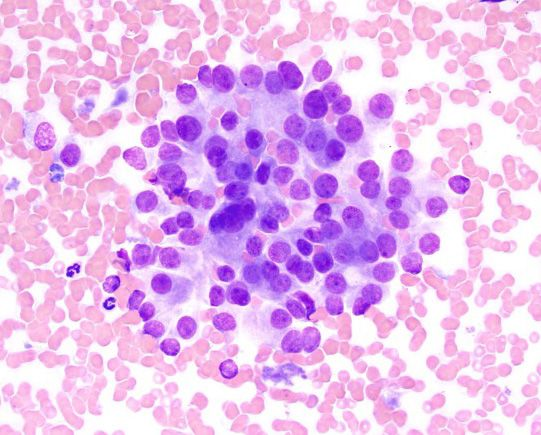
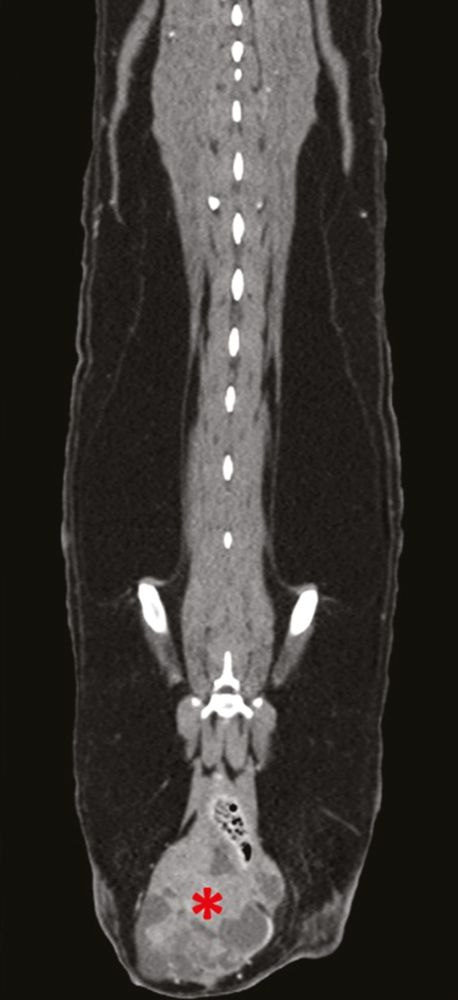
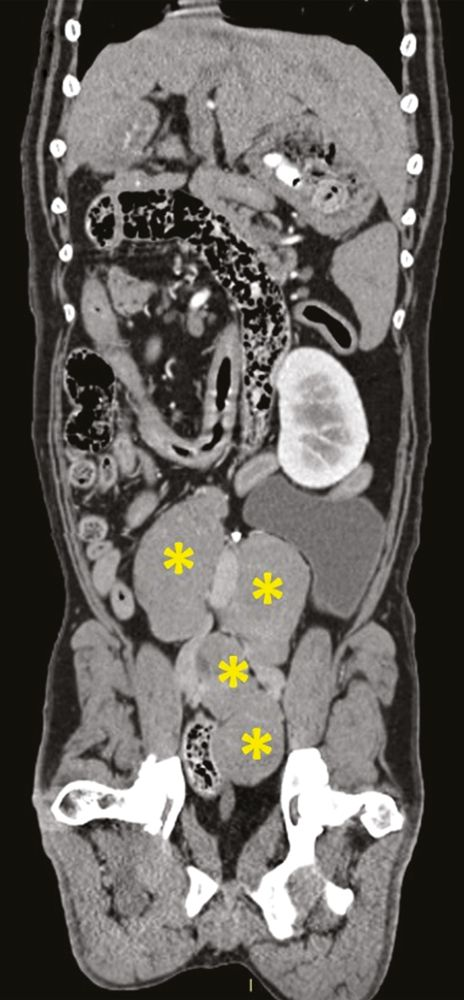
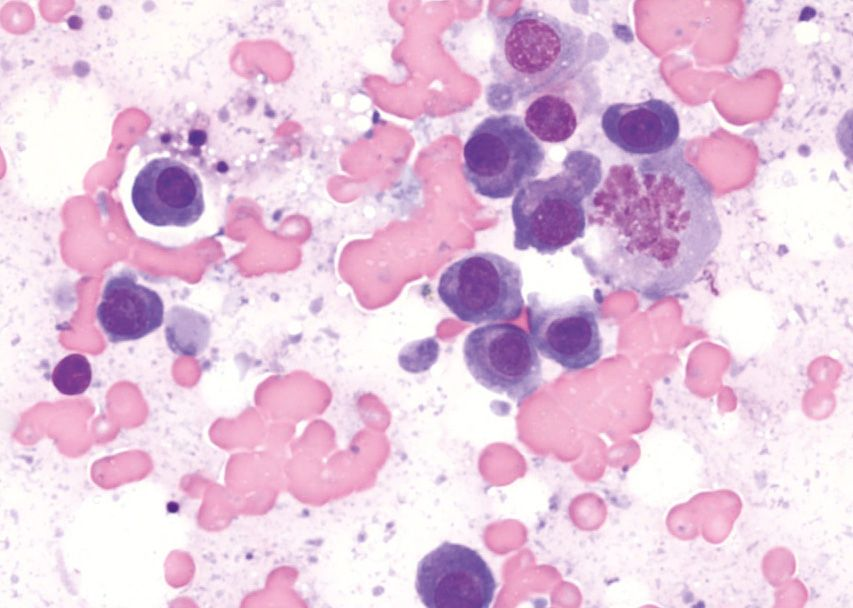
Si con estas pruebas no se identifica la causa subyacente de hipercalcemia, puede ser necesaria la realización de pruebas adicionales, como la determinación de la concentración sérica circulante de PTH, PTHrp y calcitriol. En pacientes con hipercalcemia maligna, la concentración sérica de PTH es baja o indetectable, mientras que la concentración de PTHrp puede ser detectable y/o elevada. El calcitriol sérico suele ser normal, pero también puede encontrarse aumentado o disminuido. Más allá de estas pruebas diagnósticas convencionales, si la causa subyacente sigue sin encontrarse se pueden considerar otros métodos de diagnóstico como el estudio radiográfico óseo, la gammagrafía ósea (medicina nuclear), la aspiración de médula ósea y la tomografía computarizada (TC), (Figuras 9-11).
Las alteraciones del calcio pueden estar asociadas a trastornos graves y potencialmente mortales. La hipercalcemia, independientemente de la causa subyacente, puede poner en peligro la vida del paciente [20]. Para medir el iCa se necesitan analizadores especializados, que no siempre están al alcance de los veterinarios clínicos. Teniendo en cuenta esta limitación, el veterinario muchas veces debe confiar en su capacidad para interpretar el valor del calcio total (tCa), que incluye las tres fracciones del calcio sérico. Desgraciadamente, interpretar el tCa de forma precisa es complicado, ya que no refleja fielmente el estado del iCa en un paciente en concreto. Aunque se han propuesto varias fórmulas para calcular el tCa con factores de corrección basados en la concentración de albúmina o de proteínas totales, los resultados no son fiables y no han conseguido validar ni mejorar la discordancia diagnóstica entre el tCa y el iCa [20],[21]. Por este motivo es recomendable investigar cualquier valor anómalo del tCa realizando pruebas que determinen directamente la concentración real de iCa.
Tratamiento
Dado que la hipercalcemia puede deberse a una amplia variedad de procesos patológicos, la gravedad de los signos clínicos, el tratamiento adecuado y el pronóstico general dependerán de la etiopatogenia subyacente. No existe un único protocolo de tratamiento eficaz para todas las causas, pero en la mayoría de los pacientes, la estimulación de la excreción urinaria de calcio puede proporcionar un beneficio clínico inmediato. El tratamiento definitivo y óptimo de la hipercalcemia se basa en la identificación y resolución de la causa subyacente, pero algunos casos son más complicados y esto no siempre es posible. En última instancia, el estado clínico del paciente dictará la agresividad del tratamiento.
El tratamiento más efectivo de la hipercalcemia maligna es la eliminación de la neoplasia subyacente mediante cirugía, si es anatómicamente factible, o la inducción de la remisión clínica mediante quimioterapia (más utilizada para la hipercalcemia asociada a LSA) o radioterapia. De forma empírica se ha recomendado iniciar un tratamiento agresivo cuando la concentración sérica de calcio sea de 16 mg/dl (4 mmol/l) o superior; sin embargo, el tratamiento debe individualizarse en función del seguimiento en tiempo real y de los hallazgos diagnósticos. Cabe esperar un pronóstico desfavorable en pacientes especialmente comprometidos con alguna de las siguientes características:
- pacientes clínicamente enfermos con una hipercalcemia superior a 16 mg/dl (4 mmol/l),
- pacientes con azotemia renal grave,
- pacientes con un producto calcio-fósforo superior a 60 y la consiguiente mineralización metastásica,
- pacientes con hipercalcemia maligna asociada a tumores sólidos no susceptibles de extirpación quirúrgica.
El tratamiento inicial consiste en la fluidoterapia agresiva con cloruro de sodio isotónico (0,9%) para corregir la deshidratación, que es una consecuencia frecuente de la poliuria inducida por la hipercalcemia (diabetes insípida nefrogénica secundaria). La hemoconcentración por disminución de la filtración glomerular da lugar a una retención adicional de calcio, ya que los riñones intentan conservar el sodio y la excreción urinaria de calcio disminuye [9]. La administración IV de una solución salina no solo restablecerá la hidratación, sino que también proporcionará el beneficio añadido de promover la expansión del volumen con el consiguiente aumento de la tasa de filtración glomerular y mejora de la calciuresis. La solución salina sin calcio suplementado tiene un alto contenido en sodio que compite con el calcio por la absorción tubular renal, lo que ayuda aún más a promover la excreción urinaria de calcio [22]. Una vez obtenida la rehidratación adecuada, se recomienda administrar diuréticos del asa (p. ej., furosemida a razón de 2-4 mg/kg IV/SC/PO dos o tres veces al día) y continuar con la fluidoterapia para promover aún más la excreción urinaria de calcio y disminuir la probabilidad de hipervolemia iatrogénica. Sin embargo, hay que tener especial cuidado para evitar la deshidratación en estos pacientes, ya que la hemoconcentración puede anular el efecto de la calciuresis deseada.
Los glucocorticoides pueden proporcionar beneficios rápidamente en ciertos casos de hipercalcemia. Sin embargo, lo ideal sería identificar la causa subyacente antes de administrarlos, ya que pueden dificultar el diagnóstico definitivo (p. ej., ocultando una neoplasia hematopoyética) o incluso pueden estar contraindicados (enfermedad granulomatosa infecciosa). Los glucocorticoides contribuyen a reducir los niveles séricos de calcio al disminuir la reabsorción ósea, la absorción intestinal de calcio y aumentar la excreción renal de calcio [22]. Son especialmente beneficiosos en casos de hipercalcemia asociada a una neoplasia maligna como el linfoma, el adenocarcinoma de sacos anales, el mieloma múltiple y el timoma, así como en el hipoadrenocorticismo o la hipervitaminosis D. Los glucocorticoides más utilizados son la prednisona (1-2,2 mg/kg, IV/SC/PO, cada 12 h), y/o la dexametasona (0,1-0,22 mg/kg cada 12 h), siendo ambos muy asequibles por precio y disponibilidad. Las dosis se deben reducir progresivamente y se debe evitar el mantenimiento de dosis elevadas a largo plazo.
Los bifosfonatos son otra opción de tratamiento; son un grupo de fármacos que se han desarrollado en medicina humana para inhibir la reabsorción ósea patológica asociada a la osteoporosis y metástasis esqueléticas. El zoledronato y el pamidronato son los más utilizados en medicina humana, pueden normalizar los niveles de calcio en 4-10 días y sus efectos duran entre 1 y 4 semanas [23]. Aunque actualmente existen más datos sobre el pamidronato, el zoledronato ha demostrado ser eficaz controlando la hipercalcemia aguda en perros [24]. Las dosis de los distintos fármacos varían según su potencia antirreabsortiva y los posibles efectos secundarios (Figura 12). La dosis recomendada del zoledronato es de 0,1-0,25 mg/kg diluidos en solución salina y administrados por vía IV en infusión continua durante 15-20 minutos, mientras que la dosis de pamidronato es de 1,0-2,0 mg/kg diluidos en solución salina durante 2-4 horas. Es importante tener en cuenta que, en estudios preclínicos de toxicidad, se ha observado que la administración de estos fármacos en bolos de dosis elevadas puede causar lesión renal aguda. En las pautas recomendadas anteriormente, la infusión de los fármacos es prolongada y, por lo tanto, se reduce drásticamente el riesgo de daño renal, pero, aun así, es recomendable vigilar la función renal del paciente durante el tratamiento. Cabe señalar que en gatos con hipercalcemia idiopática persistente se ha investigado el uso del alendronato (bifosfonato oral) y parece tolerarse bien [14],[25], pero es necesaria una mayor investigación para evaluar su eficacia, dada su mínima biodisponibilidad oral, y determinar si en esta especie se debería utilizar preferentemente antes que otros bifosfonatos.
En teoría, la mitramicina, la calcitonina y el nitrato de galio son otras opciones para el tratamiento de la hipercalcemia, pero en la práctica, su utilidad es limitada debido a su coste, efectos secundarios y pautas de administración. La mitramicina (plicamicina) es un antibiótico antitumoral que inhibe la síntesis de ARN en los osteoclastos, provocando la rápida inhibición de la reabsorción ósea [22]. Este fármaco ha dejado de utilizarse tanto en medicina veterinaria como humana debido al potencial de causar trombocitopenia, necrosis renal y hepática e hipocalcemia. La calcitonina es otra opción, ya que reduce la reabsorción ósea al inhibir la actividad y la formación de osteoclastos y, como consecuencia, la concentración sérica de calcio disminuye a las pocas horas de su administración y este efecto es más rápido que el de cualquier otro tratamiento, pero sus efectos son relativamente cortos debido a la disminución compensatoria de los receptores. El nitrato de galio es un agente antineoplásico que inhibe los osteoclastos y disminuye la solubilidad reabsortiva de la hidroxiapatita al unirse a los cristales de hidroxiapatita. Este fármaco se suele utilizar en casos refractarios a los bifosfonatos y, en algunos estudios, ha demostrado ser más eficaz que los bifosfonatos reduciendo los niveles de calcio en pacientes con hipercalcemia por neoplasias. Sin embargo, no se considera como tratamiento de elección debido a su potencial de nefrotoxicidad.
La concentración de calcio iónico en el organismo se encuentra estrictamente regulada para garantizar el mantenimiento de niveles estables, ya que esa es la forma activa del electrolito.
Conclusión
La concentración de calcio iónico se encuentra estrictamente regulada y es crítica para el organismo, puesto que las alteraciones pueden provocar importantes efectos sistémicos multiorgánicos. La hipercalcemia paraneoplásica es una complicación grave y relativamente frecuente en el perro y existen varios tipos de tumores que pueden inducir hipercalcemia mediante mecanismos que alteran la homeostasis del calcio dando lugar a manifestaciones clínicas. La neoplasia que con más frecuencia causa hipercalcemia en el perro es el linfoma de células T, pero en cualquier paciente con hipercalcemia, también se deben tener en cuenta otras neoplasias, así como enfermedades no neoplásicas. Aunque los signos clínicos de hipercalcemia suelen ser inespecíficos, la detección precoz de la causa subyacente es fundamental. Una vez identificada la causa, el tratamiento definitivo y las medidas de soporte permitirán reducir las complicaciones potencialmente mortales y maximizar las posibilidades de un pronóstico favorable.
Jordan M. Hampel
DVM, Departamento de Medicina Clínica Veterinaria, Universidad de Illinois en Urbana-Champaign (UIUC), Illinois, EE. UU.
Estados Unidos
La Dra. Hampel obtuvo el doctorado en veterinaria por la Universidad de Illinois en el 2020 y posteriormente realizó un internado rotatorio en Pequeños Animales en la Universidad Estatal de Michigan. Regresó a la UIUC para continuar su formación como interna en Oncología realizando ensayos clínicos y actualmente es residente en Oncología y está realizando un Máster en Ciencias sobre estrategias para amplificar la acción citotóxica de la radioterapia ionizante.
Timothy M. Fan
DVM, PhD, Dip. ACVIM (Oncología, Medicina Interna), Departamento de Medicina Clínica Veterinaria, Universidad de Illinois en Urbana-Champaign, Illinois, EE. UU.
Estados Unidos
El Dr. Fan se licenció en Veterinaria por la Facultad Regional de Medicina Veterinaria de Virginia-Maryland en 1995 y continuó formándose para especializarse en Medicina Interna y Oncología de Pequeños Animales en la Universidad de Cornell y la UIUC, respectivamente. Posteriormente realizó un doctorado sobre inmunología tumoral en Illinois y comenzó a trabajar en la UIUC, donde actualmente es profesor. Además, es miembro del grupo Anticancer Discovery from Pets to People y lidera un programa de investigación en el Centro de Cáncer de Illinois sobre los animales de compañía como modelos para estudiar el cáncer.
Referencias
- Clapham DE. Calcium signaling. Cell. 2007;131(6):1047-1058.
- Hajdu S, Leonard EJ. A calcium transport system for mammalian cells. Life Sci. 1975;17(10);1527-1533.
- Matikainen N, Pekkarinen T, Ryhnen EM, et al. Physiology of calcium homeostasis: an overview. Endocrinol. Metab. Clin. North Am. 2021;50(4):575-590.
- Potts JT. Parathyroid hormone: past and present. J. Endocrinol. 2005;187(3):311-325.
- Silva BC, Bilezikian JP. Parathyroid hormone: anabolic and catabolic actions on the skeleton. Curr. Opin. Pharmacol. 2015;22:41-50.
- Huang JC, Sakata T, Pfleger LL, et al. PTH differentially regulates expression of RANKL and OPG. J. Bone Miner. Res. 2004;19(2):235-244.
- Christakos S, Li S, de la Cruz J, et al. Vitamin D and the intestine: review and update. J. Steroid. Biochem. Mol. Biol. 2020;196:105501.
- Xie J, Guo J, Kanwal Z, et al. Calcitonin and bone physiology: in vitro, in vivo, and clinical investigations. Int. J. Endocrinol. 2020;2020:3236828.
- Daniels E, Sakakeeny C. Hypercalcemia: pathophysiology, clinical signs, and emergent treatment. J. Am. Anim. Hosp. Assoc. 2015;51(5):291-299.
- Coady M, Fletcher DJ, Goggs R. Severity of ionized hypercalcemia and hypocalcemia is associated with etiology in dogs and cats. Front. Vet. Sci. 2019;6;276.
- Elliott J, Dobson JM, Dunn JK, et al. Hypercalcemia in the dog a study of 40 cases. J. Small Anim. Pract. 1991;32(11):564-571.
- Messinger JS, Windham WR, Ward CR. Ionized hypercalcemia in dogs: a retrospective study of 109 cases (1998-2003). J. Vet. Intern. Med. 2009;23(3):514-519.
- Savary KCM, Price GS, Vaden SL. Hypercalcemia in cats: a retrospective study of 71 cases (1991-1997). J. Vet. Intern. Med. 2000;14(2):184-189.
- Hardy BT, de Brito Galvao JF, Green TA, et al. Treatment of ionized hypercalcemia in 12 cats (2006-2008) using PO-administered alendronate. J. Vet. Intern. Med. 2015;29(1):200-206.
- Goldner W. Cancer-related hypercalcemia. J. Oncol. Pract. 2016;12(5):426-432.
- Mirrakhimov AE. Hypercalcemia of malignancy: an update on pathogenesis and management. N. Am. J. Med. Sci. 2015;7(11):483-493.
- de Papp AE, Stewart AF. Parathyroid hormone-related protein a peptide of diverse physiologic functions. Trends Endocrinol. Metab. 1993;4(6):181-187.
- Weller RE, Hoffman WE. Renal function in dogs with lymphosarcoma and associated hypercalcemia. J. Small Anim. Pract. 1992;33(2):61-66.
- Galvao JFD, Parker V, Schenck PA, et al. Update on feline ionized hypercalcemia. Vet. Clin. North. Am. Small Anim. Pract. 2017;47(2);273-292.
- Lebastard M, Cuq B, Sharman MJ, et al. Diagnostic performance of predicted ionized calcium in dogs with total hypercalcemia and total hypocalcemia. Vet. Clin. Pathol. 2021;50(4):515-524.
- Groth EM, Chew DJ, Lulich JP, et al. Determination of a serum total calcium concentration threshold for accurate prediction of ionized hypercalcemia in dogs with and without hyperphosphatemia. J. Vet. Intern. Med. 2020;34(1):74-82.
- Schaer M. Therapeutic approach to electrolyte emergencies. Vet. Clin. North Am. Small Anim. Pract. 2008;38(3):513-533.
- Schenk A, Lux C, Lane J, et al. Evaluation of zoledronate as treatment for hypercalcemia in four dogs. J. Am. Anim. Hosp. Assoc. 2018;54(6);e54604
- Repasy AB, Selmic LE, Kisseberth WC. Canine apocrine gland anal sac adenocarcinoma: a review. Top. Companion Anim. Med. 2022;50;100682
- Kurtz M, Desquilbet L, Maire J, et al. Alendronate treatment in cats with persistent ionized hypercalcemia: a retrospective cohort study of 20 cases. J. Vet. Intern. Med. 2022;36(6):1921-1930.
Otros artículos de este número
Compartir en las redes sociales