Tratamiento de las heridas con plasma frío
El tratamiento con plasma frío a presión atmosférica es una tecnología emergente en medicina veterinaria; este artículo describe esta novedosa técnica y cómo puede ser beneficiosa para el paciente canino.
© Christoph Klinger
Puntos clave
El tratamiento con plasma fro es una tcnica simple e indolora que elimina eficazmente los agentes infecciosos y acelera el proceso de curacin de las heridas.
Aunque el PFPA puede ser muy eficaz frente a bacterias multirresistentes, no elimina ninguna causa subyacente y no debe sustituir en ningn caso al diagnstico clnico.
Introducción
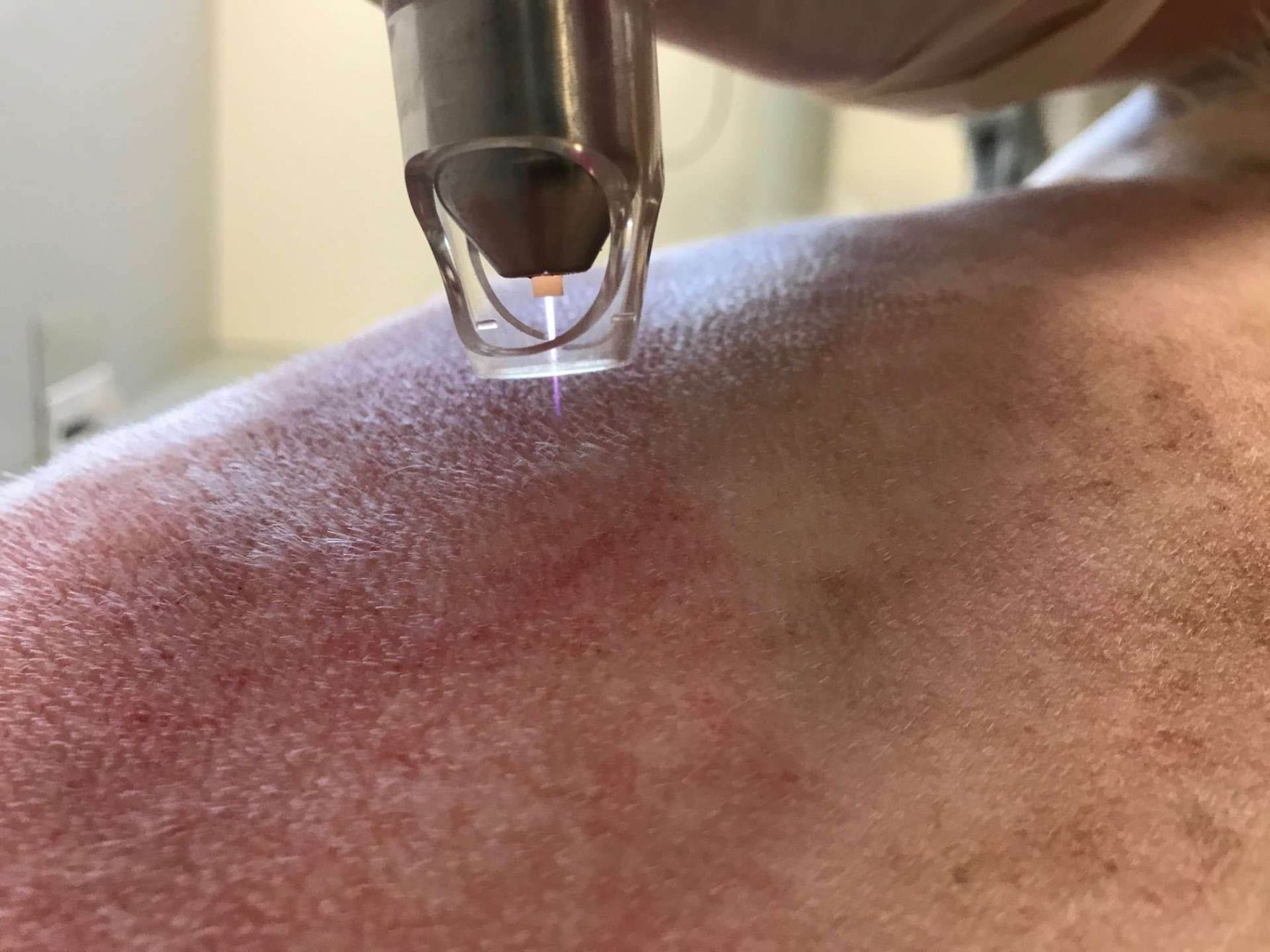
Ante el aumento en todo el mundo del número de infecciones bacterianas y fúngicas resistentes a fármacos, cada vez cobra mayor importancia el desarrollo de alternativas terapéuticas frente a este tipo de agentes infecciosos. El avance hacia el desarrollo de métodos sostenibles físicos, o de otro tipo, que permitan eliminar estos agentes problemáticos parece ser cada vez más esencial y el tratamiento con Plasma Frío a Presión Atmosférica (PFPA) es una técnica de este tipo con una eficacia probada frente a patógenos bacterianos, víricos y fúngicos resistentes a los antibióticos [1][2][3][4][5]. Esta técnica también permite alterar y controlar numerosos factores que promueven y aceleran la reparación de tejidos, lo que puede resultar especialmente beneficioso en pacientes con trastornos relacionados con la cicatrización de heridas [6][7]. El tratamiento con PFPA se desarrolló originalmente en medicina humana y cada vez cuenta con mayor aceptación en medicina veterinaria, en parte porque es una técnica indolora que se puede aplicar sin sedación [8], aunque debido a la falta de estudios con animales esta técnica todavía es relativamente desconocida. Este artículo ofrece una perspectiva general de este tratamiento con algunos ejemplos prácticos sobre cómo se puede aplicar de forma efectiva esta técnica en las clínicas veterinarias de pequeños animales (Figura 1).
Principios físicos básicos y modo de acción
El plasma a veces también se conoce como el "cuarto estado de la materia" (después de sólido, líquido y gas) y básicamente consiste en una mezcla gaseosa de iones o electrones libres en un espacio cerrado reducido [9]. Algunos ejemplos de este estado se encuentran en la naturaleza, como en los rayos y las auroras boleares, pero el plasma también se puede producir artificialmente, a temperatura ambiente y bajo presión atmosférica normal, por ejemplo, acelerando partículas gaseosas cargadas en un campo electromagnético. Se ha demostrado que el tratamiento con PFPA tiene efectos positivos en la reparación de los tejidos, acelerando el proceso de curación y reduciendo la formación de una cicatriz. Todavía no se comprende del todo el modo de acción, aunque se sabe que el PFPA afecta en gran medida a ciertos factores de crecimiento (p. ej., el FGF-7 para la migración de los queratinocitos), moléculas de señalización antiinflamatorias (p. Ej., TGF-β) y vías de señalización inflamatorias [6][7][8][9][10][11].
El uso del PFPA se reservó inicialmente para desinfectar heridas y promover la curación de quemaduras en personas, pero actualmente también se utiliza en muchas otras situaciones. Es un tratamiento eficaz para las infecciones cutáneas, tanto simples como complicadas (especialmente por la presencia de patógenos multirresistentes), así como para otros trastornos de cicatrización de heridas, como los que se pueden desarrollar como consecuencia de diabetes [1][3][6]. Se ha documentado ampliamente su efectividad para combatir patógenos bacterianos, víricos y fúngicos, incluso en caso de formación de biofilms [2][3][5][9], y debido a su modo de acción físico cualquier resistencia a antibióticos, antimicóticos o antivirales resulta irrelevante. Los estudios han demostrado que el PFPA tiene un excelente efecto bacteriostático sobre Staphylococcus aureus spp. resistente a la meticilina (SARM), S. pseudintermedius resistente a la meticilina (SPRM) y Pseudomonas aeruginosa multirresistente (MRPA), que son algunas de las bacterias patógenas de la piel más frecuentes en medicina veterinaria [1][2][3][4].
Diseño y aplicaciones de los dispositivos
Actualmente están disponibles en el mercado tres tipos básicos de dispositivos, cada uno con sus ventajas e inconvenientes. Todos los dispositivos conllevan la creación de plasma frío mediante la ionización de un gas hacia su estado de plasma, generalmente utilizando aire atmosférico (es decir, oxígeno y nitrógeno) o un gas inerte como el argón.
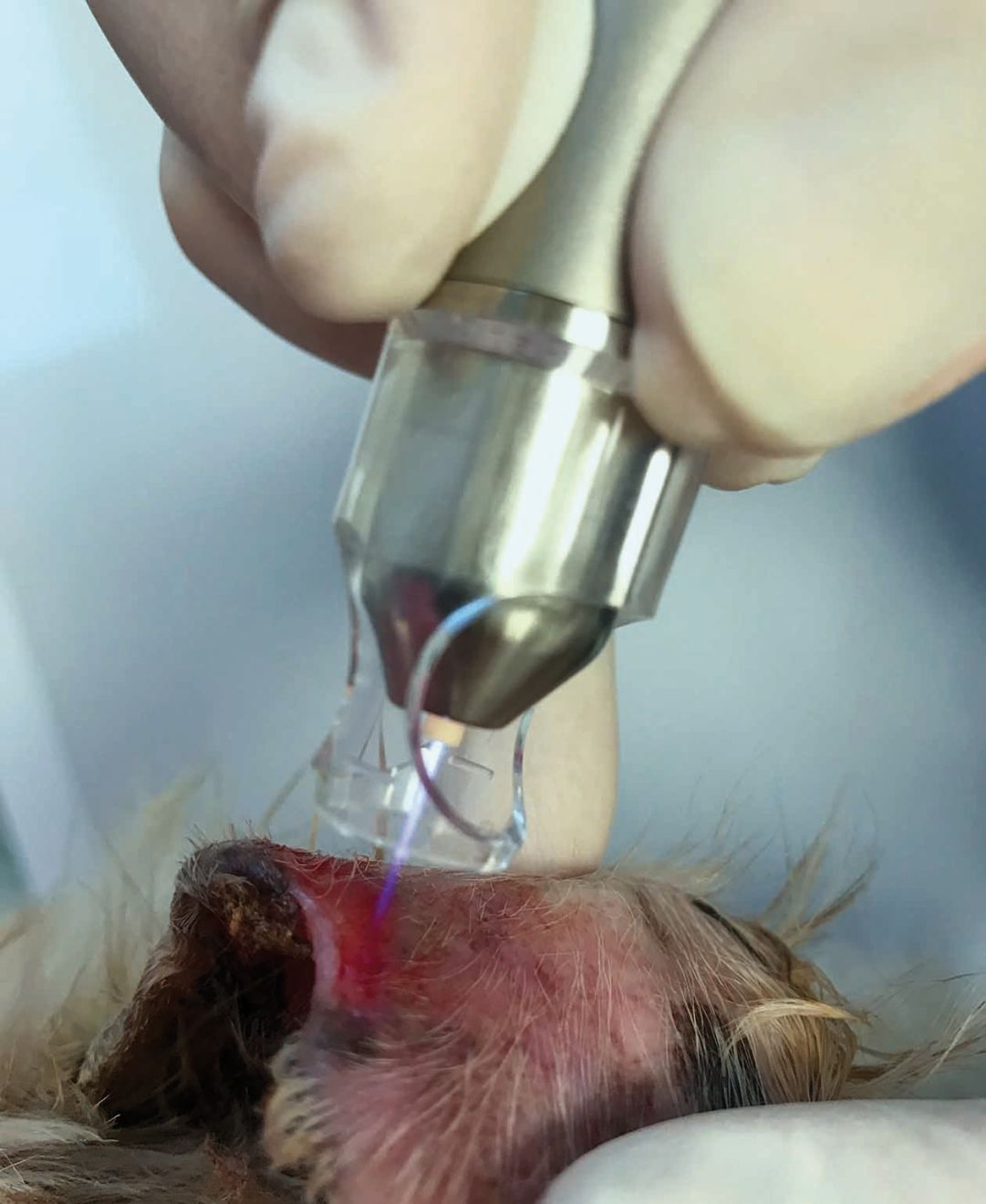
- El tipo más sencillo y económico (a partir de 2.000 €) genera una carga eléctrica en el cátodo del dispositivo y utiliza la propia piel como el ánodo, de tal manera que se genera plasma en el estrecho espacio que queda entre ambos (Figura 2). Las principales ventajas de este dispositivo, además del menor coste, son la facilidad de uso y el diseño relativamente simple, permitiendo que el dispositivo funcione con pilas. A algunos pacientes les puede molestar el ruido o la sensación de "hormigueo", dependiendo de la intensidad de la corriente.
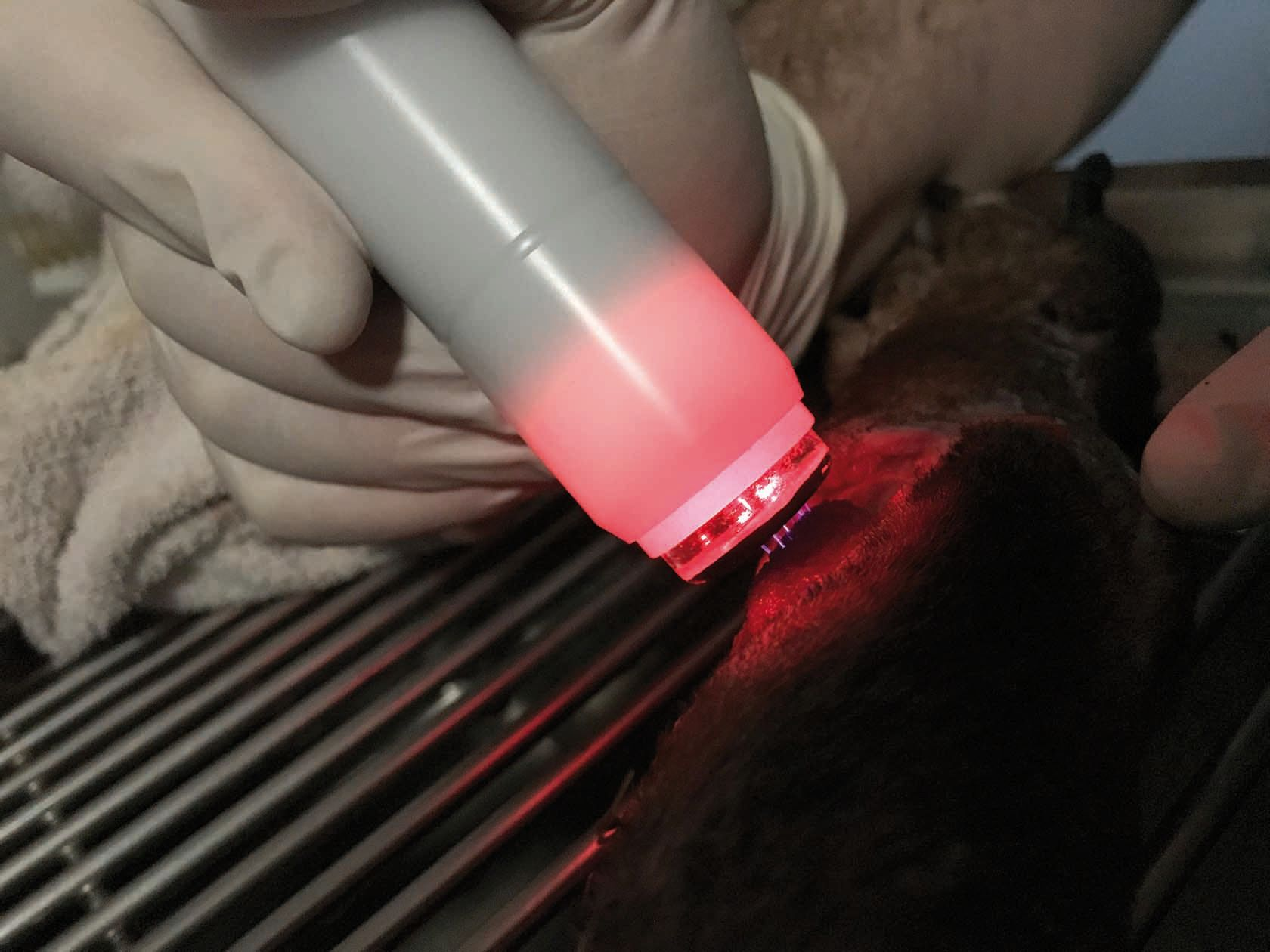
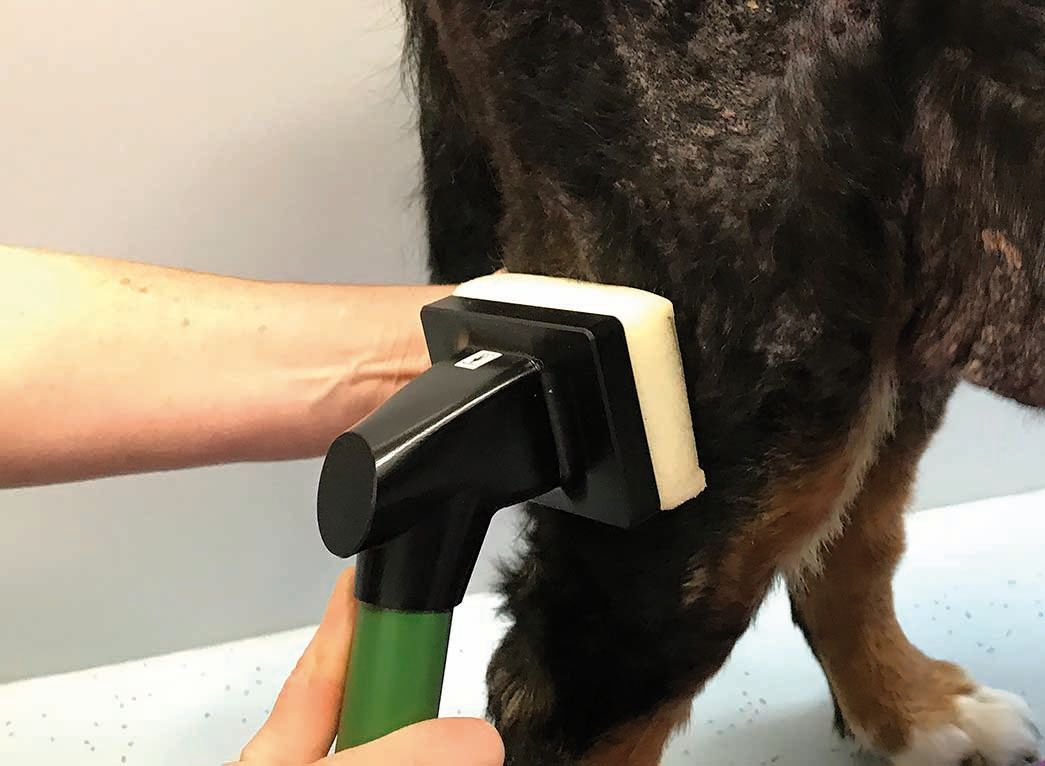
- El segundo tipo de dispositivo utiliza un medio intermedio (como la gomaespuma) como conductor eléctrico entre el cátodo y la piel. Así se disminuye o elimina cualquier sensación de hormigueo (Figura 3), aunque a algunos pacientes les puede desagradar el contacto directo con la herida. Con este tipo de dispositivos se pueden tratar superficies relativamente grandes, por lo que es más eficiente en cuanto al tiempo empleado en el tratamiento de heridas extensas o en perros grandes. Sin embargo, el hecho de colocar correctamente la gomaespuma puede dificultar su uso en pacientes de pequeño tamaño, con heridas más pequeñas o en lesiones de los pliegues cutáneos. Además, se debe cambiar de gomaespuma con cada paciente y, aunque los dispositivos son portátiles, tienen que estar conectados a la red eléctrica para poder funcionar.
- Existe un tercer tipo de dispositivo que genera plasma a partir de un gas inerte como el argón, liberándolo en forma de una pequeña llama que sale del extremo del dispositivo más cercano a la piel (Figura 1). Se utiliza realizando movimientos circulares sobre la superficie de la piel, de forma que el chorro esté cerca de la herida, pero sin llegar a tocarla. Este diseño permite realizar un tratamiento en “puntos” o localizaciones más selectivas, incluso en pliegues cutáneos o en cavidades de las heridas y puede facilitar el secado rápido de heridas húmedas y purulentas, sin apenas causar irritación o molestias por el ruido. El inconveniente es su coste (de hasta 15000 €), el consumo de gas y la portabilidad, significativamente limitada, del dispositivo.
Está ampliamente documentada la efectividad del PFPA para combatir patógenos bacterianos, víricos y fúngicos, incluso cuando se forma un biofilm y debido a su modo de acción físico, cualquier resistencia a antibióticos, antimicóticos o antivirales resulta irrelevante
Los tres tipos de dispositivos son fáciles de utilizar y los auxiliares veterinarios pueden aprender a manejarlos tras un breve periodo de formación, por lo que el tratamiento con PFPA se puede integrar fácilmente en la rutina diaria de la clínica y se puede aplicar tanto en condiciones no estériles en una sala de consulta, como en un quirófano aséptico. Al ser un tratamiento indoloro, no suele ser necesaria la anestesia. No obstante, para tratar con éxito al paciente obviamente hay que identificar la causa del problema [6][7]. La duración y la frecuencia de aplicación dependerá en parte de las características del dispositivo (la profundidad de penetración puede variar de nanómetros a unos pocos milímetros) y del tipo, la profundidad y la naturaleza de la lesión. La pauta inicial que suele utilizarse y que consiste en tratar el área afectada cada 2 o 3 días durante dos semanas y después, una vez a la semana, suele ser efectiva.
Hasta la fecha, los efectos secundarios del tratamiento con PFPA parecen ser mínimos, aparte de la mínima irritación donde haya existido contacto prolongado con la piel [8]. A pesar de que existen pocos estudios que comparen la eficacia de los diferentes dispositivos [12], según la opinión del autor, la tolerancia del paciente y la velocidad de curación parecen ser mejores con el tercer tipo. No obstante, los propietarios normalmente se han mostrado muy satisfechos con los resultados de cualquiera de los dispositivos de PFPA, estando dispuestos a pagar el coste adicional que supone este tratamiento.
Posibles aplicaciones en veterinaria
Actualmente, los dispositivos están diseñados para un uso principalmente tópico y la característica más significativa e innovadora del tratamiento con PFPA es que se obtiene una desinfección física de bacterias, virus u hongos, en casi cualquier localización [1][4][5], siendo altamente eficaz frente a bacterias, incluyendo las cepas resistentes a fármacos [1][12]. Dada la limitada capacidad de penetración tisular, la aplicación ideal de esta técnica parecen ser las heridas abiertas y superficiales; los efectos beneficiosos en localizaciones de difícil acceso (como los espacios interdigitales, las cavidades corporales, el conducto auditivo y las heridas profundas) son más cuestionables. Al menos por el momento, las posibles aplicaciones dependen en gran medida del tipo de dispositivo y de la lesión tratada, por lo que algunos dispositivos pueden resultar más adecuados para el tratamiento de la pododermatitis u otitis externa, mientras que otros son más apropiados para áreas extensas de la piel.
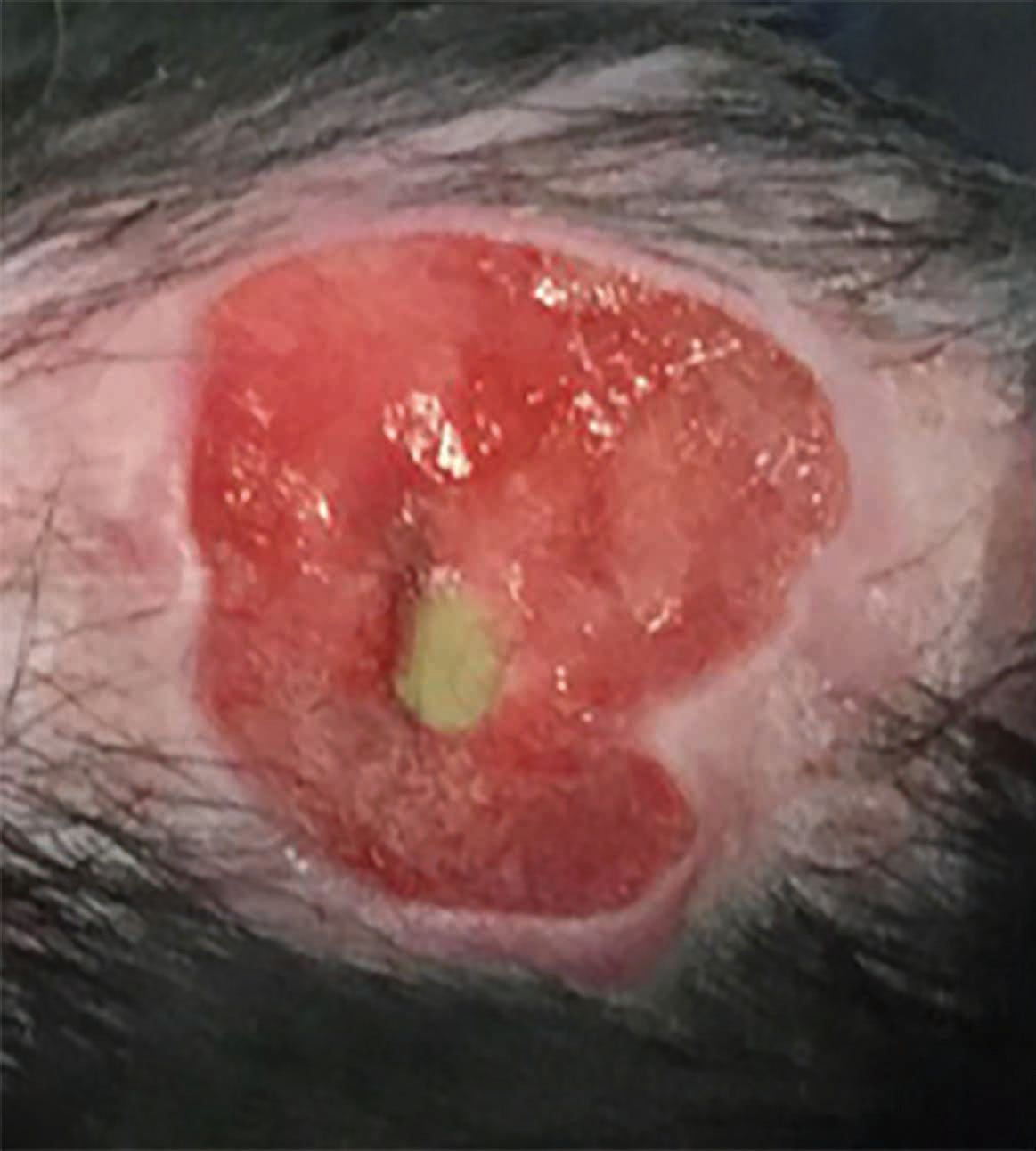
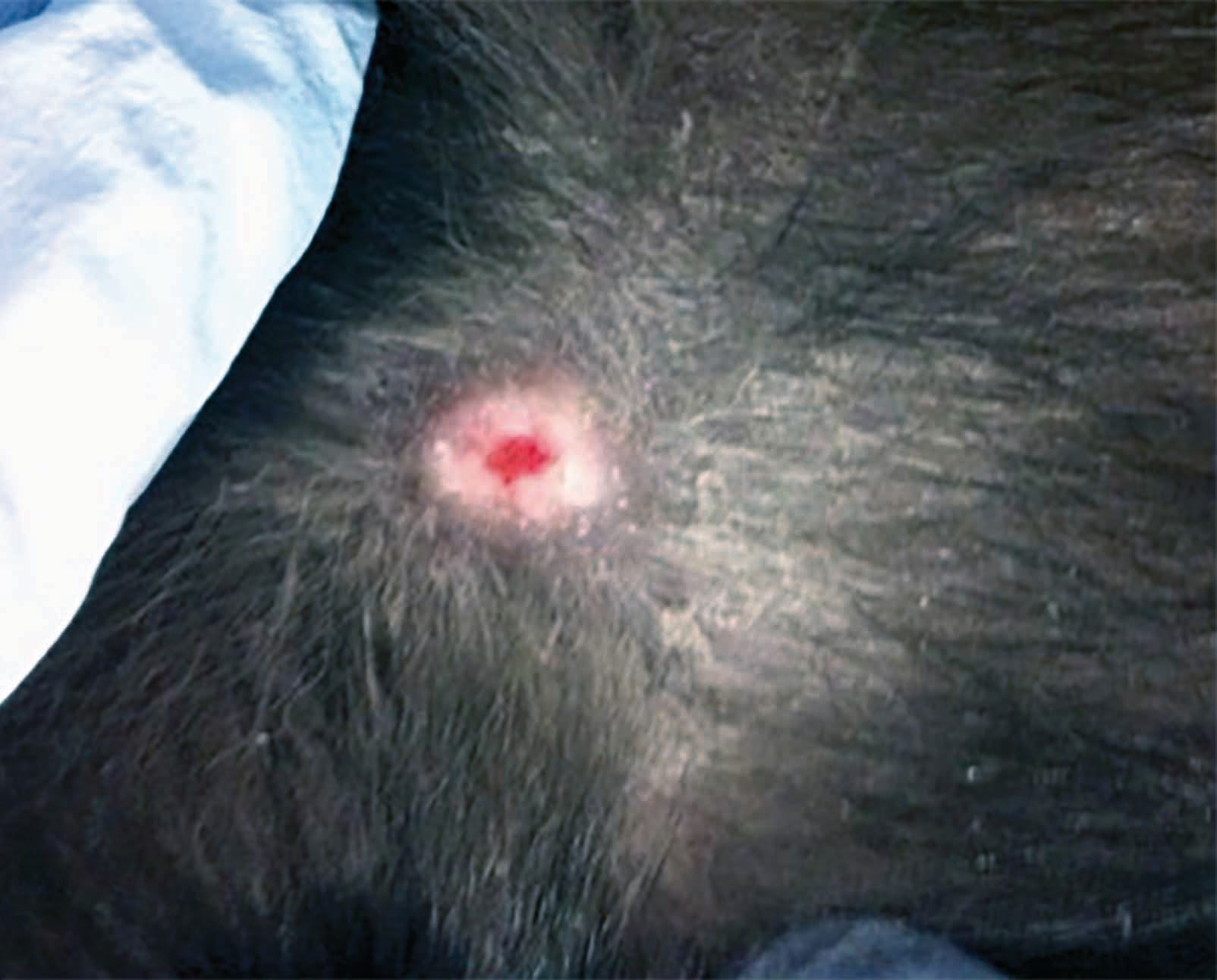
Además del efecto desinfectante, también se están haciendo más evidentes otros beneficios de este tratamiento. Por ejemplo, esta técnica se está utilizando cada vez más para tratar lesiones relacionadas con la vasculitis, como las lesiones observadas en perros con leishmaniosis. El perro de la Figura 4 es un Labrador con leishmaniosis tratado previamente con un ciclo de cuatro semanas de antimoniato de meglumina, miltefosina y alopurinol. A pesar de la buena respuesta al tratamiento, tanto en los parámetros clínicos como en el título de anticuerpos, la vasculitis asociada dio lugar a un agravamiento progresivo de la lesión ulcerativa de la cara interna del pabellón auricular, quedando expuesto el cartílago subyacente. Mediante el tratamiento con PFPA se logró una remisión casi completa a los 28 días, aunque los signos reaparecieron seis meses después como consecuencia de la leishmaniosis asociada.
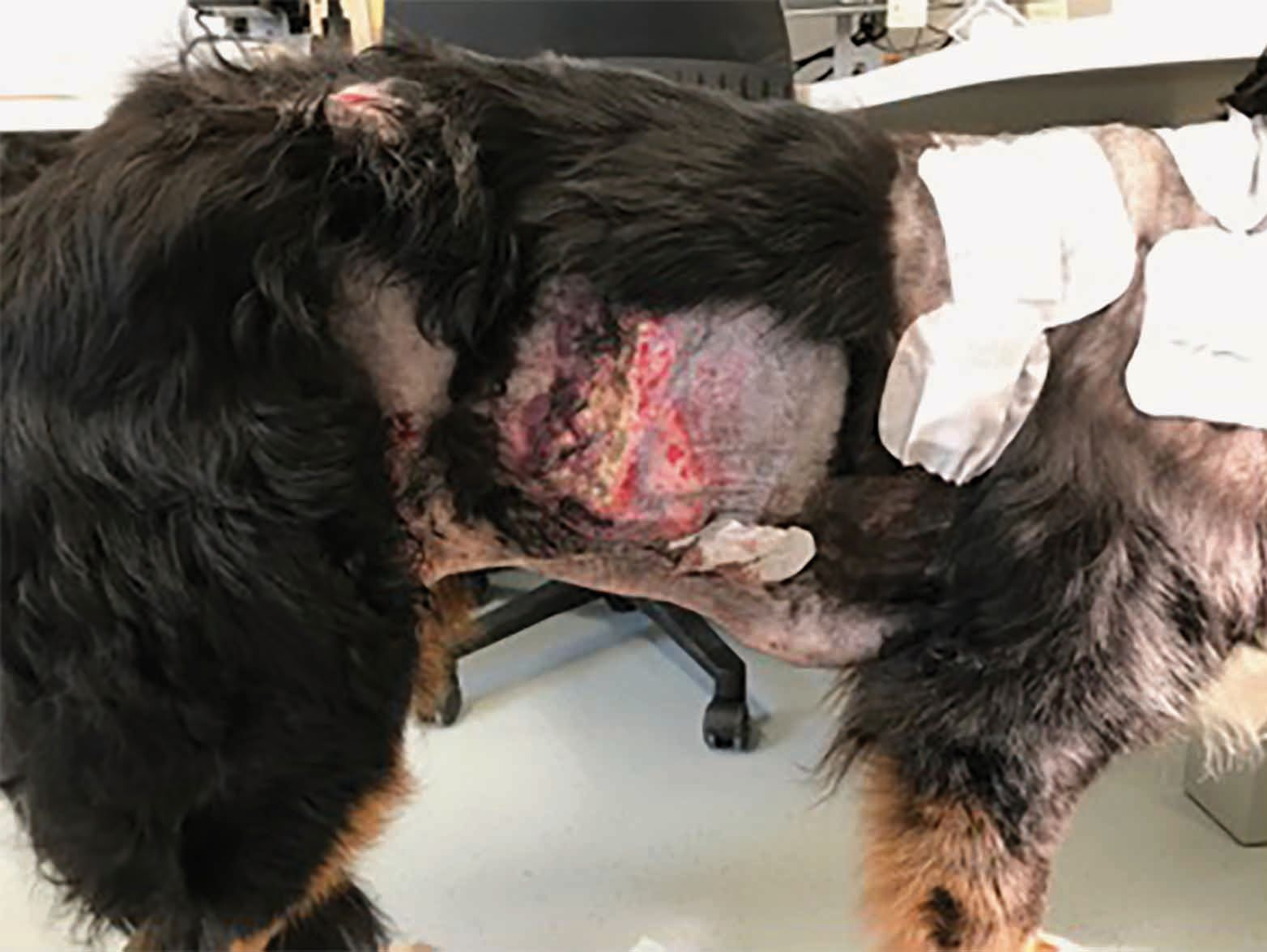
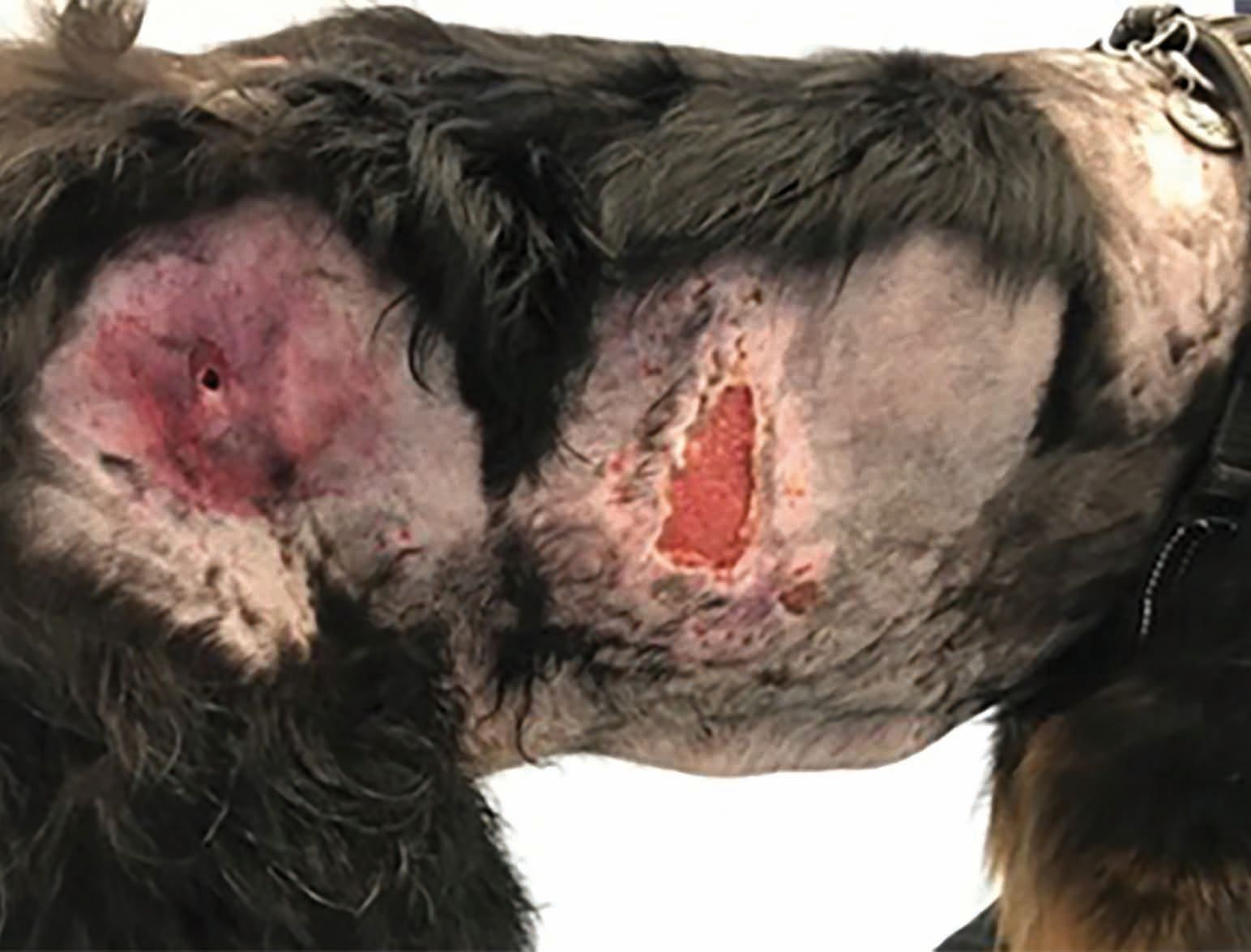
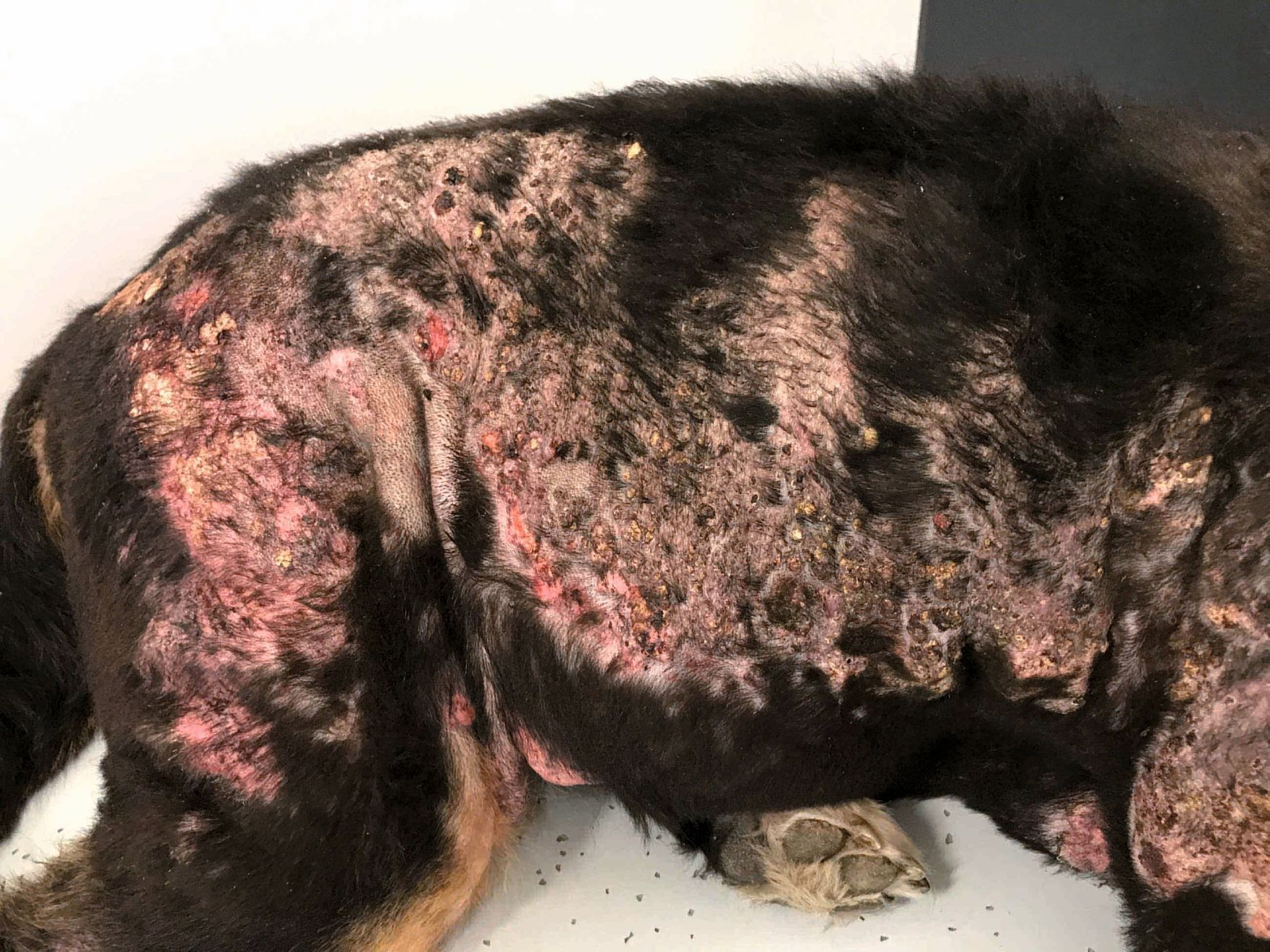
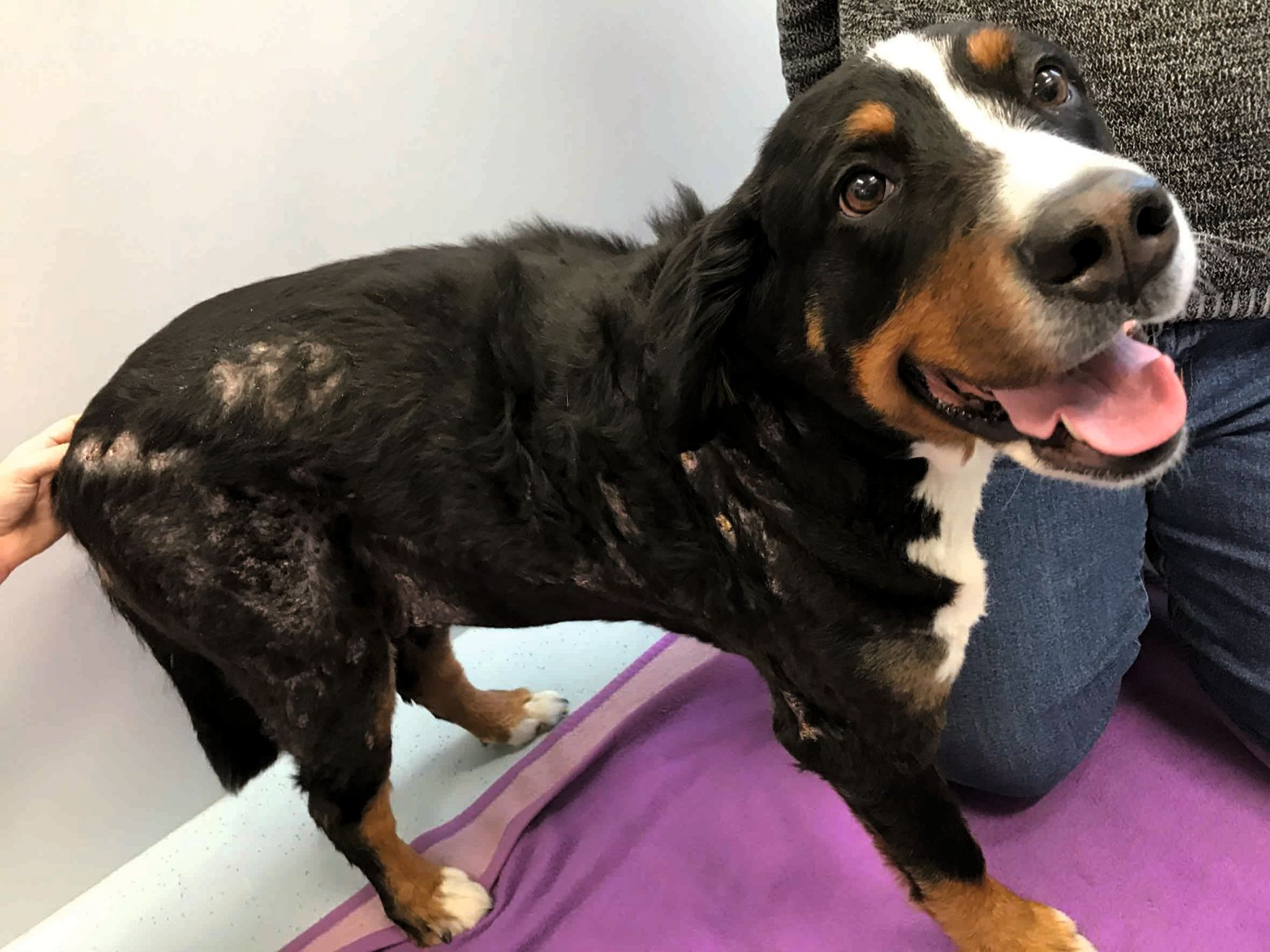
Es importante señalar que, aunque el PFPA promueve la curación de las heridas, si la enfermedad subyacente no se trata, es probable que se produzcan recidivas a corto plazo como, por ejemplo, en el caso pacientes inmunodeprimidos [13]. La Figura 5 muestra a un Boyero de Berna de ocho años de edad con septicemia secundaria a un íleo necrotizante por cuerpo extraño. Este perro había sido previamente diagnosticado de hipoadrenocorticismo y fue tratado con desoxicorticosterona durante varios años. Como consecuencia de la septicemia desarrolló fascitis necrotizante en varias áreas de los flancos, mostrando una respuesta limitada al tratamiento triple con antibióticos, presumiblemente debido a la corticoterapia. Sin embargo, mediante la aplicación de PFPA se obtuvo una rápida mejoría en el transcurso de tres semanas y, aunque durante ese tiempo aparecieron nuevas áreas de fascitis, estas también se pudieron tratar con éxito y todas las lesiones se resolvieron a los 24 días de tratamiento y sin producirse ninguna recidiva.
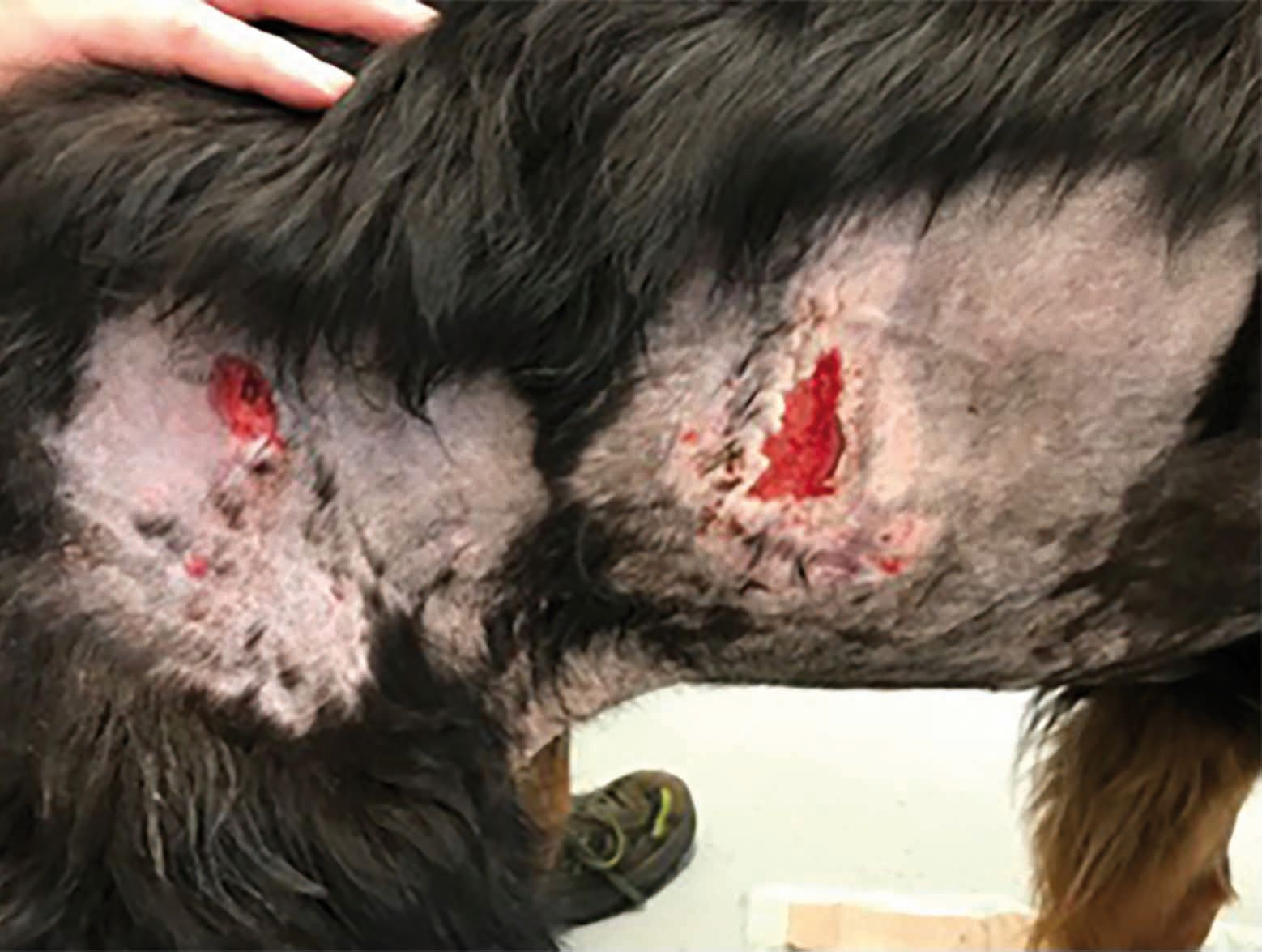
También se ha demostrado que el PFPA es beneficioso en pacientes con diversas enfermedades inmunomediadas, como es el caso del Pastor Alemán de tres años de edad que se muestra en la Figura 6. Este perro presentaba fístulas perianales y fue tratado con PFPA, junto con ciclosporina y tacrolimus por vía tópica. Para poder comparar el resultado, solo se aplicó tratamiento con PFPA a la mitad izquierda del ano y el lado derecho se cubrió con un papel durante las sesiones de plasma frío. A los 18 días se hizo evidente que, si bien el tratamiento farmacológico había sido eficaz, el lado izquierdo de la herida se cerró de forma significativamente más rápida y con menos cicatrices que el lado derecho.
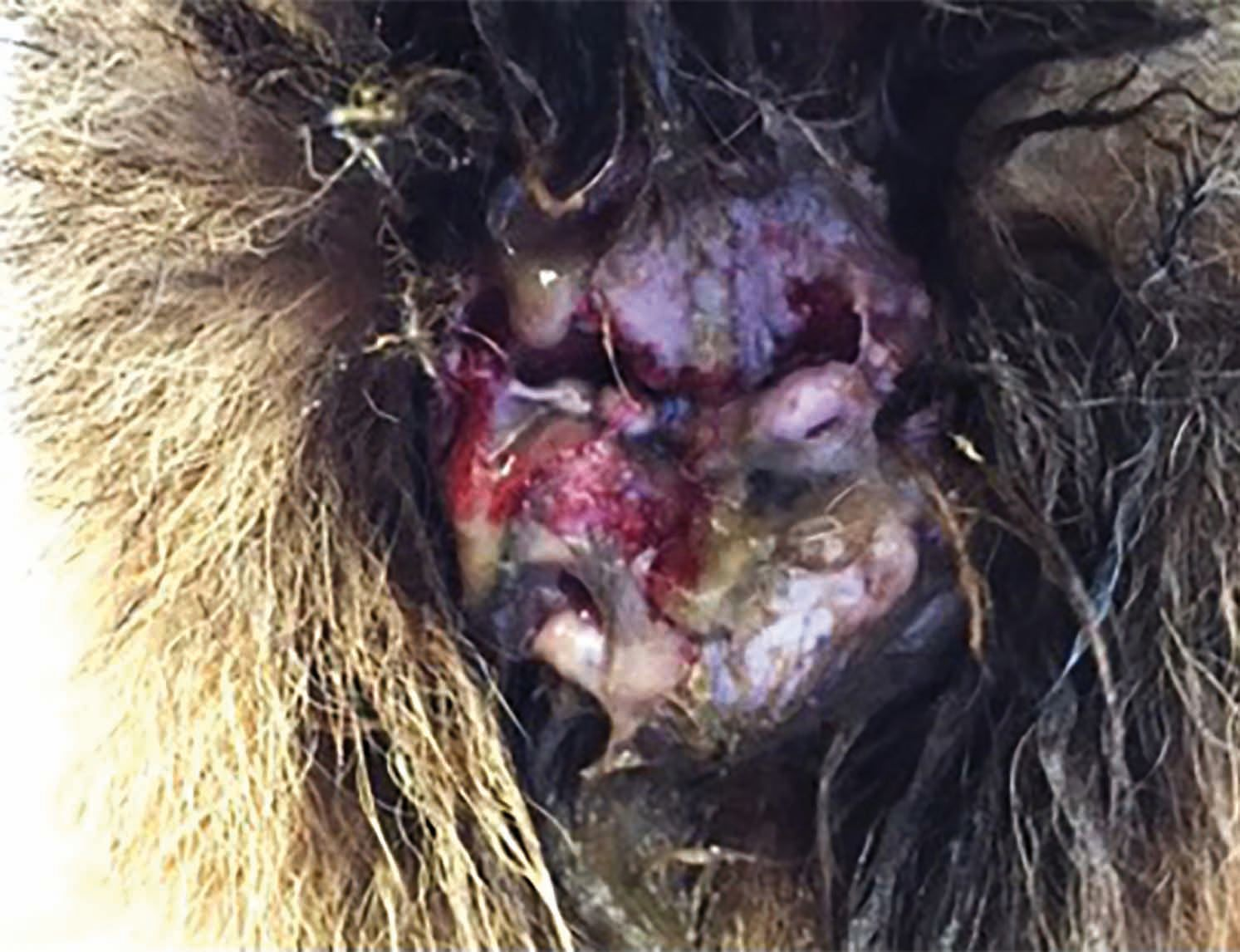
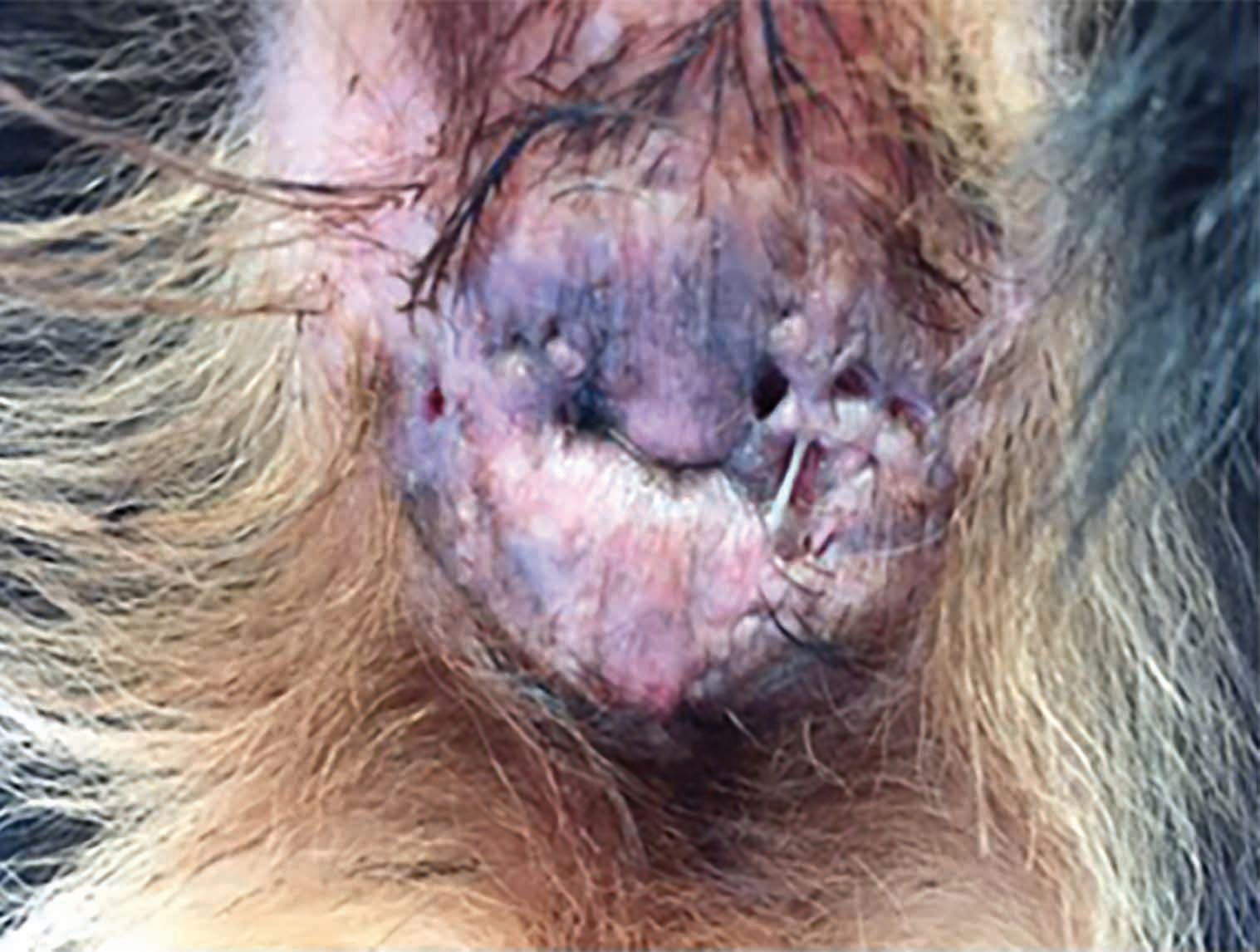
Otro enfoque que actualmente se está utilizando se basa en el efecto beneficioso del plasma frío sobre la fibrosis [11]. La Figura 7 muestra a un Boyero de Berna de cuatro años de edad con calcinosis cutis grave secundaria a hiperadrenocorticismo iatrogénico, como consecuencia del tratamiento de pénfigo foliáceo. En este tipo de casos, las opciones de tratamiento farmacológico para controlar el pénfigo, aparte de la aplicación local de antiinflamatorios (p. ej., DMSO) y la sustitución de glucocorticoides por otros agentes como la ciclosporina, son muy limitadas. La calcinosis cutis muchas veces da lugar al desarrollo de cicatrices importantes, pero en este caso, se obtuvo una respuesta muy rápida con el tratamiento con PFPA y, a las cuatro semanas, se obtuvo la resolución completa en el 90% de la piel sin que se formaran cicatrices, además de conseguir que todo el pelo volviera a crecer de nuevo.
Por último, el PFPA podría tener más aplicaciones en otras áreas. Actualmente se están investigando opciones para que la técnica pueda aplicarse internamente mediante intervenciones mínimamente invasivas (como la endoscopia) [14]. Su aplicación quirúrgica sigue siendo controvertida; puede ser beneficiosa para la desinfección posoperatoria de heridas y la prevención de cicatrices, pero existe cierta incertidumbre respecto al uso intraoperatorio. Aunque puede reducir la carga bacteriana de la cirugía, el procedimiento se alarga y se puede producir la pérdida de líquido tisular, dando lugar a una cicatrización más deficiente [11][15].
Conclusión
El tratamiento con plasma frío a presión atmosférica (PFPA) es una técnica física sencilla que puede acelerar significativamente la curación de muchas heridas de la piel. Elimina eficazmente los agentes infecciosos, independientemente de la resistencia a fármacos, y acelera la recuperación del paciente, especialmente cuando existen factores que podrían retrasar el proceso de curación. La aplicación de PFPA es rápida, indolora y sencilla, por lo que es una técnica que se puede utilizar de forma rutinaria en la clínica, aunque su eficacia todavía no se ha evaluado de forma objetiva. Es importante destacar que el PFPA no debe reemplazar en ningún caso al diagnóstico veterinario, ya que no resuelve ninguna enfermedad subyacente.
Christoph J. Klinger
Dr. med. vet.
Alemania
El Dr. Klinger se licenció en Múnich en el 2011 y trabajó en una clínica de pequeños animales antes de realizar un internado de un año de duración en la Universidad Ludwig Maximilian. Posteriormente, completó la residencia en Múnich para obtener la diplomatura por el ECVD y el ACVD, y finalizó su tesis doctoral en el 2016.
Referencias
- Daeschlein G, Napp M, von Podewils S, et al. In vitro susceptibility of multidrug resistant skin and wound pathogens against low temperature atmospheric pressure plasma jet (APPJ) and dielectric barrier discharge plasma (DBD). Plasma Process Polym 2014;11(2):175-183.
- Daeschlein G, Scholz S, Ahmed R, et al. Cold plasma is well-tolerated and does not disturb skin barrier or reduce skin moisture. J Dtsch Dermatol Ges 2012;10(7):509-515.
- Filipić A, Gutierrez-Aguirre I, Primc G, et al. Cold plasma, a new hope in the field of virus inactivation. Trends Biotechnol 2020;38(11):1278-1291.
- Haertel B, Eiden K, Deuter A, et al. Differential effect of non-thermal atmospheric-pressure plasma on angiogenesis. Lett Appl NanoBioScience 2014;3(2):159-166.
- Metelmann HR, Vu TT, Do HT, et al. Scar formation of laser skin lesions after cold atmospheric pressure plasma (CAP) treatment: a clinical long-term observation. Clin Plasma Med 2013;1(1):30-35.
- Arndt S, Schmidt A, Karrer S, et al. Comparing two different plasma devices kINPen and Adtec SteriPlas regarding their molecular and cellular effects on wound healing. Clin Plasma Med 2018;9(10):1016.
- Classen J, Dengler B, Klinger CJ, et al. Cutaneous alternariosis in an immunocompromised dog successfully treated with cold plasma and cessation of immunosuppressive medication. Tierrztl Prax K 2017;45(05):337-343.
- Winter J, Nishime TM, Bansemer R, et al. Enhanced atmospheric pressure plasma jet setup for endoscopic applications. J Phys Appl Phys 2018;52(2):024005.
- Nolff MC, Winter S, Reese S, et al. Comparison of polyhexanide, cold atmospheric plasma and saline in the treatment of canine bite wounds. J Small Anim Pract 2019;60(6):348-355.
- Hfner A, Steffen H, Holtfreter B, et al. Effects of non-thermal atmospheric pressure plasma and sodium hypochlorite solution on Enterococcus faecalis biofilm: an investigation in extracted teeth. Plasma Process Polym 2017;14(3):1600064.
- Koban I, Matthes R, Hbner N-O, et al. Treatment of Candida albicans biofilms with low-temperature plasma induced by dielectric barrier discharge and atmospheric pressure plasma jet. NJP 2010;12(7):073039.
- Kondeti VSK, Phan CQ, Wende K, et al. Long-lived and short-lived reactive species produced by a cold atmospheric pressure plasma jet for the inactivation of Pseudomonas aeruginosa and Staphylococcus aureus. Free Radic Biol Med 2018;124:275-287.
- Sun P, Sun Y, Wu H, et al. Atmospheric pressure cold plasma as an antifungal therapy. Appl Phys Lett 2011;98(2):021501.
- Hasse S, Duong Tran T, Hahn O, et al. Induction of proliferation of basal epidermal keratinocytes by cold atmospheric pressure plasma. Clin Exp Dermatol 2016;41(2):202-209.
- Schmidt A, Bekeschus S, Wende K, et al. A cold plasma jet accelerates wound healing in a murine model of full-thickness skin wounds. Exp Dermatol 2017;26(2):156-162.
Otros artículos de este número
Compartir en las redes sociales