Le colostrum de la chienne
Ecrit par Sylvie Chastant et Hanna Mila
La période néonatale est une période à risque dans l’espèce canine, puisqu’environ 20 % des chiots nés vivants meurent avant l’âge de 21 jours. La première semaine compte à elle seule pour 70 % des cas de mortalité néonatale.
Article

Points clés
Le colostrum est capital pour la survie du chiot, car il apporte à la fois des immunoglobulines et des nutriments au nouveau-né.
La concentration en immunoglobulines du colostrum au cours des deux premiers jours post-partum est 5 fois plus importante que celle du lait, mais elle chute très rapidement avec le temps.
La qualité immunologique du colostrum est très variable d’une chienne à l’autre, mais aussi chez une même chienne selon la paire de mamelles. Néanmoins, la paire donnant le colostrum de meilleure qualité n’est pas la même d’une femelle à l’autre.
Le suivi de la croissance au cours des deux premiers jours de vie est un bon critère prédictif de la survie du chiot en période néonatale.
Il n’existe à ce jour aucun substitut complet (en termes d’énergie et d’immunité) au colostrum de chienne.
Introduction
La période néonatale est une période à risque dans l’espèce canine, puisqu’environ 20 % des chiots nés vivants meurent avant l’âge de 21 jours. La première semaine compte à elle seule pour 70 % des cas de mortalité néonatale [1 ][2]. La survie des chiots pendant les premières semaines dépend en particulier du colostrum, cette sécrétion spécifique de la glande mammaire pendant les deux premiers jours post-partum. En effet, le colostrum est source de nutriments mais aussi d’immunoglobulines (Ig), les chiots étant presque agammaglobulinémiques à la naissance. Ainsi, le risque de mortalité néonatale dépend chez le chiot de deux facteurs : la qualité du transfert d’immunité passive (évalué par le taux d’IgG circulant à l’âge de 2 jours) et la croissance entre la naissance et l’âge de 2 jours (la perte de poids ne devant pas dépasser 4 % du poids de naissance) [3 ][4]. Les apports immunitaires et énergétiques du colostrum sont donc capitaux pour le chiot mais loin d’être toujours suffisants : à l’âge de deux jours, environ 20 % des chiots montrent un déficit d’immunité passive et 30 % une croissance précoce insuffisante [3 ][4].
Formation et composition du colostrum
Le colostrum est la première sécrétion mammaire produite après la mise bas (parfois dès avant la mise bas), et la transition du colostrum vers le lait s’effectue entre le deuxième et le troisième jour de lactation (Tableau 1). Aucune donnée n’est disponible sur la quantité de colostrum produite par la chienne.
| Jours de lactation | |||||
| 1 | 3 | 7 | 14 | 21 | |
| Nutriments | Colostrum | Lait | Lait | Lait | Lait |
| Protéines (g/L) | 143.0 | 102.3 | 81.7 | 66.8 | 68.4 |
| Immunoglobulines G (g/L) | 24.8 | * | 5.9 | 0.6 | 0.6 |
| Lipides (g/L) | 132.2 | 137.2 | 132.1 | 118.5 | 112.5 |
| Lactose (g/L) | 16.6 | 29.3 | 35.4 | 39.9 | 39.4 |
| Calcium (mg/L) | 1,363 | 1,366 | 1,773 | 1,950 | 1,929 |
| Phosphore (mg/L) | 935 | 914 | 1,166 | 1,175 | 1,359 |
| Energie (kcal/L) | 1,831 | 1,761 | 1,657 | 1,493 | 1,444 |
* valeur inconnue
Au cours de la gestation, le tissu mammaire se développe sous l’action des œstrogènes et de la progestérone, et l’activité sécrétoire – induite par la prolactine – n’est possible que lorsque le taux de progestérone chute. Certains composants du colostrum sont synthétisés par les cellules mammaires épithéliales (protéines, lactose, lipides) tandis que d’autres (immunoglobulines (Ig), leucocytes, hormones et certains facteurs de croissance) proviennent de la circulation sanguine de la chienne. Macroscopiquement, le colostrum est jaunâtre et plus visqueux que le lait. D’un point de vue qualitatif, il se différencie du lait essentiellement par sa concentration élevée en protéines (double de celle du lait deux semaines après la mise bas, et particulièrement en immunoglobulines), une concentration légèrement plus élevée en lipides (+10 %) et une plus faible teneur en glucides (deux fois moins que le lait) [5 ][6]. Pour diverses raisons (faible nombre d’études, importante variabilité entre les chiennes et disparité des méthodes analytiques), sa composition nutritionnelle observée est assez variable : le taux protéique est généralement compris entre 4 et 14 %, le taux lipidique entre 6 et 13 % et le taux glucidique entre 1,7 et 2,3 % ([5 ][7 ][8] et données non publiées).
Outre la caséine (60 % des protéines totales), les immunoglobulines représentent entre 20 et 37 % des protéines colostrales (20 à 45 g/L d’Ig totales) [6 ][7 ][9 ][10]. Trois classes d’Ig (IgG, IgM, IgA) sont présentes dans le colostrum canin, les IgG étant majoritaires (60-75 % des Ig) alors que les IgE sont indétectables. La concentration initiale en IgG du colostrum est de l’ordre de 15 à 30 g/L, mais elle chute très rapidement pour atteindre environ 5 g/L à 7 jours et moins de 1 g/L à J14 (données non publiées). La concentration en IgG du lait est donc 20 fois inférieure à celle du colostrum. Les IgA représentent 16 à 40 % des Ig colostrales, mais elles deviennent ensuite largement majoritaires dans le lait [7 ][10] (Figure 1). La majorité des IgG provient du sérum de la mère, une petite fraction étant produite localement dans la mamelle [11]. La mamelle exerce une véritable action de concentration des IgG, de sorte que le taux d’IgG colostral est généralement 3 fois plus élevé que le taux d’IgG sérique maternel, bien qu’il n’y ait pas de relation entre ces deux taux [10 ][12]. Cette concentration sélective est sous contrôle endocrinien, les Ig étant stockées dans les alvéoles mammaires jusqu’à leur relargage suite à la parturition [13]. En revanche, les IgA et les IgM semblent majoritairement produites localement dans la mamelle par les lymphocytes [13].
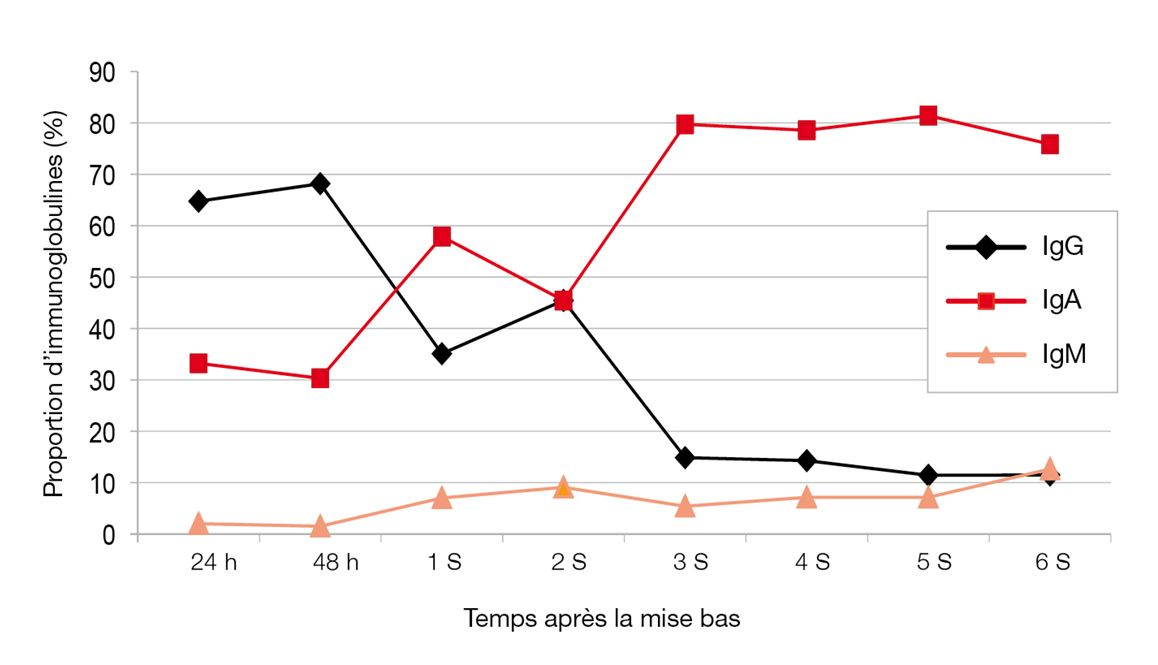
Des inhibiteurs de la trypsine sont également présents dans le colostrum (mais plus dans le lait), réduisant ainsi la dégradation des Ig colostrales et augmentant potentiellement leur absorption par le nouveau-né [14]. Le colostrum contient aussi des facteurs antimicrobiens (tels que la lactoferrine et le lysozyme), des hormones (cortisol, thyroxine, insuline, hormone de croissance) et des facteurs de croissance (insulinomimétiques (IGF), épidermique (EGF) et nerveuse (NGF) [15]). Ceux-ci sont impliqués dans le développement et la maturation de nombreux organes comme la thyroïde et l’intestin, et sont indispensables à la croissance globale du nouveau-né (voir plus loin).
Le colostrum canin est très concentré en deux enzymes, les gamma-glutamyl transférases (gamma-GT) et les phosphatases alcalines (PAL), respectivement 100 et 10 fois plus que le sérum maternel [16]. Ces deux enzymes étant quasiment absentes du sang circulant à la naissance, leur dosage dans le sérum du chiot permet de prouver l’ingestion de colostrum (bien que leur concentration ne soit pas corrélée à la concentration en IgG).
Enfin, le colostrum canin contient également différentes cellules comme des macrophages, des granulocytes neutrophiles et des lymphocytes. Ces cellules sont absorbées par le chiot avant que sa barrière intestinale ne se ferme, et soit elles passent dans la circulation, soit elles jouent un rôle dans l’immunité locale digestive, cellulaire ou humorale [17].
Rôles du colostrum canin
Le placenta de type endothéliochorial de la chienne est quasi totalement imperméable aux molécules de grande taille, comme les immunoglobulines. Ceci explique pourquoi les chiots naissent avec un taux circulant d’IgG très faible, de l’ordre de 0,3 g/L (contre 8 à 25 g/L chez un chien adulte) [3][18][19]. C’est la prise de colostrum qui permet l’acquisition de l’immunité passive, de sorte que la concentration sérique en IgG du chiot atteindra environ 6 g/L 48 heures après l’ingestion du colostrum ; 85 à 95 % des Ig circulantes du chiot sont donc d’origine colostrale [20]. Cet apport d’Ig, potentialisé par les antitrypsines colostrales, représente le rôle le plus spécifique du colostrum et est un facteur déterminant de la survie des chiots [3], puisque la mortalité néonatale est majoritairement d’origine infectieuse [21]. La lactoferrine colostrale semble jouer un rôle marginal dans l’immunité des chiots [22] tandis que le rôle des cellules immunitaires contenues dans le colostrum n’est pas encore bien défini. Pour que le chiot puisse acquérir une immunité passive, il doit recevoir du colostrum dans les huit premières heures de sa vie (Figure 2). Ce délai est critique pour deux raisons :
- Premièrement, la concentration colostrale en Ig chute rapidement dès les premières heures post-partum.
- Deuxièmement, la barrière intestinale se ferme rapidement après la mise bas ; c’est à ce moment-là que les macromolécules ne peuvent plus traverser la paroi intestinale pour passer dans la circulation, de sorte que si le chiot absorbe en moyenne 40 % des IgG colostrales ingérées à la naissance, il n’en absorbe plus que 20 % 4 heures après, et seulement 9 % 12 heures après. A partir de 24 heures après la mise bas, l’absorption est nulle [20].

La qualité immunologique du colostrum, en termes de concentration en IgG, est assez variable, à la fois entre les chiennes et entre les paires de mamelles d’une même femelle (Figure 3). Dans une étude évaluant le colostrum de 44 chiennes d’un même élevage, les taux d’IgG variaient d’un facteur 5 entre les femelles. Ni l’âge de la mère, ni son format racial, ni la taille de sa portée ne semblaient influer sur la qualité immunologique du colostrum [12]. La concentration en IgG des 180 échantillons provenant de différentes paires de mamelles variait de 0,8 à 61 g/L avec un coefficient de variation de 42 % entre les paires d’une même chienne [12]. Cependant, la paire de mamelles produisant le colostrum de meilleure qualité varie d’un animal à l’autre, et il n’est donc pas possible de conseiller la tétée d’une paire plutôt que d’une autre. Néanmoins, la très forte variabilité de la qualité immunologique du colostrum entre les chiennes (et entre les mamelles d’une même chienne) est susceptible d’exposer certaines portées à un risque accru de mortalité néonatale.
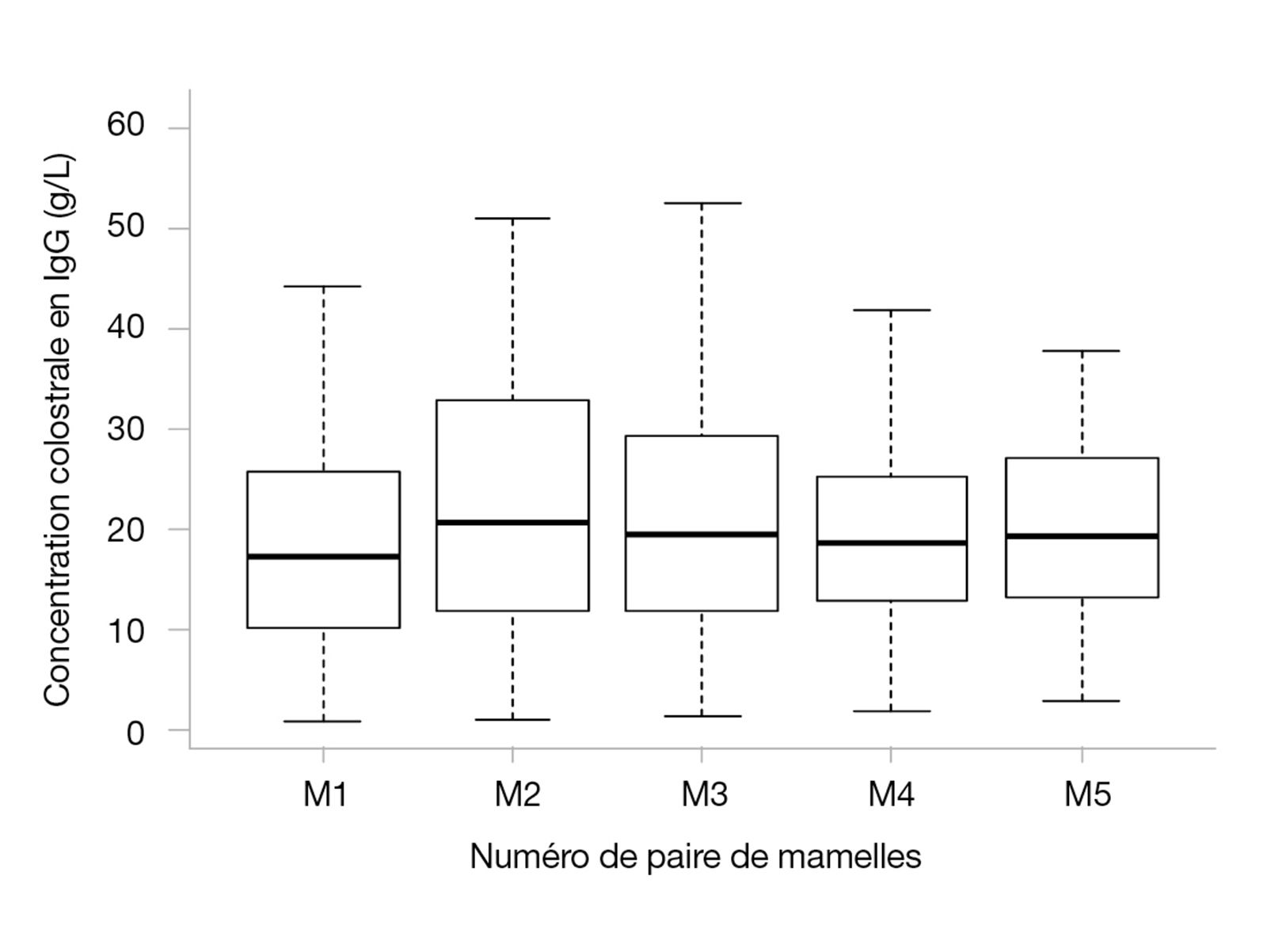
Si le colostrum apporte une majorité d’IgG assurant l’immunité systémique, les IgA assurent quant à elles l’immunité locale, digestive, et plus généralement muqueuse. Les IgA apportées par le colostrum vont participer à la défense locale du tube digestif et ce rôle se poursuivra avec l’ingestion du lait, riche en IgA. Pour la fraction absorbée dans la circulation sanguine avant la fermeture de la barrière intestinale, les IgA seront également relarguées vers les muqueuses, digestive et non digestive [20][23].
Bien que le transfert des IgG maternelles aide à réduire le risque de mortalité néonatale, l’immunité maternelle risque, en fin de période pédiatrique (vers l’âge de 6-8 semaines), d’interférer avec la vaccination du chiot. Plus la concentration en IgG acquise à l’âge de deux jours est élevée, plus elle sera élevée en période pédiatrique [24], et plus il y aura de risques que le chiot ne soit pas protégé après la vaccination. Néanmoins, cette interférence est variable et dépend à la fois de l’individu, de l’immunogénicité du vaccin et de la dose utilisée.
Croissance
A la naissance, les chiots ont de faibles réserves en tissu adipeux, ainsi que des capacités de glycogénolyse limitées. L’apport précoce d’énergie par le colostrum est donc indispensable ; la croissance du chiot n’est possible que si les apports énergétiques sont supérieurs à ses besoins d’entretien (Figure 4).

La valeur énergétique du colostrum est supérieure d’au moins 20 % à celle du lait, bien que la teneur en énergie puisse varier entre les chiennes (toutefois assez faiblement, d’un facteur 1,6) et qu’il puisse y avoir de légères différences entre les paires de mamelles d’une même chienne (avec un coefficient de variation de l’ordre de 8 %, contre 42 % pour la valeur immunologique). Aucun effet de l’âge de la chienne, de son format racial, ni de la taille de sa portée n’a été mis en évidence sur la valeur énergétique. 52 % de l’énergie apportée par le colostrum est d’origine protéique et 40 % proviennent des lipides ; les variations de la valeur énergétique s’expliquent essentiellement par des variations du taux de lipides [25].
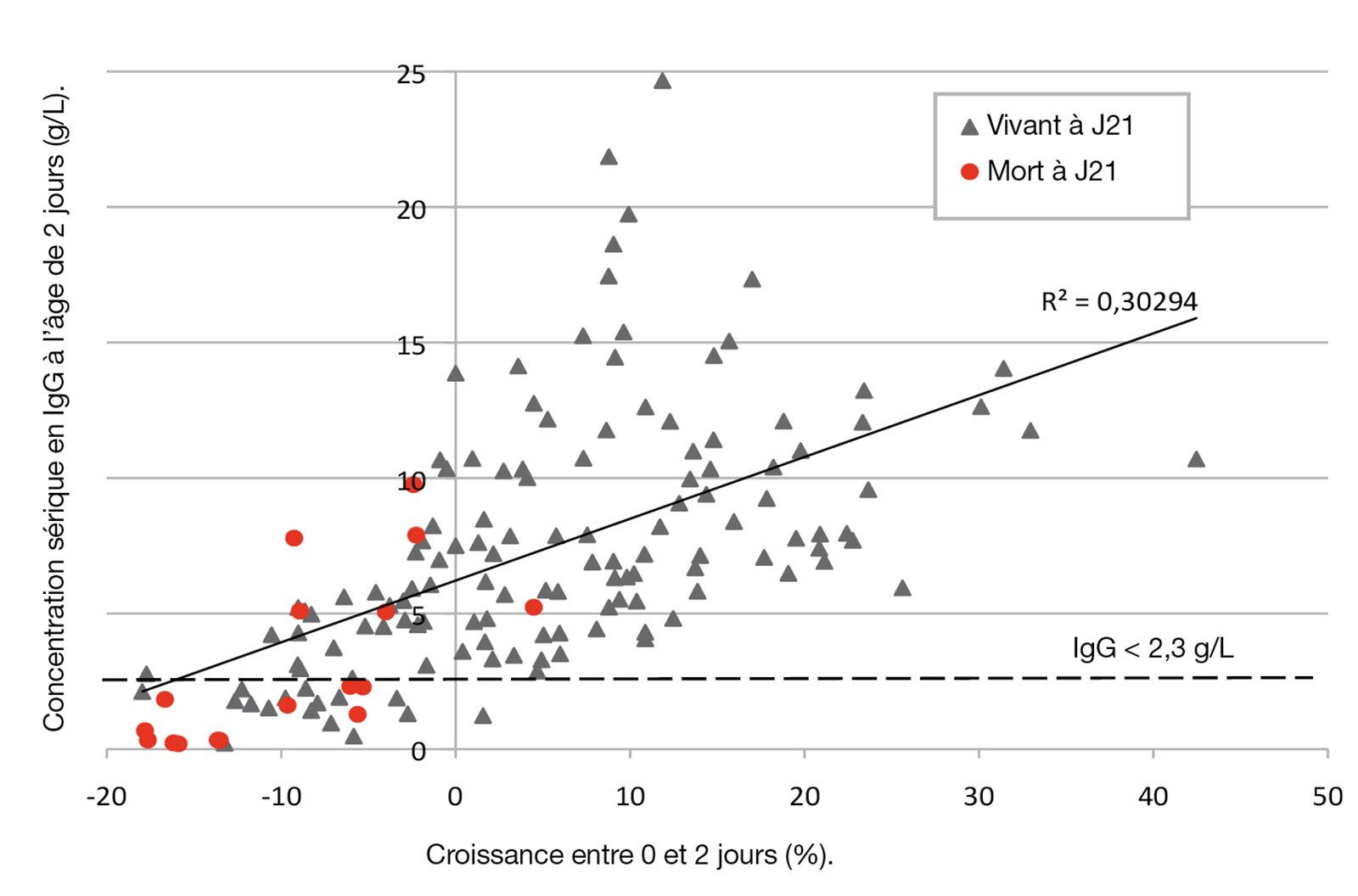
Si les Ig et l’énergie apportées par le colostrum conditionnent le risque de mortalité du chiot en période néonatale [3][4], il est intéressant de noter que la qualité immunologique et la valeur énergétique du colostrum ne sont pas corrélées [28]. D’autre part, la quantité de colostrum moyen à ingérer par le chiot pour couvrir ses besoins immunitaires est de 1,3 mL pour 100 g de poids vif (en admettant que le taux circulant d’IgG à atteindre soit de 2,3 g/L, avec un taux d’absorption digestive de 40 %, un hématocrite de 35 %, et un taux d’IgG colostral de 20 g/L). A l’opposé, la quantité moyenne de colostrum à ingérer par le chiot pour couvrir ses besoins énergétiques est bien plus élevée : 12 mL pour 100 g de poids vif (pour un besoin énergétique de 212 kcal/kg/j et un colostrum apportant 1.800 kcal/L). Bien qu’il semble donc beaucoup plus difficile de couvrir le besoin énergétique que le besoin immunologique, la proportion de chiots déficitaires en énergie (30 %) n’est que légèrement supérieure à celle des chiots déficitaires en Ig (20 %) (Figure 5). Alors que les concentrations colostrales minimales d’IgG et d’énergie nécessaires au contrôle du risque de mortalité néonatale ont été déterminées dans certaines espèces, elles sont actuellement inconnues chez le chien.
Développement des organes
Outre la croissance pondérale, le colostrum est également impliqué dans le développement et la maturation de certains organes, notamment le tube digestif. Cet effet serait lié aux hormones et aux facteurs de croissance colostraux. Une étude a montré que les chiots nourris avec du colostrum avaient une muqueuse intestinale plus développée de 60 à 95 % selon le critère utilisé par rapport aux chiots nouveau-nés de poids équivalent nourris avec du lait maternisé 26, bien que ces résultats ne se retrouvent pas toujours dans les autres études [27]
Conclusion
Le colostrum canin est une sécrétion de composition très particulière, qui répond aux besoins spécifiques du chiot, à savoir l’acquisition de l’immunité passive et un apport d’énergie et de certains facteurs nécessaires à la croissance et à la différenciation des organes. La quantité de colostrum ingérée peut être un facteur limitant de la survie de certains chiots dans une portée, mais l’impact de l’alimentation maternelle sur la quantité et la qualité du colostrum reste à explorer. D’un point de vue pratique, la mise au point d’un substitut ou d’un complément colostral, capable d’assurer un apport immunitaire efficace contre les pathogènes canins, outre un apport énergétique, constituerait une avancée cruciale dans le contrôle de la mortalité néonatale chez le chiot.
Remerciements
Les auteurs tiennent à remercier toutes les personnes qui ont contribué à améliorer les connaissances sur le colostrum canin, en particulier Karine Reynaud, Elie Marcheteau, Marie-Blanche Bertieri, Jennifer Anne, Maelys Martin, Milène Gonnier, Lisa Rossig et Stéphanie Coinus.
Sylvie Chastant
Dre vétérinaire, PhD, Dip. ECAR, NeoCare, École Nationale Vétérinaire de Toulouse, France
La Dre Chastant est diplômée de l’École nationale vétérinaire d’Alfort depuis 1990 et a obtenu un PhD pour ses recherches sur la préimplantation d’embryons de mammifères en 1995. Diplômée de l’European College for Animal Reproduction (ECAR), elle est actuellement professeure à l’École nationale vétérinaire de Toulouse, où elle enseigne la reproduction des animaux de compagnie et dirige Neocare, un centre dédié à tous les aspects de la néonatologie et de la pédiatrie des chiots et des chatons.
Hanna Mila
DVM, PhD, Assistant Professor
Hanna Mila est diplômée de la faculté vétérinaire de Wrocław (Pologne, 2009), où elle a travaillé pendant deux ans à la clinique de reproduction des animaux de compagnie. En 2012, elle a rejoint la Clinique de reproduction des animaux de compagnie de l'École vétérinaire de Toulouse (France). En septembre 2015, elle a obtenu son doctorat avec un travail sur les éléments déterminants de la survie des chiots. Aujourd'hui, Hanna Mila est professeure adjointe à l'École vétérinaire de Toulouse (France). Ses intérêts de recherche se concentrent sur la néonatologie et la pédiatrie canine, en particulier sur les facteurs de risque pour la survie des chiots et des chatons, leur suivi et leur gestion pendant les premiers mois de leur vie.
References
- Mila H, Grellet A, Chastant-Maillard S. Prognostic value of birth weight and early weight gain on neonatal and pediatric mortality: a longitudinal study on 870 puppies. In: Program and Abstracts, 7th ISCFR Symposium 2012;163-164.
- Gill MA. Perinatal and late neonatal mortality in the dog. University of Sydney 2001. PhD thesis; available at; http://ses.library.usyd.edu.au/bitstream/2123/4137/1/m_gill_thesis_2001.pdf Accessed 23rd September 2015.
- Mila H, Feugier A, Grellet A, et al. Inadequate passive immune transfer in puppies: definition, risk factors and prevention in a large multi-breed kennel. Prev Vet Med 2014;116(1-2):209-213.
- Mila H, Grellet A, Feugier A, et al. Differential impact of birth weight and early growth rate on neonatal mortality in puppies. J Anim Sci 2015;93(9):4436-4442.
- Adkins Y, Lepine AJ, Lonnerdal B. Changes in protein and nutrient composition of milk throughout lactation in dogs. Am J Vet Res 2001;62(8):1266-1272.
- Bebiak DM, Lawler DF, Reutzel LF. Nutrition and management of the dog. Vet Clin North Am Small Anim Pract 1987;17(3):505-533.
- Schäfer-Somi S, Bär-Schadler S, Aurich JE. Immunoglobulins in nasal secretions of dog puppies from birth to six weeks of age. Res Vet Sci 2005;78(2):143-150.
- Cost chescu E, Hoha G, Fotea L. Research regarding the lactating period of the bitch. Lucr tiin Ser Zooteh 2011;55:180-183.
- Norcross N. Secretion and composition of colostrum and milk. J Am Vet Med Assoc 1982;181(10):1057-1060.
- Chastant-Maillard S, Marcheteau E, Freyburger L, et al. Identification and quantification of immunoglobulins in canine colostrum – Quantification of colostral transfer. In Proceedings, 7th EVSSAR Congress 2010;107.
- Stoffel MH, Friess AE, Hartmann SH. Ultrastructural evidence of transplacental transport of immunoglobulin G in bitches. J Reprod Fertil 2000;118(2):315-326.
- Mila H, Feugier A, Grellet A, et al. Immunoglobulin G concentration in canine colostrum: evaluation and variability. J Reprod Immunol 2015;112:24-28.
- Hurley WL, Theil PK. Perspectives on immunoglobulins in colostrum and milk. Nutrients 2011;3(4):442-474.
- Levieux D, Ollier A. Bovine immunoglobulin G, lactalbumin and serum albumin in colostrum and milk during the early post-partum period. J Dairy Res 1999;66(03):421-430.
- White ME, Hathaway MR, Dayton WR, et al. The role of growth factors in canine and feline milk. 1996; Available at: http://agris.fao.org/agris-search/ search.do?recordID=US9620653. Accessed 18th August 2015.
- Center S, Randolph JF, Man Warren T, et al. Effect of colostrum ingestion on gamma-glutamyltransferase and alkaline phosphatase activities in neonatal pups. Am J Vet Res 1991;52(3):499-504.
- Wheeler TT, Hodgkinson AJ, Prosser CG, et al. Immune components of colostrum and milk – a historical perspective. J Mam Gland Biol Neoplasia 2007;12(4):237-247.
- Bouchard G, Plata-Madrid H, Youngquist RS, et al. Absorption of an alternate source of immunoglobulin in pups. Am J Vet Res 1992;53(2):230-233.
- Poffenbarger EM, Olson PN, Chandler ML, et al. Use of adult dog serum as a substitute for colostrum in the neonatal dog. Am J Vet Res 1991;52(8):1221-1224.
- Chastant-Maillard S, Freyburger L, Marcheteau E, et al. Timing of the intestinal barrier closure in puppies. Reprod Dom Anim 2012;47:190-193.
- Meloni T, Martino P, Grieco V, et al. A survey on bacterial involvement in neonatal mortality in dogs. Vet Ital 2014;50(4):293-299.
- Handl S, Wehr U, Zentek J, et al. Histological and immunohistochemical evaluation of duodenal and colonic biopsies after oral bovine lactoferrin supplementation in beagle puppies. J Anim Physiol Anim Nutr 2009;93(1):76-82.
- Salmon H, Berri M, Gerdts V, et al. Humoral and cellular factors of maternal immunity in swine. Dev Comp Immunol 2009;33(3):384-393.
- Mila H, Grellet A, Desario C, et al. Protection against canine parvovirus type 2 infection in puppies by colostrum-derived antibodies. J Nutr Sci 2014. Available at: http://journals.cambridge.org/article_S2048679014000573. Accessed 18 August 2015.
- Mila H, Grellet A, Feugier A, et al. Nutritional and immunological composition of canine colostrum. In Proceedings, 18th EVSSAR Congress 2015.
- Heird WC, Schwarz SM, Hansen IH. Colostrum-induced enteric mucosal growth in beagle puppies. Pediatr Res 1984;18(6):512-515.
- Schwarz SM, Heird WC. Effects of feeding on the small intestinal mucosa of beagle pups during the first 5 days of life. Am J Clin Nutr 1994;60(6):879- 886.
- Claus MA, Levy JK, MacDonald K, et al. Immunoglobulin concentrations in feline colostrum and milk, and the requirement of colostrum for passive transfer of immunity to neonatal kittens. J Feline Med Surg 2006;8(3):184- 191.
- Heinze CR, Freeman LM, Martin CR, et al. Comparison of the nutrient composition of commercial dog milk replacers with that of dog milk. J Am Vet Med Assoc 2014;244(12):1413-1422.
Autres articles de ce numéro
Partager sur les réseaux sociaux