La pododermatite du chat
Ecrit par Ronnie Kaufmann
Les chats qui sont amenés en consultation généraliste présentent souvent diverses lésions podales ; Ronnie Kaufmann détaille ici le diagnostic différentiel et les options thérapeutiques.
Article

Points clés
La pododermatite est un terme descriptif, non un diagnostic définitif ; elle peut concerner la peau des coussinets, les espaces interdigités ou les replis unguéaux.
Il existe de nombreuses causes de pododermatite mais la plupart peuvent être identifiées en se basant sur des signes cliniques caractéristiques, ainsi que sur les résultats de l’aspiration à l’aiguille fine.
Le diagnostic définitif repose sur l’histopathologie et, si le traitement implique généralement un immunomodulateur, il varie pour chaque maladie, tout comme le pronostic.
Lorsqu’un traitement à long terme est nécessaire, la posologie des médicaments immunomodulateurs devra toujours être la plus faible possible, tout en veillant au confort du chat.
Introduction
La pododermatite est le nom donné à la présentation clinique d’une inflammation affectant les coussinets, bien qu’elle puisse impliquer la peau des coussinets, les espaces interdigités ou les replis unguéaux (paronychie). La pododermatite peut être la seule anomalie détectée ou être accompagnée d’autres signes cliniques dermatologiques ou systémiques ; un examen dermatologique et physique complet se justifie donc chez tout chat présentant des lésions des coussinets plantaires. N’oubliez pas que la pododermatite est un terme descriptif, non un diagnostic définitif, et que plusieurs hypothèses sont à envisager !
La prévalence globale de la pododermatite en dermatologie féline est faible [1]. Parmi les maladies affectant les coussinets, il faut citer, entre autres, le complexe granulome éosinophilique félin, le pemphigus foliacé, l’hypersensibilité aux piqûres de moustiques, l’adénocarcinome métastatique (appelé syndrome du « poumon-doigt ») et la pododermatite plasmocytaire.
La pododermatite plasmocytaire
Étiologie et signes cliniques
Une pododermatite plasmocytaire (PP) est une affection dermatologique féline rare, caractérisée par un gonflement mou des coussinets, pouvant éventuellement s’ulcérer et provoquer des douleurs et des boiteries [2] [3] [4] [5] [6] [7]. L’étiologie et la pathogenèse exactes ne sont pas entièrement élucidées bien que de nombreuses études aient examiné les déclencheurs possibles. Une étude récente [7] n’a pas réussi à détecter des agents infectieux (dont Bartonella spp., Ehrlichia spp., Anaplasma phagocytophilum, Chlamydophila felis, Mycoplasma spp., Toxoplasma gondii et l’herpès virus félin) par immunohistochimie et test PCR sur des prélèvements tissulaires. Des publications antérieures ont fait état d’une infection concomitante par le virus de l’immunodéficience féline (FIV) dans 44 à 62 % des cas, mais cette association est peut-être plus fortuite que causale [4] [5] [6] [7] [8]. Une origine allergique a également été suggérée en raison d’une saisonnalité apparente [4] [8]. Quelle que soit la cause, un mécanisme à médiation immunitaire serait impliqué dans la PP, supporté par l’absence de traces d’agents infectieux et l’observation d’une plasmacytose tissulaire, d’une hypergammaglobulinémie constante et d’une réponse favorable aux agents immunomodulateurs [2] [3].
La maladie peut toucher des chats de tout âge, sans prédisposition de sexe ni de race. Les signes cliniques vont d’un gonflement mou et spongieux des coussinets, indolore, avec un érythème, une dépigmentation, des stries argentées et des squames fines, à une ulcération entraînant des saignements, une douleur et une boiterie pouvant être graves (Figures 1, 2 et 3). En général, plusieurs coussinets sont touchés, les lésions se situant principalement sur les coussinets métacarpiens et métatarsiens centraux. Les coussinets digitaux peuvent également être affectés mais généralement à un degré moindre. Il est rare qu’un seul coussinet plantaire soit concerné. Les infections bactériennes secondaires sont fréquentes [2] [3] [4] [5] [6] [7] [8].
Certains chats affectés peuvent présenter d’autres symptômes, notamment un mauvais état général, une hypersalivation [4], une lymphadénopathie, une pyrexie, une anorexie, une léthargie et plus rarement une dermatite plasmocytaire, avec un gonflement de la truffe ou une stomatite [3] [4]. Des glomérulonéphrites à médiation immunitaire ou des amyloïdoses rénales ont également été signalées [2] [3] [8]. Les résultats d’analyse sanguine peuvent montrer une anémie, une leucocytose et une thrombocytopénie. Une gammopathie polyclonale est présente dans tous les cas et peut persister après le traitement [2] [5].
Diagnostic
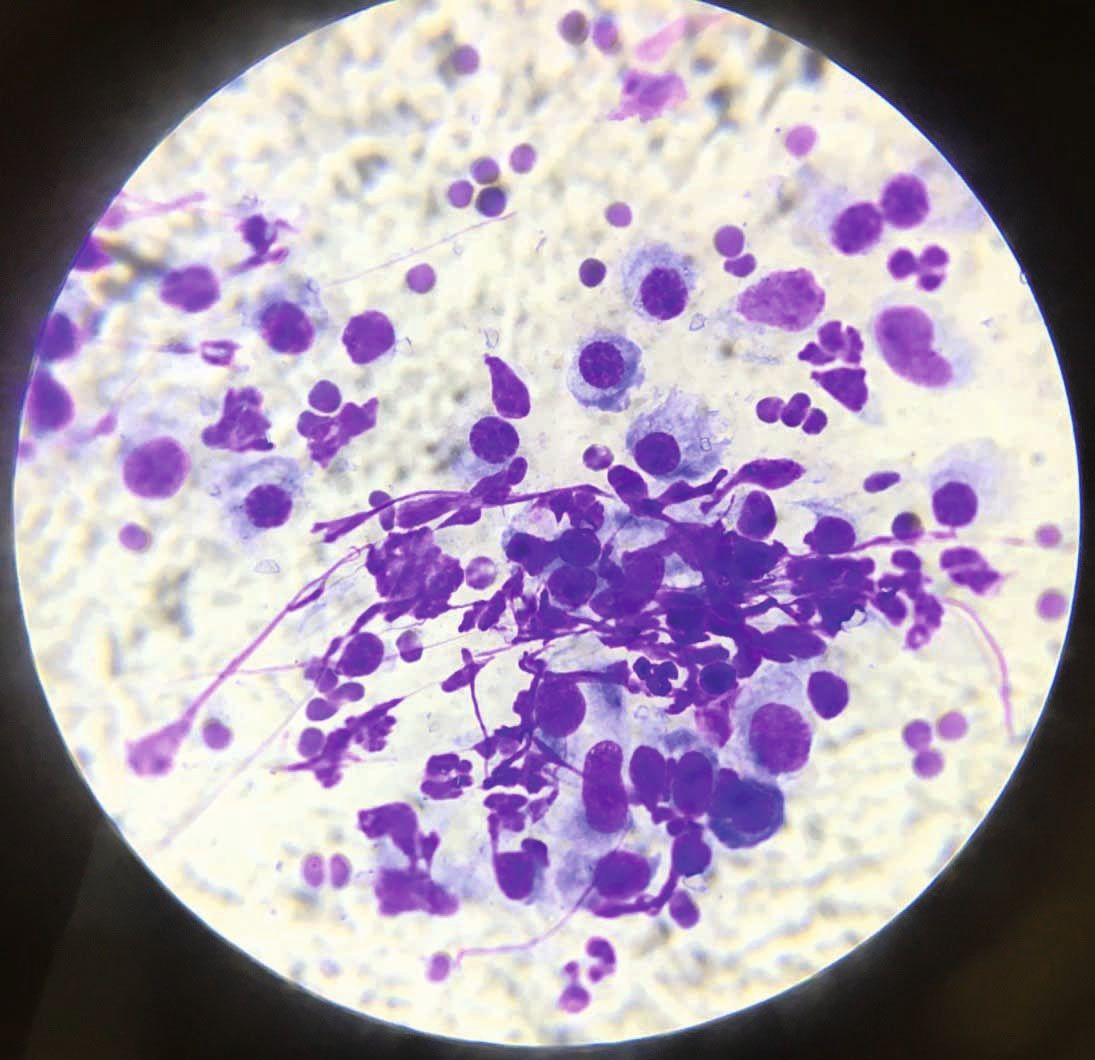
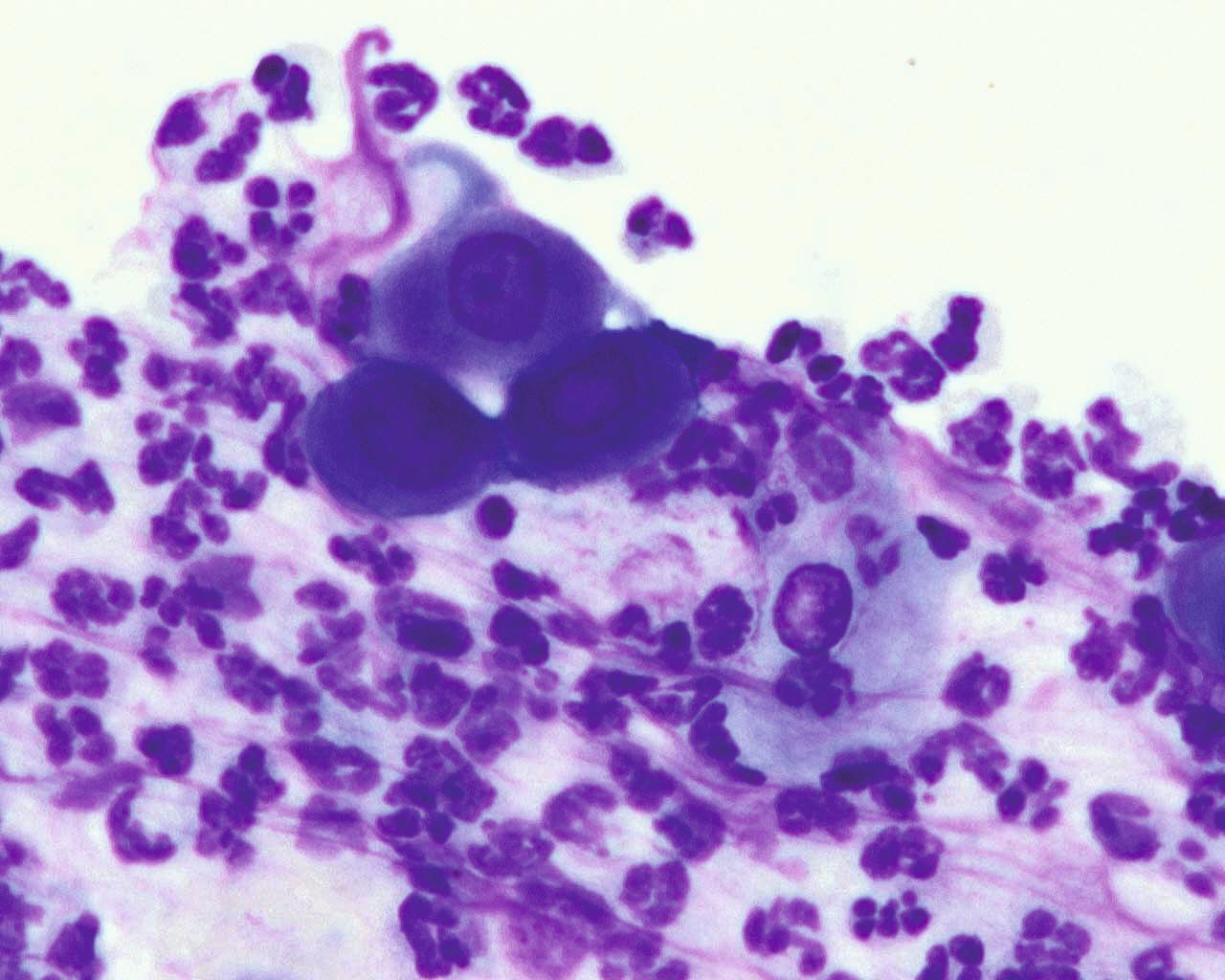
Un diagnostic provisoire peut être établi sur la base de signes cliniques typiques, car le gonflement mou des coussinets centraux, avec ou sans ulcération, et généralement sur plus d’une extrémité, caractérise la PP. Lorsque ce gonflement est présent sans autres lésions dermatologiques, le niveau de suspicion est très élevé, surtout si l’aspiration à l’aiguille fine (AAF) d’un coussinet gonflé met des plasmocytes en évidence [2] [3] [6] (Figure 4). Le diagnostic définitif est basé sur l’histopathologie, mais il faut éviter de prélever des lésions ulcérées. L’histopathologie met généralement en évidence une infiltration plasmocytaire diffuse du derme et du tissu sous-cutané, ainsi qu’un nombre variable de lymphocytes, de neutrophiles et d’éosinophiles, en plus des cellules de Mott (plasmocytes contenant des corps de Russell). Une fibrose et un tissu de granulation peuvent être observés dans les cas chroniques [2] [3] [4] [6] [7] [8]. La PP ne devra pas être confondue avec un complexe granulome éosinophilique félin : avec ce dernier, il y a souvent présence de lésions cutanées concomitantes, il est rare que plusieurs extrémités soient affectées et les espaces interdigitaux sont plus touchés que les seuls coussinets [2] [3]. Lorsqu’un seul coussinet est atteint, il faut envisager une tumeur ou un corps étranger [3]. Si plusieurs pattes sont touchées, surtout en présence d’une paronychie, une étiologie infectieuse sera envisagée.
Traitement
La pododermatite plasmocytaire se caractérise par une évolution irrégulière ; certains cas connaissent une rémission spontanée tandis que d’autres nécessitent un traitement à vie [2] [3] [6] [8]. Le traitement repose aujourd’hui surtout sur l’immunomodulation : le médicament à privilégier est la doxycycline par voie orale [2] [3], un antibiotique aux propriétés immunomodulatrices. La dose recommandée est de 10 mg/kg q24h ou 5 mg/kg q12h jusqu’à la résolution clinique, qui peut prendre jusqu’à 12 semaines [5] [6]. Ce médicament peut cependant provoquer une œsophagite chez certains chats, voire une sténose œsophagienne, et il est donc impératif d’administrer les comprimés ou les capsules avec de la nourriture ou de l’eau [2] [3]. Dans les cas graves ou si la doxycycline est inefficace, des glucocorticoïdes seront administrés par voie systémique : la prednisolone à 2-4 mg/kg q24h, la triamcinolone à 0,4-0,6 mg/kg q24h ou la dexaméthasone à 0,5 mg/kg ou la cyclosporine à 5-7,5 mg/kg q24h, en diminuant lentement la dose une fois la rémission obtenue [2] [3]. L’excision chirurgicale a également été signalée comme étant curative et un suivi de 2 ans n’a pas montré de récidives sur les coussinets traités chirurgicalement [4] [8]. Dans les cas nécessitant un traitement chronique, la posologie et la fréquence du traitement immunomodulateur doivent toujours être les plus basses possible, tout en veillant au confort du patient.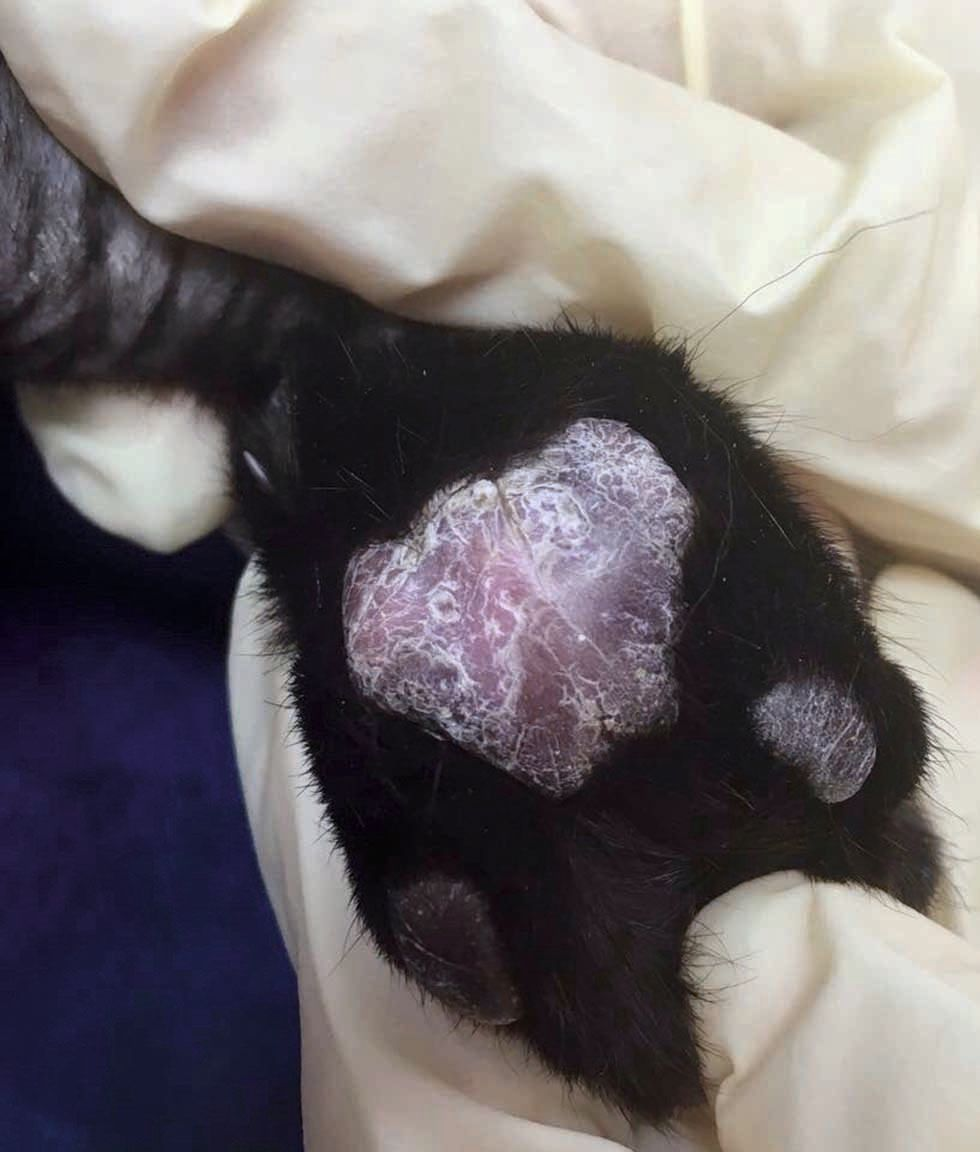

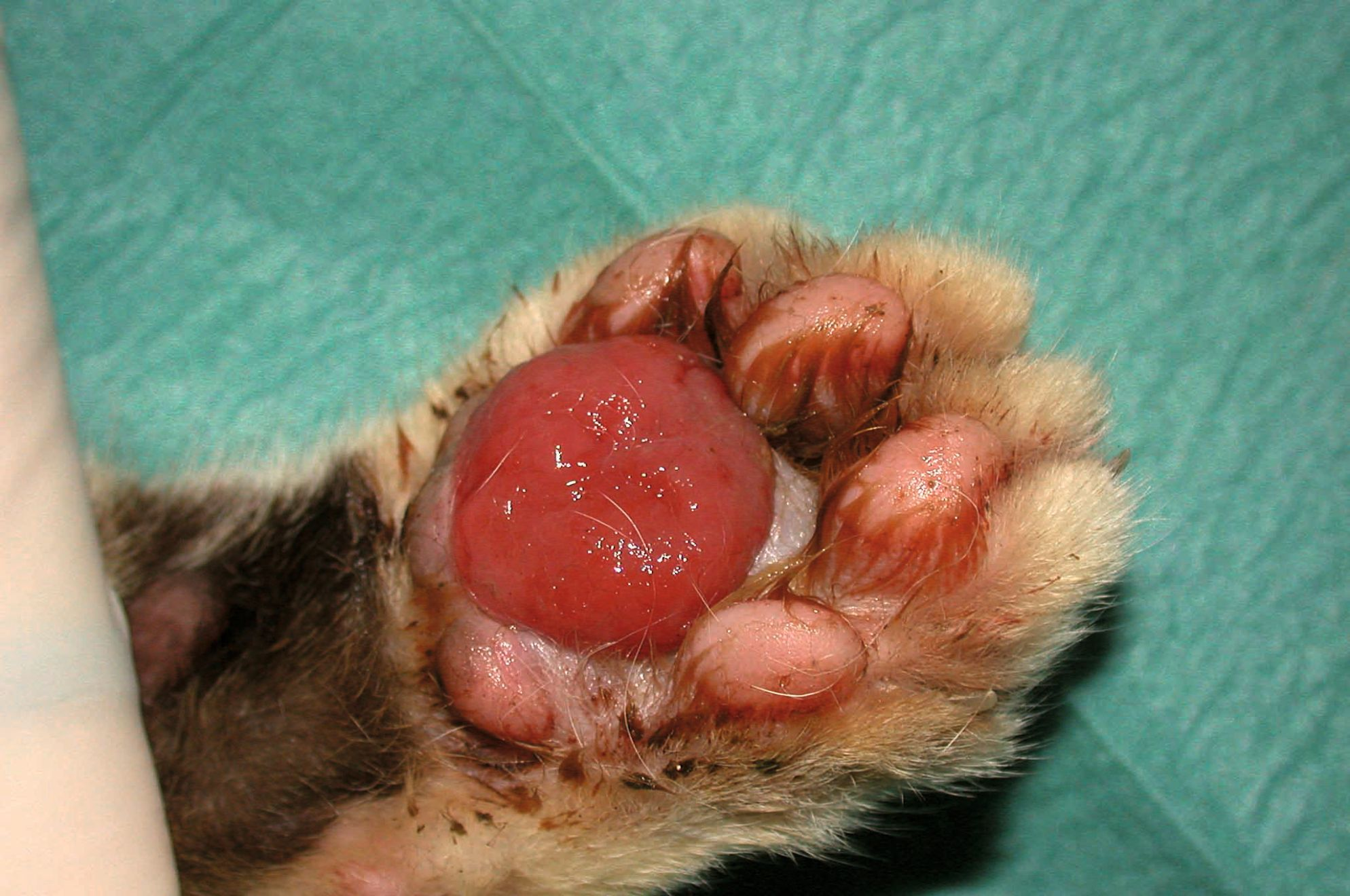
Une pododermatite plasmocytaire se caractérise par un gonflement mou des coussinets centraux, avec ou sans ulcération, et généralement sur plus d’une extrémité des membres. Lorsque cette observation ne s’accompagne pas d’autres lésions dermatologiques, la suspicion doit être très élevée et une aspiration à l’aiguille fine permettra de confirmer le diagnostic.
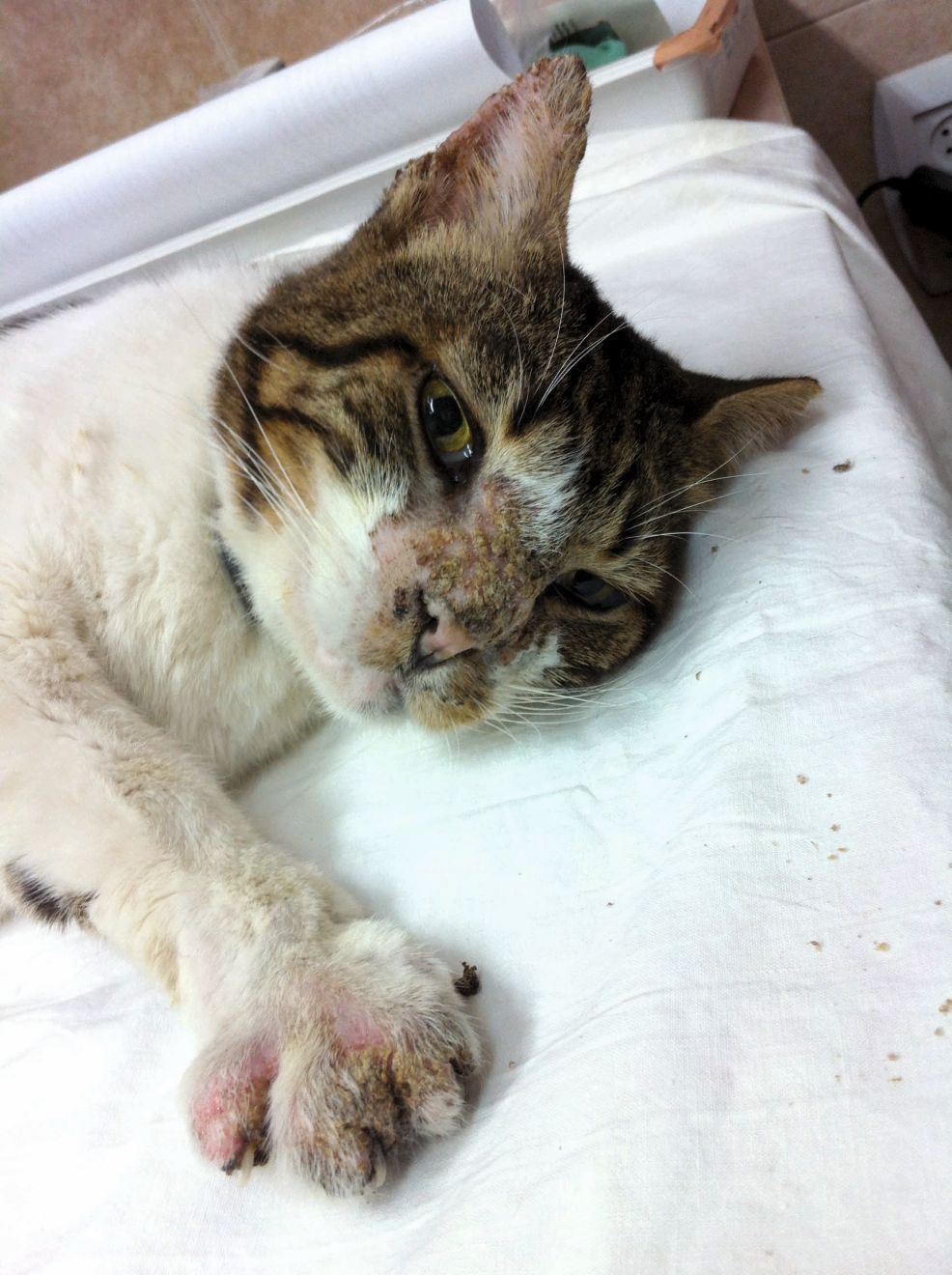

Lorsqu’un chat présente des ulcérations ou des lésions croûteuses des coussinets, un examen dermatologique complet doit être effectué, incluant la cavité buccale, pour vérifier que d’autres parties ne sont pas atteintes.
Granulome éosinophilique
Étiologie et signes cliniques
Le granulome éosinophilique félin (GE) affectant les coussinets est l’une des trois présentations courantes du complexe granulome éosinophilique félin (CGEF) [9] [10] [11]. Le granulome éosinophilique est un schéma réactionnel cutané mais représente rarement le diagnostic final. Bien que l’étiopathogénie exacte du CGEF ne soit pas claire, la plupart des données indiquent une hypersensibilité sous-jacente aux insectes (principalement aux puces) ou aux allergènes environnementaux, ou une hypersensibilité alimentaire. Certains cas sont idiopathiques bien qu’une base génétique puisse également être envisagée [9] [10] [11] [12].
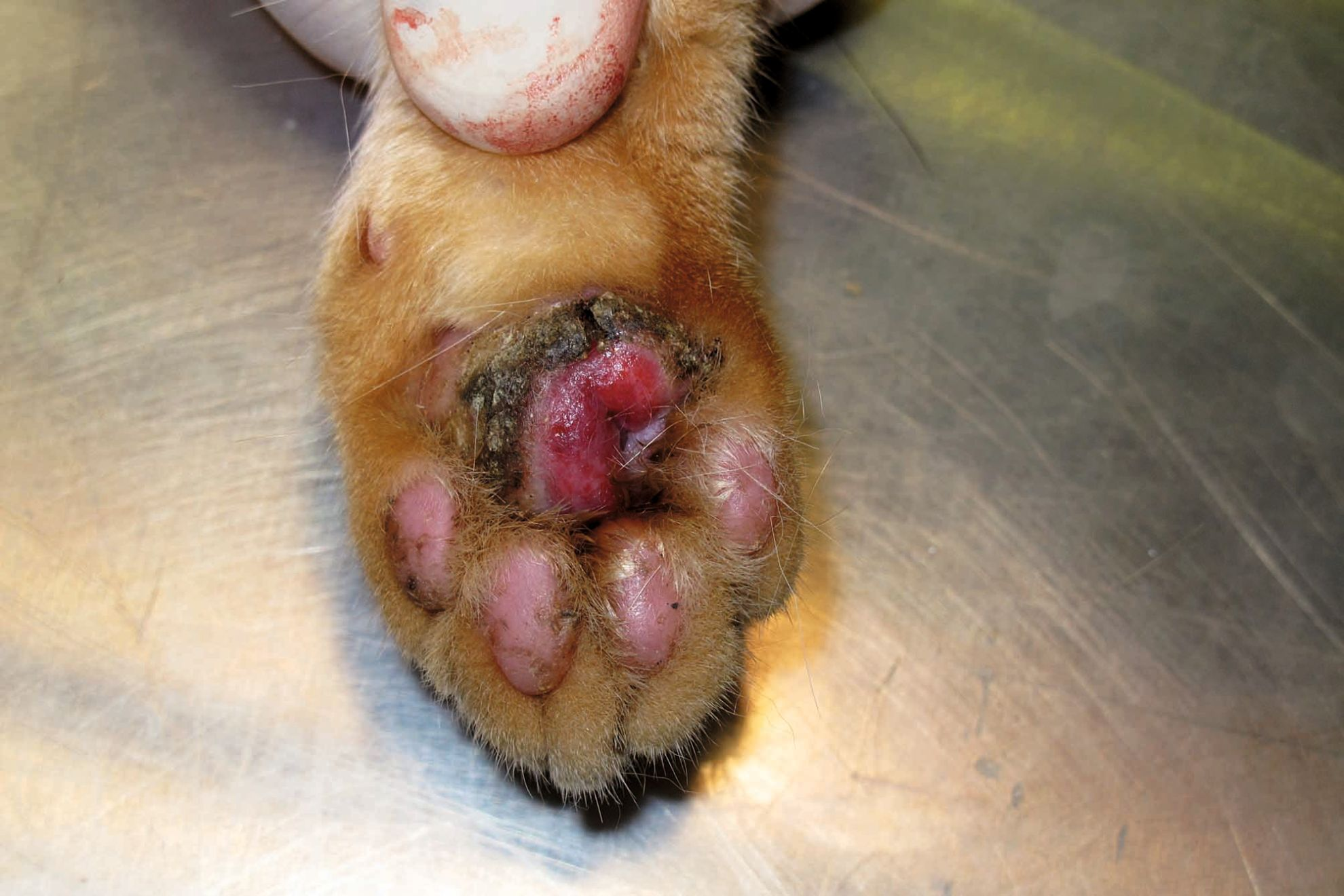
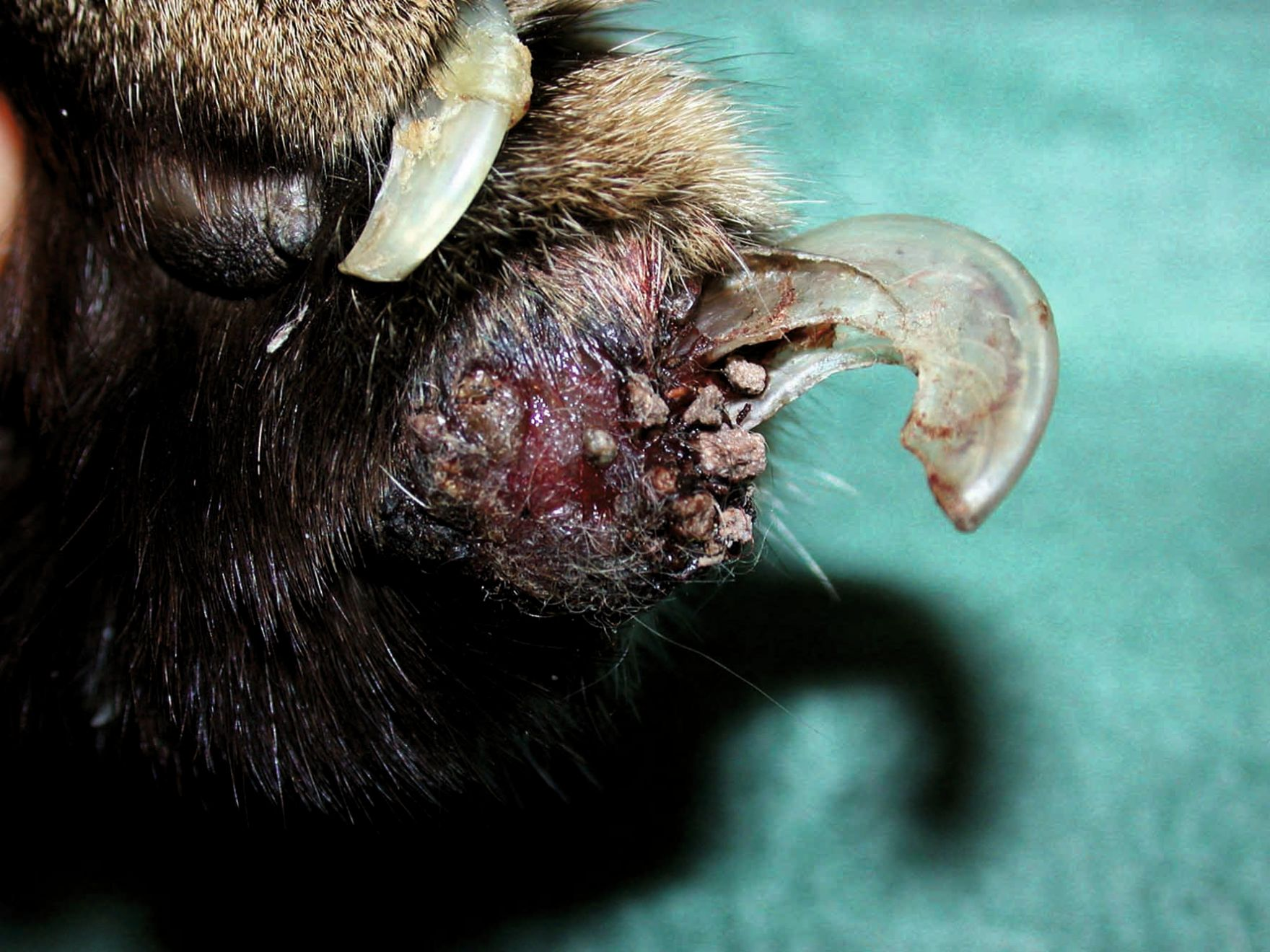
À l’exclusion des formes héréditaires, qui se manifestent à un âge précoce [9] [10] [12], il n’existe aucune prédisposition de race, de sexe ou d’âge pour le GE [9] [10] [11]. La présentation clinique est très variable car les lésions peuvent apparaître n’importe où sur le corps, même dans la cavité buccale. Elles sont généralement non prurigineuses, bien délimitées, surélevées à nodulaires, érythémateuses à jaune-orangé et parfois ulcérées [9] [10] [11]. Les lésions des coussinets plantaires sont généralement croûteuses et ulcérées (Figure 5). Une éosinophilie peut être présente mais ce n’est pas une caractéristique diagnostique [9] [10] [11]. Une étude récente a décrit des lésions de GE atypiques affectant plusieurs extrémités des membres chez deux chats de la même portée [12].
Diagnostic
Lorsqu’un chat présente des lésions croûteuses ou ulcérées des coussinets, un examen dermatologique complet doit être effectué, incluant la cavité buccale, pour vérifier que d’autres régions ne sont pas affectées. Des lésions caractéristiques à d’autres endroits feront suspecter un GE. Les chats affectés peuvent également présenter simultanément d’autres lésions éosinophiliques ou une dermatite miliaire, renforçant alors encore la suspicion d’une maladie éosinophilique [9] [10] [11]. Des frottis provenant de lésions ulcérées ou de prélèvements sous les croûtes ou une AAF dans une lésion nodulaire faciliteront le diagnostic ; les résultats montrent généralement une réaction inflammatoire mixte avec un infiltrat à prédominance éosinophile [9] [10]. L’éosinophilie tissulaire confortera l’hypothèse de GE mais ne suffit pas au diagnostic : une évaluation histologique est nécessaire pour le confirmer [9] [10] [11].
Le diagnostic différentiel des lésions des coussinets dues à un GE inclut : les tumeurs (carcinome épidermoïde et tumeur mastocytaire), les granulomes infectieux (folliculite et furonculose bactériennes, mycobactéries, dermatophytes ou infection fongique profonde), un abcès, une infection par le virus cowpox, une réaction à un corps étranger et le granulome stérile [9] [10] [11]. Le diagnostic de certitude sera donné par l’histopathologie, qui doit obligatoirement être pratiquée sur une lésion nodulaire isolée pour exclure une tumeur ou un corps étranger. Les caractéristiques histopathologiques consistent en une dermatite granulomateuse nodulaire à diffuse, avec un infiltrat éosinophile important et des zones collagéniques multifocales entourées d’éosinophiles dégranulés, appelées « figures en flamme » [9] [10] [11]. Une fois le diagnostic de GE confirmé, il convient de tout mettre en œuvre pour identifier l’étiologie sous-jacente.
Traitement
Comme pour la pyodermite plasmocytaire (PP), le pronostic d’un GE varie et une résolution spontanée est possible. Dans les cas où une cause sous-jacente est identifiée et gérée avec succès (par exemple les puces ou une hypersensibilité alimentaire), le pronostic est très bon tant que les facteurs déclenchants incriminés peuvent être évités. Dans les cas idiopathiques ou atopiques, un traitement à vie est nécessaire [9] [10] [11]. Le traitement repose sur l’immunomodulation, soit l’administration orale de prednisolone à 1-2 mg/kg par jour, en jours alternés si possible. Des doses plus élevées (jusqu’à 4 mg/kg) peuvent parfois être nécessaires et certains cas répondront mieux à la dexaméthasone à raison de 0,1-0,2 mg/kg (en diminuant jusqu’à une dose d’entretien de 0,05-0,1 mg/kg q72h) ou à la triamcinolone à la dose de 0,2-0,3 mg/kg par jour. L’objectif reste toujours de maintenir le chat à la dose la plus faible possible et, plus important encore, à la fréquence d’administration la plus basse possible tout en veillant à son confort [9] [10] [11]. Il faut tout faire pour éviter les injections d’acétate de méthylprednisolone en raison du risque élevé d’effets secondaires, associé à l’impossibilité d’interrompre le traitement en cas d’effets indésirables et au fait que des doses plus élevées peuvent devenir nécessaires lorsque la réponse est insuffisante [9]. Les effets secondaires des glucocorticoïdes sont moins fréquents que chez le chien mais incluent les risques de polydipsie polyphagie, prise de poids, diabète sucré, infections urinaires, hyperadrénocorticisme iatrogène et syndrome de fragilité cutanée, insuffisance cardiaque congestive, démodécie et dermatophytose [9] [10].
La cyclosporine, à raison de 7-7,5 mg/kg q24h, s’est également révélée efficace pour le GE [9] [10] [11]. En raison d’une phase de latence de 2 à 3 semaines, le traitement doit se poursuivre pendant au moins 4 semaines, puis diminuer progressivement pour passer en jours alternés lorsque cela est possible, certains cas pouvant être contrôlés avec une administration toutes les 72 heures. Les effets secondaires sont peu fréquents, bien que 25 % des chats présentent des signes digestifs transitoires, notamment des vomissements et de la diarrhée. Selon l’expérience de l’auteur, la co-administration de maropitant (2 mg/kg) pendant les 2 à 3 premières semaines et/ou l’augmentation progressive de la dose quotidienne de cyclosporine peuvent limiter le risque de vomissements. Les autres effets indésirables décrits sont la perte de poids et (rarement) l’hyperplasie gingivale, l’hypersalivation, l’anorexie et la lipidose hépatique [9] [10]. Les chats recevant de la cyclosporine doivent être négatifs au FIV et au FeLV et ne doivent pas être autorisés à chasser ou à manger de la viande crue, en raison du risque de développer une toxoplasmose potentiellement mortelle.
Pemphigus foliacé
Étiologie et signes cliniques
Le pemphigus foliacé (PF) est la maladie auto-immune cutanée la plus fréquente chez le chat : elle représente près de 1 % de tous les cas examinés par les dermatologues [1]. Il s’agit d’une dermatose pustuleuse, érosive et croûteuse qui touche la face, les oreilles et les extrémités des membres. Les rechutes sont fréquentes et la plupart des cas nécessitent un traitement à long terme, qui doit être adapté à chaque patient [13] [14] [15] [16] [17] [18].
La plupart des cas semblent être idiopathiques, le reste résultant de réactions aux médicaments et aux vaccins [13] [14] [15] [16], d’un thymome [14] [15] [16] ou d’une leishmaniose [14]. La maladie est caractérisée par la production d’auto-anticorps contre les jonctions intercellulaires reliant les cellules de l’épiderme superficiel et l’épithélium folliculaire, appelées desmosomes. Il en résulte une perte d’adhérence entre les cellules et la formation de cellules acantholytiques qui s’accumulent dans des pustules sous-cornéennes et intra-épidermiques, pouvant éventuellement former des croûtes ; celles-ci sont responsables de l’aspect clinique classique de la maladie [13] [14] [15] [16]. Bien que des auto-anticorps (IgG) anti-kératinocytes circulants ou présents au niveau des tissus soient détectés chez la majorité des chats atteints de PF, le mécanisme pathologique exact reste à découvrir et le principal auto-antigène cible chez les chats est encore inconnu [14] [15] [16] [17] [18].
L’âge médian d’apparition est de 6 ans, avec une fourchette de 0,25 à 16 ans [13] [14] [15] [16] [17] [18]. Les chats européens sont surreprésentés, la prédisposition sexuelle n’a pas été confirmée mais deux études récentes suggèrent que les femelles pourraient être légèrement plus sujettes à cette maladie [13] [14].
Le PF se présente comme une maladie pustulaire bilatérale symétrique mais, comme les pustules se rompent facilement, les signes cliniques typiques comprennent des croûtes, des érosions, des ulcérations, des érythèmes et de l’alopécie (Figure 6). Dans la majorité des cas, les lésions concernent plus d’une région du corps, notamment la tête ou la face, les replis unguéaux et les pattes et les coussinets [13] [14] [15] [16] [17] [18]. Dans certains cas, seuls les replis unguéaux sont affectés, ce qui justifie l’hypothèse d’un PF chez un chat présentant une paronychie érosive, exsudative et/ou croûteuse affectant la majorité des doigts [14], au point que les doigts sont parfois écartés (Figure 7). Le prurit est variable et, dans plus de la moitié des cas, des signes systémiques sont présents : léthargie, pyrexie et anorexie [13] [14] [15] [16] [17] [18]. La boiterie et la douleur sont fréquentes en cas de lésions graves des coussinets. Les analyses clinicopathologiques mettent parfois en évidence une leucocytose, une neutrophilie, une hyperglobulinémie ou une anémie [13] [15].
Diagnostic
En présence de signes cliniques typiques, le plus souvent des pustules et des croûtes affectant plusieurs régions du corps de manière symétrique, ou plusieurs doigts, une cytologie sera réalisée à partir des pustules ou sous les croûtes. Les observations caractéristiques incluent des cellules acantholytiques (kératinocytes arrondis avec un cytoplasme sombre, ressemblant à un « œuf au plat ») avec des neutrophiles intacts et parfois des éosinophiles [15] [16] [17] [18] (Figure 8).
Le diagnostic définitif sera basé sur des biopsies de pustules entières ou, lorsqu’une pustule ne peut être prélevée, de croûtes. Les résultats histopathologiques typiques montrent des croûtes qui s’étendent souvent sur plusieurs follicules pileux, des pustules sous la couche cornée ou intragranulaires, de nombreux kératinocytes acantholytiques et un infiltrat dermique à prédominance neutrophile souvent accompagné d’éosinophiles, de mastocytes et de plasmocytes [13] [14] [15] [16] [17] [18].
Traitement
Le pronostic du PF félin est favorable : la majorité des chats présentent une rémission quelques semaines après le début du traitement [13] [14] [15] [16] [17] [18]. Il est important de noter que la maladie est considérée comme contrôlée lorsque les lésions ne sont plus actives et que les lésions initiales cicatrisent, sans voir forcément tous les signes disparaître [14]. La plupart des chats répondent très bien à la monothérapie aux glucocorticoïdes, soit en général la prednisolone à une dose initiale de 2-4 mg/kg par jour, mais la plupart des cas documentés répondent à une dose inférieure. Les autres options comprennent la triamcinolone par voie orale (0,2-0,6 mg/kg) ou la dexaméthasone (0,1-0,2 mg/kg). Il est recommandé de diminuer la dose (de 20 à 25 % toutes les 2 à 4 semaines) une fois que la maladie est stabilisée depuis au moins 2 semaines et que la plupart des lésions cutanées initiales ont guéri [14] [15] [17] [18].
Parmi les médicaments non stéroïdiens cités comme pouvant aider à contrôler la maladie chez le chat, il y a la cyclosporine (5-10 mg/kg par jour) et le chlorambucil (0,1-0,3 mg/kg par jour) ; ils sont recommandés lorsque les glucocorticoïdes seuls ne donnent pas de résultats, lorsqu’ils entraînent des effets secondaires graves ou quand la posologie ne peut pas être diminuée [14] [15] [16] [17] [18]. La plupart des chats ont besoin d’un traitement à long terme en raison de la fréquence élevée des récidives associées à la diminution progressive ou à l’arrêt du traitement, mais elles peuvent également survenir dans des cas bien contrôlés [13] [14] [15] [16] [17] [18].
Les propriétaires doivent être informés de ce risque dès le moment du diagnostic et il convient de discuter avec eux des différents protocoles de traitement et des effets secondaires.
Conclusion
Tout chat présentant des lésions des coussinets doit subir un examen dermatologique et clinique complet. Lorsque seuls les coussinets sont atteints, le diagnostic différentiel inclura la pododermatite plasmocytaire (PP), le syndrome « poumon-doigt » (SPD) et, dans une moindre mesure, le granulome éosinophile félin (GE) qui, occasionnellement, n’affecte que les extrémités des membres. L’aspect des lésions et les résultats de l’aspiration à l’aiguille fine (AAF) orienteront le diagnostic. Si d’autres régions corporelles sont touchées, un pemphigus foliacé (PF) et une hypersensibilité aux piqûres de moustiques (HPM) seront envisagés. GE, HPM et PF vont affecter plus typiquement d’autres régions du corps mais le pemphigus foliacé (PF) présentera généralement une localisation bilatérale symétrique des pustules et des croûtes. A contrario, le granulome éosinophile (GE) aura une distribution sporadique des lésions et celles de l’hypersensibilité aux piqûres de moustiques seront localisées sur les zones peu couvertes de poils. Enfin, les signes systémiques sont plus communs en cas de PF. Le diagnostic définitif repose sur l’histopathologie et, bien que le traitement fasse en général appel à l’immunomodulation, il sera différent pour chaque maladie, tout comme le pronostic.
Ronnie Kaufmann
BSc, Dr Vétérinaire, Dipl. ECVD
Le Dr Kaufmann est diplômée de l’École vétérinaire de l'Université hébraïque de Jérusalem depuis 2006 ; elle a travaillé en clientèle généraliste pendant trois ans avant de retourner à l'École de médecine vétérinaire Koret pour un résidanat en dermatologie. Elle y est ensuite devenue clinicienne et enseignante avant de prendre la direction du département de dermatologie en 2017. Ses principaux domaines d'intérêt sont la straelensiose* chez les animaux de compagnie et les affections dermatologiques génétiques
Références
- Scott DW, Miller WH, Erb HN. Feline dermatology at Cornell University: 1407 cases (1988-2003). J Feline Med Surg 2012;15(4):307-316.
- Cain CL, Mauldin EA. Diagnostically Challenging Dermatoses of Cats. In: Little SE (ed.) August's Consultations in Feline Internal Medicine Vol. 7. 1st ed. St Louis, MO; WB Saunders 2016;295-306.
- Banovic F. Immune-Mediated Diseases. In: Noli C, Colombo S (eds.) Feline Dermatology. 1st ed. Switzerland AG, Springer Nature 2020;511-530.
- Guaguere E, Prelaud P, Degorce‐Rubiales F, et al. Feline plasma cell pododermatitis: a retrospective study of 26 cases. Vet Dermatol 2004;15:27.
- Scarampella F, Ordeix L. Doxycycline therapy in 10 cases of feline plasma cell pododermatitis: clinical, haematological and serological evaluations. Vet Dermatol 2004;15:27.
- Bettenay SV, Mueller RS, Dow K, et al. Prospective study of the treatment of feline plasmacytic pododermatitis with doxycycline. Vet Rec 2003;152:564-566.
- Bettenay SV, Lappin MR, Mueller RS. An immunohistochemical and polymerase chain reaction evaluation of feline plasmacytic pododermatitis. Vet Pathol 2007;44:80-83.
- Pereira PD, Faustino AMR. Feline plasma cell pododermatitis: a study of 8 cases. Vet Dermatol 2003;14:333-337.
- Buckley L, Nuttall T. Feline eosinophilic granuloma complexities: some clinical clarification. J Feline Med Surg 2012;14:471-481.
- Bloom PB. Canine and feline eosinophilic skin diseases. Vet Clin North Am Small Anim Pract 2006;36:141-160.
- Miller WH, Griffin CE, Campbell KL. Miscellaneous skin diseases. In: Muller and Kirk's Small Animal Dermatology. 7th ed. Philadelphia, WB Saunders, 2013;695-723.
- Pressanti C, Cadiergues MC. Feline familial pedal eosinophilic dermatosis in two littermates. J Feline Med Surg 2015;1(1):2055116915579683.
- Jordan TJM, Affolter VK, Outerbridge CA, et al. Clinicopathological findings and clinical outcomes in 49 cases of feline pemphigus foliaceus examined in Northern California, USA (1987-2017). Vet Dermatol 2019;30:209-219.
- Bizikova P, Burrows A. Feline pemphigus foliaceus: original case series and a comprehensive literature review. BMC Vet Res 2019;22:1-15.
- Preziosi DE. Feline pemphigus folliaceus. Vet Clin Small Anim 2019;49:95-104.
- Olivry T. A review of autoimmune skin diseases in domestic animals: 1 superficial pemphigus. Vet Dermatol 2006;17:291-305.
- Bizikova P. Autoimmune Diseases. In: Noli C, Colombo S (eds.) Feline Dermatology. 1st ed. Switzerland AG, Springer Nature 2020;495-509.
- Klinger CJ, Mueller RS. Pemphigus foliaceus in feline patients. Vet Focus 2018;28.1:15-19.
- Mason K. Mosquito-byte Hypersensitivity. In: Noli C, Colombo S (eds.) Feline Dermatology. 1st ed. Switzerland AG Springer Nature, 2020;489-494.
- Goldfinch N, Argyle D. Feline lung-digit syndrome: unusual metastatic patterns of primary lung tumors in cats. J Feline Med Surg 2012;14:202-208.
- Sugiyama H, Maruo T, Shida T, et al. Clinical findings in lung-digit syndrome in five cats. J Jpn Vet Cancer Soc 2010;1(1):8-13.
- Thrift E, Greenwell C, Turner AL, et al. Metastatic pulmonary carcinomas in cats (feline lung-digit syndrome): further variations on a theme. J Feline Med Surg open rep 2017;1-8.
- van der Limde-Sipman JS, van den Ingh TS. Primary and metastatic carcinomas in the digits of cats. Vet Q 2010;3:141-145.
- Wobeser BK, Kidney BA, Powers BE, et al. Diagnoses and clinical outcomes associated with surgically amputated feline digits submitted to multiple veterinary diagnostic laboratories. Vet Pathol 2007;44:362-365.
Autres articles de ce numéro
Partager sur les réseaux sociaux