Transplantation rénale chez le chat
La transplantation rénale a été lancée aux Etats-Unis comme une option thérapeutique dans le cadre des maladies rénales félines mais elle reste réservée aux spécialistes. Lillian Aronson passe en revue la technique, les aspects éthiques et les pièges éventuels dans cet article, qui pourra aussi être utile aux vétérinaires généralistes s’occupant des petits animaux.

Points clés
La transplantation rénale peut être une option valable pour certains chats souffrant d'insuffisance rénale aiguë et chronique.
Une sélection rigoureuse des cas est essentielle lors de l'évaluation des patients, pour prévenir des complications engageant le pronostic vital.
L'immunosuppression postopératoire à vie consiste à associer un inhibiteur de la calcineurine, la cyclosporine, et un glucocorticoïde, la prednisolone.
Pour des raisons éthiques, le propriétaire du chat transplanté s'engage à adopter le donneur.
Introduction
La transplantation rénale chez le chat est de mieux en mieux acceptée comme une option thérapeutique pour les patients présentant une insuffisance rénale chronique précoce et décompensée, ainsi que pour ceux souffrant d'une insuffisance rénale aiguë irréversible. Depuis son apparition en médecine vétérinaire en 1987, entre 600 et 700 transplantations rénales félines auraient été réalisées dans différentes structures aux Etats-Unis. La réalisation de cette opération chez le chat a été rendue possible grâce à un certain nombre de facteurs, dont : l'utilisation de la cyclosporine pour la thérapie immunosuppressive, le développement et le perfectionnement de techniques microchirurgicales spécifiques à cette procédure et le recours à un allogreffon issu d'un donneur non apparenté ou apparenté [1]. Une transplantation réussie peut faire disparaître les signes cliniques précédemment associés à la maladie rénale du patient, favoriser la prise de poids, améliorer la qualité de vie globale du patient et augmenter son espérance de vie par rapport à une prise en charge médicale de l'affection [2].
Information du propriétaire
Il est important que les propriétaires comprennent que la transplantation rénale chez un chat a des conséquences financières et souvent émotionnelles, et que l’importance de la prise en charge postopératoire à long terme ne doit pas être pas sous-estimée. Le but de l'intervention est d'améliorer la qualité de vie du patient mais ce n'est pas un remède et des complications peuvent survenir. De plus, bien que les traitements médicaux (réhydratation liquidienne sous-cutanée, alimentation spéciale pour la fonction rénale, traitement hormonal pour stimuler la production de globules rouges, chélateurs du phosphate, médicaments antihypertenseurs et protecteurs gastro-intestinaux) peuvent souvent être interrompus après la transplantation, une thérapie immunosuppressive à vie est nécessaire pour prévenir le rejet de l'allogreffe. Le propriétaire doit être informé des risques de l'intervention et averti du fait que son animal peut être refusé comme candidat potentiel s’il est difficile à soigner ou s'il échoue aux tests de sélection lors de l’examen médical. Les engagements financiers comprennent les coûts induits par l’hospitalisation initiale du receveur et du donneur, ainsi que les frais à prévoir une fois que le chat quitte la structure de transplantation. Ces frais couvrent les visites répétées chez le vétérinaire pour contrôler les paramètres sanguins et l’état de l’animal, ainsi que le traitement des complications potentielles si elles surviennent. Avant la réalisation de l'intervention, le propriétaire doit désigner un vétérinaire et une clinique qui garantissent un suivi à long terme et qui pourront assurer des soins 24 heures sur 24 en cas de complications. De plus, quel que soit le résultat, le propriétaire s’engage à adopter le chat donneur et lui fournir un foyer à vie.
Sélection du receveur et du donneur
Receveur
L’examen approfondi d'un receveur potentiel vise à prévenir des complications éventuelles après l'intervention. Il est généralement effectué par le vétérinaire traitant, en collaboration avec l'équipe de transplantation. Les chats doivent être exempts d'autres maladies, notamment d’infections urinaires récurrentes, de cardiopathies importantes et de néoplasie sous-jacente, et être négatifs vis-à-vis du virus de la leucose féline [FeLV] et de l'immunodéficience féline [FIV]. Une urolithiase à oxalate de calcium, une maladie inflammatoire intestinale et/ou des antécédents d'infection des voies respiratoires supérieures ne sont en revanche pas des contre-indications à la réalisation de cette procédure ; des chats présentant ces affections ont été transplantés avec succès dans la structure de l'auteure [3].
|
Tableau 1. Evaluation préopératoire d’un chat potentiellement candidat à une transplantation rénale.
Bien que le moment exact de l'intervention fasse encore débat, l'auteure recommande d’intervenir chirurgicalement chez les patients souffrant d'une insuffisance rénale aiguë irréversible, ou chez ceux souffrant d'une maladie chronique et qui montrent des signes de décompensation tels qu’une perte constante de poids et une aggravation de l'azotémie et de l'anémie en dépit de la prise en charge médicale [4] [5]. Il est important de noter que l’état de certains patients cliniquement stables peut se détériorer rapidement et le décès peut intervenir sans signes avant-coureurs de décompensation. Bien qu'il n'y ait pas de limite d'âge fixée pour l'intervention, une association entre l'âge du receveur et la durée de survie est apparue : une première étude a montré un taux de mortalité plus élevé chez les chats de plus de 10 ans pendant les 6 premiers mois après l'opération et une seconde a mis en évidence une diminution de la durée médiane de survie avec l'âge [2] [6].
L'évaluation actuelle d'un receveur potentiel comprend des analyses de laboratoire (groupe sanguin et compatibilité, hémogramme et bilan biochimique, évaluation thyroïdienne), une évaluation de la fonction urinaire (analyse et culture d'urine, protéines urinaires, ratio créatinine/protéines urinaires, radiographie et échographie abdominales), l’évaluation de la fonction cardiaque (radiographie thoracique, électrocardiographie, échocardiographie et mesure de la pression artérielle), le dépistage des maladies infectieuses (FeLV, FIV), ainsi qu’un dépistage sérologique de la toxoplasmose [IgG et IgM]) (Tableau 1). Si le patient vient de loin, un échantillon de sang peut être préalablement envoyé pour un test de compatibilité croisée avec des donneurs potentiels, afin de déterminer si un donneur compatible est disponible.
Donneur
Dans la structure où travaille l'auteure, une colonie de donneurs est entretenue, composée de jeunes chats en bonne santé (généralement âgés de 1 à 3 ans) adoptés dans un refuge local. Une fois qu'un donneur est attribué à un receveur spécifique, le propriétaire du chat receveur s’engage à adopter le chat donneur et à lui assurer un foyer à vie. Le bien-être du chat donneur est de la plus haute importance pour l'équipe de transplantation. Les personnes qui travaillent dans ce domaine sont conscientes des implications éthiques de la procédure. Il faut tenir compte des conséquences et des souffrances potentiellement liées à l’opération ainsi que de ses effets sur l’espérance de vie du chat. Pour répondre à ces préoccupations, une vaste étude rétrospective a été réalisée dans cet établissement en 2016, portant sur la morbidité péri-opératoire et les suites à long terme d'une néphrectomie unilatérale pratiquée chez 141 donneurs de rein [7]. Les résultats indiquent que la morbidité péri-opératoire était suffisamment faible pour être acceptable ; la durée médiane d’hospitalisation était de 3,6 jours. Un suivi à long terme fut réalisé pour 99 chats ; l'âge médian de ces chats au moment du suivi était de 12,2 ans. Trois chats avaient présenté des signes de maladie rénale chronique stable (médiane : 6,2 ans après l'opération) et deux chats avaient été traités avec succès pour une maladie rénale aiguë, 4 et 6 ans après l'opération. Deux chats sont morts d'insuffisance rénale chronique 12 et 13 ans après l'opération et quatre chats ont développé une obstruction urétérale aiguë suite à une urolithiase à oxalate de calcium, avec une médiane de 7 ans après l'opération. En raison de cette dernière constatation, des radiographies abdominales de routine sont réalisées lors des bilans de santé annuels afin de repérer d’éventuels calculs et de pouvoir les traiter avant qu'ils n'entraînent de la morbidité ou de la mortalité.
L'évaluation standard du donneur comprend une angiographie par tomodensitométrie pour évaluer la vascularisation et le parenchyme rénaux, afin de déceler toute anomalie (Figure 1a) (Figure 1b). Les autres tests obligatoires comprennent une numération formule et un typage sanguin complets, un profil biochimique sérique, une analyse et une culture d'urine, ainsi que des tests sérologiques vis-à-vis des virus FeLV, FIV et de la toxoplasmose (IgG et IgM). Un foyer approprié est trouvé pour tout donneur potentiel qui échoue au processus de sélection.
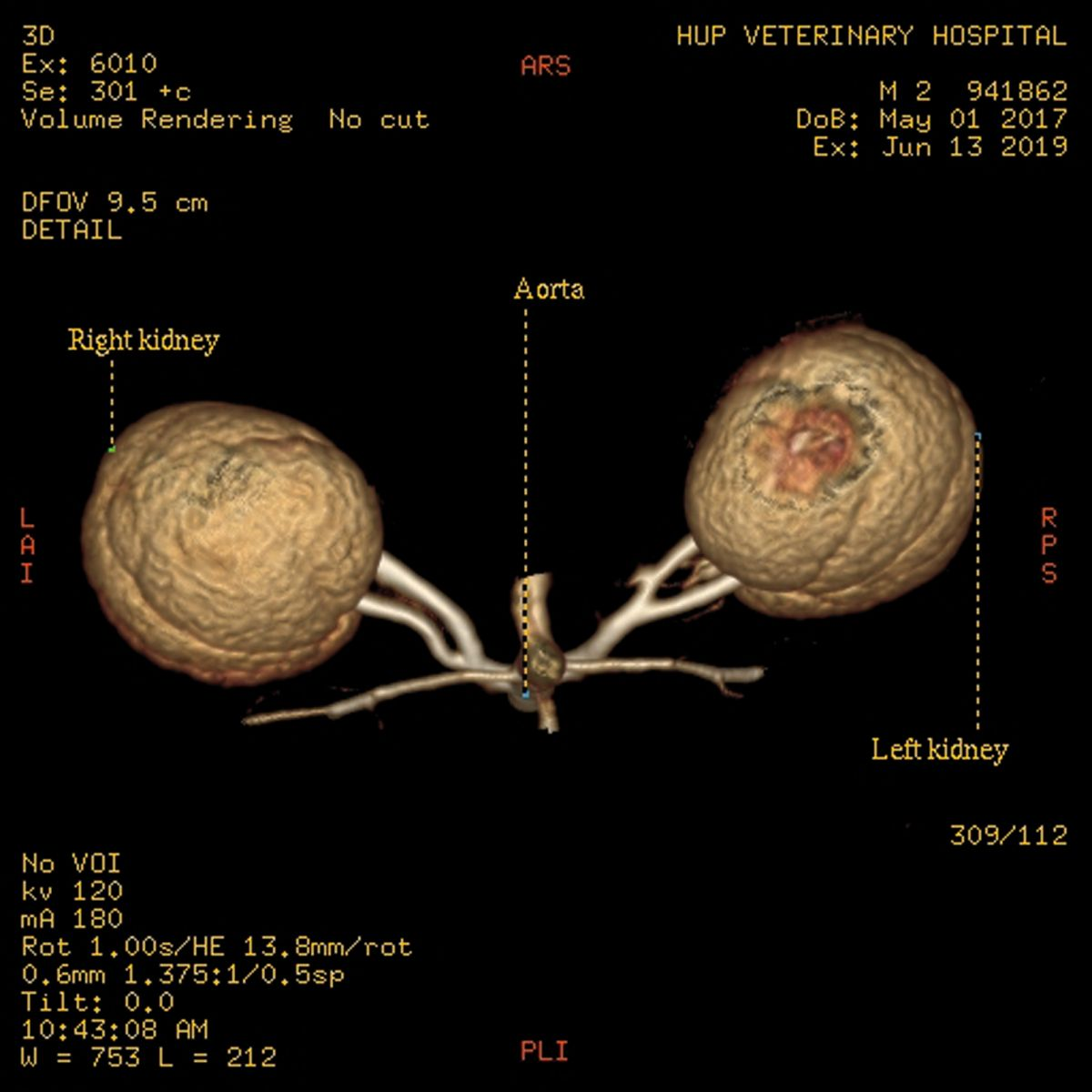
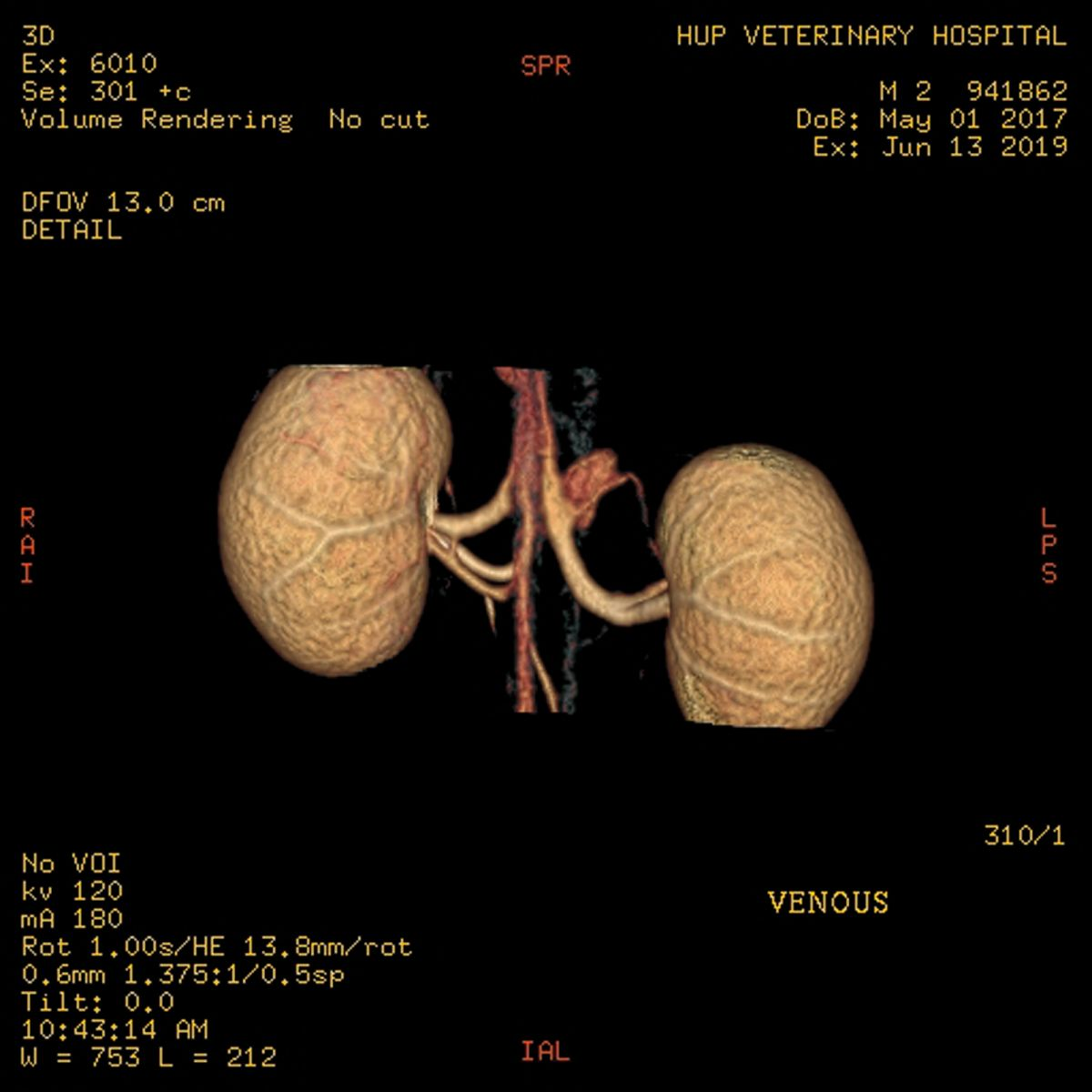
Traitement préopératoire
La prise en charge médicale (qui inclut un régime spécifique pour la fonction rénale, une thérapie liquidienne, des produits sanguins, des protecteurs gastro-intestinaux, des chélateurs du phosphate et un traitement contre l’hypertension) varie selon la stabilité du receveur. Si le patient est anorexique, une sonde naso-gastrique sera mise en place pour faciliter l’alimentation et prévenir la lipidose hépatique. A cause des complications rencontrées avec les sondes d'œsophagostomie chez certains chats recevant un traitement immunosuppresseur chronique, l’auteure déconseille l’usage de ces sondes dans cette population de patients, sauf en cas d'absolue nécessité.
Une transplantation rénale réussie peut faire disparaître les signes cliniques précédemment associés à la maladie rénale, favoriser la prise de poids, améliorer la qualité de vie globale du patient et augmenter son espérance de vie par rapport à une prise en charge médicale de l'affection.
Deux protocoles immunosuppresseurs existent actuellement pour prévenir le rejet de l'allogreffe. Le protocole aujourd’hui utilisé dans l'établissement de l'auteure associe un inhibiteur de la calcineurine, la cyclosporine (CsA), et un corticostéroïde, la prednisolone. Une formulation liquide de cyclosporine est utilisée par voie orale afin de pouvoir ajuster la dose à chaque chat. L’administration de cyclosporine démarre généralement 72 à 96 heures avant la transplantation, tandis que l’administration de prednisolone commence le matin de l'intervention. La concentration sanguine minimale de cyclosporine sur 12 heures est mesurée la veille de l'opération pour ajuster la dose orale prescrite ensuite. La vitamine B12 (administrée par voie intramusculaire) a été utilisée chez certains patients pour faciliter l'absorption gastro-intestinale de la cyclosporine. Pour l'immunosuppression, certains chirurgiens pratiquant des transplantations associent le kétoconazole avec la cyclosporine et la prednisolone, ce qui permet d’administrer les médicaments une fois par jour [8] [9]. Avec ce protocole, la concentration minimale de cyclosporine est mesurée toutes les 24 heures. Si des signes d'hépatotoxicité apparaissent, l'administration de kétoconazole sera interrompue. Si les tests sérologiques (IgM et IgG) sont positifs vis-à-vis de Toxoplasma gondii, de la clindamycine sera administrée en même temps que le traitement immunosuppresseur, pendant toute la vie du chat.
Chirurgie
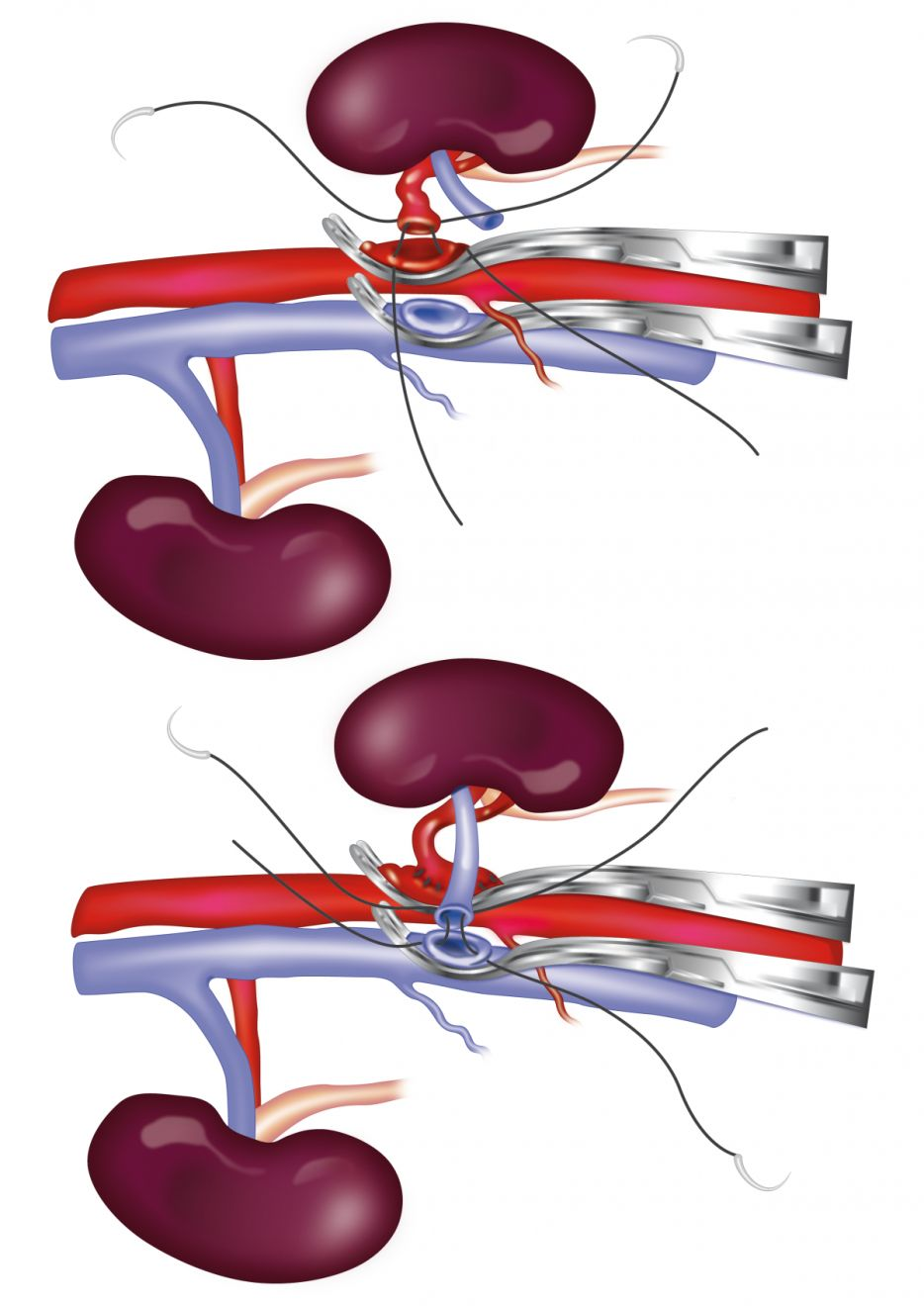
Dans l'établissement de l'auteure, la procédure de transplantation dure environ 6-7 heures et implique une équipe de 3 chirurgiens. Le rein du donneur est préparé pour la néphrectomie. Le rein gauche est préféré parce que la veine est plus longue mais le rein droit peut être utilisé si nécessaire. L'artère et la veine rénales sont dégagées de leur graisse et des adventices, et l’uretère est libéré par dissection jusqu’au point de jonction avec la vessie. Il est essentiel de prélever le rein du donneur avec une seule artère rénale, d'une longueur minimale de 0,5 cm au point de jonction de l'artère avec l'aorte [10]. La néphrectomie est effectuée lorsque le système vasculaire du receveur est prêt à recevoir le rein.
Un microscope chirurgical est utilisé pour réaliser l’essentiel de l’intervention chirurgicale chez le receveur. L'allogreffon est rincé avec une solution de conservation des organes contenant du saccharose et tamponnée par des phosphates, ou une solution saline héparinée. L'artère rénale du donneur est anastomosée de manière terminolatérale à l'aorte abdominale, à l'aide d’un fil de nylon 8-0, avec des points simples et continus. La veine rénale du donneur est anastomosée de manière terminolatérale à la veine cave caudale à l'aide d’un fil de soie 7-0, avec des points simples et continus (Figure 2) [10]. Une fois l'opération terminée, les pinces hémostatiques sont retirées ; une petite hémorragie se produit généralement à ce stade, contrôlable par pression, mais toute fuite importante sera traitée grâce à des sutures supplémentaires.
Une autre technique chirurgicale passe par le stockage du rein du donneur en hypothermie pour le préserver jusqu'à la greffe chez le receveur. Cette technique permet de réduire le personnel et les ressources nécessaires à la transplantation.
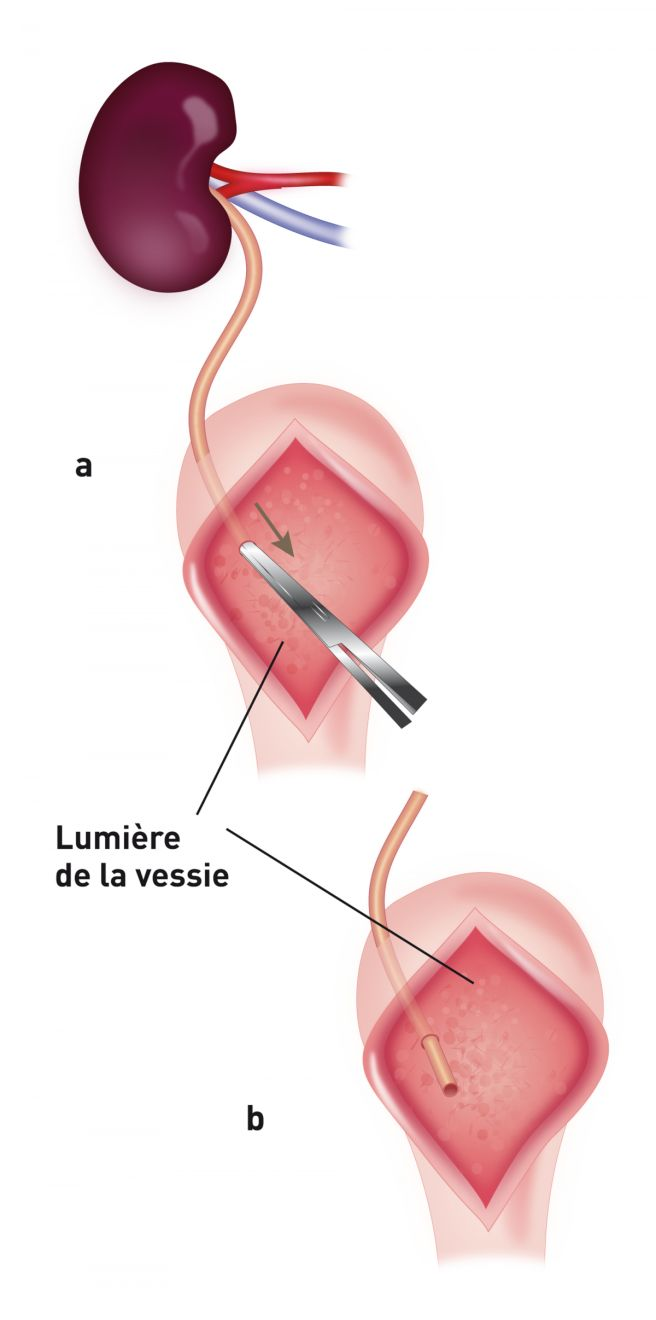
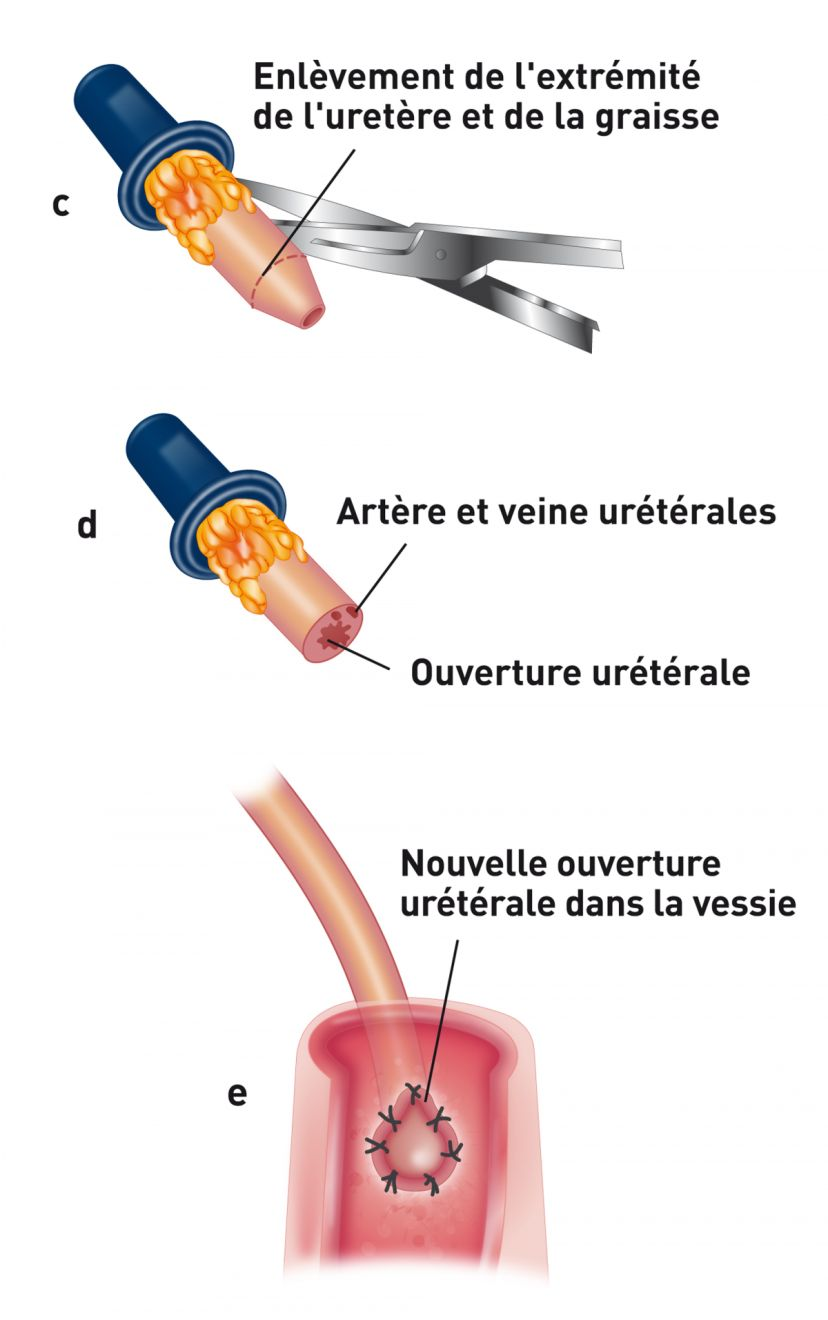
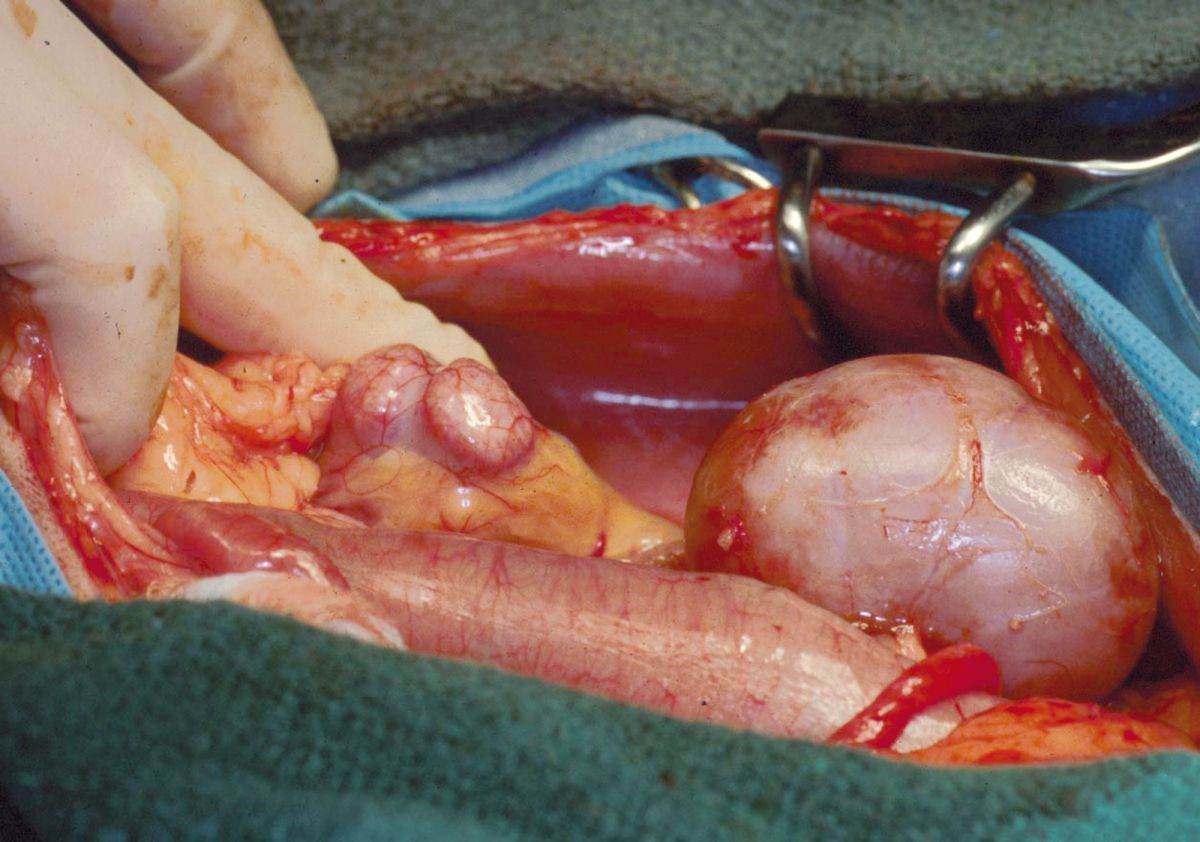
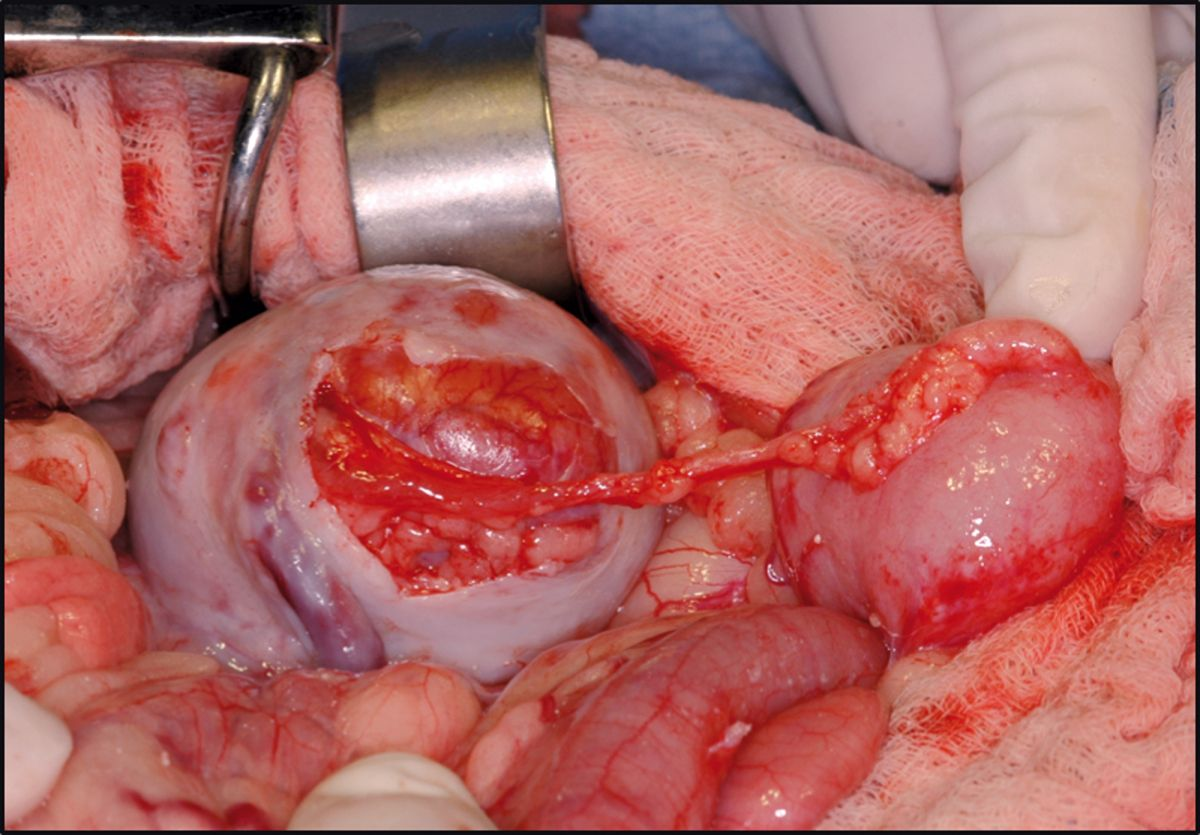
Après la partie vasculaire de l'intervention, l'uretère du donneur est fixé à la vessie par l'une des trois techniques disponibles. Dans l'établissement de l'auteure, une urétéronéocystostomie est effectuée au moyen d'une technique d'apposition intravésiculaire sur la muqueuse. Une cystotomie ventrale de la ligne médiane est effectuée, puis l'extrémité de l'uretère est amenée directement vers l’apex de la vessie. L'extrémité de l'uretère est spatulée et la muqueuse urétérale est suturée à la muqueuse de la vessie en utilisant du nylon 8-0 ou du matériel de suture synthétique résorbable, avec des points simples, discontinus (Figure 3a) (Figure 3b). Avant la fermeture, l'allogreffon est fixé à la paroi abdominale pour éviter la torsion. Les reins du receveur sont habituellement laissés en place pour servir de réserve si le greffon tarde à remplir sa fonction (Figure 4). Comme les patients suivent un traitement immunosuppresseur, la paroi abdominale sera fermée avec du fil non résorbable (polypropylène) pour prévenir la déhiscence de l'incision.
Soins postopératoires
Les soins postopératoires sont adaptés à chaque patient mais incluent généralement une thérapie liquidienne intraveineuse jusqu'à ce que le chat mange et boive, une antibiothérapie, éventuellement des produits sanguins et des analgésiques. Limiter le stress, les manipulations et prévenir l'hypothermie sont essentiels au début de la période postopératoire. L’hématocrite, les protéines totales, les électrolytes, la glycémie et le statut acido-basique sont d'abord évalués 2 à 3 fois par jour pendant les premiers jours, puis quotidiennement jusqu'à la sortie. La pression artérielle indirecte est surveillée toutes les 2 à 4 heures pendant les 48 à 72 premières heures pour détecter l'apparition d’une hypertension. La fonction rénale sera contrôlée toutes les 24-48 heures et le niveau de cyclosporine tous les 3-4 jours, en adaptant la posologie en conséquence. Si nécessaire, un bilan biochimique sanguin et une numération globulaire seront effectués. Les urines sont échantillonnées quotidiennement pour évaluer la densité. Si l'intervention est réussie, l'azotémie se résorbe généralement dans les 24 à 72 heures suivant l'opération. Si aucune amélioration n’intervient, une échographie rénale est recommandée pour évaluer le flux sanguin et détecter tout signe d'obstruction urétérale. Si la perfusion du greffon est adéquate et qu'il n’y a aucun signe d'obstruction, un retard fonctionnel du greffon sera envisagé. Il arrive en effet que la fonction rénale ne s’améliore qu’au cours des premières semaines suivant l'intervention. Si le rein transplanté ne fonctionne pas, une biopsie s’impose avant une nouvelle transplantation.
Suivi à long terme et complications
Au début de la période postopératoire, les patients sont confinés dans une pièce vide ou dans une grande cage pour chien afin de prévenir tout traumatisme susceptible de faire échouer la greffe. Des évaluations hebdomadaires sont recommandées pendant les 6 à 8 premières semaines, puis les contrôles seront espacés, selon la stabilité de l’état de l'animal. A long terme, les patients seront revus par le vétérinaire 3 à 4 fois par an. Lors de chaque examen, le poids et la tension artérielle sont enregistrés. L'évaluation clinique doit inclure la fonction rénale, l’hématocrite, les protéines totales, le taux de cyclosporine et une analyse d'urine s’il est possible d’en recueillir. Si nécessaire, une numération globulaire complète et une analyse biochimique du sérum seront réalisées. Une évaluation par un cardiologue est recommandée tous les 6 à 12 mois au cas où le patient présentait une maladie cardiaque sous-jacente avant la transplantation.
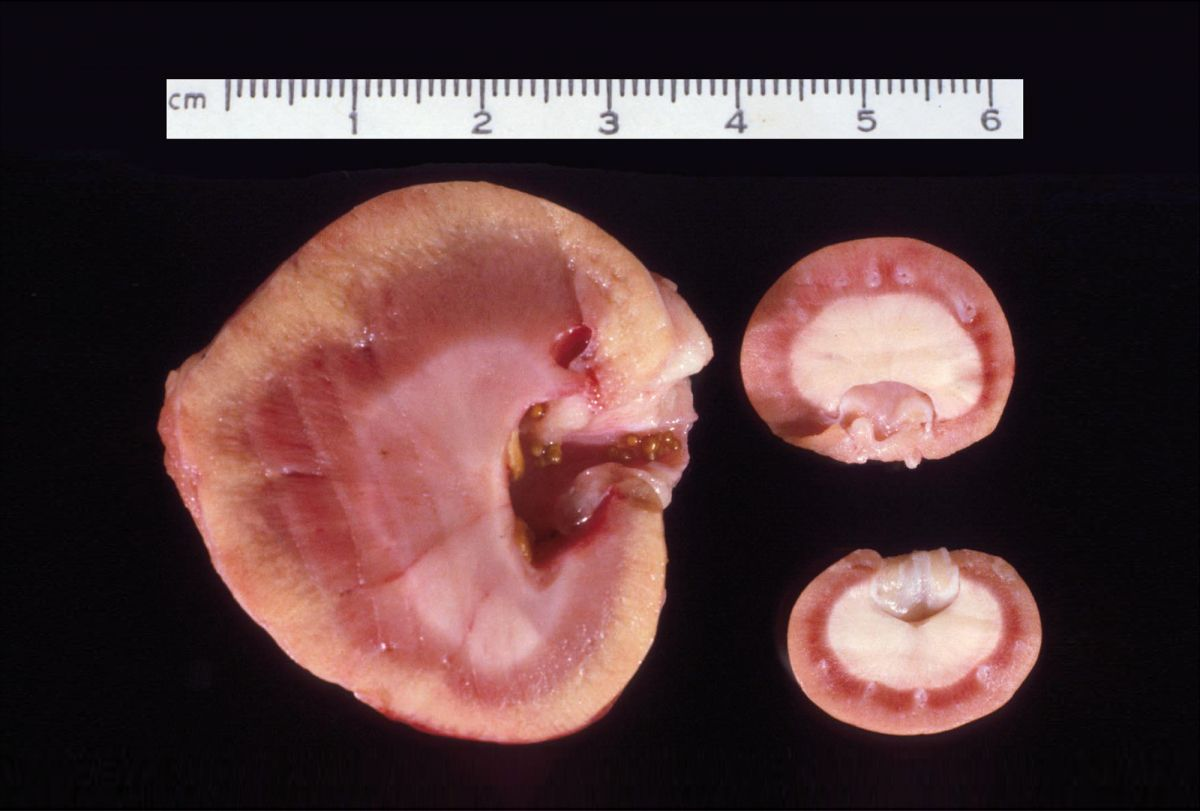
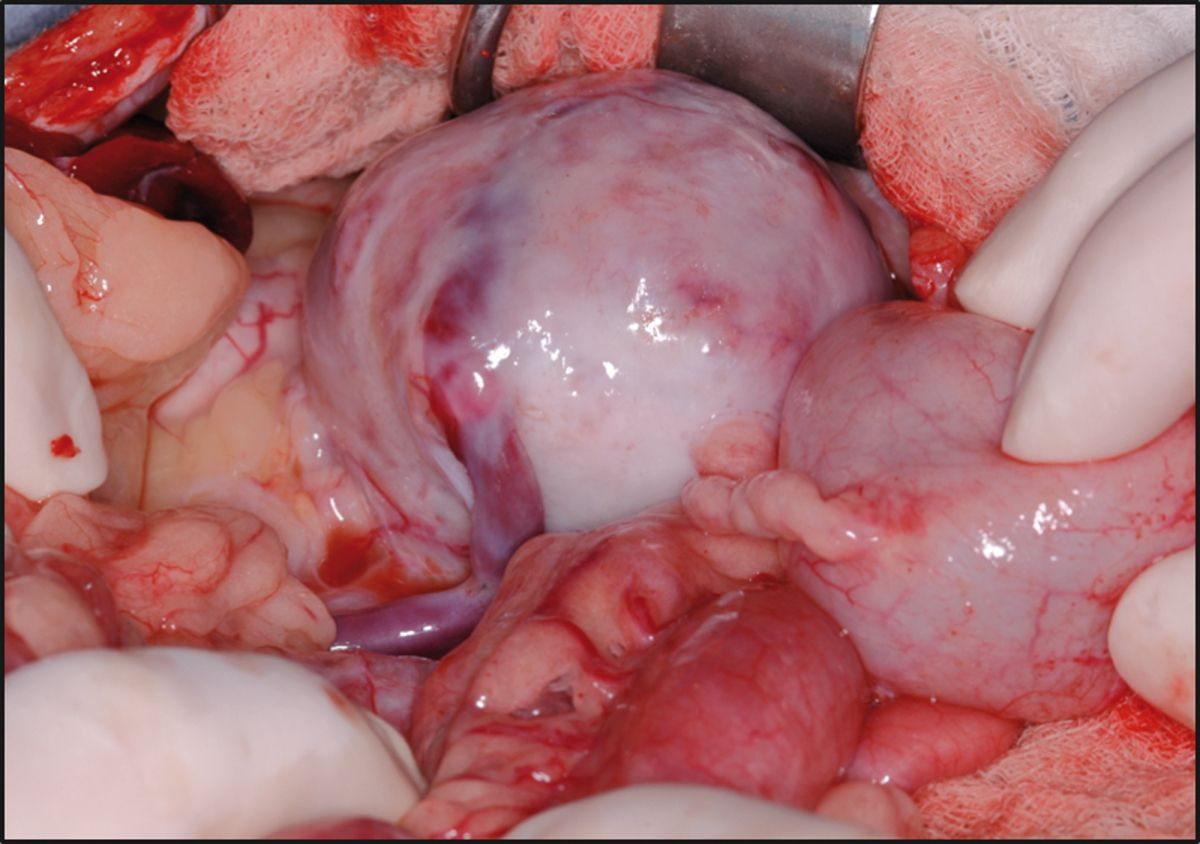
Les complications de l'intervention peuvent être liées à l'allogreffe et au traitement immunosuppresseur à long terme. Des complications techniques peuvent survenir lors de l'opération avec le pédicule vasculaire et la réimplantation urétérale, impliquant d’intervenir à nouveau. Parmi les autres complications directement liées à l'allogreffe, mentionnons le retard fonctionnel du greffon, le rejet aigu, la néphrite à oxalate de calcium (Figure 5) et la fibrose rétropéritonéale (Figure 6a) (Figure 6b) [3] [11] [12]. Les patients présentant des signes de rejet peuvent être traités avec succès en administrant un immunosuppresseur par voie IV. Une intervention chirurgicale peut être nécessaire pour les patients développant une urolithiase à oxalate de calcium dans l'allogreffon, et elle est toujours indiquée pour les chats qui développent une fibrose rétropéritonéale, afin de retirer le tissu cicatriciel ayant entraîné une obstruction urétérale. Parmi les complications liées au traitement immunosuppresseur, il faut citer : le développement d'une infection (incluant des infections opportunistes), le diabète sucré (DS) et le lymphome (Figure 7) [13] [14] [15] [16] [17] [18] [19] [20]. Le traitement des complications infectieuses doit être ciblé sur l'agent infectieux spécifique. Chez les patients qui développent un DS suite à un traitement immunosuppresseur chronique, il faudra tenter de diminuer ce dernier, adapter le régime alimentaire et, dans certains cas, administrer de l'insuline. Malheureusement, les patients ayant développé un lymphome secondairement à un traitement immunosuppresseur et à une transplantation n’ont pas survécu, et le pronostic est donc considéré comme réservé.

Actuellement, dans l'établissement de l'auteure, 92 % des chats (154/168) opérés ont pu sortir et leur durée de survie moyenne et médiane ont été respectivement de 994 et 595 jours après l’intervention. Avec l'expérience clinique accumulée concernant la prise en charge à court et long terme, ainsi que l’identification des facteurs de risque pré- et postopératoires, les résultats à long terme continueront sans doute à s’améliorer chez ces patients. Bien qu'elle ne soit pas une option pour tous les chats atteints d'IRC, la transplantation rénale devient de plus en plus disponible et le praticien généraliste doit connaître les intérêts et les inconvénients de cette technique, ainsi que les considérations éthiques et financières qui l'accompagnent.
Lillian R. Aronson
Dr vétérinaire, Dip. ACVS
États-Unis
Après avoir fait ses études et son internat à l'Université de Pennsylvanie, le Dr Aronson a effectué un résidanat en chirurgie des petits animaux à l'Université de Californie, à Davis (UCD). De 1994 à 1996, elle a coordonné le programme de transplantation rénale chez les animaux à l'UCD. Après son résidanat, elle a rejoint la faculté de l'Université de Pennsylvanie, où elle est actuellement Professeure de chirurgie, et a lancé le programme de transplantation rénale. Elle s’intéresse à tous les domaines de la chirurgie des tissus mous, mais la chirurgie microvasculaire et la chirurgie complexe des voies urinaires (incluant la transplantation rénale) sont ses domaines de prédilection, avec le traitement des urolithiases. En plus des nombreuses conférences qu’elle donne dans ses domaines de prédilection, elle est l'auteure d'un manuel sur les urgences chirurgicales chez les petits animaux.
Bibliographie
- Gregory CR, Gourley IM. Organ transplantation in clinical veterinary practice. In: Slatter DH, ed. Textbook of Small Animal Surgery. Philadelphia: WB Saunders, 1993;95-100.
- Schmiedt CW, Holzman G, Schwarz T, et al. Survival, complications and analysis of risk factors after renal transplantation in cats. Vet Surg 2008;37:683-695.
- Aronson LR, Kyles AE, Preston A, et al. Renal transplantation in cats diagnosed with calcium oxalate urolithiasis: 19 cases (1997-2004). J Am Vet Med Assoc 2006;228:743-749.
- Gregory CR, Bernsteen L. Organ transplantation in clinical veterinary practice. In: Slatter DH, ed. Textbook of Small Animal Surgery. Philadelphia: WB Saunders, 2003;122-136.
- Mathews KG. Renal transplantation in the management of chronic renal failure. In: August J, ed. Consultation in Feline Internal Medicine 4. Philadelphia: WB Saunders, 2001;319.
- Adin CA, Gregory CR, Kyles AE, et al. Diagnostic predictors and survival after renal transplantation in cats. Vet Surg 2001;30:515-521.
- Wormser C, Aronson LR. Perioperative morbidity and long-term outcome of unilateral nephrectomy in feline kidney donors: 141 cases. J Am Vet Med Assoc 2016;248:275-281.
- Katayama M, McAnulty JF. Renal transplantation in cats: techniques, complications, and immunosuppression. Compend Contin Educ Pract Vet 2002;24:874-882.
- McAnulty JF, Lensmeyer GL. The effects of ketoconazole on the pharmacokinetics of cyclosporine A in cats. Vet Surg 1999;28:448-455.
- Aronson LR, Phillips H. Renal transplant. In; Johnston SA and Tobias KM, eds. Veterinary Surgery; Small Animal. St Louis: Elsevier, 2018;2263-2280.
- Aronson LR. Retroperitoneal fibrosis in four cats following renal transplantation. J Am Vet Med Assoc 2002;221:984-989.
- Wormser C, Phillips H, Aronson LR. Retroperitoneal fibrosis in feline renal transplant recipients: 29 cases (1998-2011). J Am Vet Med Assoc 2013;243:1580-1585.
- Kadar E, Sykes JE, Kass PH, et al. Evaluation of the prevalence of infections in cats after renal transplantation: 169 cases (1987-2003). J Am Vet Med Assoc 2005;227:948-953.
- Bernsteen L, Gregory CR, Aronson LR, et al. Acute toxoplasmosis following renal transplantation in three cats and a dog. J Am Vet Med Assoc 1999;215:1123-1126.
- Lo AJ, Goldschmidt MH, Aronson LR. Osteomyelitis of the coxofemoral joint due to Mycobacterium species in a feline transplant recipient. J Feline Med Surg 2012;14:919-923.
- Case JB, Kyles AE, Nelson RW, et al. Incidence of and risk factors for diabetes mellitus in cats that have undergone renal transplantation: 187 cases (1986-2005). J Am Vet Med Assoc 2007;230:880-884.
- Wooldridge J, Gregory CR, Mathews KG, et al. The prevalence of malignant neoplasia in feline renal transplant recipients. Vet Surg 2002;31:94-97.
- Durham AC, Mariano AD, Holmes ES, et al. Characterization of post transplantation lymphoma in feline renal transplant recipients. J Comp Pathol 2014;150:162-168.
- Wormser C, Mariano A, Holmes E, et al. Post-transplant malignant neoplasia associated with cyclosporine-based immunotherapy: prevalence, risk factors and survival in feline renal transplant recipients. Vet Compar Oncol 2016;14:e126-e134.
- Schmiedt CW, Grimes JA, Holzman G. Incidence and risk factors for development of malignant neoplasia after feline renal transplantation and cyclosporine-based immunosuppression. Vet Compar Oncol 2009;7:45-53.
Autres articles de ce numéro
Partager sur les réseaux sociaux