Les maladies à transmission vectorielle chez le chat
Écrit par Mary Thompson et Peter Irwin
Contrairement à ce qu’on observe à propos des maladies transmises aux chiens par les arthropodes hématophages, les vétérinaires semblent relativement peu conscients de l’importance mondiale des maladies à transmission vectorielle (MTV) chez le chat. Mais si nous connaissions mieux ces MTV félines, nous ne serions pas surpris d’apprendre qu’un grand nombre des facteurs responsables de l’émergence des maladies infectieuses chez le chien et chez l’Homme concernent également les chats.
Article
Points clés
Les agents pathogènes transmis par les arthropodes sont une cause de maladies infectieuses émergentes chez le chat, et les voyages des animaux, le développement périurbain, le mode de vie en extérieur, le changement climatique sont tous des facteurs qui y contribuent.
Les récents progrès des outils diagnostiques ont permis d’améliorer nos connaissances des maladies à transmission vectorielle (MTV) chez le chat.
Les maladies chroniques, concomitantes et immunosuppressives, peuvent être à l’origine d’une recrudescence des MTV félines.
Il faut penser aux maladies vectorielles quand une transfusion sanguine est envisagée chez le chat.
Certaines MTV félines comportent un risque zoonotique et les vétérinaires doivent donc rester vigilants.
L’application régulière d’antiparasitaires externes est la clé du contrôle de ces maladies.
Introduction
Contrairement à ce qu’on observe à propos des maladies transmises aux chiens par les arthropodes hématophages, les vétérinaires semblent relativement peu conscients de l’importance mondiale des maladies à transmission vectorielle (MTV) chez le chat [1]. Mais si nous connaissions mieux ces MTV félines, nous ne serions pas surpris d’apprendre qu’un grand nombre des facteurs responsables de l’émergence des maladies infectieuses chez le chien et chez l’Homme concernent également les chats. Chaque fois qu’une transfusion sanguine est envisagée pour un chat, ou chaque fois qu’un chat présente une fièvre, une anémie ou une thrombocytopénie inexpliquée, le vétérinaire doit toujours envisager la possibilité d’une infection transmise par un arthropode hématophage. Ce bref récapitulatif a pour but de fournir aux vétérinaires des informations clés sur la distribution, le diagnostic, le traitement et la prévention des MTV félines.
MTV félines : distribution mondiale, émergence et importance
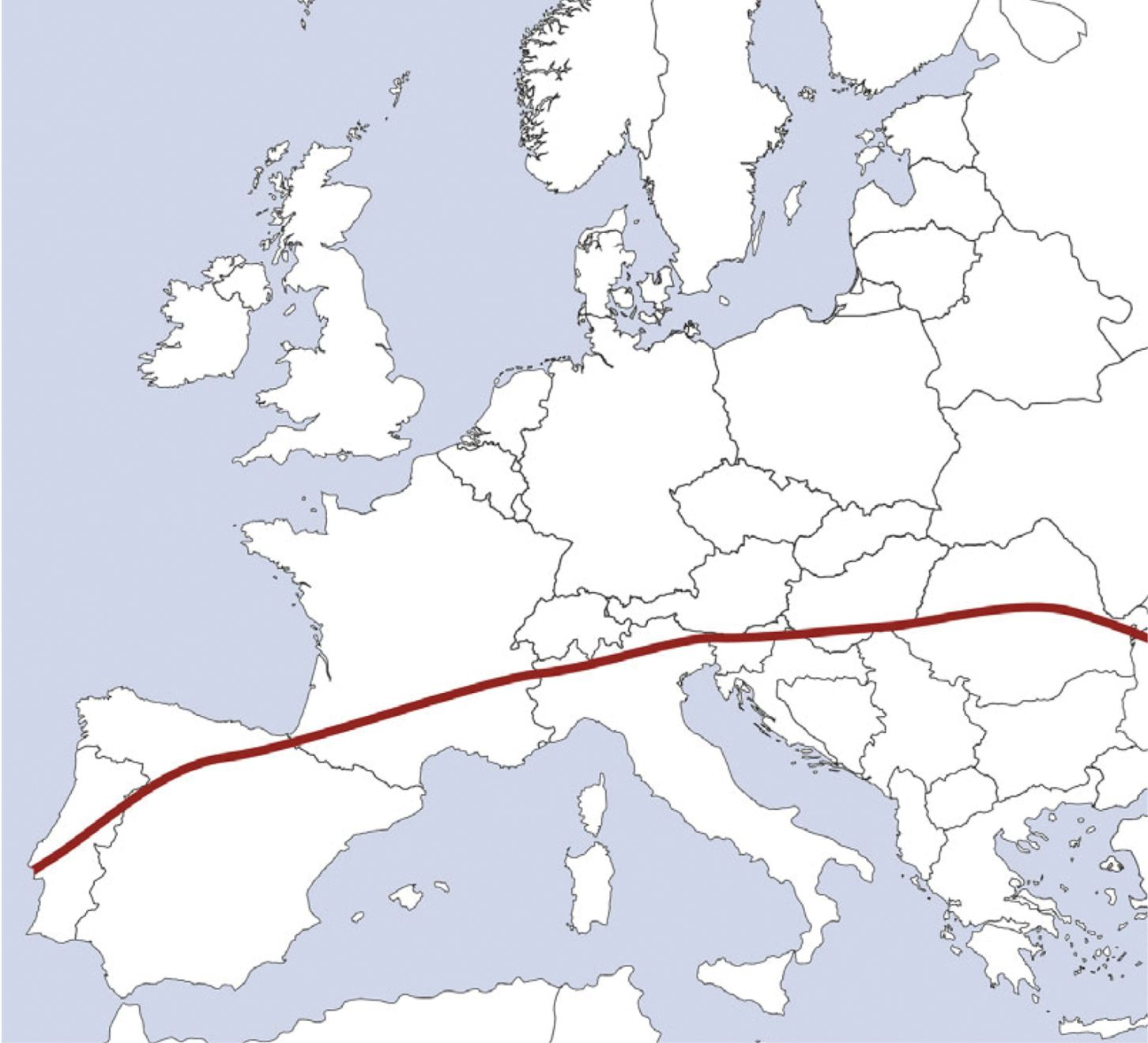
Les maladies à transmission vectorielle sont dues à des agents pathogènes transmis par des arthropodes hématophages, à savoir notamment les puces, tiques, moustiques, phlébotomes, poux et insectes du genre Triatominae. Ces maladies ont une distribution mondiale (Tableau 1), mais leur prévalence varie de manière importante selon les régions, en raison de différences en termes de territoire géographique et de préférences d’habitat de leurs vecteurs respectifs. Les différences climatiques de température et d’humidité expliquent largement la présence de l’une ou l’autre espèce. Par exemple, les tiques hygrophiles comme Ixodes et Dermacentor spp. ont besoin d’humidité et ne tolèrent ni la chaleur ni la sécheresse, alors que les tiques xérophiles comme Rhipicephalus vivent dans les régions chaudes et tolèrent bien la sécheresse mais pas le gel. Les distributions relatives de Rhipicephalus sanguineus et Dermacentor reticulatus en Europe illustrent très bien cela (Figure 1). Le microenvironnement est également crucial. Les tiques endophiles comme R. sanguineus préfèrent les environnements clos (chenils, par exemple), ce qui explique leur capacité à s’établir dans les habitats des humains, parfois bien au-delà de leur territoire géographique (par exemple, quand un animal rentre de vacances passées dans ces régions). Cela contraste avec les tiques exophiles dont les stades de vie libre sont présents dans les forêts, les bois, les champs, les parcs et les jardins.
| Distribution | Maladie | Principaux agents pathogènes | Principal vecteur | Zoonotique ? |
| Monde entier | Infection à mycoplasme hémotrope félin (Anémie infectieuse féline) | Mycoplasma haemofelis “Candidatus M. haemominutum” “Candidatus M. turicensis” | Puces (Ct. felis) | Éventuellement |
| Monde entier | Bartonellose |
Bartonella henselae,
B. clarridgeiae,
B. koehlerae
|
Puces (Ct. felis) | Oui |
| Afrique du Sud | Babésiose | Babesia felis | Tiques | Non |
| Sud des États-Unis | Cytauxzoonose | Cytauxzoon felis | Tiques | Non |
| États-Unis, Europe | Ehrlichiose |
Ehrlichia canis, E. chaffeensis,
E. ewingii
|
Tiques | Oui |
| États-Unis, Europe | Anaplasmose | Anaplasma phagocytophilum | Tiques | Oui |
| États-Unis, Europe | Leishmaniose | Leishmania infantum | Phlébotomes | Oui |
| États-Unis, Europe | Rickettsiose |
Rickettsia rickettsii, R. conorii,
R. massiliae
|
Tiques | Oui |
| États-Unis, Europe | Tularémie | Francisella tularensis | Tiques | Oui |
| États-Unis, Europe | Peste |
Yersinia pestis | Puces | Oui |
| Régions tropicales | Dirofilariose | Dirofilaria immitis | Moustiques |
Rarement |
Chaque fois qu’une transfusion sanguine est envisagée pour un chat, ou chaque fois qu’un chat présente une fièvre, une anémie ou une thrombocytopénie inexpliquée, le vétérinaire doit toujours envisager la possibilité d’une infection transmise par un arthropode hématophage.
Le réchauffement global et l’évolution de l’habitat qui résulte de la déforestation et de l’expansion résidentielle dans les zones boisées sont parmi les facteurs à l’origine de l’émergence et de la réémergence des maladies vectorielles. Ils exposent les chats à des arthropodes dont le rôle potentiel en tant que vecteur est encore inconnu [2] [3]. Les habitats et les conditions climatiques favorables au cycle de vie des tiques sont des facteurs de risque importants de la zoonose à Cytauxzoon felis aux États-Unis [4]. L’évolution des modes de vie peut influencer l’exposition des chats domestiques aux infections transmises indirectement par les félidés sauvages tels que le puma et le lynx [5]. Les vétérinaires doivent donc être au courant des ectoparasites présents dans leur région, mais doivent également être vigilants et s’attendre à l’inattendu en matière de maladies vectorielles.
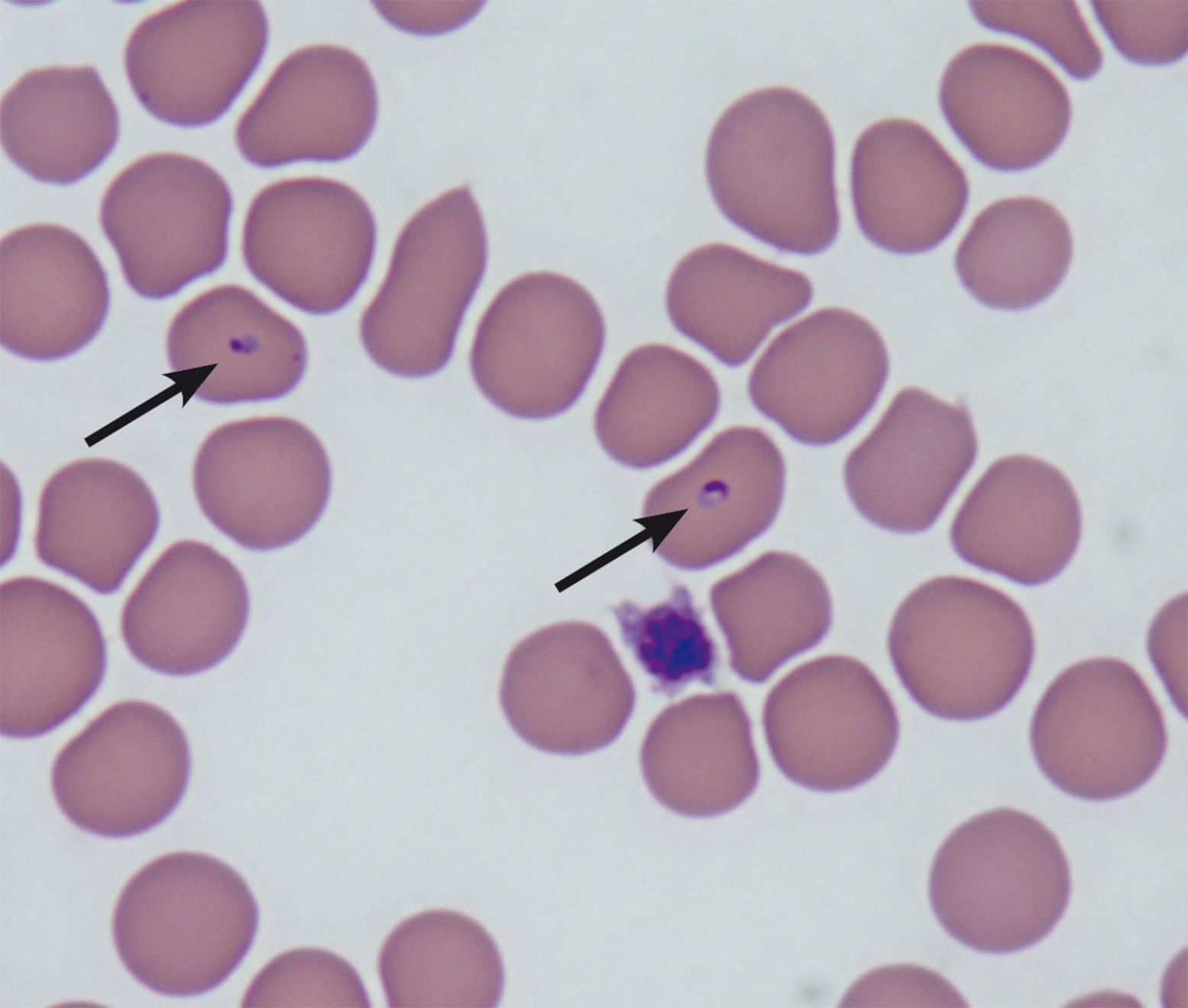
Malgré les préférences géographiques évoquées ci-dessus, certains vecteurs comme la puce du chat, Ctenocephalides felis, sont réellement omniprésents. Cela explique sans doute l’incidence mondiale des deux premières MTV félines, à savoir l’hémoplasmose et la bartonellose (Tableau 1). Les bactéries hémotropes qui sont à leur origine expliquent nombre des caractéristiques énigmatiques des maladies transmises par les arthropodes. Les mycoplasmes hémotropes félins (« hémoplasmes ») infectent les hématies en se fixant à la surface des cellules érythrocytaires, et plusieurs espèces de pathogénicité variable ont été identifiées grâce aux études moléculaires. L’espèce Bartonella est Gram négatif et infecte les érythrocytes mais aussi les cellules endothéliales. Ces deux groupes de bactéries sont transmis par des vecteurs (puces, principalement), bien qu’il existe d’autres modes d’infection reconnus, comme les combats et les produits du sang (voir ci-après). Ils sont parfois appelés « organismes discrets », ce qui veut dire que l’infection subclinique est fréquente avec ces bactéries (d’où la difficulté de leur diagnostic) mais que la maladie clinique est rare. Ceci étant dit, Mycoplasma haemofelis (Figure 2) en particulier est un agent pathogène important chez le chat, qui provoque pâleur, léthargie, anorexie, perte de poids, déshydratation et fièvre, ainsi qu’une anémie potentiellement mortelle, et il nécessite un traitement avec de la tétracycline, de la doxycycline ou des fluoroquinolones, associé dans de nombreux cas à des transfusions de sang compatible (par typage ou compatibilité croisée) ou d’autres produits du sang.
A l’origine de maladies infectieuses émergentes, des agents pathogènes à transmission vectorielle peuvent apparaître quand on s’y attend le moins. Après l’ouragan Katrina, des chiens et des chats ont été déplacés de la Nouvelle-Orléans vers toutes les parties des États-Unis, dispersant ainsi des animaux infectés (et les pathogènes qui leur avaient été transmis par des vecteurs) dans des zones où le risque pour ces maladies était faible [6]. De plus en plus, des animaux domestiques, dont des chats, sont sauvés par des organisations de protection des animaux et déplacés d’un endroit à l’autre (du sud au nord de l’Europe, par exemple), transportant potentiellement avec eux des organismes infectieux, et la communauté vétérinaire s’inquiète de plus en plus de l’utilisation abusive du Programme de Voyage des Animaux de Compagnie (PVAC) en Europe et du risque d’importations illégales. En outre, les chats peuvent parcourir de grandes distances pour aller à des concours ou en vacances avec leurs propriétaires dans des régions où apparaissent de nouveaux vecteurs et leurs agents pathogènes. Il est donc essentiel d’informer les clients des risques liés à ces voyages et de leur conseiller un programme antiparasitaire externe adapté (Tableau 2).
| Principe(s) actif(s) | Mode(s) d’action | Arthropodes(s) cible(s) | Formulation(s) |
|---|---|---|---|
|
Imidaclopride
|
Bloque la neurotransmission post-synaptique au niveau des récepteurs nicotiniques de l’acétylcholine (nACh) de l’insecte | Insectes (puces) | Spot-on avec activité résiduelle |
|
Imidaclopride (10 %)
plus flumethrin
(4.5 %)
|
Idem ci-dessus, plus la fluméthrine interfère avec les canaux sodium voltage-dépendants des neurones des invertébrés | Tiques et insectes (puces, phlébotomes, moustiques, et mouches piqueuses) |
Collier (matrice pour libération prolongée) |
|
Fipronil
|
Se fixe aux récepteurs glutamate et GABA et les bloque, inhibant ainsi les canaux chlorure | Tiques, acariens et insectes (puces, poux) | Spray et spot-on |
|
Nitenpyrame
|
Bloque la neurotransmission post-synaptique au niveau des récepteurs nicotiniques de l’ACh de l’insecte | Puces | Comprimés |
|
Spinétorame (spinosad modifié)
|
Se fixe aux récepteurs nACh de l’insecte et les stimule | Puces | Spot-on |
|
Moxidectine
|
Se fixe aux canaux chlorure glutamate-dépendants et a une action GABA-mimétique ; souvent associée à l’imidaclopride
|
Puces | Spot-on et solution topique |
| Sélamectine | Se fixe aux canaux chlorure glutamate-dépendants et a une action GABA-mimétique | Puces | Spot-on |
|
Métaflumizone
|
Bloque les canaux sodium en se fixant à leurs récepteurs | Puces | Spot-on |
|
Indoxacarbe
|
Inhibe les canaux sodium voltage-dépendants dans les cellules de l’insecte | Puces | Spot-on |
|
Méthoprène et s-méthoprène
|
Régulateurs de croissance des insectes : réduit l’éclosion des œufs et la mue des larves | Puces | Spot-on |
| Lufénuron | Inhibiteur de la chitine synthétase, prévient l’éclosion | Puces | Orale et injectable |
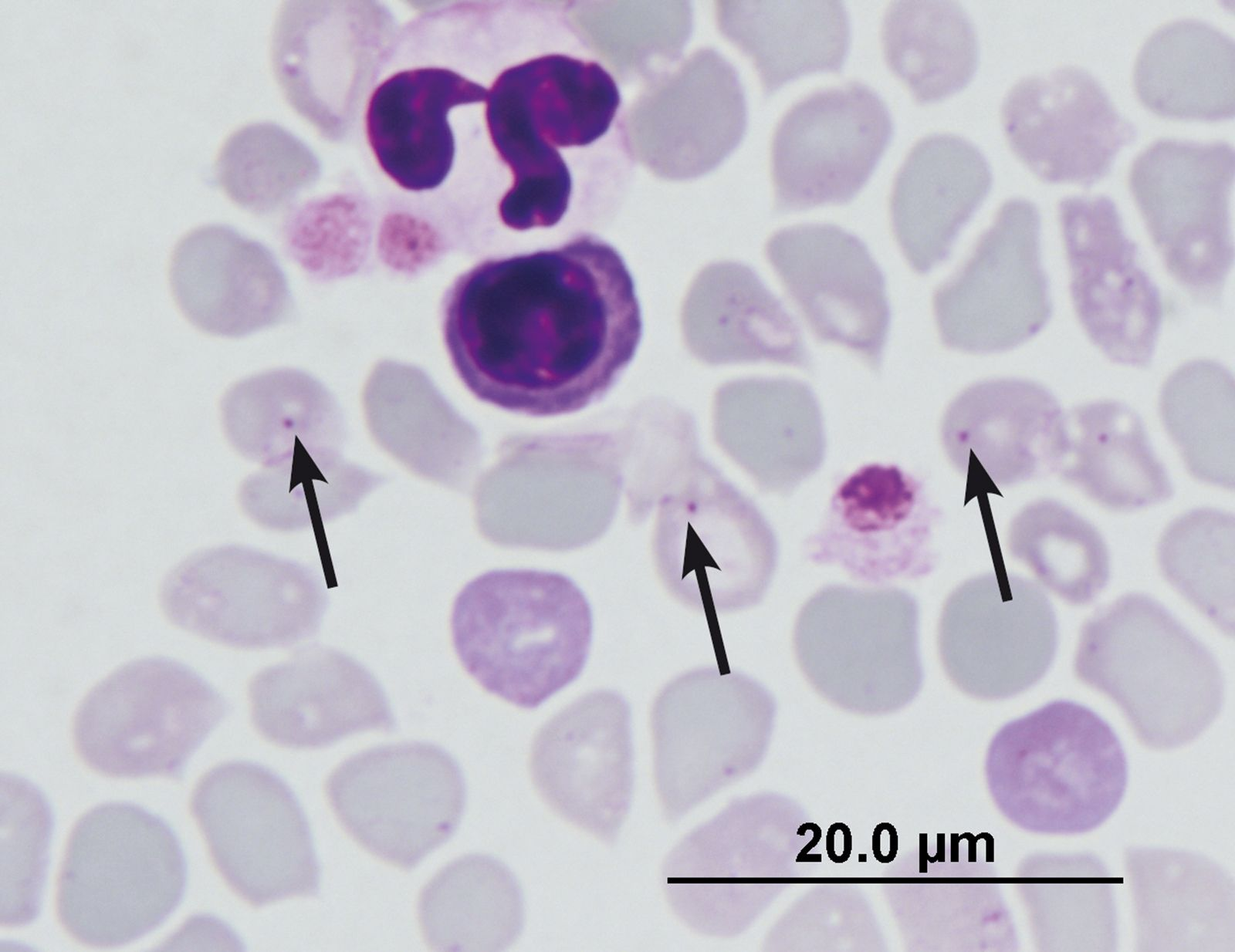
Les MTV félines étant des infections à transmission hématogène, l’examen microscopique d’un frottis sanguin sert à diagnostiquer certaines infections, notamment les infections à protozoaires comme la babésiose (Figure 3) et la cytauxzoonose. Toutefois, la microscopie reste peu sensible pour la détection d’autres infections comme l’hémoplasmose et la bartonellose. La bonne nouvelle, c’est que notre capacité à détecter de nombreux organismes responsables de MTV félines s’améliore, surtout grâce au développement et à la grande diffusion de tests ADN très sensibles. Les études épidémiologiques moléculaires menées chez le chat nous ont permis de mieux connaître la prévalence et la distribution des MTV félines, grâce à la diminution de leur coût et au développement de systèmes à haut rendement [1], et les tests sérologiques laissent peu à peu la place aux tests PCR pour la détection de l’ADN de leurs agents pathogènes. Et chose importante, cette technique reflète plus justement le statut infectieux de l’animal testé, à condition que la détection de l’ADN implique un pathogène viable, plutôt qu’une exposition antérieure, et le vétérinaire peut ainsi, en connaissant la prévalence de la bactériémie, de la parasitémie ou de la virémie, mieux appréhender le statut infectieux réel de ses patients.

La bartonellose est sans doute la zoonose vectorielle féline la plus importante actuellement au monde. Les chats, parmi d’autres espèces de mammifères, peuvent être infectés par ou servir de réservoir à plusieurs espèces bactériennes de Bartonella.
Quel est l’impact zoonotique des MTV félines ?
Partout dans le monde, une cohabitation fréquente existe entre l’Homme et le chat, de nombreux foyers hébergeant au moins un chat, et il existe aussi de nombreux individus qu’on pourrait qualifier de copropriétaires, c’est-à-dire qui nourrissent ou s’occupent de chats qu’ils ne considèrent pas comme étant les leurs. Beaucoup de gens sont ainsi quotidiennement en contact avec des chats, qui sont de plus en plus considérés comme des membres de la famille ou des compagnons de sommeil. Parallèlement, le concept « One Health » (approche multidisciplinaire où Homme et animal sont soignés ensemble) s’étend et les vétérinaires sont de plus en plus appelés à se prononcer sur les risques que comportent les maladies infectieuses émergentes ou réémergentes pour les êtres humains (notamment les individus très jeunes, très âgés ou immunodéprimés) via les chats ou d’autres animaux avec lesquels ils sont en contact. Les praticiens doivent également avoir conscience de l’exposition professionnelle, car dans de nombreux cas, l’exposition aux chats infectés par des MTV, et aussi à leurs vecteurs, est importante pour le personnel vétérinaire.
Les agents à transmission vectorielle importants pour les vétérinaires félins, car potentiellement zoonotiques, incluent Bartonella spp., Rickettsia felis, Yersinia pestis, et Tularemia francisella. Leishmania infantum et Anaplasma phagocytophilum peuvent également infecter à la fois l’Homme et le chat, et le rôle des chats en tant que réservoirs de la maladie humaine continue d’être exploré.
Bartonellose
La bartonellose est sans doute la zoonose vectorielle féline la plus importante actuellement au monde. Les chats, parmi d’autres espèces de mammifères, peuvent être infectés par ou servir de réservoir à plusieurs espèces bactériennes de Bartonella. Chez l’Homme, la maladie a d’abord été jugée limitée à cette maladie relativement bénigne dite des griffes du chat, caractérisée par de la fièvre et une hypertrophie des nœuds lymphatiques régionaux, mais de nombreuses autres manifestations de bartonellose humaine s’observent aujourd’hui à la fois chez des individus immunodéprimés et (moins souvent) immunocompétents [7]. Nos connaissances continuent de s’élargir et, ces 25 dernières années, le nombre d’espèces identifiées de Bartonella est passé de 2 à plus de 24. Les espèces les plus importantes chez le chat sont actuellement B. henselae, B. clarridgeiae, et B. koehlerae (Tableau 1), dont les puces seraient des vecteurs importants [8].
L’infection subclinique des chats par B. henselae est répandue dans le monde entier, un faible pourcentage seulement d’animaux développant une maladie plus grave. Les facteurs de risque de bactériémie chez le chat incluent le jeune âge, l’accès à l’extérieur, l’infestation par les puces et les environnements où cohabitent plusieurs chats [9]. La transmission de chat à chat se fait principalement via des excréments de puces présents sur les griffes contaminées, et l’organisme peut survivre plusieurs jours dans le milieu extérieur [8].
L’Homme est généralement infecté par Bartonella spp. en se faisant griffer par un chat dont les griffes sont contaminées par des excréments de puce, mais une infection par morsure de chat ou une transmission indirecte par des puces du chat est également possible [10]. Les personnes immunocompétentes sont généralement infectées de manière subclinique, mais les sujets immunodéprimés peuvent souffrir de diverses maladies, incluant endocardite, neurorétinite, fièvre récidivante, méningite aseptique et uvéite [11] [12].
Les vétérinaires doivent être capables de donner des conseils sur la manière de limiter la transmission de Bartonella spp. du chat à l’Homme, surtout quand il y a des individus immunodéprimés dans la famille. Une approche prudente doit prendre en compte les facteurs liés au chat, à l’Homme et à la transmission. Les recommandations sont les suivantes [13] :
• choisir un chat à faible risque de bactériémie : c’est-à-dire un chat apparemment sain, âgé de plus de 1 an, sans puces et provenant d’un environnement sans autre chat ;
• limiter la transmission : couper les griffes du chat, éviter les jeux violents, et nettoyer rapidement les plaies de griffure ou de morsure ;
• éradiquer les vecteurs : effectuer un contrôle strict des puces et des tiques et empêcher l’accès à l’extérieur.
Si un jeune chat (de moins de 2 ans, par exemple) cohabitant avec des personnes immunodéprimées ou des enfants se révèle infecté par Bartonella spp., de manière subclinique ou autre, les directives recommandent une antibiothérapie du chat afin de diminuer la charge bactérienne et le risque de transmission [13].
Infection à Rickettsia felis
Rickettsia felis est l’agent responsable de la fièvre boutonneuse à puces (ou « cat flea typhus »), qui est également considéré comme un agent pathogène émergent chez l’Homme. Les signes cliniques de la fièvre boutonneuse à puces incluent éruptions macropapuleuses et escarres, fièvre, fatigue et céphalées [14]. Fait intéressant, alors que l’ADN de R. felis a été isolé chez des puces du chat, les chiens seraient un réservoir plus probable de l’infection, et de l’ADN de rickettsie a été identifié dans cette espèce [15]. La plupart des tentatives d’isolement de l’ADN de R. felis dans du sang félin ont échoué et aucune maladie clinique n’a été décrite chez le chat, mais le rôle des chats dans le maintien des populations de puces pourrait être important pour la transmission de la maladie.
Yersinia
Yersinia pestis, un coccobacille Gram négatif, est l’agent responsable de la peste, à laquelle les chats sont très sensibles. Dans les zones endémiques (régions du Nord et du Sud de l’Amérique, de l’Afrique et de l’Asie), les chats peuvent contracter la peste via des puces de rongeurs infectées, ou par l’ingestion de petits mammifères. Il a été suggéré que le risque de peste humaine liée au chat pourrait augmenter au fur et à mesure que le développement résidentiel se poursuit, empiétant sur l’environnement naturel où existent les foyers de Y. pestis de l’Ouest des États-Unis [2]. Chez le chat, les signes cliniques classiques incluent hypertrophie des nœuds lymphatiques mandibulaires et rétropharyngés ; la progression en choc septique et les formes pulmonaires de la peste sont moins fréquentes [16]. Les êtres humains peuvent contracter la peste provenant des chats soit indirectement via des puces des rongeurs, soit directement par voie aérienne, morsure ou griffure ; du personnel vétérinaire a déjà été infecté.
Tularémie
La tularémie est une maladie rare présente en Amérique du Nord et en Europe, provoquée par le coccobacille Gram négatif Francisella tularensis. Les principaux réservoirs de l’organisme incluent un large panel de petits mammifères, et les chats s’infectent en chassant et en ingérant leurs proies [17]. Les chats infectés présentent des signes cliniques incluant fièvre, hypertrophie des nœuds lymphatiques périphériques, hépatomégalie et splénomégalie [18]. La transmission du chat à l’Homme se fait par morsure (ou plus rarement griffure), et les signes cliniques chez l’Homme incluent hypertrophie des nœuds lymphatiques et maladie pseudo grippale transitoire, avec évolution possible en pneumonie [19].
MTV et comorbidités
L’association entre immunodépression humaine et maladies vectorielles est bien identifiée. Un des exemples les plus parlants est l’interaction manifeste entre le virus de l’immunodéficience humaine (VIH) et la leishmaniose viscérale, qui a été décrite dans de nombreux pays à travers le monde. La leishmaniose est devenue une cause importante de mortalité chez les patients atteints du Sida, et l’immunosuppression associée au VIH a changé le spectre de la maladie, avec un risque accru de maladie viscérale chez les individus infectés par le rétrovirus comparé aux formes cutanées habituellement observées chez les personnes immunocompétentes [20].
Quelques études ont examiné le lien entre la séropositivité à Bartonella et le FIV ou le FeLV [21] [22]. Aucune association n’a été démontrée, mais il pourrait y avoir un risque accru de maladies de la cavité orale (stomatite, gingivite) chez les chats séropositifs à Bartonella. Un lien entre les rétrovirus félins et M. haemofelis a été démontré dans certaines, mais pas la totalité, des études. En outre, il a été démontré que « Ca. M. haemominutum » et « Ca. M. turicensis », bien que n’étant pas une cause d’anémie importante chez les chats immunocompétents, entraînent respectivement une anémie plus marquée en présence d’une infection par le FeLV et une immunosuppression concomitante [23] [24]. Aucune association n’a été décrite à ce jour entre la leishmaniose féline et les rétrovirus, mais seuls quelques chats infectés ont été examinés.
Un cas clinique récent a décrit un chat co-infecté par Anaplasma platys, B. henselae, B. koehlerae et « Ca. M. haemominutum » [25]. Un diagnostic de myélome multiple a également été établi chez ce chat, basé sur la présence d’une plasmocytose splénique et d’une gammapathie monoclonale. Il a été suggéré que l’infection par un ou plusieurs de ces pathogènes pourrait avoir mimé ou joué un rôle dans, la maladie myélomateuse. Ou bien l’immunosuppression liée à la maladie myélomateuse pourrait avoir prédisposé le chat aux MTV multiples.
Transfusions sanguines et MTV félines
Les vétérinaires doivent avoir conscience des risques potentiels de MTV associés à la transfusion de produits sanguins chez le chat, et doivent en avertir les propriétaires. Beaucoup de chats qui reçoivent des transfusions sanguines sont intrinsèquement immunodéprimés, ou seront ensuite médicalement immunodéprimés, et peuvent donc être plus sensibles à l’infection clinique par des agents pathogènes de MTV accidentellement transmis par du sang infecté.
Il existe d’excellentes recommandations de limitation des risques de transmission de maladie infectieuse par transfusion de produits sanguins félins [26] [27], les premières incluant une fiche d’évaluation de donneur de sang félin potentiel utile aux vétérinaires. Ces recommandations sont axées sur le choix des donneurs les moins susceptibles d’être infectés, avec un dépistage judicieux des agents pathogènes selon les régions.
Par rapport aux MTV félines, le donneur de sang idéal [26] :
• a plus de 3 ans (pour limiter les risques de bactériémie à Bartonella) ;
• n’a jamais cohabité avec un autre chat ;
• a une bonne protection contre les puces et les tiques ;
• n’a aucun antécédent de voyage ;
• n’a aucun antécédent de MTV.
Concernant le dépistage des MTV chez les chats donneurs de sang, un bilan minimum incluant un test PCR pour la recherche de M. haemofelis, B. henselae et A. phagocytophilum est recommandé [27]. Toutefois, un test PCR supplémentaire pour la recherche de A. platys, autres Bartonella spp., Cytauxzoon felis, Ehrlichia canis, « Ca. M. haemominutum » et « Ca. M. turicensis » est idéalement recommandé, en parallèle d’une confirmation de séronégativité à A. platys et B. henselae. Les autres hémopathogènes qui doivent être recherchés chez les chats donneurs de sang, en fonction des connaissances locales de la maladie et du portage subclinique, incluent A. phagocytophilum, Babesia spp., C. felis, Ehrlichia spp. et Leishmania infantum.
Si le risque de transmission de MTV félines par les produits sanguins peut être limité avec un dépistage adapté, il faut toujours insister auprès des propriétaires sur le fait que la transfusion sanguine elle-même n’est pas sans risque, que ce soit en termes de MTV ou d’autres complications.
Contrôle des MTV félines
En conclusion, les hémopathogènes transmis par les arthropodes sont une cause mondiale de maladies infectieuses émergentes chez le chat, et leur impact sur la santé des chats eux-mêmes ainsi que sur celle de leurs propriétaires oblige les vétérinaires à savoir les reconnaître et les traiter de manière adaptée. Dans la mesure du possible, les MTV félines doivent faire l’objet d’un contrôle et d’une prévention [28]. Étant donné le rôle clé de la puce du chat dans la transmission de beaucoup de zoonoses abordées ci-dessus, ainsi que le risque pour les chats eux-mêmes, nous n’insisterons jamais assez sur l’importance d’un contrôle strict des puces, englobant idéalement des arthropodes vecteurs comme les tiques. La pierre angulaire de la prévention est l’utilisation d’antiparasitaires externes et de composés interférant avec le développement des œufs ou autres stades des parasites (Régulateurs de Croissance des Insectes et Inhibiteurs du Développement des Insectes) [29], parallèlement à une chimioprophylaxie avec de l’ivermectine dans les zones endémiques de dirofilariose pour prévenir cette maladie chez le chat. Les autres stratégies disponibles chez le chien, comme la vaccination contre des maladies telles que la babésiose, la leishmaniose et la maladie de Lyme, sont soit inutiles, soit indisponibles chez le chat du fait de différences entre ces deux espèces concernant leur rôle de réservoir. Les traitements couramment utilisés pour la prévention des MTV félines sont listés dans le Tableau 2. Notons qu’en raison des capacités limitées de glucuronidation hépatique chez le chat, un certain nombre d’antipuces, d’anti-acariens et de groupes d’antiparasitaires externes comme les organophosphorés, les carbamates, l’amitraz et la plupart des pyréthroïdes (notamment la perméthrine) ne doivent pas être utilisés chez le chat en raison de leur toxicité.
Mary Thompson
BVSc (Hons), Dip. ACVIM (SAIM), MANZCVS
Australie
Le Dr Thompson est diplômée de l’Université de Sydney puis effectue un résidanat en médecine interne des petits animaux à l’Université de Purdue. En 2001, elle obtient le diplôme de l’ACVIM (Collège Américain de Médecine Interne Vétérinaire). Ses recherches portent sur Rickettsia felis, sur les infections urinaires récidivantes, les souches d’E. coli multirésistantes et les intoxications alimentaires. Elle est actuellement professeur adjoint en Médecine des Petits Animaux à l’Université Murdoch, et elle est vice-présidente des sections Féline et Petits Animaux du MANZCVS (Collège Australien et Néozélandais de Recherche en Médecine Vétérinaire).
Peter Irwin
Australie
Diplômé du Royal Veterinary College de Londres, le Dr Irwin effectue ensuite un PhD à l’UniversitéJames Cook de Townsville en Australie puis devient membre du Collège Australien et Néozélandais de Recherche en Médecine Vétérinaire en 1995. Il est actuellement professeur de Sciences Cliniques Vétérinaires et co-directeur du Groupe de Recherche sur les Pathogènes transmis par les Vecteurs et par l’Eau, à l’Université Murdoch. C’est un expert mondialement reconnu des maladies vectorielles, et ses recherches actuelles s’intéressent aux infections transmises par les tiques chez les animaux de compagnie, la faune sauvage et l’Homme, en Australie.
References
- Hegarty BC, Qurollo BA, Thomas B, et al. Serological and molecular analysis of feline vector-borne anaplasmosis and ehrlichiosis using species-specific peptides and PCR. Parasit Vectors 2015;8:320.
- Gage KL, Dennis DT, Orloski KA, et al. Cases of cat-associated human plague in the Western US, 1977-1998. Clin Infect Dis 2000;30:893-900.
- Harrus S, Baneth G. Drivers for the emergence and re-emergence of vector-borne protozoal and bacterial diseases. Int J Parasitol 2005;35:1309-1318.
- Raghavan RK, Almes K, Goodin DG, et al. Spatially heterogeneous land cover/land use and climatic risk factors of tick-borne feline cytauxzoonosis. Vector Borne Zoonotic Dis 2014;14:486-495.
- Bevins SN, Carver S, Boydston EE, et al. Three pathogens in sympatric populations of pumas, bobcats, and domestic cats: implications for infectious disease transmission. PLoS One 2012;7:e31403.
- Levy JK, Lappin MR, Glaser AL, et al. Prevalence of infectious diseases in cats and dogs rescued following Hurricane Katrina. J Am Vet Med Assoc 2011;238:311-317.
- Breitschwerdt EB, Maggi RG, Chomel BB, et al. Bartonellosis: an emerging infectious disease of zoonotic importance to animals and human beings. J Vet Emerg Crit Care (San Antonio) 2010;20:8-30.
- Chomel BB, Boulouis HJ, Breitschwerdt EB, et al. Ecological fitness and strategies of adaptation of Bartonella species to their hosts and vectors. Vet Res 2009;40:29.
- Guptill L, Wu CC, HogenEsch H, et al. Prevalence, risk factors, and genetic diversity of Bartonella henselae infections in pet cats in four regions of the United States. J Clin Microbiol 2004;42:652-659.
- Stutzer B, Hartmann K. Chronic bartonellosis in cats: What are the potential implications? J Feline Med Surg 2012;14:612-621.
- Slater LN, Welch DF, Hensel D, et al. A newly recognized fastidious Gram-negative pathogen as a cause of fever and bacteremia. N Eng J Med 1990;323:1587-1593.
- De la Rosa GR, Barnett BJ, Ericsson CD, et al. Native valve endocarditis due to Bartonella henselae in a middle-aged human immunodeficiency virus negative woman. J Clin Microbiol 2001;39:3417-3419.
- Pennisi MG, Marsilio F, Hartmann K, et al. Bartonella species infection in cats: ABCD guidelines on prevention and management. J Feline Med Surg 2013;15:563-569.
- Richter J, Fournier PE, Petridou J, et al. Rickettsia felis infection acquired in Europe and documented by polymerase chain reaction. Emerg Infect Dis 2002;8:207-208.
- Hii SF, Kopp SR, Abdad MY, et al. Molecular evidence supports the role of dogs as potential reservoirs for Rickettsia felis. Vector Borne Zoonotic Dis 2011;11:1007-1012.
- Sykes JE, Chomel BB. Yersinia pestis (Plague) and other Yersinioses. In: Sykes JE, ed. Canine and Feline Infectious Diseases, 1st ed. St Louis, Missouri: Elsevier Saunders; 2014:531-536.
- Ellis J, Oyston PC, Green M, et al. Tularemia. Clin Microbiol Rev 2002;15:631-646.
- Sykes JE, Chomel BB. Tularemia. In: Sykes JE, ed. Canine and Feline Infectious Diseases, 1st ed. St Louis, Missouri: Elsevier Saunders 2014:537-545.
- Capellan J, Fong IW. Tularemia from a cat bite: case report and review of feline-associated tularemia. Clin Infect Dis 1993;16:472-475.
- Desjeux P. Worldwide increasing risk factors for leishmaniasis. Med Microbiol immunol 2001;190:77-79.
- Ueno H, Hohdatsu T, Muramatsu Y, et al. Does co-infection of Bartonella henselae and FIV induce clinical disorders in cats? Microbiol Immunol 1996;40:617-620.
- Glaus T, Hofmann-Lehmann R, Greene C, et al. Seroprevalence of Bartonella henselae infection and correlation with disease status in cats in Switzerland. J Clin Microbiol 1997;35:2883-2885.
- George JW, Rideout BA, Griffey SM, et al. Effect of pre-existing FeLV infection or FeLV and feline immunodeficiency virus coinfection on pathogenicity of the small variant of Haemobartonella felis in cats. Am J Vet Res 2002;63:1172-1178.
- Willi B, Tasker S, Boretti FS, et al. Phylogenetic analysis of Candidatus Mycoplasma turicensis isolates from pet cats in the United Kingdom, Australia, and South Africa, with analysis of risk factors for infection. J Clin Microbiol 2006;44:4430-4435.
- Qurollo BA, Balakrishnan N, Cannon CZ, et al. Co-infection with Anaplasma platys, Bartonella henselae, Bartonella koehlerae and Candidatus Mycoplasma haemominutum in a cat diagnosed with splenic plasmacytosis and multiple myeloma. J Feline Med Surg 2014;16:713-720.
- Pennisi MG, Hartmann K, Addie DD, et al. Blood transfusion in cats: ABCD guidelines for minimising risks of infectious iatrogenic complications. J Feline Med Surg 2015;17:588-593.
- Wardrop KJ, Birkenheuer A, Blais MC, et al. Update on canine and feline blood donor screening for blood-borne pathogens. J Vet Intern Med 2016;30:15-35.
- Dantas-Torres F, Otranto D. Best practices for preventing vector-borne diseases in dogs and humans. Trends Parasitol 2016;32:43-55.
- Beugnet F, Franc M. Insecticide and acaricide molecules and/or combinations to prevent pet infestation by ectoparasites. Trends Parasitol 2012;28:267-279.
Autres articles de ce numéro
Partager sur les réseaux sociaux