Il colostro canino
Il periodo neonatale è una fase di rischio importante nel cane, poiché circa il 20% dei cuccioli nati vivi, muore prima dei 21 giorni e Il 70% dei decessi cade nella prima settimana che segue il parto.
Article

Il colostro è cruciale per la sopravvivenza del cucciolo, poiché fornisce al neonato sia le immunoglobuline sia la nutrizione..
La concentrazione di immunoglobulina nel colostro nei primi due giorni dopo il parto è cinque volte superiore rispetto al latte ma i livelli cadono molto rapidamente con il passare del tempo..
La qualità immunologica del colostro varia da una madre all’altra e anche tra un capezzolo e l’altro della stessa madre. Nelle cagne inoltre, i capezzoli che offrono il colostro della massima qualità non sono sempre gli stessi..
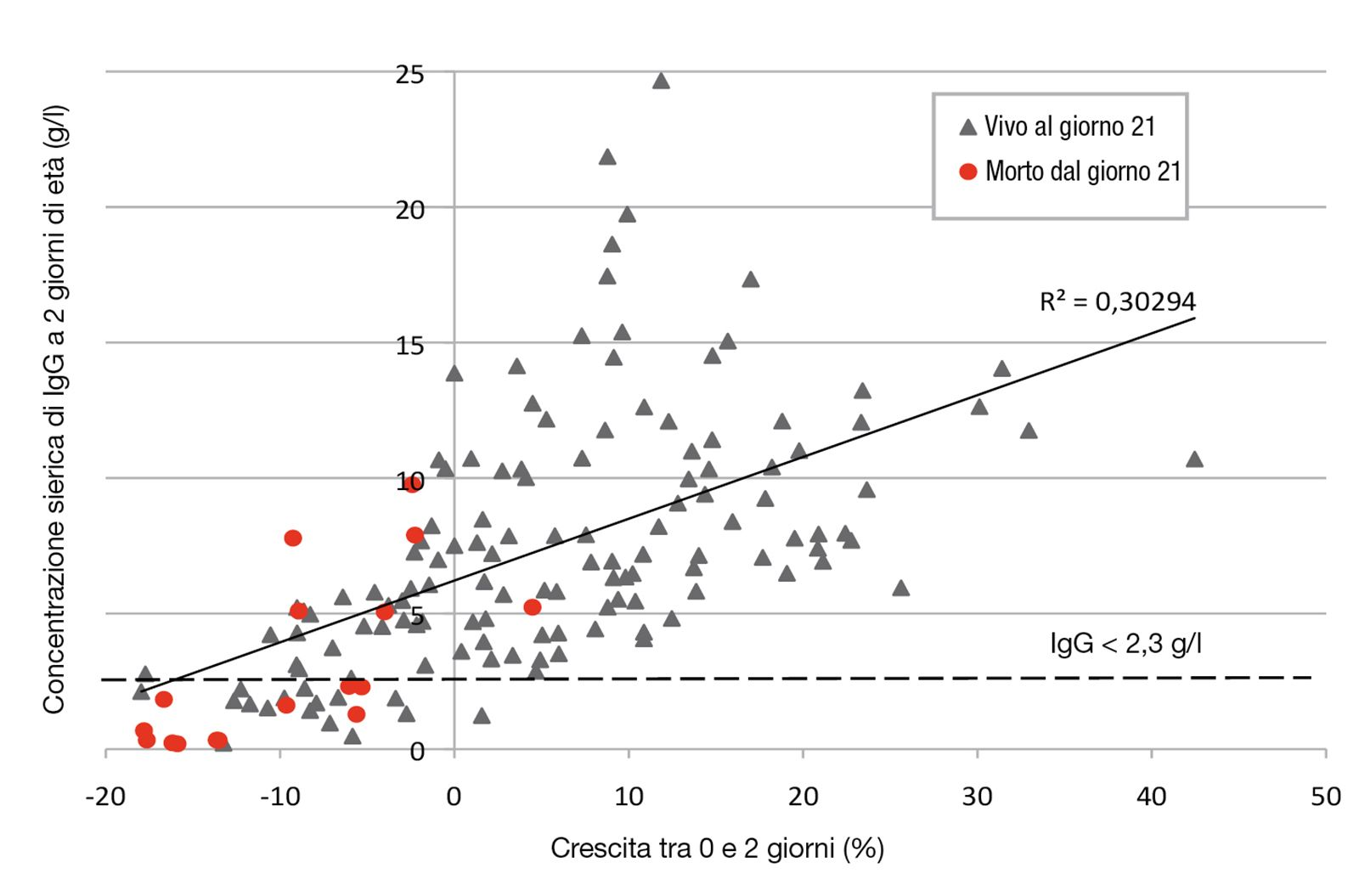
Monitorare la crescita nei primi due giorni di vita fornisce una valida indicazione per predire la sopravvivenza del cucciolo nel periodo neonatale.
Non esiste attualmente un sostituto completo (energia + immunità) per il colostro canino.
Introduzione
Formazione e composizione del colostro
Il colostro è la prima secrezione mammaria prodotta dopo il parto (ed è talvolta presente prima del parto), mentre il passaggio al latte avviene dopo due-tre giorni di allattamento (Tabella 1). La quantità effettiva di colostro prodotta da una cagna in allattamento è sconosciuta.
| Giorni di lattazione | |||||
| 1 | 3 | 7 | 14 | 21 | |
| Nutrienti | Colostro | Latte | Latte | Latte | Latte |
| Proteine (g/l) | 143,0 | 102,3 | 81,7 | 66,8 | 68,4 |
| Immunoglobuline G (g/l) | 23,8 | * | 5,9 | 0,6 | 0,6 |
| Lipidi (g/l) | 132,2 | 137,2 | 132,1 | 118,5 | 112,5 |
| Lattosio (g/l) | 16,6 | 29,3 | 35,4 | 39,9 | 39,4 |
| Calcio (mg/l) | 1.363 | 1.366 | 1.773 | 1.950 | 1.929 |
| Fosforo (mg/l) | 935 | 914 | 1.166 | 1.175 | 1.359 |
| Energia (kcal/l) | 1.831 | 1.761 | 1.657 | 1.493 | 1.444 |
* Valore sconosciuto
Durante la gestazione, il tessuto mammario si sviluppa sotto l’influenza degli estrogeni e del progesterone; la sua secrezione, indotta dalla prolattina, è possibile solo quando cadono i livelli di progesterone. Alcuni composti del colostro sono sintetizzati dalle cellule mammarie epiteliali (proteine, lattosio, lipidi) mentre altri, come immunoglobuline (Ig), leucociti, ormoni e alcuni fattori di crescita, sono prelevati dal flusso ematico materno. Macroscopicamente, il colostro è giallastro e più viscoso del latte. Dal punto di vista qualitativo, si distingue dal latte essenzialmente per la sua concentrazione proteica elevata (due volte quella del latte secreto due settimane dopo il parto, essendo particolarmente ricco di immunoglobuline), una concentrazione di lipidi leggermente superiore (10% in più) e un contenuto di carboidrati inferiore (metà rispetto al latte) 5 [6]. Per vari motivi (scarsità di studi, notevole variabilità tra le cagne e disparità nei metodi analitici), la misurazione delle componenti chiave del colostro varia tra uno studio e l’altro; i livelli proteici sono in genere del 4-14%, i livelli lipidici del 6-13% e i livelli di carboidrati del 1,7-2,3% (5 7 [8] e dati non pubblicati).
Oltre alla caseina (60% delle proteine totali), le immunoglobuline rappresentano il 20-37% delle proteine colostrali [6] 7 [9] 10. Nel colostro canino sono presenti tre classi di immunoglobuline: IgG, IgM e IgA, con le IgG predominanti, che rappresentando il 60-75% del totale. Le IgE sono non rilevabili. Le IgG nel colostro sono inizialmente pari a circa 15-30 g/l ma cadono molto rapidamente a circa 5 g/l il giorno 7 e sotto 1 g/l il giorno 14 (dati non pubblicati). La concentrazione di IgG nel latte è pertanto 20 volte inferiore a quella del colostro. Le IgA rappresentano il 16-40% delle Ig del colostro, per diventare in seguito il tipo di immunoglobulina più comune nel latte 7 10 (Figura 1). La maggior parte delle IgG proviene dal siero della madre, anche se una piccola frazione viene prodotta localmente nella ghiandola mammaria 11. Quest’ultima è responsabile della concentrazione di IgG, in modo tale che i livelli colostrali sono generalmente 3 volte superiori rispetto a quelli del flusso ematico materno, anche se non esiste alcuna relazione tra concentrazione colostrale di IgG e concentrazione nel siero materno 10 [12]. Questa concentrazione selettiva è sotto controllo endocrino, con le Ig conservate negli alveoli mammari fino al loro rilascio dopo il parto 13. D’altra parte, la maggior parte delle IgA e IgM sembra essere prodotta localmente nella ghiandola mammaria dai linfociti 13.
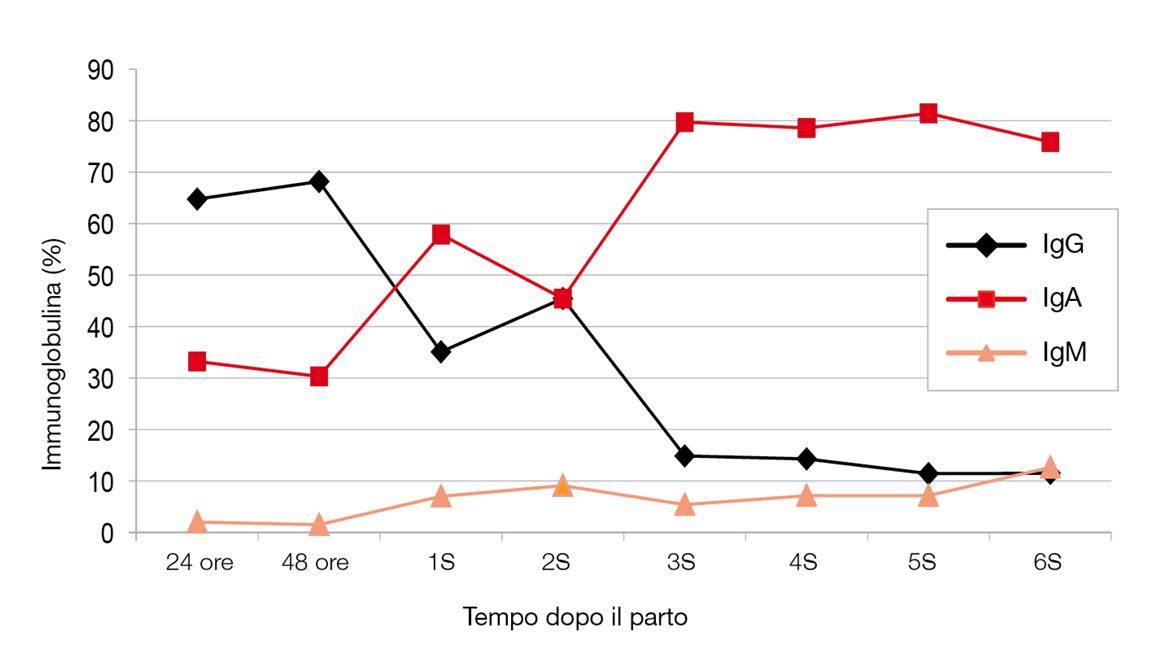
Nel colostro (ma non nel latte) si trovano anche inibitori della tripsina che riducono la degradazione delle Ig colostrali e possono aumentarne l’assorbimento da parte del neonato [14]. Il colostro contiene inoltre fattori antimicrobici (come lattoferrina e lisozima), ormoni (cortisolo, tiroxina, insulina e ormone della crescita) e fattori di crescita (ad esempio, fattori di crescita insulinosimili, fattore di crescita epidermica e fattore di crescita delle cellule nervose 15). Questi sono coinvolti nello sviluppo e nella maturazione di vari organi come ad esempio la tiroide e l’intestino, oltre ad essere essenziali per la crescita generale del cucciolo (vedere di seguito).
Il colostro canino possiede alti livelli di due enzimi, gamma-glutamil transferasi e fosfatasi alcalina, rispettivamente 100 e 10 volte più concentrati rispetto al siero materno [16]. Queste due sostanze chimiche sono sostanzialmente assenti dal sangue circolante alla nascita; per questo, il rilevamento di questi enzimi nel siero di un cucciolo conferma l’ingestione del colostro (sebbene i livelli enzimatici non siano correlati alla concentrazione di IgG).
Infine, il colostro canino contiene anche varie cellule compresi macrofagi, neutrofili e linfociti. Queste cellule vengono assorbite dal cucciolo prima che si chiuda la barriera intestinale, dopo di che entrano nella circolazione, oppure svolgono un ruolo nell’immunità cellulare, umorale, locale o digestiva 17.
Ruoli del colostro canino
Nei cani, la placenta endoteliocoriale è quasi completamente impermeabile alle molecole di grosse dimensioni come le immunoglobuline. Questo spiega perché i cuccioli nascono con bassi livelli di IgG circolanti (circa 0,3 g/l), al contrario degli 8-25 g/l dei cani adulti 3 [18] [19]. L’assunzione del colostro permette l’acquisizione dell’immunità passiva, di modo che la concentrazione sierica di IgG di un neonato 48 ore dopo l’ingestione del colostro sarà dell’ordine di 6 g/l; l’85-95% delle Ig circolanti di un cucciolo ha quindi origine colostrale 20. La fornitura di Ig, che è potenziata dalle antitripsine colostrali, è il ruolo più specifico del colostro ed è il fattore determinante per la sopravvivenza del cucciolo 3, dato che la mortalità del neonato è dovuta principalmente all’infezione [21]. La lattoferrina colostrale sembra giocare un ruolo marginale nell’immunità del cucciolo [22], mentre il ruolo delle cellule immunitarie presenti nel colostro non è ancora ben definito. Perché possa essere acquisita l’immunità passiva, i cuccioli devono ricevere il colostro nelle prime otto ore di vita (Figura 2).
Questo intervallo di tempo è critico per due ragioni:
- In primo luogo, le IgG colostrali diminuiscono rapidamente nelle prime ore dopo il parto.
- In secondo luogo, la rapida chiusura della barriera intestinale. Questo è il momento in cui le macromolecole (comprese le IgG) non possono più attraversare la parete intestinale per entrare nel flusso ematico; la conseguenza è che mentre alla nascita un cucciolo assorbe circa il 40% delle IgG colostrali ingerite, quattro ore dopo il parto assorbe solo il 20% e dodici ore dopo il parto appena il 9%. 24 ore dopo il parto, l’assorbimento è nullo 20.

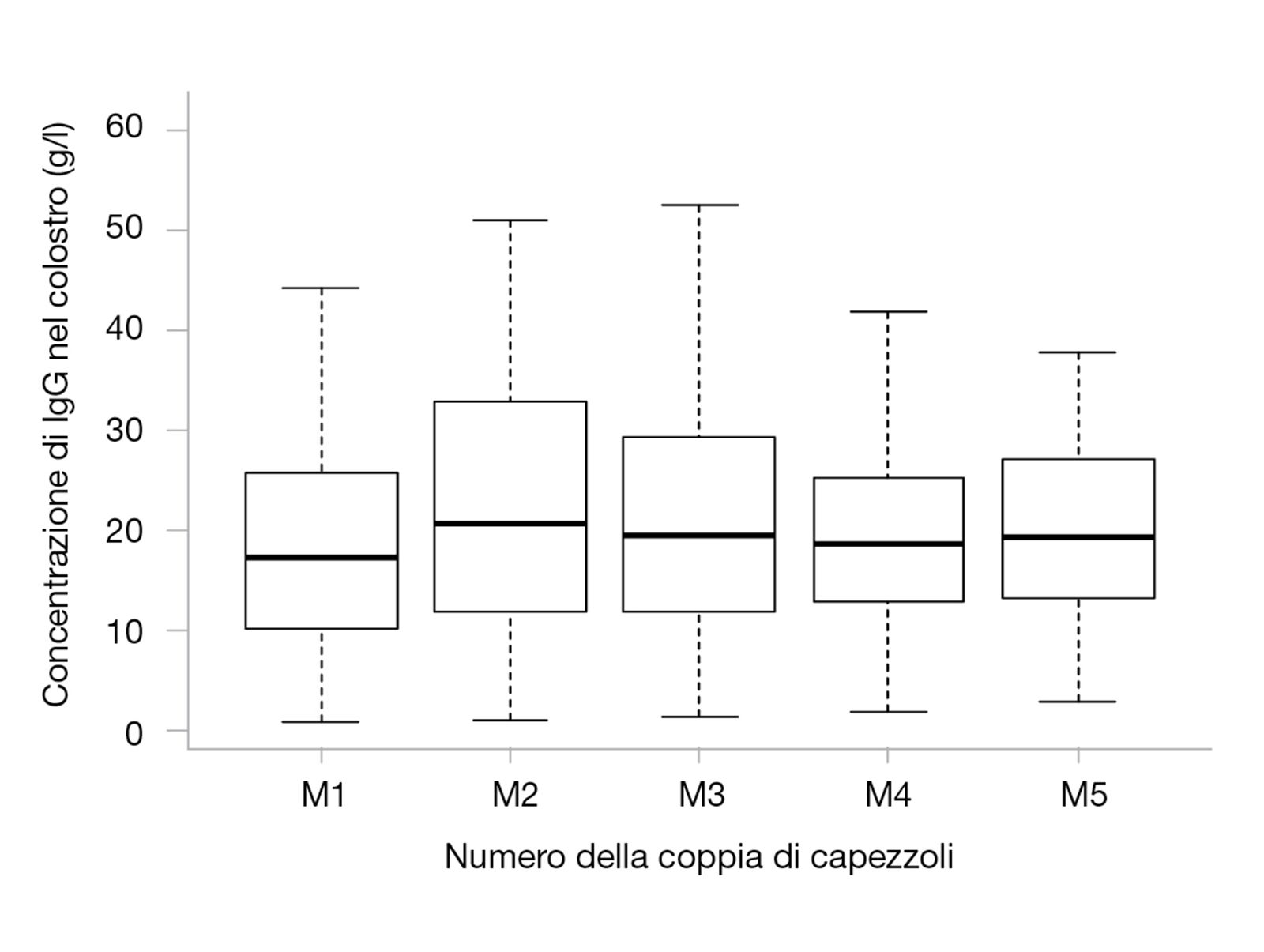
La qualità immunologica del colostro, in termini di concentrazione di IgG, è molto variabile sia tra una cagna e l’altra che tra coppie di capezzoli della stessa femmina (Figura 3). In uno studio sul colostro di 44 cagne di 13 razze diverse, provenienti dallo stesso allevamento, i livelli di IgG variavano tra una femmina e l’altra di un fattore 5; né l’età o la taglia della madre né le dimensioni della cucciolata, sembravano influire sulla qualità immunologica del colostro [12]. La concentrazione di IgG in 180 campioni da coppie diverse di capezzoli variava tra 0,8 e 61 g/l, con un coefficiente di variazione del 42% tra coppie di capezzoli della stessa cagna [12]. Tuttavia, la coppia di capezzoli che produce il colostro della massima qualità varia da un animale all’altro, quindi il consiglio di far alimentare i cuccioli su una determinata coppia di capezzoli non ha alcun valore. Ciò nonostante, la marcata variazione nella qualità immunologica tra una madre e l’altra (e tra coppie di capezzoli della stessa femmina) potrebbe significare che alcune cucciolate abbiano un rischio aumentato di mortalità neonatale.

Il colostro fornisce la maggior parte delle IgG per l’immunità sistemica mentre le IgA assicurano l’immunità locale e digestiva, in particolare l’immunità mucosale. Le IgA colostrali sono coinvolte nella difesa locale del tratto digerente e questo ruolo prosegue con l’ingestione del latte, che è ricco di IgA. Oltre alla frazione assorbita nel flusso ematico prima della chiusura della barriera intestinale, le IgA sono distribuite nelle sedi mucosali, sia digestive che non digestive 20 [23].
Sebbene il trasferimento delle Ig materne contribuisca a ridurre la mortalità neonatale, alla fine del periodo pediatrico, quando il cucciolo ha 6-8 settimane di età, l’immunità materna può interferire con la vaccinazione del cucciolo. Maggiore è la concentrazione di IgG acquisita a partire da due giorni di età, più alta sarà tale concentrazione nel periodo pediatrico 24 e questo aumenta il rischio che il cucciolo non sia protetto dopo la vaccinazione. Tuttavia, l’interferenza è variabile, essendo legata al singolo animale, all’immunogenicità del vaccino e alla dose somministrata.
Crescita
Alla nascita, i cuccioli hanno riserve di tessuto adiposo insufficienti e capacità di glicogenolisi limitate. È dunque indispensabile l’apporto energetico fornito dal colostro; la crescita è possibile solo se l’energia fornita supera i fabbisogni di mantenimento del cucciolo (Figura 4).
Sviluppo degli organi
Oltre alla crescita, il colostro è anche coinvolto nello sviluppo e nella maturazione di alcuni organi, in particolare il tratto digerente. Questo è legato agli ormoni e ai fattori di crescita colostrali. Uno studio ha segnalato che i tratti gastrointestinali di cuccioli che avevano ricevuto il colostro, mostravano uno sviluppo migliore del 60-95% rispetto a cuccioli dello stesso peso corporeo che avevano ricevuto una formulazione a base di latte sintetico [26]; tuttavia, altri studi non hanno fornito costantemente questo risultato [27].
Induzione della produzione e del rilascio di colostro
A volte una madre produce quantità di colostro limitate o nulle alla nascita o subito dopo il parto. Questa agalassia può essere causata da parto prematuro, taglio cesareo, endotossiemia o malnutrizione ma è più spesso dovuta allo stress post-partum, soprattutto nelle femmine primipare. È quindi sempre necessario fornire un’area tranquilla e calma per il parto e in alcuni casi può essere raccomandato somministrare un medicinale alle madri ansiose, in modo da incoraggiare la produzione di colostro (Tabella 2).| Medicinale | Effetto | Dosaggio |
| Acepromazina | Tranquillante; favorisce il rilascio di prolattina e aumenta la secrezione di colostro | 0,1-0,2 mg/kg SC |
| Metoclopramide | Rilascio di prolattina | 0,1-0,2 mg/kg PO o SC ogni 8 ore |
| Aglepristone | Riduce i livelli di progesterone, quindi favorisce il rilascio di prolattina | 15 mg/kg SC, 59-60 giorni dopo l’ovulazione. La somministrazione è raccomandata solo 20-24 ore prima del taglio cesareo |
| Ossitocina | Azione locale che stimola il rilascio ma non la produzione del colostro | 0,5-2 UI SC ogni 2 ore |
| Integrazione con semi di fieno greco o di finocchio | Stimola la secrezione lattea ma il meccanismo è sconosciuto | Somministrazione orale; dose ottimale sconosciuta |
Alternative al colostro
Quando la madre è assente o non produce abbastanza colostro, è essenziale fornire un sostituto per limitare la mortalità neonatale. I cuccioli devono ricevere come minimo una fonte di energia, sebbene sia desiderabile anche una fornitura di immunoglobuline. L’ideale sarebbe avere a disposizione un’altra cagna che abbia partorito meno di 2-3 giorni prima e farle adottare i cuccioli; in alternativa, è possibile aspirare da questa il colostro e somministrarlo ai cuccioli. Se la madre adottiva ha partorito più di 2-3 giorni prima, il suo latte garantisce energia sufficiente (poiché il valore energetico del latte è solo del 20% inferiore a quello del colostro) ma la fornitura di IgG sarà insufficiente poiché il latte contiene solo 1-2 g/l di IgG rispetto ai 20 g/l del colostro; quindi, un cucciolo richiederà 13-26 ml di latte per avere la stessa quantità di IgG ottenute da 1 ml di colostro. Non sono disponibili dati per i cuccioli ma gattini alimentati con il latte di una gatta adottiva non hanno mostrato alcun trasferimento significativo di IgG 28. I latti formulati sono privi di immunoglobuline canine e hanno una concentrazione energetica di circa 1 kcal/ml (cioè metà del colostro) [29]; quindi, ancora una volta, garantiscono un approvvigionamento nutrizionale ma nessun apporto immunologico.
Viceversa, il siero prelevato da un cane adulto contiene immunoglobuline ma con una concentrazione circa 3 volte inferiore rispetto al colostro e un valore energetico limitato. Gli studi sulla somministrazione alla nascita di siero canino per via orale a cuccioli privi di colostro hanno mostrato un aumento delle IgG circolanti ma con livelli molto inferiori rispetto al colostro standard [18] [19].
Tuttavia, uno studio [18] ha mostrato che la somministrazione orale alla nascita di siero canino a cuccioli cui era stato negato il colostro ha prodotto livelli di IgG ragionevoli. Questo suggerisce che, almeno in alcuni cuccioli, la somministrazione del siero possa garantire il raggiungimento della concentrazione protettiva minima di IgG (cioè, 2,3 g/l).
Attualmente, il colostro bovino come fonte di immunoglobuline eterologhe riveste interesse perché è facile da raccogliere ed è facilmente disponibile ma il suo valore immunologico o nutrizionale deve ancora essere valutato nei cuccioli. Un’altra fonte abbondante di Ig è costituita dalle IgY (da uova di gallina immunizzate); infatti un recente lavoro ha mostrato che è possibile fornire l’immunità ai cuccioli somministrando il siero contenente anticorpi specifici contro patogeni canini (E. coli e CPV2), ottenuto da uova iperimmunizzate; gli Autori hanno testato la somministrazione ai cuccioli di IgY orali prima della chiusura della barriera intestinale ottenendo risultati promettenti in termini di salute generale, con un aumento della crescita nelle prime tre settimane di vita (dati non pubblicati).
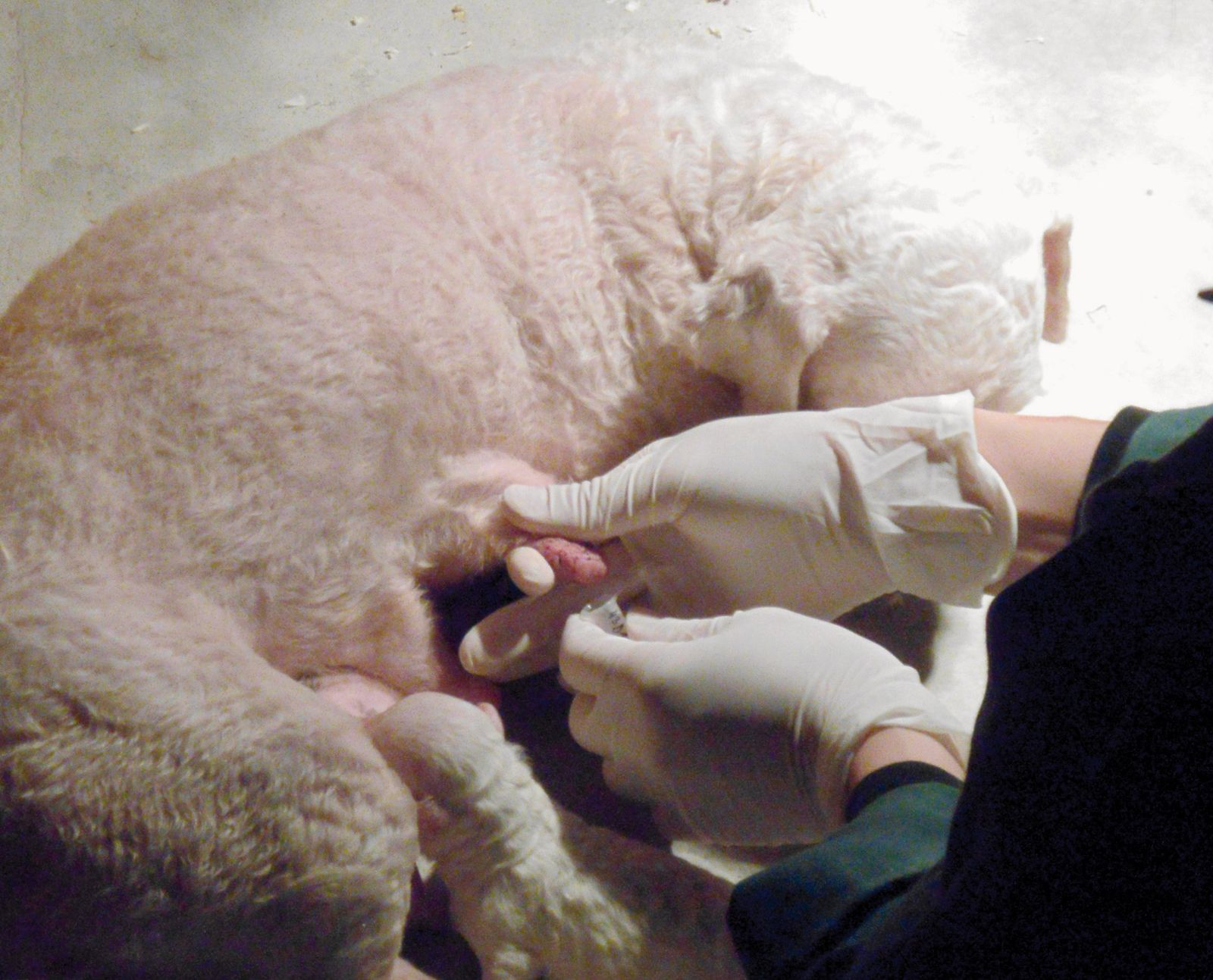
In assenza di un sostituto ideale, l’unica soluzione attualmente disponibile è creare una banca del colostro, come si fa attualmente con bovini e cavalli. Gli allevatori possono prelevare il latte da una cagna il secondo giorno dopo il parto (poiché questo garantisce che i suoi cuccioli abbiano acquisito l’immunità passiva). In generale, mungere una cagna in allattamento è facile; dopo la pulizia della cute con un sapone a base di clorexidina, il colostro può essere prelevato in piccole provette di plastica, quindi congelato (Figura 6). Quando serve, piccole quantità di colostro possono essere scongelate (a 37 °C evitando nel modo più assoluto il forno a microonde) e somministrate mediante biberon o sondino di alimentazione alla dose di 1,5 ml per 100 g di peso corporeo del cucciolo al giorno.
Conclusione
Il colostro canino è una secrezione di particolare composizione concepita per soddisfare le esigenze specifiche del cucciolo, cioè fornire in particolare l’immunità passiva, l’energia e alcuni fattori necessari per la crescita e la differenziazione degli organi. La quantità di colostro ricevuta può essere un fattore limitante la sopravvivenza di taluni cuccioli di una cucciolata, mentre rimane da esplorare l’impatto della nutrizione materna sulla quantità e qualità del colostro prodotto. Da un punto di vista pratico, lo sviluppo di un sostituto o integratore colostrale capace di fornire un supporto immunologico efficace contro i patogeni canini, nonché un apporto energetico, costituirebbe un avanzamento cruciale nel controllo della mortalità neonatale nei cuccioli.
Ringraziamenti
Gli autori desiderano ringraziare tutti coloro che hanno contribuito a migliorare le conoscenze sul colostro canino, in particolare Karine Reynaud, Elie Marcheteau, Marie-Blanche Bertieri, Jennifer Anne, Maelys Martin, Milène Gonnier, Lisa Rossig e Stéphanie Coinus.
Sylvie Chastant
DMV, PhD, Dip. ECAR, NeoCare, École Nationale Vétérinaire di Tolosa, Francia
Francia
La Dr.ssa Chastant ha conseguito la laurea in Medicina veterinaria nel 1990 presso la National Veterinary School di Alfort (Francia), e nel 1995 ha conseguito il dottorato di ricerca sull’analisi preimpianto di embrioni di mammifero. Diplomata ECAR (European College for Animal Reproduction), è attualmente docente all’Ecole Nationale Vétérinaire di Tolosa, dove insegna Riproduzione dei piccoli animali e dirige Neocare, un centro dedicato agli aspetti della neonatologia e pediatria del cucciolo e del gattino.
Hanna Mila
DVM, PhD, Assistant Professor
Francia
Hanna Mila si è laureata alla Facoltà di Medicina Veterinaria di Breslavia in Polonia nel 2009, dove ha lavorato per due anni presso la Clinica di medicina della riproduzione per piccoli animali. Nel 2012 è entrata a far parte della Clinica di medicina della riproduzione per piccoli animali della Scuola di Medicina Veterinaria di Tolosa. Nel settembre 2015 ha conseguito un dottorato con uno studio sui determinanti della sopravvivenza nei cuccioli. Oggi, Hanna Mila è cultrice della materia in allevamento del cane e del gatto presso la facoltà di Tolosa. I suoi interessi di ricerca riguardano la neonatologia e la pediatria canina, e in particolare i fattori di rischio sulla sopravvivenza di cuccioli e gattini, il loro monitoraggio e la gestione durante i primi mesi di vita.
References
- Mila H, Grellet A, Chastant-Maillard S. Prognostic value of birth weight and early weight gain on neonatal and pediatric mortality: a longitudinal study on 870 puppies. In: Program and Abstracts, 7th ISCFR Symposium 2012;163-164.
- Gill MA. Perinatal and late neonatal mortality in the dog. University of Sydney 2001. PhD thesis; available at; http://ses.library.usyd.edu.au/bitstream/2123/4137/1/m_gill_thesis_2001.pdf Accessed 23rd September 2015.
- Mila H, Feugier A, Grellet A, et al. Inadequate passive immune transfer in puppies: definition, risk factors and prevention in a large multi-breed kennel. Prev Vet Med 2014;116(1-2):209-213.
- Mila H, Grellet A, Feugier A, et al. Differential impact of birth weight and early growth rate on neonatal mortality in puppies. J Anim Sci 2015;93(9):4436-4442.
- Adkins Y, Lepine AJ, Lonnerdal B. Changes in protein and nutrient composition of milk throughout lactation in dogs. Am J Vet Res 2001;62(8):1266-1272.
- Bebiak DM, Lawler DF, Reutzel LF. Nutrition and management of the dog. Vet Clin North Am Small Anim Pract 1987;17(3):505-533.
- Schäfer-Somi S, Bär-Schadler S, Aurich JE. Immunoglobulins in nasal secretions of dog puppies from birth to six weeks of age. Res Vet Sci 2005;78(2):143-150.
- Cost chescu E, Hoha G, Fotea L. Research regarding the lactating period of the bitch. Lucr tiin Ser Zooteh 2011;55:180-183.
- Norcross N. Secretion and composition of colostrum and milk. J Am Vet Med Assoc 1982;181(10):1057-1060.
- Chastant-Maillard S, Marcheteau E, Freyburger L, et al. Identification and quantification of immunoglobulins in canine colostrum – Quantification of colostral transfer. In Proceedings, 7th EVSSAR Congress 2010;107.
- Stoffel MH, Friess AE, Hartmann SH. Ultrastructural evidence of transplacental transport of immunoglobulin G in bitches. J Reprod Fertil 2000;118(2):315-326.
- Mila H, Feugier A, Grellet A, et al. Immunoglobulin G concentration in canine colostrum: evaluation and variability. J Reprod Immunol 2015;112:24-28.
- Hurley WL, Theil PK. Perspectives on immunoglobulins in colostrum and milk. Nutrients 2011;3(4):442-474.
- Levieux D, Ollier A. Bovine immunoglobulin G, lactalbumin and serum albumin in colostrum and milk during the early post-partum period. J Dairy Res 1999;66(03):421-430.
- White ME, Hathaway MR, Dayton WR, et al. The role of growth factors in canine and feline milk. 1996; Available at: http://agris.fao.org/agris-search/ search.do?recordID=US9620653. Accessed 18th August 2015.
- Center S, Randolph JF, Man Warren T, et al. Effect of colostrum ingestion on gamma-glutamyltransferase and alkaline phosphatase activities in neonatal pups. Am J Vet Res 1991;52(3):499-504.
- Wheeler TT, Hodgkinson AJ, Prosser CG, et al. Immune components of colostrum and milk – a historical perspective. J Mam Gland Biol Neoplasia 2007;12(4):237-247.
- Bouchard G, Plata-Madrid H, Youngquist RS, et al. Absorption of an alternate source of immunoglobulin in pups. Am J Vet Res 1992;53(2):230-233.
- Poffenbarger EM, Olson PN, Chandler ML, et al. Use of adult dog serum as a substitute for colostrum in the neonatal dog. Am J Vet Res 1991;52(8):1221-1224.
- Chastant-Maillard S, Freyburger L, Marcheteau E, et al. Timing of the intestinal barrier closure in puppies. Reprod Dom Anim 2012;47:190-193.
- Meloni T, Martino P, Grieco V, et al. A survey on bacterial involvement in neonatal mortality in dogs. Vet Ital 2014;50(4):293-299.
- Handl S, Wehr U, Zentek J, et al. Histological and immunohistochemical evaluation of duodenal and colonic biopsies after oral bovine lactoferrin supplementation in beagle puppies. J Anim Physiol Anim Nutr 2009;93(1):76-82.
- Salmon H, Berri M, Gerdts V, et al. Humoral and cellular factors of maternal immunity in swine. Dev Comp Immunol 2009;33(3):384-393.
- Mila H, Grellet A, Desario C, et al. Protection against canine parvovirus type 2 infection in puppies by colostrum-derived antibodies. J Nutr Sci 2014. Available at: http://journals.cambridge.org/article_S2048679014000573. Accessed 18 August 2015.
- Mila H, Grellet A, Feugier A, et al. Nutritional and immunological composition of canine colostrum. In Proceedings, 18th EVSSAR Congress 2015.
- Heird WC, Schwarz SM, Hansen IH. Colostrum-induced enteric mucosal growth in beagle puppies. Pediatr Res 1984;18(6):512-515.
- Schwarz SM, Heird WC. Effects of feeding on the small intestinal mucosa of beagle pups during the first 5 days of life. Am J Clin Nutr 1994;60(6):879- 886.
- Claus MA, Levy JK, MacDonald K, et al. Immunoglobulin concentrations in feline colostrum and milk, and the requirement of colostrum for passive transfer of immunity to neonatal kittens. J Feline Med Surg 2006;8(3):184- 191.
- Heinze CR, Freeman LM, Martin CR, et al. Comparison of the nutrient composition of commercial dog milk replacers with that of dog milk. J Am Vet Med Assoc 2014;244(12):1413-1422.
Altri articoli di questo numero
Condividi sui social media