Monitoraggio continuo del glucosio nei gatti diabetici
Scritto da J. Catharine Scott-Moncrieff
Oggi, i recenti progressi tecnologici consentono al Medico Veterinario di accedere facilmente al monitoraggio continuo del glucosio nei gatti diabetici, come descritto in questo articolo.
Article
Punti chiave
La valutazione della risposta di un gatto all’insulina deve includere la valutazione dei segni clinici, la misurazione della glicosuria e della glicemia, e la determinazione dei livelli ematici di fruttosamina.
Le limitazioni delle curve glicemiche tradizionali includono il costo, lo stress dovuto alle punture venose multiple, e la variabilità inter-giorno marcata nei risultati glicemici.
Il monitoraggio continuo del glucosio sta sostituendo la tradizionale curva glicemica per la valutazione del controllo glicemico.
I limiti del monitoraggio continuo del glucosio includono la difficoltà a mantenere in sede i sensori, oltre al guasto e ai malfunzionamenti degli stessi.
Introduzione
Il diabete mellito (DM) è un disturbo comune nei gatti geriatrici [1] e la sua gestione appropriata richiede un attento monitoraggio della risposta all’insulinoterapia, considerato che un controllo glicemico appropriato può portare in molti casi alla remissione del diabete [2],[3],[4]. La recente introduzione della tecnologia che consente il monitoraggio continuo del glucosio interstiziale ha determinato notevoli miglioramenti nella capacità del veterinario di supervisionare e migliorare il controllo glicemico negli animali affetti [5],[6],[7],[8],[9].
Il DM di tipo II è il tipo più comune di DM nei gatti ed è caratterizzato da una secrezione anomala di insulina dal pancreas, in combinazione con un’insulinoresistenza periferica. La diagnosi si basa sulla presenza di segni clinici (poliuria, polidipsia, polifagia e perdita di peso), e sulla documentazione di iperglicemia e glicosuria [2],[3]. Nel gatto, la diagnosi è complicata dall’iperglicemia da stress, motivo per cui è importante non solo documentare la persistenza dell’iperglicemia e della glicosuria, ma anche escludere altre malattie che possono causare segni clinici simili, come ad esempio l’ipertiroidismo e la malattia gastrointestinale. Il trattamento del DM felino si basa sull’insulinoterapia, sulla modifica della dieta, sulla gestione della malattia concomitante e sulla gestione del peso, e molti gatti diabetici di tipo II raggiungono la remissione se il trattamento insulinico determina un controllo glicemico valido. I fattori che influenzano la probabilità di remissione includono la gravità della malattia pancreatica, la presenza di insulinoresistenza causata da malattie o terapie farmacologiche concomitanti, l’obesità e la capacità di fornire una dieta a basso contenuto di carboidrati [10],[11]. La progressiva perdita delle cellule beta può finire per determinare la progressione verso il DM di tipo 1, ed è per questo che un controllo glicemico ottimale è la chiave per un esito positivo nei gatti affetti.
Insulinoterapia
Tipi di insulina
Esistono tre prodotti a base di insulina appropriati per il trattamento di prima linea del DM felino (Tabella 1); insulina zinco protamina (PZI), insulina lenta (sospensione di insulina zinco porcina) e insulina glargina, un analogo dell’insulina [3]. Si può usare anche detemir (un altro analogo dell’insulina), ma non è una scelta di prima linea a causa del suo costo. L’insulina NPH (Neutral Protamine Hagedorn, protamina neutra di Hagedorn) tende ad avere una durata d’azione molto breve nei gatti, e non è raccomandata.
La dose di avvio dell’insulina per un nuovo paziente diabetico felino è di 1-3 U/gatto (0,25-0,5 Unità/kg) e l’autrice raccomanda il limite inferiore di questa dose. Qualunque sia la formulazione scelta, è più probabile che due iniezioni al giorno determinino un controllo glicemico ottimale rispetto alla terapia una volta al giorno. Se il primo dosaggio non è possibile, in alcuni gatti iniezioni effettuate una volta al giorno con PZI o glargina possono determinare un controllo efficace dei segni clinici.
Tabella 1. Prodotti a base di insulina raccomandati per l’uso nei gatti.
|
Insulina lenta: 65% cristallina e 35% amorfa Insulina PZI: insulina in complesso con protamina e zinco Glargina: analogo dell’insulina Detemir: analogo dell’insulina |
Obiettivi del trattamento insulinico
L’obiettivo primario dell’insulinoterapia nei gatti affetti è controllare i segni clinici del DM evitando l’ipoglicemia. Un obiettivo secondario può includere il raggiungimento della remissione diabetica. Il piano per il monitoraggio deve tenere conto dello stile di vita del proprietario, di qualsiasi malattia concomitante, dell’età del paziente, e della praticità del monitoraggio rigoroso del glucosio. La probabilità di remissione nei gatti è maggiore con un controllo glicemico più serrato; tuttavia, l’ipoglicemia grave è potenzialmente letale e può causare danni neurologici permanenti. L’ipoglicemia indotta dall’insulina causa anche la secrezione di ormoni che si oppongono all’azione dell’insulina, come ad esempio glucagone, ormone della crescita, cortisolo ed epinefrina, che possono avviare l’insulinoresistenza e peggiorare il controllo del diabete.
Idealmente, la glicemia dovrebbe essere mantenuta a 80-200 mg/dL (4,4-11,1 mmol/L), ma la maggior parte dei gatti diabetici ha talvolta livelli superiori a questo intervallo. Tuttavia, la maggior parte dei gatti è clinicamente ben regolata se la concentrazione glicemica viene mantenuta inferiore a 300 mg/dL (16,7 mmol/L) per la maggior parte della giornata, perché il livello tubulare massimo per il riassorbimento del glucosio dal rene felino è di circa 270 mg/dL (15 mmol/L) [12]. È importante ricordare che è difficile valutare la durata d’azione dell’insulina se il nadir del glucosio è nell’intervallo ipoglicemico, perché la secrezione di ormoni controregolatori, come ad esempio il glucagone, aumenta prematuramente la glicemia. La strategia di monitoraggio ideale per valutare la risposta al trattamento insulinico nei gatti diabetici dev’essere personalizzata per il paziente e il proprietario
Monitoraggio tradizionale dei pazienti diabetici
Fino a poco tempo fa, i principali strumenti di monitoraggio a disposizione del veterinario erano la valutazione dei segni clinici e del peso corporeo, unitamente alla misurazione seriale delle concentrazioni glicemiche, della glicosuria, e delle proteine glicosilate.
Segni clinici
L’obiettivo terapeutico più importante per qualsiasi gatto diabetico è controllare i segni clinici della malattia. I gatti con controllo glicemico scadente hanno tipicamente segni persistenti e perdita di peso progressiva, mentre l’ipoglicemia grave può causare segni intermittenti come ad esempio debolezza, letargia, e crisi convulsive. Un’ipoglicemia più lieve sfugge facilmente all’identificazione, perché potrebbe non provocare segni clinici evidenti, pur contribuendo a determinare un controllo glicemico inadeguato.
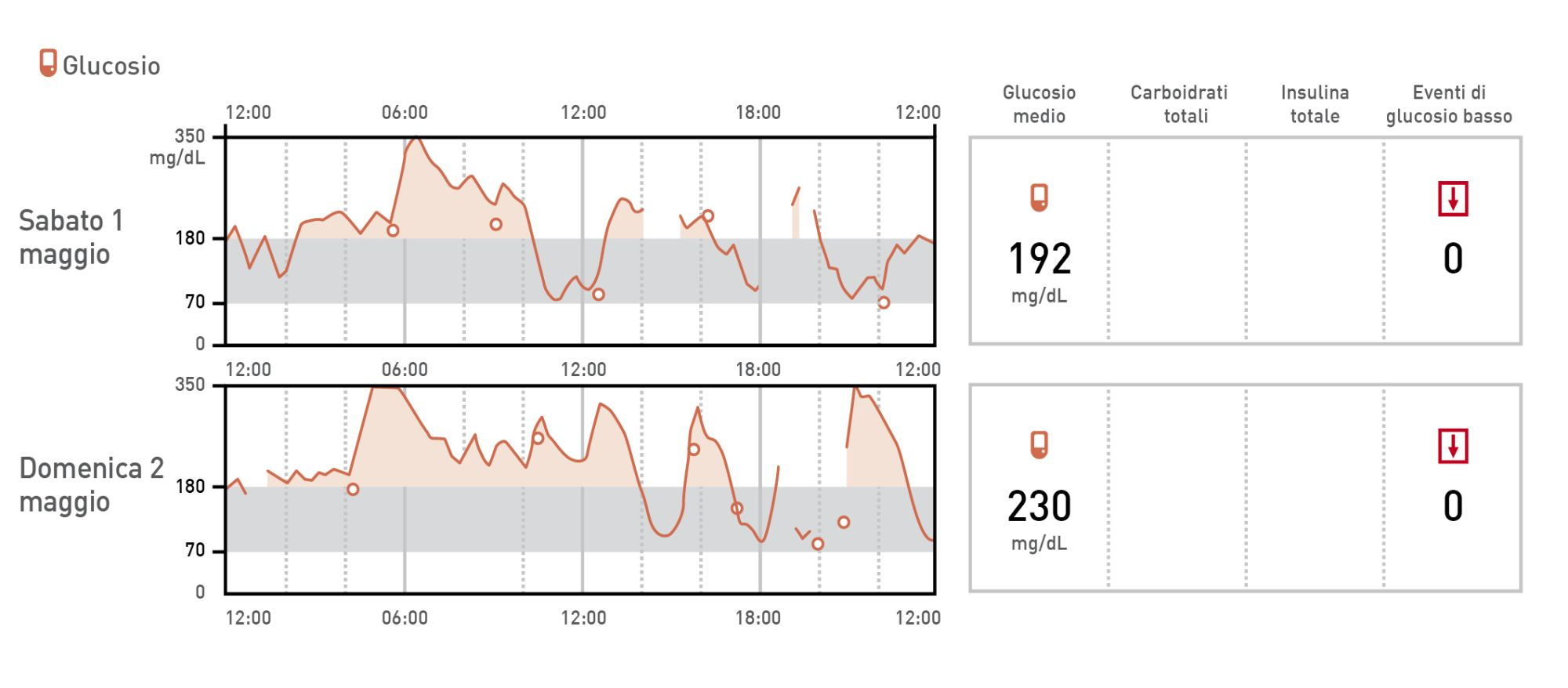
Curve glicemiche
Le tradizionali curve glicemiche valutate in clinica o a casa sono state per molti anni lo standard di riferimento nella valutazione del controllo glicemico nei gatti, ma questo metodo ha numerosi limiti. Il metodo è costoso e richiede il prelievo di campioni multipli, causando stress al paziente e al proprietario. Inoltre, le curve glicemiche mostrano una marcata variabilità inter-giorno, anche se eseguite dal proprietario a casa (Figura 1) [13]. Inoltre, l’interpretazione scorretta dei risultati può produrre decisioni terapeutiche errate.

© Shutterstock
Proteine glicosilate
La misurazione delle proteine glicosilate, come ad esempio fruttosamina ed emoglobina A1C (HbA1c) consente di valutare il controllo glicemico a lungo termine e può aiutare nell’interpretazione delle curve glicemiche. Il glucosio si lega irreversibilmente alle proteine sieriche e all’emoglobina, e questi prodotti persistono per tutta la vita della proteina; i prodotti risultanti possono essere misurati nel siero o nel sangue intero, rispettivamente. La fruttosamina indica l’adeguatezza del controllo glicemico nelle 1-2 settimane precedenti, mentre HbA1c riflette il controllo glicemico nelle 4-6 settimane precedenti [14],[15],[16].Glicosuria
Anche la misurazione della concentrazione di glucosio urinario può essere utile per valutare il controllo glicemico, soprattutto nei gatti che stanno entrando in remissione, come pure per rilevare l’eventuale recidiva del diabete dopo la remissione. Il glucosio urinario non va utilizzato per determinare la dose giornaliera di insulina, ma le tendenze della glicosuria possono essere molto utili per valutare il controllo del diabete, soprattutto se valutate regolarmente e registrate in un diario o registro. Inoltre, la presenza di chetoni urinari può aiutare a indicare una chetoacidosi diabetica imminente.
L’aggiunta del monitoraggio continuo del glucosio alla cassetta degli attrezzi del veterinario ha migliorato la capacità di monitorare accuratamente i gatti diabetici trattati con l’insulina.
Monitoraggio continuo del glucosio
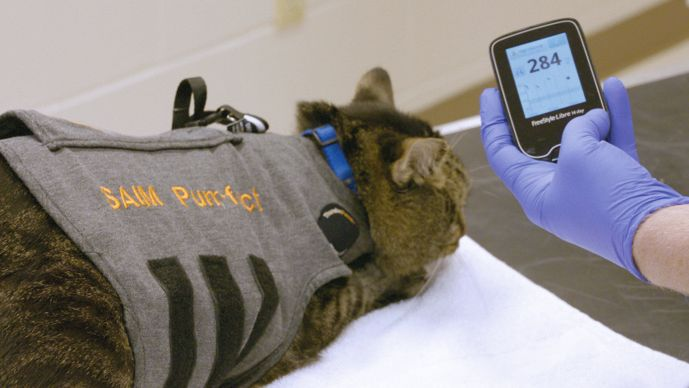
Oggi, i sistemi CGM (Continuous Glucose Monitoring, monitoraggio continuo del glucosio) consentono la valutazione continua della concentrazione di glucosio nel sangue interstiziale per un tempo massimo di 14 giorni tramite un piccolo catetere flessibile inserito per via sottocutanea. L’aggiunta del CGM alla cassetta degli attrezzi del veterinario ha migliorato la capacità di monitorare accuratamente i gatti diabetici trattati con l’insulina, ed è più sensibile rispetto alle tradizionali curve del glucosio per identificare l’ipoglicemia. Il metodo consente di titolare la dose di insulina in tempo reale e di adeguarla alle differenze tra i fabbisogni diurni e notturni. Studi di convalida su pazienti veterinari hanno dimostrato che, nella maggior parte dei casi, la concentrazione di glucosio interstiziale è ben correlata alla concentrazione glicemica, e gli attuali sistemi CGM utilizzati in medicina veterinaria sono convenienti, facili da applicare e utilizzare, e ben tollerati dai pazienti. Consentono un’analisi integrata delle variazioni del glucosio interstiziale nel paziente per un periodo di 14 giorni. Il dispositivo più comune attualmente in uso è il monitor del glucosio interstiziale da 14 giorni Freestyle LibreTM (FSL) (Figura 2), che è stato convalidato nei gatti. I modelli Freestyle LibreTM 2 e 3 sono stati utilizzati anche nei gatti, ma la loro accuratezza non è ancora stata riportata in modo esauriente nella letteratura a revisione paritetica. Sul mercato esistono altri sistemi di monitoraggio continuo del glucosio, inclusi Dexcom-CGMTM ed Eversense CGMTM, ma ancora una volta questi sistemi non sono stati ancora valutati nei gatti.
In termini di indicazioni per l’uso, FSL è oggi uno strumento importante per il trattamento di pazienti con chetoacidosi diabetica, in quelli che hanno appena ricevuto una diagnosi di DM, e nei pazienti diabetici instabili, dove può essere utilizzato in modo continuativo fino a ottenere un controllo glicemico migliore. È anche molto utile per il monitoraggio intermittente di routine dei pazienti stabili.
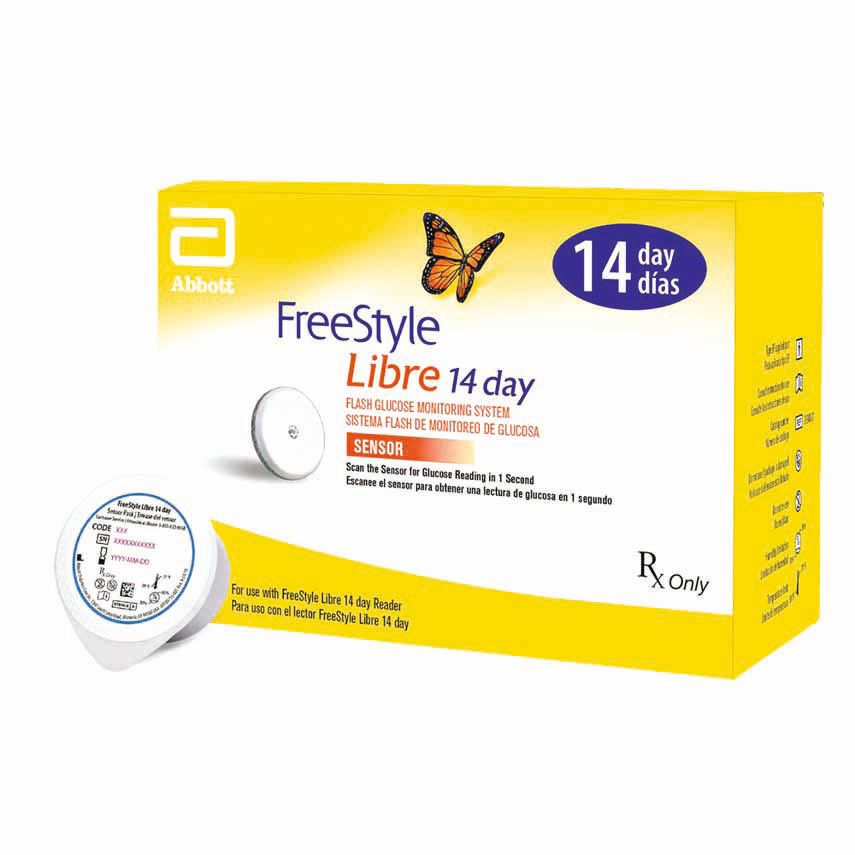
© Abbott
Accuratezza del monitor FSL
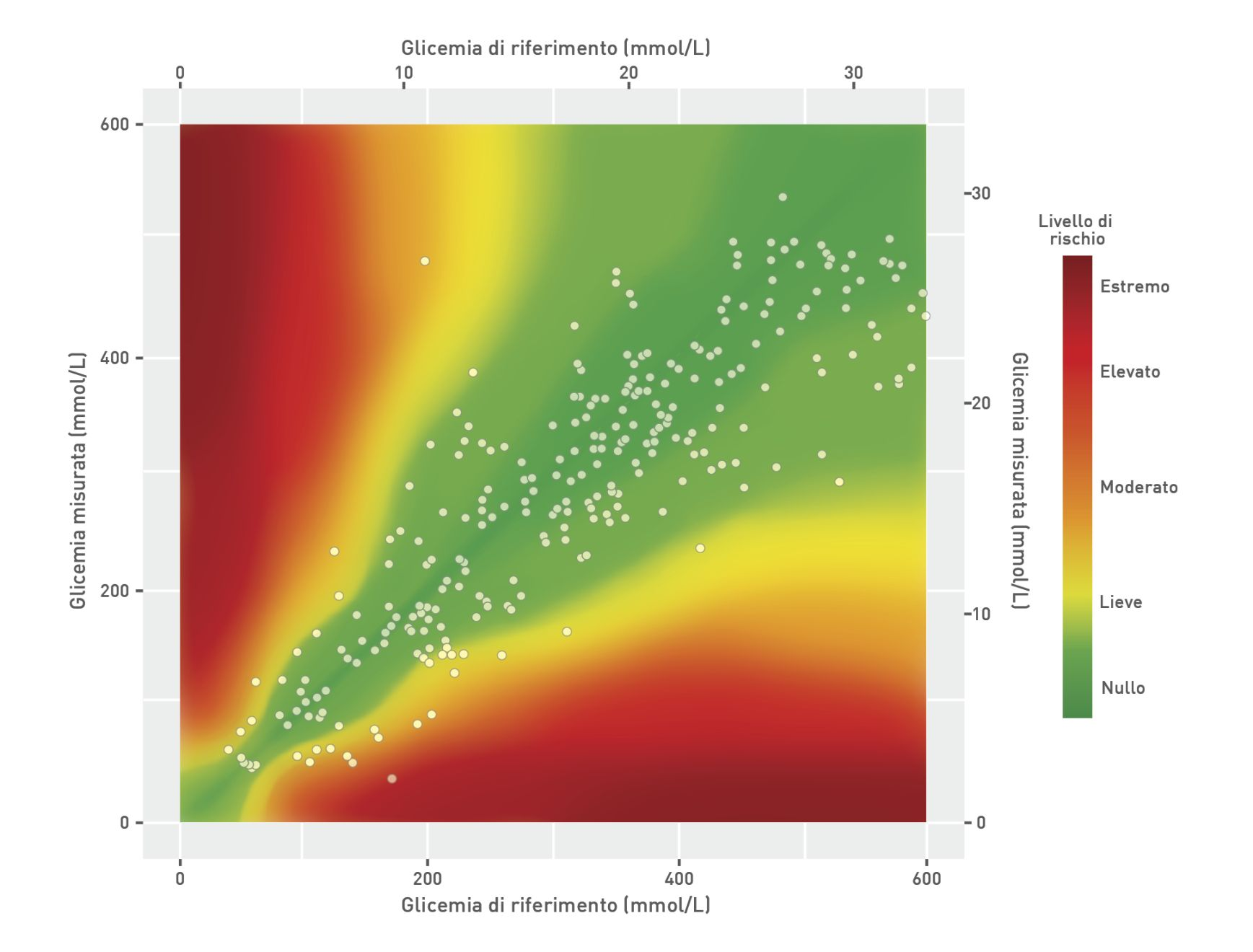
Molti studi hanno esaminato l’accuratezza del dispositivo FSL da 14 giorni nei gatti [5],[6],[7],[8]. In questi studi, il glucosio interstiziale misurato dal sensore mostrava una buona correlazione con il glucosio nel sangue periferico misurato con un glucometro point-of-care (POC) e anche con un analizzatore biochimico automatizzato. La maggior parte degli studi indica che FSL sottostima leggermente la glicemia rispetto al valore reale, ma la valutazione mediante analisi della griglia degli errori di sorveglianza indica una buona accuratezza clinica (Figura 3) [5]. È importante riconoscere che esiste un intervallo massimo di 30 minuti tra le variazioni della glicemia e le variazioni del glucosio interstiziale; quindi, le misurazioni possono differire leggermente [8], e la differenza tra le due misure è più marcata quando la glicemia cambia rapidamente. La maggior parte degli studi ha mostrato una correlazione leggermente più limitata tra glicemia e glucosio interstiziale nell’intervallo ipoglicemico, ma ciò potrebbe essere dovuto al minor numero di campioni ipoglicemici negli studi pubblicati, nonché all’effetto dei cambiamenti rapidi nella glicemia.
La valutazione del sensore Libre 2 è stata finora pubblicata solo come un singolo abstract [17], da cui emerge che il sensore ha sottostimato leggermente la glicemia negli intervalli lievemente ipoglicemici ed euglicemici, mentre ha sovrastimato i livelli a concentrazioni del glucosio molto basse (<49 mg/dL/ 2,7 mmol/L).
Nel complesso, gli studi suggeriscono che, nella maggior parte dei gatti diabetici, la differenza tra glucosio interstiziale e glicemia ha un impatto minimo o nullo sul processo decisionale clinico, ed FSL è sufficientemente accurato per il monitoraggio dei gatti affetti. Il dispositivo non è stato ancora valutato nei gatti con chetoacidosi diabetica (DKA), ma nell’ospedale dell’autrice è molto utile per i gatti di questa categoria; inoltre, è noto che nei cani le prestazioni del dispositivo non sono influenzate dalla chetosi; tuttavia, l’accuratezza è inferiore negli animali disidratati [18],[19]. È stato anche dimostrato che lo spessore della cute influenza l’accuratezza del dispositivo nei cani [20], ma questo aspetto non è stato valutato nei gatti.
© Ridisegnata da Sandrine Fontègne
Uso del monitoraggio con FSL
Il sensore da 14 giorni di FSL è un dispositivo monouso con diametro di 35 mm e spessore di 5 mm (Figura 4), cosa che consente di accedere in tempo reale alle misurazioni del glucosio interstiziale facendo passare uno scanner sul sensore. È possibile acquistare un lettore dedicato e utilizzarlo più volte con sensori sequenziali, il che è vantaggioso per i pazienti ospedalizzati; in alternativa, esistono app gratuite per la maggior parte dei dispositivi Android o iPhone che possono essere utilizzate per scansionare il sensore. Con entrambe le opzioni, i dati possono quindi essere caricati su un computer o sul sito Web di LibreView utilizzando un software gratuito. Per il sensore Freestyle LibreTM 14 giorni, il lettore e l’app possono essere utilizzati insieme, purché si usi inizialmente il lettore per configurare il sensore. Questo non vale per il sensore Libre 2, dove il lettore e l’app dello smartphone non possono essere utilizzati in modo intercambiabile. L’acquisto del sensore e del lettore da una farmacia al dettaglio richiede una prescrizione negli USA, ma non nella maggior parte delle altre aree del mondo.

© J. Catharine Scott-Moncrieff
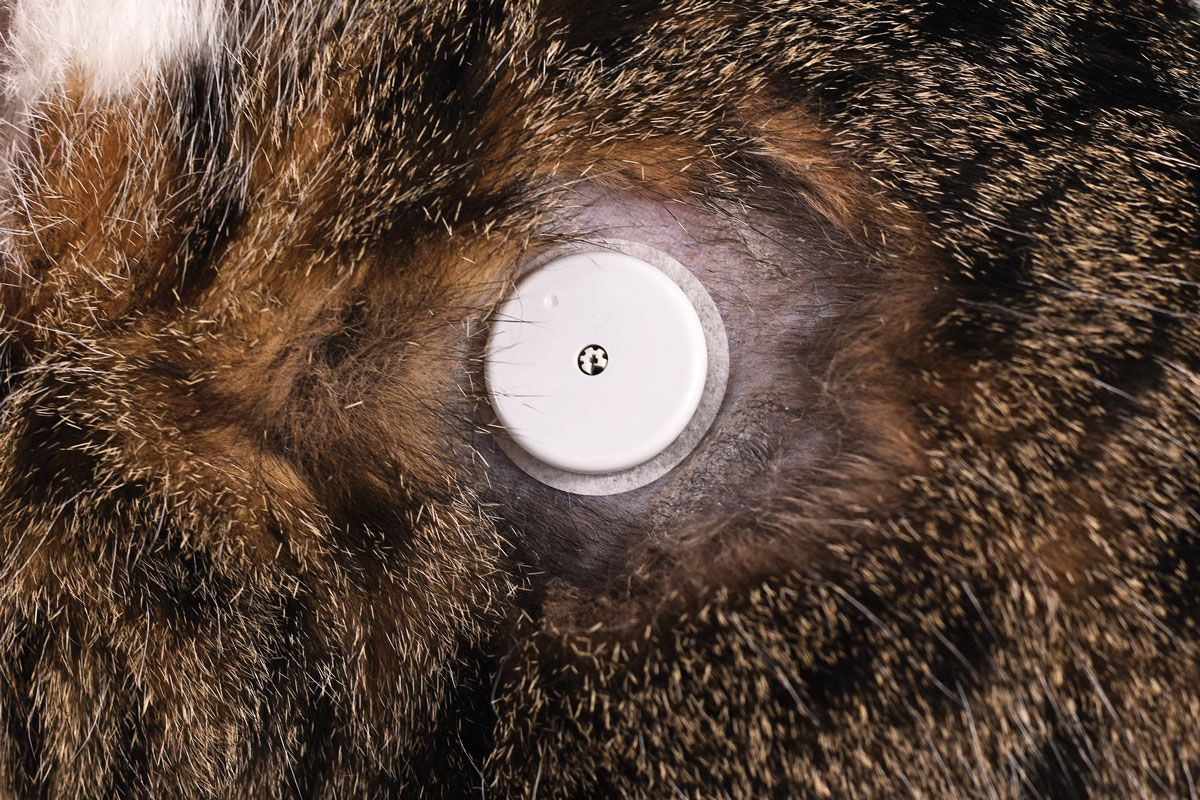
Per preparare l’installazione del sensore, un’area cutanea (circa 5 cm x 5 cm) leggermente più ampia del sensore viene rasata e disinfettata con un tampone imbevuto di alcol. Il sensore viene caricato nell’applicatore (Figura 5), e sul contorno della superficie inferiore del disco si mettono 4-8 gocce di colla tissutale, come le ore dell’orologio. L’applicatore viene quindi applicato, assicurandosi che venga tenuto con le giuste angolature rispetto alla superficie cutanea ed eviti le prominenze ossee. Una volta rilasciato il sensore, l’ago rilascia la sonda nel sottocute, e il disco resta fissato alla superficie cutanea. Per avviare il sensore, che sarà pronto per l’uso 60 minuti dopo, si usa quindi un lettore o uno smartphone. Esistono molte possibili sedi corporee utilizzabili sull’animale, ma la posizione migliore è tipicamente la parete toracica dorso-laterale o tra le spalle (Figura 6). È importante evitare qualsiasi contatto con collari o pettorine che potrebbero applicare sollecitazioni di taglio sul sensore.

© J. Catharine Scott-Moncrieff
© Shutterstock
A seconda del singolo paziente, il sensore può essere lasciato scoperto oppure protetto da un cerotto adesivo, una T-shirt, un maglione per pet o simili (Figura 7). Nei pazienti attivi o che vivono con altri gatti che potrebbero tentare di rimuovere il sensore va certamente utilizzata una copertura, e non è necessario rimuovere alcun rivestimento per recuperare i dati dal lettore. Sebbene il sensore sia impermeabile, non è consigliabile fare il bagno all’animale, né lasciarlo nuotare mentre il sensore è in sede. Una volta scaduto, il sensore può essere facilmente rimosso staccandolo delicatamente dalla cute, utilizzando eventualmente alcool od olio per neonati per rimuovere la colla.
FSL misura il glucosio interstiziale ogni minuto e memorizza questi dati ogni 15 minuti nel disco sensore per un massimo di 14 giorni. Il disco può memorizzare fino a 8 ore di dati, ma a ogni scansione del sensore i dati vengono caricati sul lettore o sullo smartphone. Il sensore può essere scansionato in qualsiasi momento, ma per ottenere letture continue questo dovrebbe avvenire almeno ogni 8 ore per evitare che i dati vengano sovrascritti. I dati possono quindi essere caricati su un computer o sul sito Web di LibreView e visualizzati online o come file PDF in qualsiasi momento durante la vita utile del sensore. Il sito Web di LibreView consente di archiviare nel cloud i dati di più pazienti, e vi possono accedere sia il proprietario che il team veterinario. Il software gratuito consente all’utente di generare un rapporto riassuntivo, che può essere visualizzato online o scaricato in formato PDF.

© J. Catharine Scott-Moncrieff
Complicanze del CGM
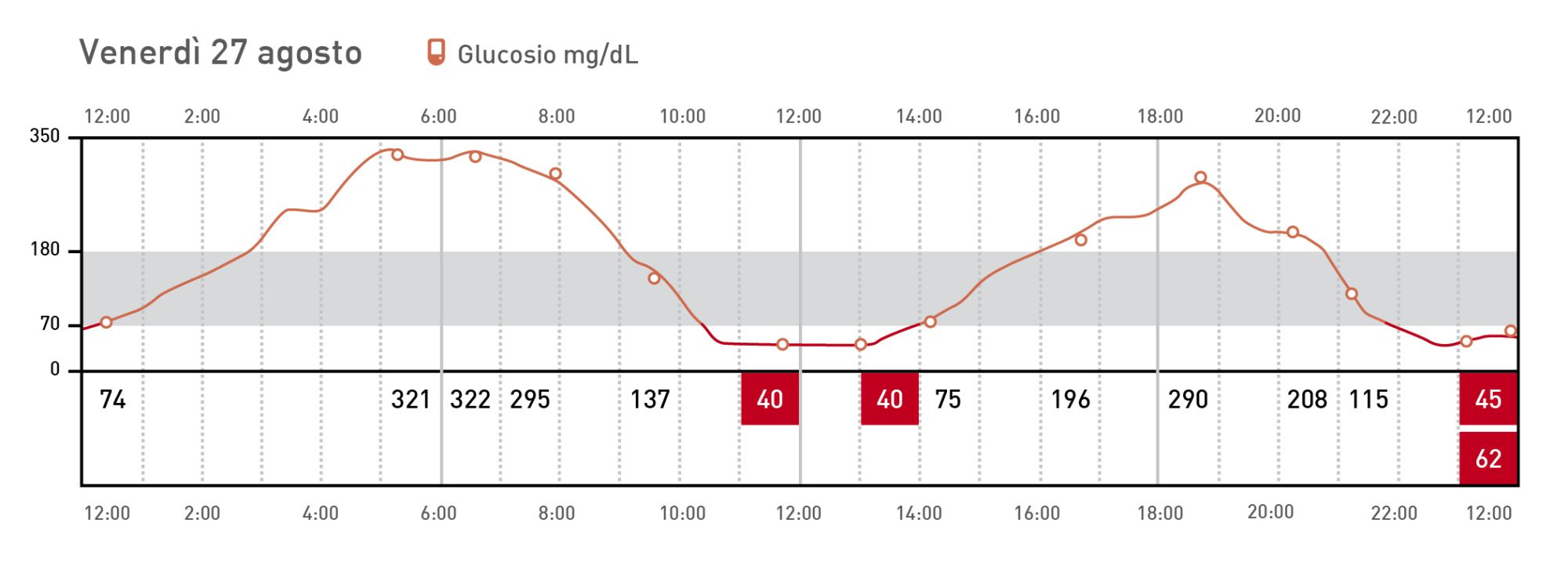
Sebbene esista in generale una buona correlazione tra glicemia e glucosio interstiziale, con l’uso del sensore possono sorgere problemi. Questi includono messaggi di errore, ritardi nella segnalazione del glucosio misurato, letture costantemente alte o basse che non sono correlate al quadro clinico, lacune nei dati, e fluttuazioni rapide nel glucosio interstiziale segnalato (Figura 8). Qualche volta è pure possibile avere un guasto totale del sensore. Un’altra piccola considerazione è che, sebbene il dispositivo misuri concentrazioni di glucosio comprese tra 40 e 500 mg/dL, i grafici generati nei rapporti non visualizzano le concentrazioni di glucosio superiori a 350 mg/dL (19,4 mmol/L). In caso di dubbi sull’accuratezza delle letture, la glicemia va controllata con un glucometro POC convalidato o un analizzatore biochimico automatizzato. A volte possono anche svilupparsi complicanze relative al paziente; queste includono eritema nella sede di applicazione e (raramente) formazione di un ascesso; quindi, se si devono usare sensori sequenziali in un singolo paziente, occorre cambiare la sede di applicazione per evitare di utilizzare la stessa sede due volte. Inoltre, sebbene FSL possa misurare il glucosio interstiziale per un massimo di 14 giorni, in molti pazienti si stacca prima, e nei gatti la vita media del sensore è di circa 8 giorni.
© Ridisegnata da Sandrine Fontègne
Interpretazione dei dati
Il report di riepilogo di FSL, che può essere visualizzato sul sito Web del produttore o tramite un software scaricabile gratuitamente, ha varie opzioni di visualizzazione. Registro giornaliero e Riepilogo settimanale mostrano le curve di singoli giorni, mentre Approfondimenti sui modelli glicemici e Profilo glicemico ambulatoriale mostrano la media dei dati nel tempo. Ciò consente di valutare, sia la variabilità inter-giorno, sia le tendenze settimanali. I report consentono al Medico Veterinario di valutare la dose e la durata dell’insulina, e determinare se esistono differenze nei fabbisogni di insulina del giorno rispetto alla notte. Ciò consente anche di valutare accuratamente il controllo glicemico nei gatti che ricevono insulina una volta al giorno. Un altro grande vantaggio è la capacità di valutare la variabilità inter-giorno della risposta all’insulina e determinare la frequenza degli eventi di ipoglicemia e iperglicemia.
L’interpretazione delle curve individuali è simile a quella di una curva glicemica tradizionale, ma con la possibilità di apprezzare meglio la variabilità inter-giorno. Il nadir del glucosio, la durata dell’effetto dell’insulina, e i livelli medi di glucosio possono essere facilmente determinati. Idealmente, per la maggior parte della giornata il nadir del glucosio dovrebbe essere di 80-150 mg/dL (da 4,4 a 8,3 mmol/L) e la concentrazione di glucosio dovrebbe rimanere inferiore a 300 mg/dL (16,6 mmol/L). I problemi che possono essere rilevati utilizzando i report di FSL includono dosaggio inadeguato di insulina, durata insufficiente dell’azione dell’insulina (metabolismo rapido), ipoglicemia indotta da insulina (Figura 9) e mancata risposta all’insulina; quest’ultimo problema suggerisce una scarsa compliance del cliente o la presenza di insulinoresistenza. In base alla valutazione della curva, se necessario, è possibile modificare la dose o la formulazione dell’insulina e valutare la risposta mentre il sensore è ancora in sede. Poiché le misurazioni del glucosio sono disponibili in tempo reale, è anche possibile identificare l’ipoglicemia clinicamente significativa, trattarla subito, e ridurre la dose di insulina. Quando si utilizza FSL per regolare la dose di insulina, è importante attendere 5-7 giorni tra le modifiche; inoltre, poiché il sensore ha una durata utile di 14 giorni, durante questo periodo è generalmente possibile effettuare due regolazioni della dose; naturalmente, la dose può essere ridotta più volte, se necessario.
Sebbene la correlazione tra FSL e i glucometri POC sia generalmente buona, possono verificarsi malfunzionamenti o errori del sensore. Se le misurazioni del glucosio con FSL non corrispondono al quadro clinico, la glicemia dev’essere valutata utilizzando con glucometro POC o altro metodo affidabile. Le indicazioni di malfunzionamento del sensore includono un messaggio di errore, un messaggio indicante che occorre ripetere più avanti la scansione del sensore, lacune nei dati, e oscillazioni inaspettatamente ampie della glicemia che non si adattano ai segni clinici. In queste situazioni, se i risultati di FSL non sono correlati a un dispositivo POC, il sensore deve essere sostituito.
© Ridisegnata da Sandrine Fontègne
Conclusione
In sintesi, i dispositivi di monitoraggio continuo del glucosio possono essere molto preziosi per valutare il controllo glicemico nei gatti, ma conoscere bene la tecnologia del sensore scelto (e i rispettivi limiti e potenziali errori) consente di trarre il massimo da questa tecnologia. Oggi, i dispositivi consentono al Medico Veterinario di svolgere un monitoraggio più accurato dei pazienti diabetici, aumentando quindi la probabilità di ottenere la remissione diabetica, e possono essere utilizzati nella maggior parte degli ambulatori ogni qual volta è necessario.
J. Catharine Scott-Moncrieff
MA, MS, Vet MB, Dip. ACVIM, Dip. ECVIM, Scienze Cliniche Veterinarie, College of Veterinary Medicine, Purdue University, IN, USA
Stati Uniti d'America
La Dr.ssa Scott-Moncrieff ha conseguito la laurea all’University of Cambridge nel 1985, quindi ha completato un internship in Medicina e chirurgia dei piccoli animali all’University of Saskatchewan, Canada, e una residency e Master of Science in Medicina interna alla Purdue University. In seguito è entrata nella facoltà della stessa università nel 1989, ed è attualmente docente in Medicina interna dei piccoli animali e Direttore del Dipartimento di Scienze Cliniche Veterinarie.
Riferimenti
- O’Neill DG, Gostelow R, Orme C, et al. Epidemiology of diabetes mellitus among 193,435 cats attending primary-care veterinary practices in England. J. Vet. Intern. Med. 2016;30:964-972.
- Behrend E, Lathan P, Rucinksy R, et al. 2018 AHHA Diabetes management guidelines for dogs and cats. J. Am. Anim. Hosp. Assoc. 2018;54:1-21.
- Sparkes AH, Cannon M, Church D, et al. ISFM consensus guidelines on the practical management of diabetes mellitus in cats. J. Feline Med. Surg. 2015;17:235-250.
- Roomp K, Rand J. Intensive blood glucose control is safe and effective in diabetic cats using home monitoring and treatment with Glargine. J. Feline Med. Surg. 2009;11:668-682.
- Knies M, Teske E, Kooistra H. Evaluation of the FreeStyle LibreTM, a flash glucose monitoring system, in client-owned cats with diabetes mellitus. J. Feline Med. Surg. 2022;24(8):e223-e231. DOI: 10.1177/1098612X221104051. Epub 2022 Jun 28.
- Deiting V, Mischke R. Use of the Freestyle LibreTM glucose monitoring system in diabetic cats. Res. Vet. Sci. 2021;135:253-259.
- Shea EK, Hess RS. Validation of a flash glucose monitoring system in outpatient diabetic cats. J. Vet. Intern. Med. 2021;35:1703-1712.
- Del Baldo F, Fracassi F, Pires J, et al. Accuracy of a flash glucose monitoring system in cats and determination of the time lag between blood glucose and interstitial glucose concentrations. J. Vet. Intern. Med. 2021;35:1279-1287.
- Shoelson AM, Mahoney OM, Pavlick M. Complications associated with a flash glucose monitoring system in diabetic cats. J. Feline Med. Surg. 2021;23(6):557-562.
- Clark M, Hoenig. M. Feline comorbidities: Pathophysiology and management of the obese diabetic cat. J. Feline Med. Surg. 2021;23(7);639-648.
- Gostelow R, Forcada Y, Graves T, et al. Systematic review of feline diabetic remission: Separating fact from opinion. Vet. J. 2014;202:208-221.
- Zeugswetter FK, Polsterer T, Krempl H, et al. Basal glucosuria in cats. J. Anim. Physiol. Anim. Nutr. (Berl.). 2019;103(1):324-330. DOI: 10.1111/jpn.13018. Epub 2018 Oct 29.
- Alt N, Kley S, Haessig M, et al. Day-to-day variability of blood glucose concentration curves generated at home in cats with diabetes mellitus. J. Am. Vet. Med. Assoc. 2007;230(7):1011-1017. DOI: 10.2460/javma.230.7.1011.
- Link KR, Rand JS. Changes in blood glucose concentration are associated with relatively rapid changes in circulating fructosamine concentrations in cats. J. Feline Med. Surg. 2008;10:583-592.
- Norris O, Schermerhorn T. Relationship between HbA1c, fructosamine and clinical assessment of glycemic control in dogs. PLoS One. 2022;17(2):e0264275. DOI: 10.1371/journal.pone.0264275. eCollection 2022.
- Hoening M, Ferguson DC. Diagnostic utility of glycosylated hemoglobin concentrations in the cat. Domest. Anim. Endocrinol. 1999;16(1);11-17.
- Berg AS, Crews CD, Alfonso-Castro C, et al. Assessment of the FreeStyle LibreTM 2 interstitial glucose monitor in hypo- and euglycemia in cats. Abstract EN05 (2022), ACVIM Forum Research Abstract Program. J. Vet. Intern. Med. 2022;36:2282-2454. https://doi.org/10.1111/jvim.16541
- Silva DD, Cecci GRM, Biz G, et al. Evaluation of a flash glucose monitoring system in dogs with diabetic ketoacidosis. Domest. Anim. Endocrinol. 2021;74:106525. DOI: 10.1016/j.domaniend.2020.106525. Epub 2020 Jul 18.
- Malerba E, Cattani C, Del Baldo F, et al. Accuracy of a flash glucose monitoring system in dogs with diabetic ketoacidosis. J. Vet. Intern. Med. 2020;34:83-91.
- Del Baldo F, Diana A, Canton C, et al. The influence of skin thickness on flash glucose monitoring system accuracy in dogs with diabetes mellitus. Animals (Basel) 2021;11(2):408. DOI: 10.3390/ani11020408.
Altri articoli di questo numero
Condividi sui social media