Medicina trasfusionale dei piccoli animali
Scritto da João Araújo e Maria João Dourado
Non sapete quale emoderivato usare e quando? Questo articolo offre una rassegna delle opzioni attualmente disponibili per la trasfusione nella medicina dei piccoli animali.
Punti chiave
Lavvento delle banche del sangue commerciali in molti Paesi significa che, oggi, la trasfusione di emoderivati pu essere effettuata nella maggior parte delle cliniche di prima valutazione.
Dal sangue intero si ottengono vari emoderivati, e il medico veterinario deve selezionare il prodotto pi appropriato per ogni caso.
La determinazione del gruppo sanguigno e della compatibilit donatore-ricevente sono i precursori essenziali di qualsiasi trasfusione di emoderivati.
Talvolta possono verificarsi reazioni trasfusionali, e i pazienti vanno attentamente monitorati prima, durante e dopo la trasfusione.
Introduzione
La medicina trasfusionale ha un posto essenziale nella pratica clinica dei piccoli animali, soprattutto nelle situazioni di medicina d’emergenza e terapia intensiva, e l’avvento delle banche del sangue in molti Paesi consente oggi alle cliniche di accedere su richiesta a una varietà di emocomponenti, e riceverli in tempi brevi. Questo, insieme a metodi innovativi e rapidi per la determinazione del gruppo sanguigno e della compatibilità donatore-ricevente, e ai recenti progressi nelle conoscenze, significa la possibilità di eseguire trasfusioni nella maggior parte delle cliniche. Tuttavia, sebbene la trasfusione di emoderivati possa essere un salvavita, è anche potenzialmente pericolosa per la vita, e questo articolo punta a rivedere la situazione attuale, al fine di dare informazioni utili al medico veterinario in prima linea.
Emoderivati
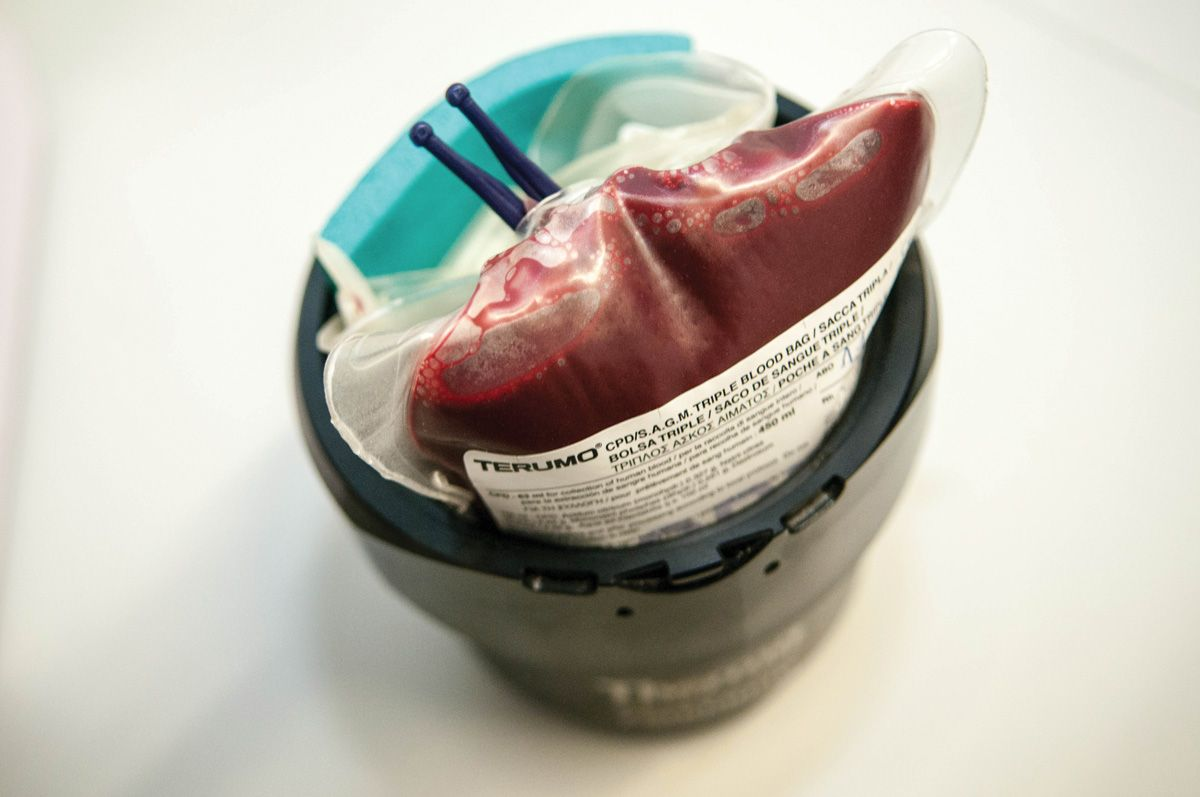
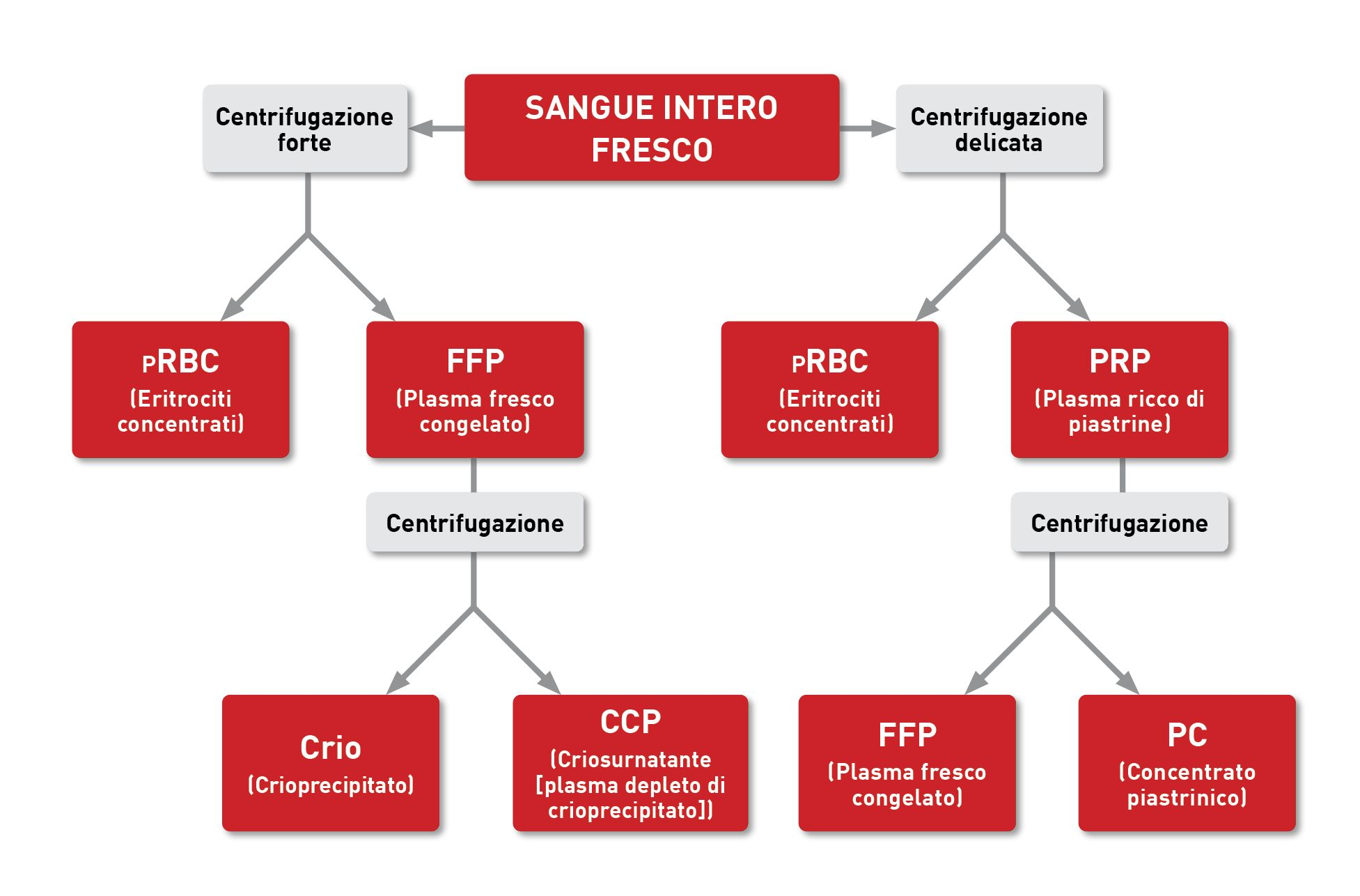
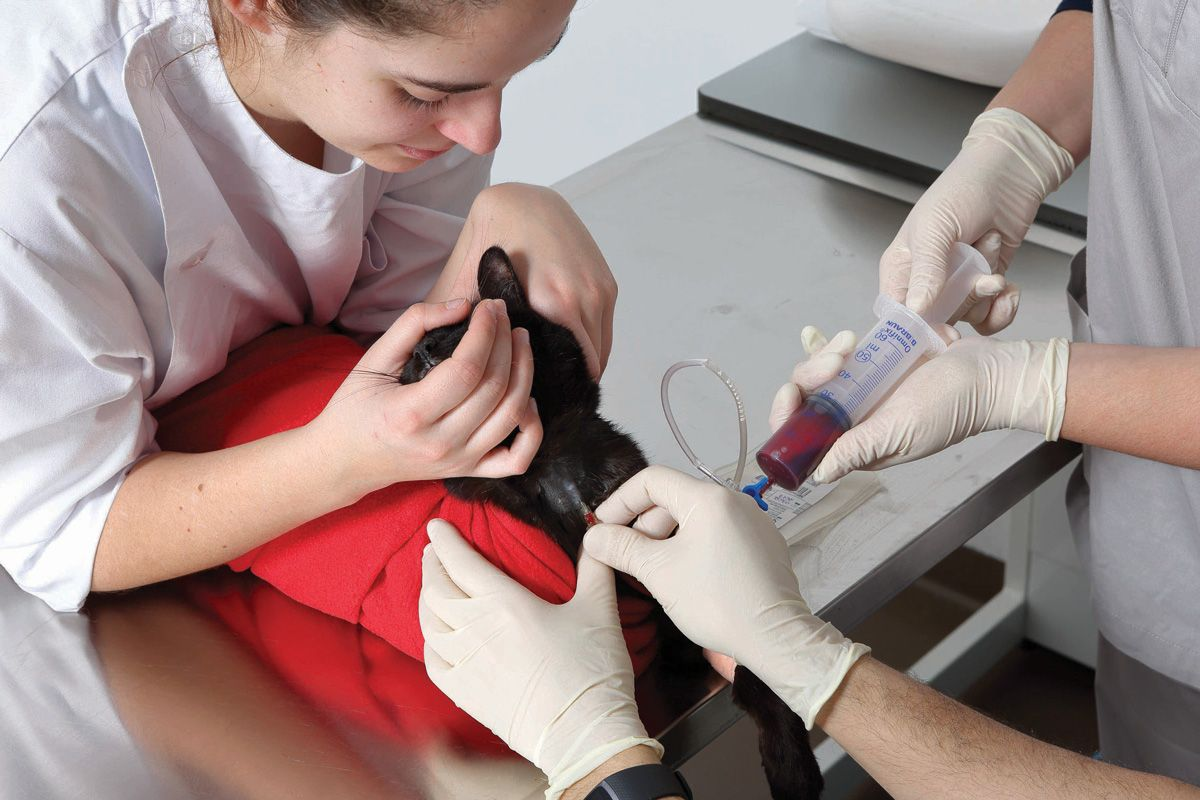
Quando il sangue viene prelevato da un donatore idoneo, viene trasferito in una sacca o una siringa contenente un anticoagulante e nutrienti per le cellule. Alcuni medici veterinari possono scegliere di prelevare il sangue nella propria clinica, utilizzando sacche di prelievo commerciali; per i cani, queste vengono generalmente fornite includendo la quantità di anticoagulante (solitamente CPD [Citrato-Fosfato-Destrosio]) corretta per il volume di sangue da donare (Figura 1). Quando si preleva sangue felino, pre-riempire una siringa con 1 mL di anticoagulante per ogni 7 mL di sangue da prelevare (Figura 2). In alternativa, si possono acquistare prodotti pronti all’uso presso banche del sangue dedicate (Figura 3), che offrono numerosi vantaggi: consentono di utilizzare il prodotto migliore per ogni specifica condizione; riducono il rischio di reazioni trasfusionali; e garantiscono un uso efficiente di tutte le risorse ematiche [1],[2]. Dal sangue prelevato si possono ottenere numerosi prodotti diversi, che sono grossolanamente classificati in prodotti a base di eritrociti (RBC) e componenti plasmatici, come mostrato nel Riquadro 1 [3].



Prodotti plasmatici
Sono ottenuti dalla centrifugazione del sangue intero, e contengono tutte le proteine ematiche funzionali alle concentrazioni originali, se lavorati entro 8 ore dal prelievo.
- Plasma fresco congelato (FFP): a meno che il plasma fresco non venga somministrato entro 1 ora dalla lavorazione [6], va congelato; per essere classificato come plasma fresco congelato, deve essere congelato entro 6-8 ore dal prelievo, in modo tale che il plasma trattenga tutti i fattori della coagulazione e le proteine [3] (Figura 5).
- Plasma congelato conservato (SFP): chiamato anche semplicemente plasma congelato, questo termine si riferisce al plasma fresco congelato, se ha superato la data di scadenza, o se la centrifugazione o il congelamento è avvenuto a più di 8 ore dal prelievo, o indica l’FFP che è stato scongelato e poi ricongelato senza aprire il contenitore. L’SFP ha quantità inferiori di fattori della coagulazione e proteine rispetto all’FFP [3],[6].
- Crioprecipitato e criosurnatante: il crioprecipitato viene prodotto mediante scongelamento controllato di un’unità di FFP seguito dalla centrifugazione; ciò si traduce in un prodotto concentrato contenente proteine insolubili, fattore VIII, fattore di von Willebrand (vWF) e fibrinogeno [1]. Il surnatante rimosso dalla preparazione del crioprecipitato viene chiamato criosurnatante (o plasma depleto di crioprecipitato); non contiene vWF, fibrinogeno e proteine insolubili, ma conserva albumina, proteine emostatiche e immunoglobuline [6].
- Plasma ricco di piastrine (PRP) e concentrato piastrinico (PC): i prodotti a base di piastrine hanno vita breve e domanda limitata, per cui le banche del sangue li producono solo su ordinazione. Il plasma ricco di piastrine risulta dalla centrifugazione delicata di sangue intero fresco [1] (Figura 6), mentre il concentrato piastrinico si ottiene per centrifugazione del PRP che “appallottola” le piastrine [7].


Indicazioni
Anemia, coagulopatie, sepsi, coagulopatia intravascolare disseminata (CID) e carenze di fattori specifici sono alcune delle indicazioni per la trasfusione con un emoderivato appropriato [3], ma la decisione di procedere va presa dopo aver considerato tutti i potenziali rischi e benefici. Se non vi sono indicazioni per la trasfusione di sangue intero, si deve effettuare un’attenta valutazione per affrontare le esigenze trasfusionali del ricevente e scegliere l’emocomponente corretto. Ciò massimizza l’uso di un’unità di sangue e riduce il rischio di reazioni trasfusionali [8],[9].
Prodotti a base di eritrociti
L’ossigenazione tissutale corretta dipende dai livelli di emoglobina nel circolo e dalla gittata cardiaca [3]. Poiché quasi tutto l’ossigeno nel sangue viene trasportato dall’emoglobina, aumentare il trasporto di ossigeno richiede la trasfusione di un prodotto a base di RBC. Determinare il PCV (Packed Cell Volume, volume della frazione corpuscolata del sangue), chiamato anche Hct (ematocrito) o la concentrazione di emoglobina (Hb) del paziente, insieme alla valutazione fisica, aiuta il medico veterinario a decidere se l’animale ha bisogno dell’emoterapia [8]. Sebbene non esista un preciso valore di Hct sotto il quale il paziente sia ritenuto idoneo per la trasfusione, l’anemia (dovuta a emorragia, emolisi, o eritropoiesi inefficace) è la ragione principale per eseguire una trasfusione di RBC, e alcuni studi suggeriscono la perdita ematica come indicazione principale per la trasfusione nel cane e nel gatto [10]. Le opzioni preferite sono FWB o pRBC. L’FWB ha tutti gli emocomponenti fisiologici (piastrine funzionali, proteine plasmatiche, fattori della coagulazione) ed è un’ottima scelta per i casi di anemia accompagnati anche da coagulopatia o trombocitopenia [8]. In caso di emorragia massiccia (perdita >50% del volume circolante), l’FWB è anche il prodotto ideale per ripristinare la funzione di trasporto dell’ossigeno e la pressione oncotica [11].
La somministrazione di pRBC è indicata in caso di anemia nel paziente normovolemico (anemia emolitica o non rigenerativa; acuta o cronica). Dato che pRBC ha un Hct del 70-80% e una pressione oncotica inferiore rispetto al sangue intero, è meno probabile che causi sovraccarico fluidico nei riceventi normovolemici [1],[11]. Nei casi ipovolemici si possono anche utilizzare gli eritrociti concentrati, ma data la necessità di aumentare la pressione oncotica e reintegrare altri elementi del sangue, occorre trasfondere anche FFP [8].
Prodotti plasmatici
L’uso di prodotti plasmatici è stato segnalato in varie situazioni, tra cui il trattamento dell’ipotensione e il supporto oncotico, il ripristino dei fattori della coagulazione nelle coagulopatie, il trattamento del sanguinamento interno e del sanguinamento mucosale incontrollabile, e il trattamento di supporto nei casi di sepsi, traumi e dilatazione gastrica-volvolo [12].
È stato dimostrato che il plasma fresco congelato mantiene la funzione delle proteine emostatiche per un anno [13], ed è la scelta principale nel trattamento delle coagulopatie [12]. Il plasma congelato/conservato può trattenere i fattori della coagulazione non labili come ad esempio la vitamina K, ed è indicato per il trattamento delle coagulopatie dovute alla intossicazione da rodenticidi (anticoagulanti) [1].
Il crioprecipitato è il prodotto plasmatico più indicato per fornire vWF, per il trattamento dell’emofilia A e della carenza o disfunzione del fibrinogeno [6], mentre il criosurnatante è l’opzione più conveniente per il trattamento della carenza di vitamina K [6].
mentre il criosurnatante è l’opzione più conveniente per il trattamento della carenza di vitamina K L’uso di prodotti plasmatici è stato descritto anche nei casi di ipoproteinemia, utilizzando FFP e criosurnatante contenenti albumina. Tuttavia, per aumentare i livelli di albumina di 0,5 g/dL è necessaria una dose di 20-25 mL/kg [6].
I prodotti a base di piastrine sono raccomandati principalmente nell’emorragia secondaria a casi gravi di trombocitopenia o altre trombopatie. Se il sanguinamento è causato dalla CID o dalla trombocitopenia immunomediata, possono essere utili anche i prodotti a base di piastrine, ma questi apportano benefici inferiori, poiché le piastrine trasfuse possono andare rapidamente incontro a distruzione [14].
Secondo l’esperienza degli autori, con l’incremento nella distribuzione degli emoderivati da parte delle banche del sangue, pRBC e FFP sono i componenti più prontamente disponibili, e quindi quelli più utilizzati per soddisfare tutte le esigenze sopra elencate [6].
Gli emoderivati pronti all’uso possono essere acquistati da banche del sangue dedicate, che offrono numerosi vantaggi: consentono di utilizzare il prodotto migliore per ogni specifica condizione; riducono il rischio di reazioni trasfusionali; e garantiscono un uso efficiente di tutte le risorse ematiche.
Gruppi sanguigni
Sia i cani che i gatti hanno gruppi sanguigni specie-specifici, definiti in base alle proteine antigeniche presenti sulla superficie degli eritrociti, e questi gruppi possono indurre reazioni avverse quando introdotti nel circolo di un altro paziente. Per questo motivo, non si sottolinea mai abbastanza che il paziente deve ricevere solo sangue compatibile, e che per tutti gli animali occorre determinare il tipo sanguigno e/o la compatibilità donatore-ricevente.
Cani
I gruppi sanguigni canini sono classificati utilizzando il sistema DEA (Dog Erythrocyte Antigen, antigene eritrocitario canino), che includeva un tempo DEA 1.1, 1.2, 1.3, 3, 4, 5, 6, 7 e 8. Gli antigeni 6 e 8 non vengono più identificati di routine data l’assenza di sieri per tipizzazione, ma nel 2007 è stato segnalato un nuovo antigene, Dal [15], e più recentemente sono stati identificati altri due antigeni: Kai 1 e Kai 2 [16]. È stato dimostrato che DEA 1.1 ha la massima antigenicità, ed è noto per la sua ereditarietà a dominanza autosomica, motivo per cui i cani sono ora classificati come DEA 1.1 positivi o negativi [17]. Questo antigene può precipitare causando una reazione emolitica grave nei cani DEA 1.1 negativi che ricevono una seconda trasfusione a causa della precedente sensibilizzazione (data la mancanza di alloanticorpi naturali) [18], motivo per cui tutti i donatori di sangue e i riceventi vanno testati per DEA 1.1.
Uno studio ha segnalato reazioni trasfusionali emolitiche acute (AHTR) dopo sensibilizzazione all’antigene DEA 4, ma poiché il 98% dei cani ha questo antigene, solo il 2% negativo dei cani è a rischio di AHTR, e unicamente dopo una precedente trasfusione. Gli altri antigeni DEA (3, 5 e 7) sembrano avere scarsa importanza nella pratica clinica, e non sono state documentate reazioni trasfusionali [19].
Gatti
Il sangue felino è classificato utilizzando il sistema AB; sono stati descritti 3 tipi principali (A, B e AB) e il tipo A è quello più frequente. A differenza di DEA 1.1 nei cani, i gatti hanno alloanticorpi naturali che possono essere responsabili delle reazioni emolitiche [20]. Di recente è stato identificato un nuovo antigene del gruppo sanguigno, noto come Mik [21]. Questo è importante dal punto di vista clinico, poiché esiste una segnalazione di una reazione trasfusionale emolitica in un gatto con sangue di tipo A che non aveva mai ricevuto prima una trasfusione [21]. Tenendo presente questo aspetto, prima di una trasfusione è essenziale verificare la compatibilità donatore-ricevente in tutti i gatti [22].
Tipizzazione
La determinazione del gruppo sanguigno può essere eseguita in un laboratorio commerciale o in loco. Attualmente sono disponibili tre tipi di kit per determinazione del gruppo sanguigno: agglutinazione su cartoncino, striscia reattiva per immunocromatografia (ICS), e provetta con gel separatore. La procedura è simile per tutti: il campione di sangue del paziente viene aggiunto a un antisiero mono-clonale o poli-clonale, e l’eventuale risultato positivo (reazione di emoagglutinazione) viene determinato in base a una variazione colorimetrica (Figura 7). Uno studio ha segnalato che i metodi con agglutinazione su cartoncino e ICS erano un’opzione ragionevole nei casi d’emergenza, ma il metodo a base di gel separatore sembra essere lo standard di riferimento per la determinazione del gruppo sanguigno di donatori e riceventi DEA 1.1 [23].
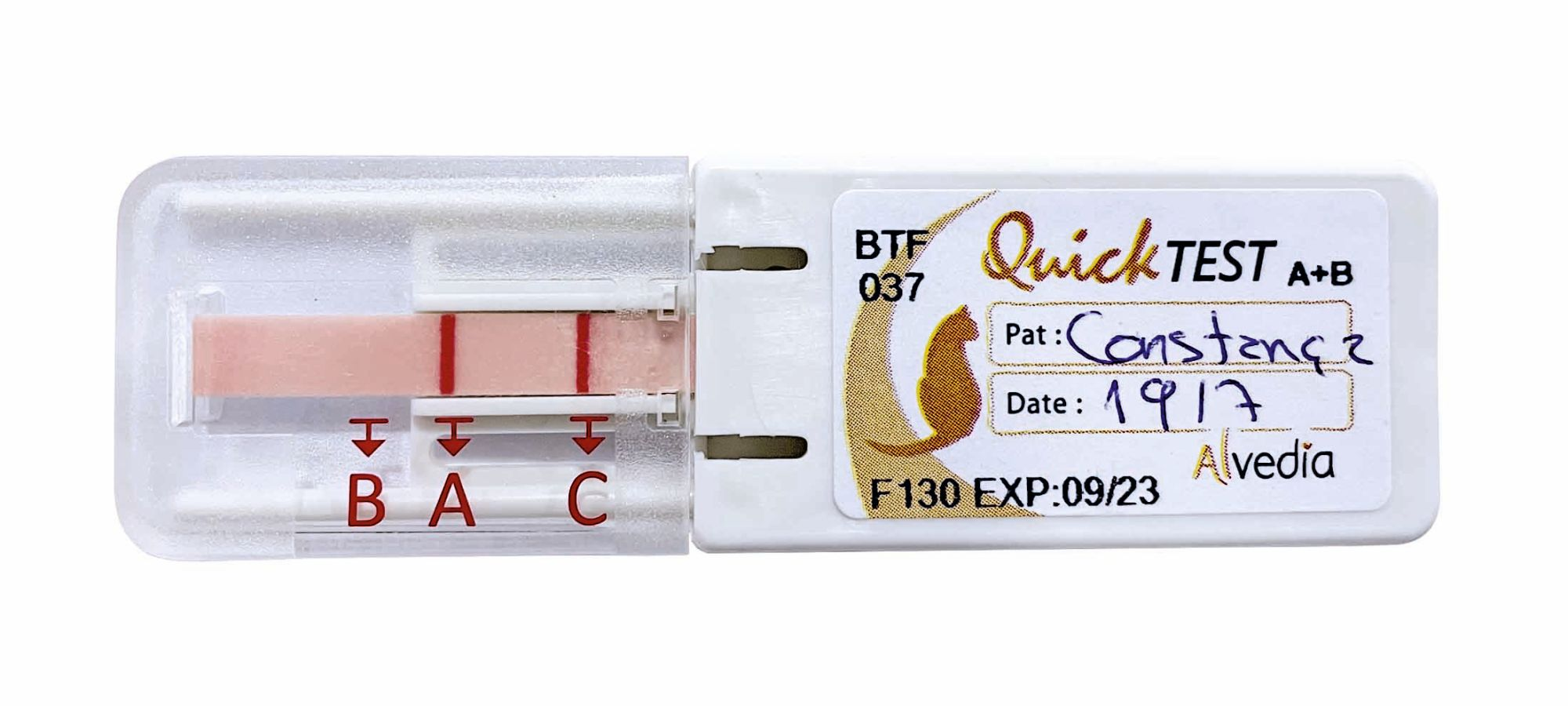
Compatibilità donatore-ricevente
Mentre la determinazione del gruppo sanguigno è correlata agli antigeni sugli RBC, la compatibilità donatore-ricevente, che può essere valutata in loco, si concentra sugli anticorpi presenti nel plasma e può indicare l’eventuale presenza di una reazione tra il sangue del donatore e quello del ricevente. È un processo a due fasi, con una compatibilità donatore-ricevente maggiore e una minore [19]. I test di compatibilità donatore-ricevente maggiore testano la compatibilità tra gli eritrociti del donatore e il plasma del ricevente; i test di compatibilità donatore-ricevente minore verificano invece la compatibilità tra il plasma del donatore e gli eritrociti del ricevente. Qualsiasi reazione di agglutinazione implica incompatibilità tra donatore e ricevente.
Le principali indicazioni per eseguire un test di compatibilità donatore-ricevente nei cani sono quando il paziente ha un’anamnesi trasfusionale sconosciuta, ha avuto precedenti reazioni trasfusionali, oppure ha ricevuto una trasfusione di eritrociti da più di 4 giorni [9]. Come osservato in precedenza, la compatibilità donatore-ricevente va sempre valutata nei gatti.
Attualmente sono disponibili tre tipi di test: test di agglutinazione con provetta standard, ovvero lo standard di riferimento attuale, dosaggio con provetta con gel separatore, e striscia reattiva per immunocromatografia [19].
Quanto trasfondere?
Il volume di emoderivato da somministrare dipende da vari fattori, tra cui il prodotto che si sta somministrando, l’effetto che si intende ottenere, e la risposta del paziente alla trasfusione.
Per i pRBC è possibile utilizzare la seguente formula:
|
Volume (mL)= 85 (cane) o 60 (gatto) x peso corporeo (kg) x [(Hct desiderato - Hct reale)/Hct del donatore] |
Quando si utilizza un prodotto plasmatico per trattare l’ipotensione, la velocità raccomandata è di 10 mL/kg in un periodo di 2-4 ore; la trasfusione può essere ripetuta ogni 6-24 ore in base alla necessità. Nei casi più gravi (ad es. ipotensione refrattaria) la velocità può essere aumentata a 20-60 mL/kg. Per l’ipoalbuminemia grave, una singola trasfusione a 10-20 mL/kg nel giro di 2-4 ore aumenta i livelli di albumina di 0,2 g/dL.
Il plasma può essere somministrato anche nei pazienti con ipoalbuminemia utilizzando un’infusione a velocità costante (CRI) di 1,5-3 mL/kg/ora nel giro di 12-24 ore per ottenere un incremento di 0,3-0,5 g/dL.
Se si somministra un concentrato piastrinico, utilizzare 40-70 mL/10 kg da 1x/die a 3x/die, a effetto. Ogni trasfusione dovrebbe aumentare il numero di piastrine di 10-40 x 103/µL.
La somministrazione di emoderivati può essere generalmente eseguita utilizzando il solo flusso a caduta, e le pompe per infusione sono solitamente sconsigliate, specialmente con i prodotti a base di RBC, poiché possono causare emolisi.
Preparazione e somministrazione dell’emoderivato
Quando si esegue una trasfusione, certi aspetti possono influire sulla qualità dell’emoderivato e sul successo della trasfusione. Innanzitutto, prima di iniziare la procedura, è importante valutare l’integrità della sacca di conservazione, il colore del componente, e la sua consistenza. Qualsiasi unità che mostri coaguli, colorazioni anomale, o aspetti insoliti non va utilizzata. Effettuare un doppio controllo per verificare che si stia assegnando l’unità corretta all’animale giusto.
Il riscaldamento degli RBC refrigerati è considerato non necessario nei pazienti normovolemici e normotermici, poiché può deteriorare più rapidamente le cellule e stimolare la crescita dei microrganismi. Va considerato solo nei riceventi ipotermici, neonati, o negli animali che ricevono grandi quantità di sangue. Se è necessario il riscaldamento, l’unità può essere mantenuta a temperatura ambiente per 30 minuti o collocata in una busta di plastica sigillata e messa a bagnomaria (<37°C) per 15 minuti [3],[8].
I prodotti plasmatici congelati devono essere scongelati lentamente prima della somministrazione al paziente; anche in questo caso, è appropriato collocare il prodotto in una busta di plastica sigillata prima di riscaldarlo a bagnomaria a circolazione (sempre <37°C), monitorando accuratamente la temperatura [9].
La via preferita per la somministrazione degli emoderivati è quella endovenosa, utilizzando un catetere da 20-22 G (da inserire non prima di 24 ore dalla trasfusione). Il catetere deve essere utilizzato solo per la trasfusione; evitare la somministrazione concomitante di medicinali, fluidi non isotonici, o Ringer lattato. Se occorre irrigare il catetere durante la trasfusione, utilizzare sempre soluzione salina allo 0,9%. Al termine della trasfusione, è possibile collegare al set di perfusione un flacone di soluzione salina per non sprecare la quota di emoderivato restante nella linea EV. Si raccomanda di evitare la somministrazione di antistaminici e antipiretici durante la trasfusione [22]. Se non è possibile l’infusione endovenosa (ad es. neonati), si può utilizzare un catetere intraosseo; le cellule raggiungeranno la circolazione sanguigna in pochi minuti [4].
Le infusioni vanno eseguite con un set di somministrazione di sangue dotato di filtro (170-260 µm) che trattiene i coaguli e le particelle di microaggregato [9], soprattutto quando si trasfonde sangue intero (Figura 8). Se si somministra l’emoderivato tramite una pompa a siringa, utilizzare un filtro pediatrico con spazio morto ridotto, o un filtro per microaggregati da 18-40 µm. La somministrazione può essere generalmente eseguita utilizzando il solo flusso a caduta, e le pompe per infusione sono solitamente sconsigliate, specialmente con i prodotti a base di RBC, poiché possono causare emolisi [24]. Se è necessaria una pompa per infusione, consultare le istruzioni del produttore per verificare se l’unità è sicura per la trasfusione di emoderivati [8].
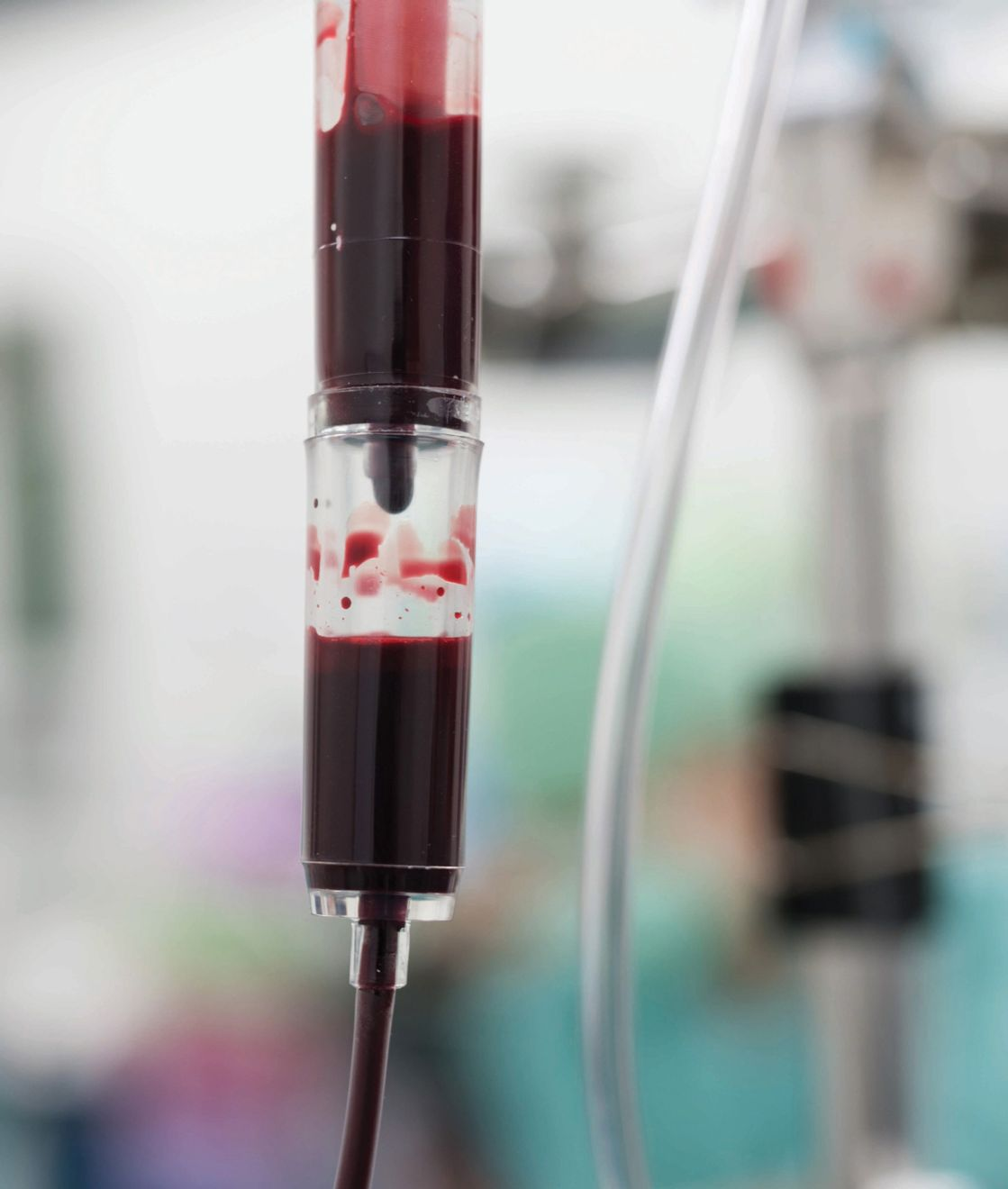
La velocità di trasfusione dipende dallo stato clinico del paziente. Nell’animale normovolemico, la velocità iniziale deve essere bassa (0,25-0,5 mL/kg/ora) nei primi 15-30 minuti per verificare che non emergano reazioni avverse; in seguito, si può aumentare a 2-10 mL/kg/ora nei cani e 3-5 mL/kg/ora nei gatti. La velocità oraria massima raccomandata per evitare il sovraccarico di fluidi è 10-20 mL/kg. Quando possibile (ad es. casi cardiaci o renali), la velocità deve essere di 1-3 mL/kg/ora, iniziando dal limite inferiore e portandolo al massimo se non ci sono reazioni avverse [1]. Nei casi gravi di perdita ematica e ipovolemia, la correzione rapida del volume può essere tollerata utilizzando pRBC a 20-60 mL/kg/ora [8]. Se sono necessarie velocità maggiori, è possibile comprimere manualmente la sacca di sangue o somministrare un bolo tramite siringa.
I tempi di infusione non devono superare le quattro ore, poiché questo aumenta il rischio di contaminazione batterica. Nei pazienti a rischio di sovraccarico di fluidi, la velocità di infusione minima raccomandata può essere incompatibile con la finestra di quattro ore, motivo per cui la trasfusione deve essere suddivisa refrigerando quanto basta il prodotto non utilizzato [4].
Monitoraggio del ricevente
Il monitoraggio del paziente deve iniziare prima della somministrazione di qualsiasi emoderivato, valutando l’Hct, i solidi totali, la frequenza cardiaca, la frequenza respiratoria, il colore delle mucose, la temperatura corporea e la pressione arteriosa. Anche il colore dell’urina può essere utile [4]. Eseguire un esame obiettivo ogni 15-30 minuti durante la procedura, quindi 1, 12 e 24 ore dopo la fine della trasfusione. Subito dopo la trasfusione, poi a 12 e 24 ore, valutare anche Hct, solidi totali, e colore dell’urina [3],[22]. Nei pazienti che ricevono un prodotto plasmatico, misurare prima e dopo la trasfusione lo stato della coagulazione, l’ematocrito e/o i solidi totali, per verificare l’efficacia della terapia [6].
Reazioni avverse
Sono note alcune possibili reazioni avverse alla trasfusione di emoderivati. Queste includono:
Reazioni trasfusionali non emolitiche febbrili (FNHTR)
Sono reazioni acute che possono avere natura immunologica o non immunologica. I pazienti sviluppano una temperatura superiore a 39°C (102,2 °F), o hanno un aumento della temperatura superiore a + 1°C (o 1,8 °F), rispetto a quello registrato all’esame obiettivo pre-trasfusione. Per diagnosticare una FNHTR, si devono escludere le seguenti condizioni come infezione, reazione trasfusionale emolitica acuta, lesione polmonare acuta correlata alla trasfusione, e infezione trasmessa dalla trasfusione [25].
Reazioni respiratorie
Reazioni respiratorieQueste includono la TAD (Transfusion Associated Dyspnea, dispnea associata a trasfusione), il TACO (Transfusion-Associated Circulatory Overload, sovraccarico cardiaco associato a trasfusione) e il TRALI (Transfusion Related Acute Lung Injury, traumatismo polmonare acuto correlato a trasfusione). La TAD è anch’essa una reazione trasfusionale acuta, dove il paziente sviluppa un distress respiratorio grave entro 24 ore dalla trasfusione. Per la diagnosi corretta di TAD, vanno esclusi il sovraccarico circolatorio trasfusionale e il traumatismo polmonare acuto correlato a trasfusione [25]. Il TACO è una reazione non immunologica, acuta, secondaria all’aumento del volume ematico, dove il paziente mostra segni di stress respiratorio ed edema polmonare entro 6 ore dalla trasfusione [25]. Il TRALI è secondario a interazioni antigene-anticorpo e si distingue per l’ipossiemia acuta e l’edema polmonare non cardiogeno, anche questi entro 6 ore dalla trasfusione [25].
Reazioni trasfusionali allergiche
Sono condizioni acute e di natura immunologica, secondarie a una risposta di sensibilità di tipo I a un antigene. Si distinguono per una risposta anafilattica (da moderata a pericolosa per la vita) entro 4 ore dalla trasfusione. Nel cane, i segni clinici possono comprendere eritema, orticaria, prurito, angioedema, alterazioni gastrointestinali ed emoaddome con progressione al collasso. Nei gatti, i segni sono principalmente respiratori, ma sono stati segnalati anche prurito e segni gastrointestinali [25].
Reazioni emolitiche
Possono avere natura acuta o presentarsi. Una reazione emolitica acuta correlata a trasfusione è caratterizzata da un’emolisi acuta che può avere natura immunologica o non immunologica; è una reazione non infettiva che si verifica durante o entro 24 ore dalla procedura trasfusionale [25]. Le reazioni ritardate (da 24 ore a 28 giorni dopo) sono anch’esse non infettive, e ancora una volta possono essere immunologiche o non immunologiche; sono secondarie a lisi o alla clearance accelerata degli RBC trasfusi [25].
Conclusione
Un tempo, le trasfusioni di sangue erano un’opzione di trattamento riservata alle cliniche specializzate, ma con la pronta disponibilità di emoderivati e la capacità di eseguire in loco la determinazione del gruppo sanguigno e i test di compatibilità donatore-ricevente, la maggior parte delle cliniche può offrire oggi trasfusioni con emoderivati di buona qualità. Dato che gli emoderivati sono una risorsa preziosa e limitata, è importante utilizzarli in modo razionale e minimizzare gli sprechi; spesso, una trasfusione non è il trattamento unico e definitivo. È essenziale ottimizzare l’uso dei vari emoderivati, e ciò significa spesso che il sangue intero non è il prodotto “di riferimento”; garantire un esito positivo richiede dunque una diagnosi corretta. Infine, è fondamentale tutelare il benessere del donatore di sangue durante l’intera procedura di prelievo.
João Araújo
DVM, BENELUX Animal Blood Bank, Braga, Portogallo
Portogallo
Il Dr. Araújo ha conseguito la laurea presso l’Universidade de Trás-os-Montes e Alto Douro (UTAD), Portogallo, nel 2006; ha svolto il suo tirocinio pratico durante l’ultimo anno di corso presso l’Hospital Veterinario do Porto, e dopo la laurea è entrato nel team di medicina d’emergenza e terapia intensiva (ECC) dello stesso Istituto, rimanendovi fino al 2014. Nel 2016 è stato eletto nell’Ordem dos Medicos Veterinários (OMV), l’organismo ufficiale portoghese per i medici veterinari, dove ricopre il ruolo di tesoriere per la delegazione del Nord. Spesso invitato come relatore a convegni su argomenti di ECC, è attualmente Vicepresidente dell’European Veterinary Emergency and Critical Care Society. Nel 2022 è stato membro fondatore, quindi CEO, della Animal Blood Bank (Benelux). Il Dr. Araújo è Direttore sanitario dell’Hospital Veterinário do Bom Jesus di Braga, Portogallo.
Maria João Dourado
DVM, Hospital Veterinário do Bom Jesus, Braga, Portogallo
Portogallo
La Dr.ssa Maria João ha conseguito la laurea all’UTAD nel 2018, dopo aver svolto il tirocinio pratico dell’ultimo anno di corso presso l’Hospital Veterinário Central – VECC, dato che l’ECC era già una delle sue aree di interesse principali. Ha iniziato la sua carriera in una piccola clinica privata, ma poi ha sentito presto il bisogno di occuparsi di medicina d’emergenza e terapia intensiva; a metà del 2018 è entrata a far parte dell’apposito team dell’Hospital Veterinário do Bom Jesus. Partecipa attivamente ai massimi congressi annuali in tema di ECC e ha completato uno stage presso SIAMU – VetAgro Sup a Lione.
Riferimenti
- Davidow B. Transfusion medicine in small animals. Vet. Clin. North Am. Small Anim. Pract. 2013;43(4):735-756. https://doi.org/10.1016/j.cvsm.2013.03.007
- Logan JC, Callan MB, Drew K, et al. Clinical indications for use of fresh frozen plasma in dogs: 74 dogs (October through December 1999). J. Am. Vet. Med. Assoc. 2001;218(9):1449-1455. https://doi.org/10.2460/javma.2001.218.1449
- Gibson G, Callan MB. Transfusion medicine. In; BSAVA Manual of Canine and Feline Emergency and Critical Care. Gloucester, BSAVA; 2018;236-248. https://doi.org/10.22233/9781910443262.14
- Chiaramonte D. Blood-component therapy: selection, administration and monitoring. Clin. Tech. Small Anim. Pract. 2004;19(2):63-67. https://doi.org/10.1053/j.ctsap.2004.01.003
- Prittie JE. Triggers for use, optimal dosing, and problems associated with red cell transfusions. Vet. Clin. North Am. Small Anim. Pract. 2003;33(6);1261-1275. https://doi.org/10.1016/s0195-5616(03)00093-7
- Brooks MB. Transfusion of Plasma Products. In; Schalms Veterinary Hematology Brooks MB, Harr KE, Seelig DM, et al (eds). Hodboken, NJ; John Wiley Sons 2022;914-920. https://doi.org/10.1002/9781119500537.ch100
- Abrams-Ogg, ACG, Blois SL. Principles of Canine and Feline Blood Collection, Processing, and Storage. In; Schalms Veterinary Hematology. Brooks MB, Harr KE, Seelig DM, et al (eds). Hodboken, NJ; John Wiley Sons. 2022;898-907.
- Callan MB. Red Blood Cell Transfusion in the Dog and Cat. In; Schalms Veterinary Hematology. Brooks MB, Harr KE, Seelig DM, et al (eds). Hodboken, NJ; John Wiley Sons 2022;908-913. https://doi.org/10.1002/9781119500537.ch99
- Sink CA. Clinical Considerations in Transfusion Practice. In; Practical Transfusion Medicine for the Small Animal Practitioner. Hoboken, NJ: John Wiley Sons 2017;32-41 https://doi.org/10.1002/9781119187691.ch4
- Klaser DA, Reine NJ, Hohenhaus AE. Red blood cell transfusions in cats: 126 cases (1999). J. Am. Vet. Med. Assoc. 2005;226(6):920-923. https://doi.org/10.2460/javma.2005.226.920
- Lanevschi A, Wardrop KJ. Principles of transfusion medicine in small animals. Can. Vet. J. 2001;42(6):447-454.
- Elias Santo‐Domingo N, Lewis DH. Indications for use and complications associated with canine plasma products in 170 patients. J. Vet. Emerg. Crit. Care 2021;31(2):263-268. https://doi.org/10.1111/vec.13047
- Wardrop, KJ. Clinical Blood Typing and Crossmatching. In; Schalms Veterinary Hematology. Brooks MB, Harr KE, Seelig DM, et al (eds). Hodboken, NJ; John Wiley Sons. 2022;964-968.
- Abrams-Ogg ACG, Blois SL. Platelet and Granulocyte Transfusion. In; Schalms Veterinary Hematology. Brooks MB, Harr KE, Seelig DM, et al (eds). Hodboken, NJ; John Wiley Sons. 2022;921-926. https://doi.org/10.1002/9781119500537.ch101
- Blais MC, Berman L, Oakley DA, et al. Canine Dal blood type: a red cell antigen lacking in some Dalmatians. J. Vet. Int. Med. 2007;21(2);281-286.
- Lee JH, Giger U, Kim HY. Kai 1 and Kai 2: Characterization of these dog erythrocyte antigens by monoclonal antibodies. PLOS ONE, 2017;12(6), e0179932. https://doi.org/10.1371/journal.pone.0179932
- Polak, K, Acierno MM, Raj K, et al. Dog erythrocyte antigen 1: Mode of inheritance and initial characterization. Vet. Clin. Pathol. 2015;44(3);369-379. https://doi.org/10.1111/vcp.12284
- Giger U, Gelens CJ, Callan MB, et al. An acute hemolytic transfusion reaction caused by dog erythrocyte antigen 1.1 incompatibility in a previously sensitized dog. J. Am. Vet. Med. Assoc. 1995;206(9);1358-1362.
- Zaremba R, Brooks A, Thomovsky E. Transfusion medicine: an update on antigens, antibodies and serologic testing in dogs and cats. Topics Comp. Anim. Med. 2019;34:36-46. https://doi.org/10.1053/j.tcam.2018.12.005
- Hohenhaus AE. Importance of blood groups and blood group antibodies in companion animals. Transfusion Med. Rev. 2004;18(2):117-126.
- Weinstein, NM, Blais MC, Harris K, et al. A newly recognized blood group in domestic shorthair cats: the Mik red cell antigen. J. Vet. Int. Med. 2007;21(2):287-292. https://doi.org/10.1892/0891-6640(2007)21[287:anrbgi]2.0.co;2
- Davidow EB, Blois SL, Goy-Thollot I, et al. Association of Veterinary Hematology and Transfusion Medicine (AVHTM) Transfusion Reaction Small Animal Consensus Statement (TRACS) Part 2: Prevention and monitoring. J. Vet. Emerg. Crit. Care 2021;31(2):167-188. https://doi.org/10.1111/vec.13045
- Seth M, Jackson KV, Winzelberg S, et al. Comparison of gel column, card, and cartridge techniques for dog erythrocyte antigen 1.1 blood typing. Am. J. Vet. Res. 2012;73(2):213-219. https://doi.org/10.2460/ajvr.73.2.213
- Stiles J, Raffe MR. Hemolysis of canine fresh and stored blood associated with peristaltic pump infusion. J. Vet. Emerg. Crit. Care 1991;1(2):50-53.
- Davidow EB, Blois SL, Goy-Thollot I, et al. Association of Veterinary Hematology and Transfusion Medicine (AVHTM) Transfusion Reaction Small Animal Consensus Statement (TRACS). Part 1: Definitions and clinical signs. J. Vet. Emerg. Crit. Care 2021;31(2):141-166. https://doi.org/10.1111/vec.13044
Altri articoli di questo numero
Condividi sui social media