Toxoplasmose bei Katzen
Geschrieben von Christopher Fernandez-Prada und Victoria Wagner
Die Toxoplasmose ist inzwischen weltweit verbreitet. Während die Katze der einzige Endwirt ist, kann der Parasit signifikante Auswirkungen auf die Gesundheit von Menschen und Tieren haben.
Article

Kernaussagen
Toxoplasma gondii-Infektionen bei Katzen sind weltweit verbreitet, die meisten infizierten Katzen bleiben aber asymptomatisch.
Beim Menschen erfolgt eine T. gondii-Infektion durch Aufnahme von Oozysten (z. B. ber Nahrung, Erde und kontaminiertes Wasser) oder Gewebezysten (nicht durchgegartes Fleisch).
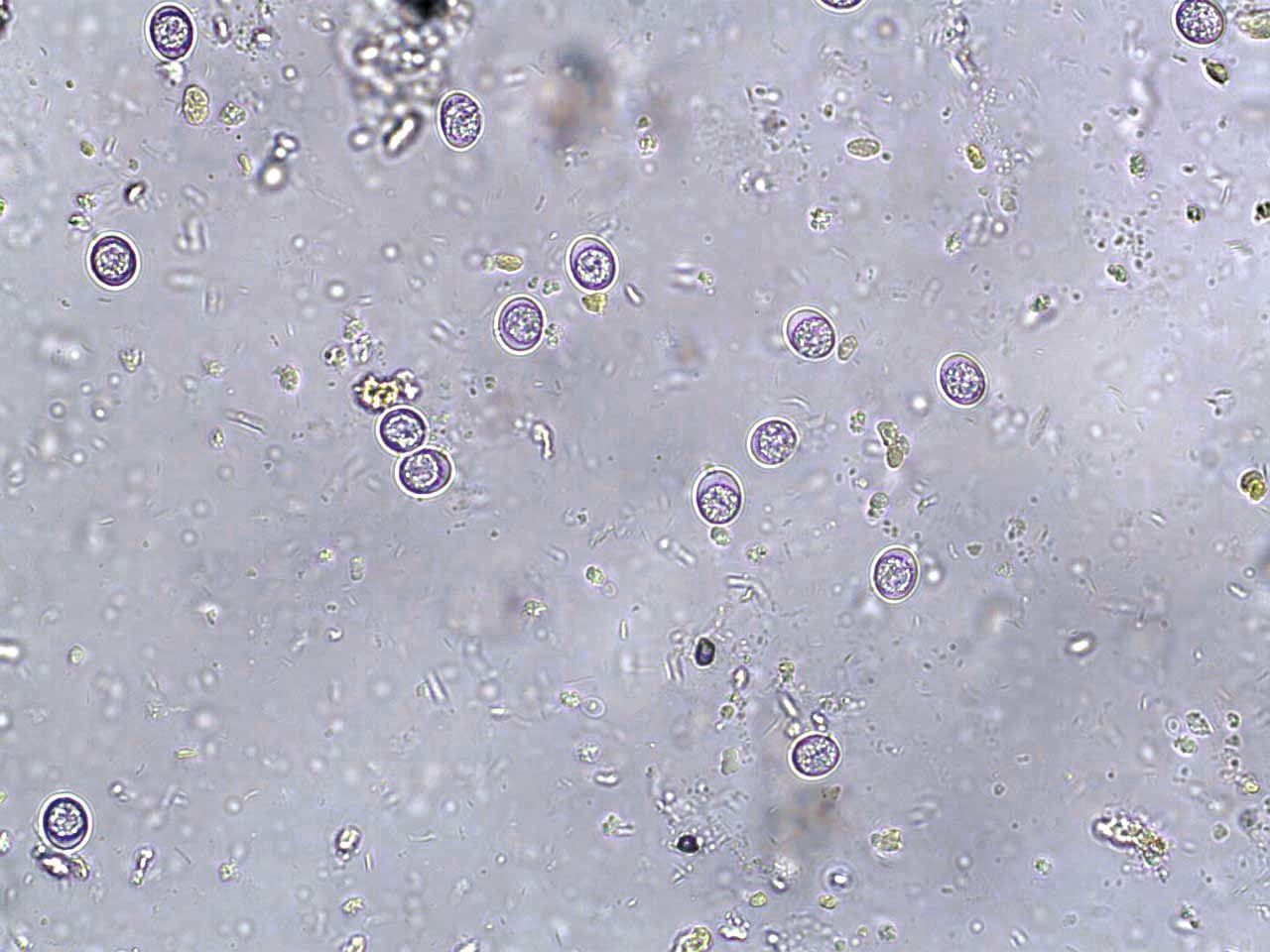
Der Nachweis von T. gondii-Oozysten im Katzenkot als ausschlielicher diagnostischer Test wird aufgrund der kurzen Ausscheidungsperioden und der morphologischen hnlichkeit mit anderen Parasiten nicht empfohlen.
Oozysten bentigen nach ihrer Ausscheidung mindestens 24 Stunden, um infektis zu werden. Die tgliche Reinigung der Katzentoilette ist daher eine wirksame Strategie zur Verhinderung einer bertragung innerhalb des Haushaltes.
Einleitung
Der intrazelluläre protozoische Parasit Toxoplasma gondii kann die meisten Wirbeltierarten infizieren. Feliden sind der einzige Endwirt, zunehmend wird der Parasit aber als große Bedrohung in vielen Ökosystemen eingeschätzt. Die Aufnahme des Parasiten durch den Endwirt oder durch einen Zwischenwirt führt im typischen Fall zu einer chronischen subklinischen oder asymptomatischen Infektion. Bei empfänglichen oder nicht immunkompetenten Individuen kann eine Toxoplasmose jedoch zu Aborten und Reproduktionsstörungen oder sogar zu Organversagen und bis hin zum Tod führen [1]. Heute kommt die Toxoplasmose weltweit vor, und je nach Land variiert die Prävalenz der Oozystenausscheidung zwischen 0,7 und 41 % aller Katzen zu jedem gegebenen Zeitpunkt. Bei Katzen in den USA liegt die Prävalenz positiver T. gondii-Antikörper-Titer zwischen 14 und 100 % [2]. Auch viele Menschen sind infiziert (z. B. etwa 40 Millionen in den USA), und während die meisten humanen Infektionen asymptomatisch verlaufen, können einige Individuen, insbesondere immunkompromittierte Patienten, unter okulären oder neurologischen Problemen leiden [3].
Entwicklungszyklus von Toxoplasma gondii
Toxoplasma gondii hat einen komplexen Entwicklungszyklus und benötigt einen Endwirt und einen Zwischenwirt, um den geschlechtlichen bzw. ungeschlechtlichen Zyklus zu vollenden (Abbildung 1). Der Parasit existiert in drei verschiedenen Formen – als Tachyzoit, Bradyzoit und Sporozoit (in Oozysten), die alle für den Menschen infektiös sein können. Die Tachyzoiten sind das sich schnell teilende ungeschlechtliche Stadium des Parasiten und können in den Geweben sämtlicher Wirbeltierwirte gefunden werden. Auch Bradyzoiten kommen ubiquitär vor und werden ebenfalls in Wirtsgeweben gefunden, dieses Entwicklungsstadium teilt sich aber nur langsam und ist in Gewebezysten enzystiert.
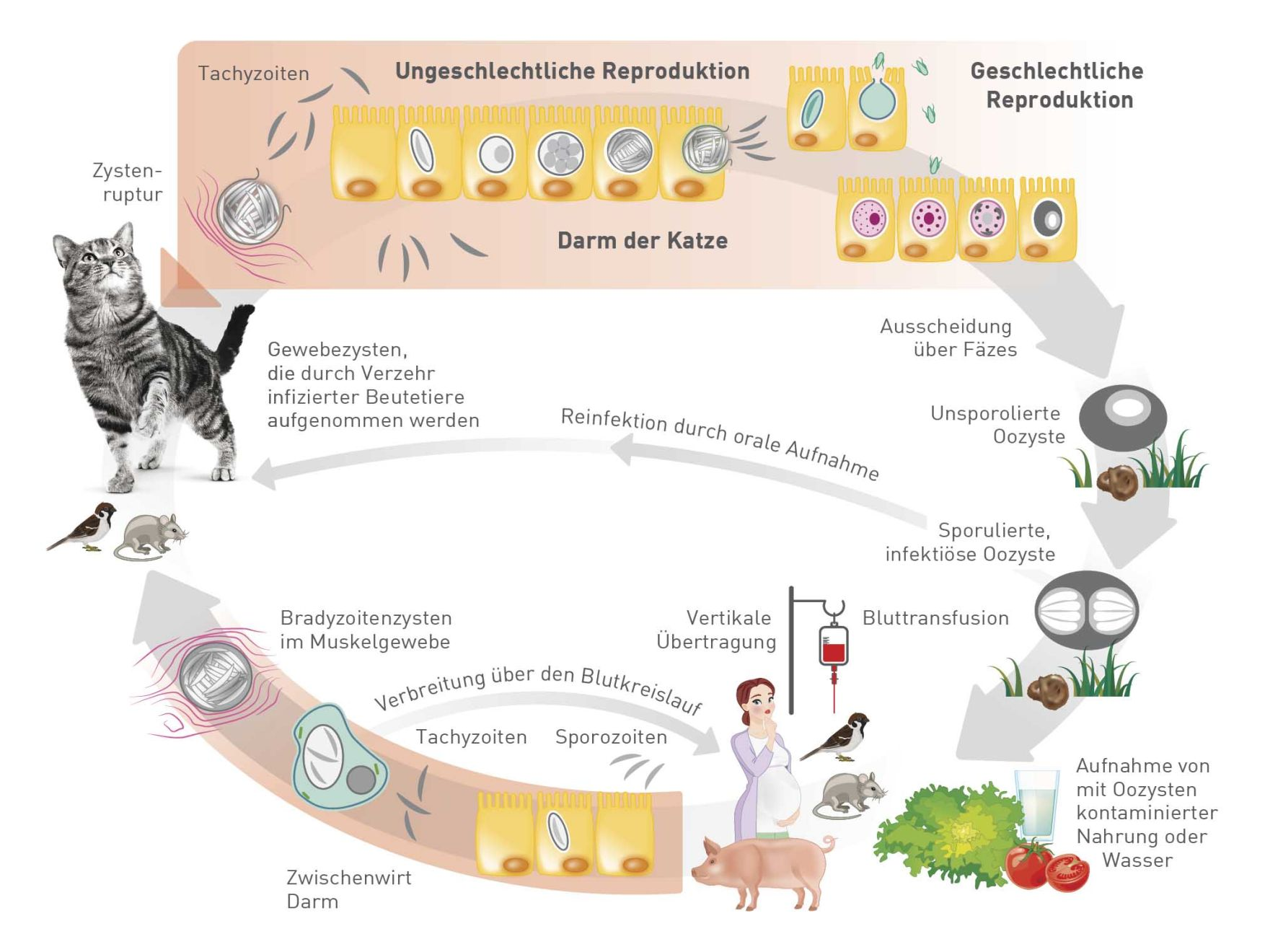
Katzen sind der Endwirt von T. gondii und infizieren sich entweder durch orale Aufnahme von Gewebezysten, z. B. beim Jagen und Fressen infizierter Beutetiere (Abbildung 2), oder durch orale Aufnahme sporulierter oder infektiöser Oozysten aus mit Katzenkot kontaminiertem Boden, Wasser oder Pflanzen. Bei Feliden kann sich der Parasit geschlechtlich reproduzieren, und mit Bradyzoiten oder Oozysten infizierte Katzen beginnen ca. 3-10 beziehungsweise 19-48 Tage nach oraler Aufnahme mit der bis zu zwei Wochen andauernden Ausscheidung von Oozysten über ihren eigenen Kot (Abbildung 3) [2],[4]. Nach der Ausscheidung dauert es 1-5 Tage bis die Oozysten sporulieren und infektiös werden. In der Umwelt sind sporulierte Oozysten äußerst resistent.

Die wichtigsten Wege für die Infektion von Menschen mit T. gondii sind der Verzehr von unzureichend gegartem Fleisch, das Parasitenzysten enthält, und die orale Aufnahme von Oozysten über fäkal kontaminierte Nahrung oder Hände usw. [4],[5].
Klinische Symptome der Toxoplasmose bei Katzen
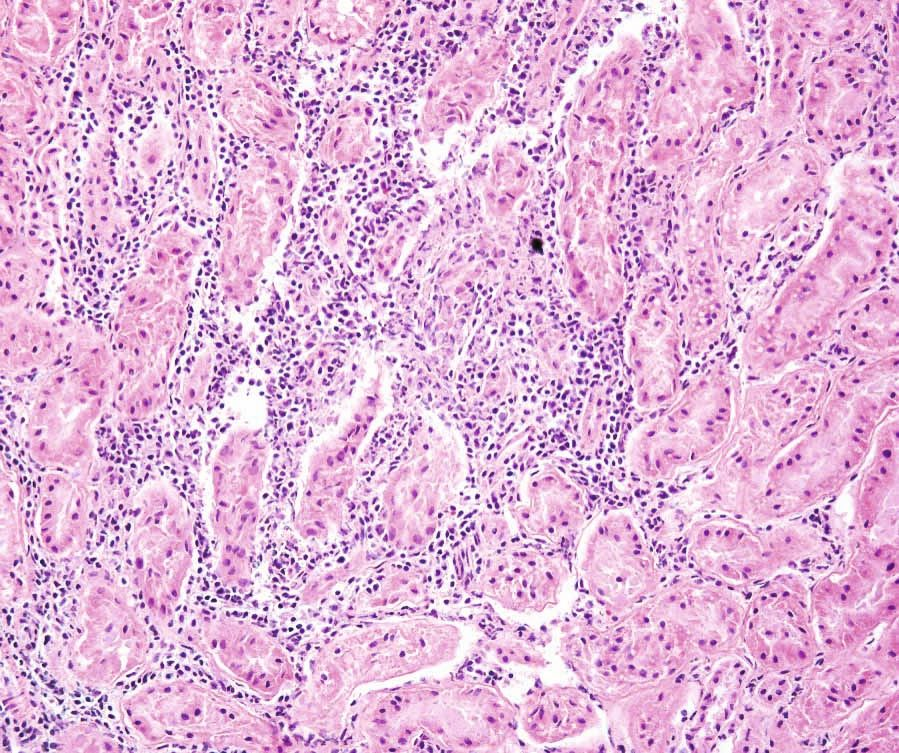
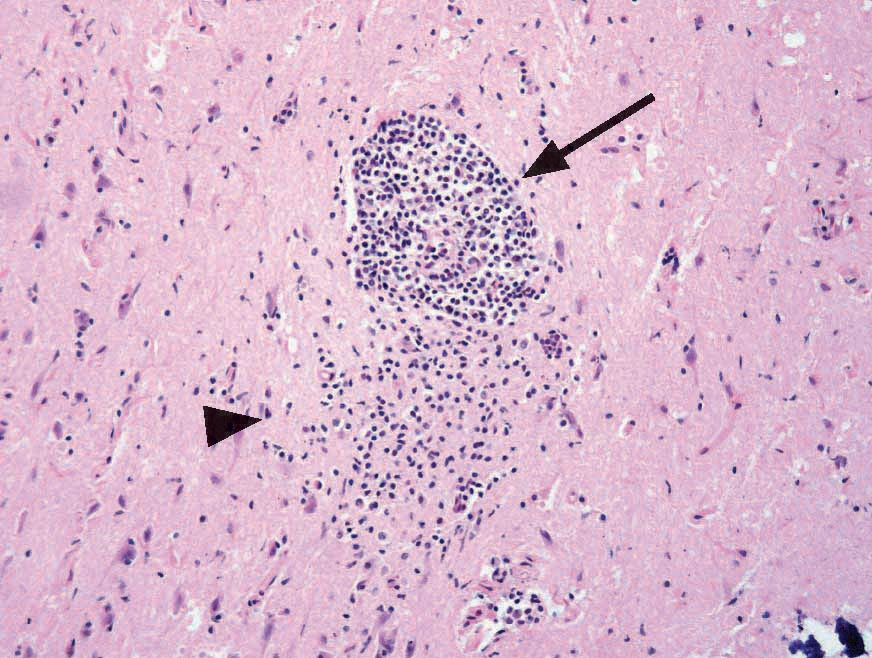
Eine Toxoplasmose kann bei Katzen schwierig zu diagnostizieren sein, da die meisten Infektionen asymptomatisch verlaufen. Wenn klinische Symptome vorhanden sind, werden am häufigsten Fieber, Anorexie und Lethargie festgestellt. Das intrazelluläre Wachstum des Parasiten führt zu direkten zytopathischen Effekten mit zellulärer Entzündung und Nekrose, und spezifischere klinische Symptome hängen weitgehend von der Lokalisierung der Tachyzoiten im Körper ab (Abbildungen 4-6). Dazu gehören unter anderem Augenveränderungen, neurologische Symptome, eine Pneumonie und Ikterus [4]. Bekannte Risikofaktoren für die Entwicklung einer klinischen Erkrankung sind eine Infektion mit dem felinen Leukämievirus oder dem felinen Immundefizienzvirus, Neoplasien sowie eine Behandlung mit Immunsuppressiva (insbesondere Cyclosporin). Akute Infektionen, insbesondere bei Katzenwelpen, verlaufen in der Regel tödlich [6].
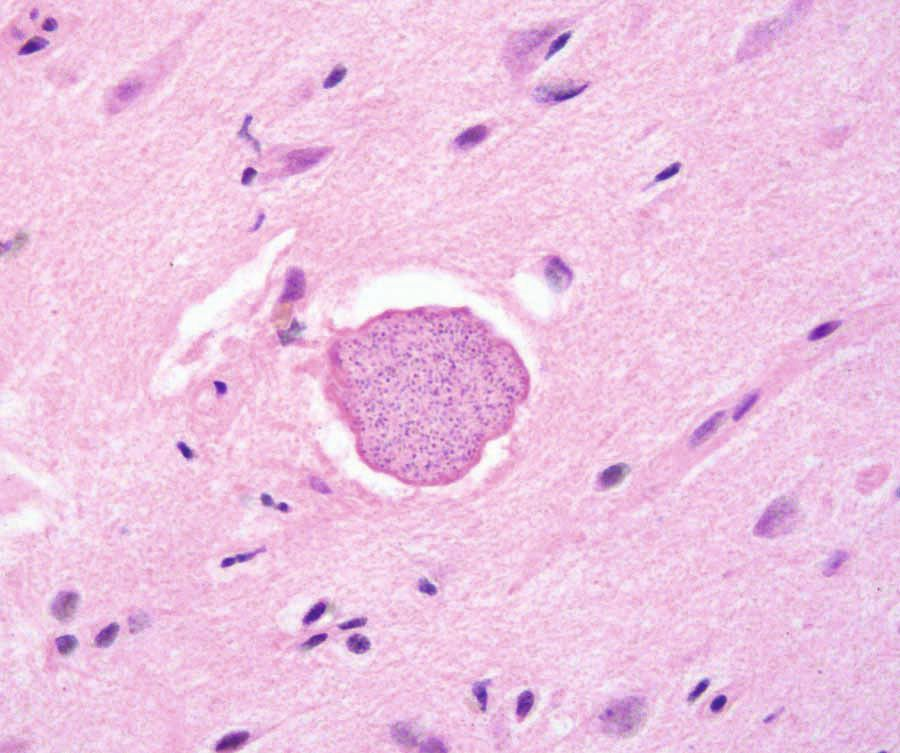
Diagnose
Die verlässliche Diagnose einer Toxoplasmose kann sich als problematisch erweisen. Zu den potenziellen hämatologischen Anomalien bei betroffenen Katzen gehören eine aregenerative Anämie, Leukozytose, Lymphozytose, Monozytose und Eosinophilie. Hochgradige Infektionen können aber auch eine Leukopenie verursachen, insbesondere eine Neutropenie mit degenerativer Linksverschiebung. Die Veränderungen der Serumbiochemie und der Harnwerte hängen in erster Linie von den jeweils betroffenen Organen bzw. Organsystemen ab [6].
Der mikroskopische Nachweis von T. gondii-Oozysten im Kot als ausschließlicher Test wird nicht empfohlen aufgrund der kurzen Ausscheidungsperiode bei felinen Wirten sowie aufgrund der morphologischen Ähnlichkeit von T. gondii-Oozysten mit anderen Parasiten [4],[7]. Hinzu kommt, dass der Nachweis von Oozysten im Kot bei Katzen nicht mit der Entwicklung einer klinischen Erkrankung korreliert [2]. Für die endgültige ante-mortem-Diagnose wird stattdessen eine serologische Untersuchung empfohlen. Hohe IgM-Titer (> 1:256) sprechen im Allgemeinen für eine kürzlich erfolgte T. gondii-Infektion. Alternativ kann auch der IgG-Titer in gepaarten Serumproben (im Abstand von 2-4 Wochen gemessen) herangezogen werden, wobei sich die Interpretation der Ergebnisse als sehr komplex erweisen kann (Tabelle 1) [1],[2]. Einige Katzen können auch unter einer chronischen T. gondii-Infektion leiden, in deren Verlauf es zu einer Ruptur von Gewebezysten mit erneuter Freisetzung von Bradyzoiten in die Zirkulation hinein kommt. Je nach Immunstatus der betreffenden Katze können solche Episoden mit der Ausscheidung von Oozysten verbunden sein oder auch nicht [8].
Ein Screening gesunder Katzen auf T. gondii-Antikörper wird nicht empfohlen [6], da serologische Tests bei Katzen kein genauer Prädiktor für die Ausscheidung von Oozysten sind, und die meisten Katzen, die aktiv Oozysten ausscheiden, zu diesem Zeitpunkt tatsächlich seronegativ sind [2].
Tabelle 1. Interpretation der Ergebnisse einer T. gondii IgG-Serologie [6].
| Serologisches Ergebnis | Interpretation/Analyse |
|---|---|
| ≥ 4-facher Titeranstieg in gepaarten Serumproben | Richtig positiv (kürzliche/aktive Infektion) |
| < 4-facher Titeranstieg in gepaarten Serumproben | Richtig negativ (keine kürzliche/aktive Infektion) ODER falsch negativ (rezidivierende Infektion) |
| Einzelnes hoch positives Ergebnis (z. B. 1:1000) | Vorhandensein von Bradyzoitenzysten |
Toxoplasmose kann bei Katzen schwer zu diagnostizieren sein, da die meisten Infektionen asymptomatisch verlaufen. Wenn klinische Symptome vorhanden sind, werden am häufigsten Fieber, Anorexie und Lethargie beobachtet.
Behandlung und Prognose
Eine zugelassene Behandlung für Katzen mit Toxoplasmose gibt es derzeit nicht. Das Mittel der Wahl für akute oder disseminierte Fälle ist Clindamycin (10-12,5 mg/kg PO alle 12 Std. über bis zu 4 Wochen), begleitet von einer geeigneten unterstützenden Behandlung [6]. Zur Verringerung einer Oozystenausscheidung können Pyrimethamin (0,25-0,5 mg/kg PO alle 12 Std. über bis zu 4 Wochen) oder Sulfonamide (15-30 mg/kg PO alle 12 Std. über bis zu 4 Wochen) verabreicht werden, die sich in der Regel in der akuten Phase der Infektion als vorteilhaft erweisen, aber nur selten zur vollständigen Eradikation der Infektion führen. Eine alternative Therapieoption sind Kombinationsbehandlungen mit Trimethoprim/Sulfonamid (15 mg/kg PO alle 12 Std. über bis zu 4 Wochen) [2], aber auch Antikokzidia (z. B. Toltrazuril, Ponazuril) können in Betracht gezogen werden. Dabei muss aber berücksichtigt werden, dass sich bislang keine Behandlung für das Bradyzoitenstadium der Infektion als signifikant wirksam erwiesen hat [1].
Die Prognose für Katzen mit klinischen Toxoplasmose-Symptomen hängt von einer Reihe von Faktoren ab. Dazu gehören unter anderem die von der Infektion betroffenen Organe bzw. Organsysteme (Abbildungen 7 und 8) und der Zeitabstand zwischen Infektion und Behandlungsbeginn. Bessern sich die klinischen Symptome innerhalb von zwei bis drei Tagen nach Einleitung der Behandlung, ist die Prognose in der Regel günstig, während Toxoplasmose-Infektionen, die Lunge oder Leber einbeziehen, eher schlechte Prognosen haben [4].
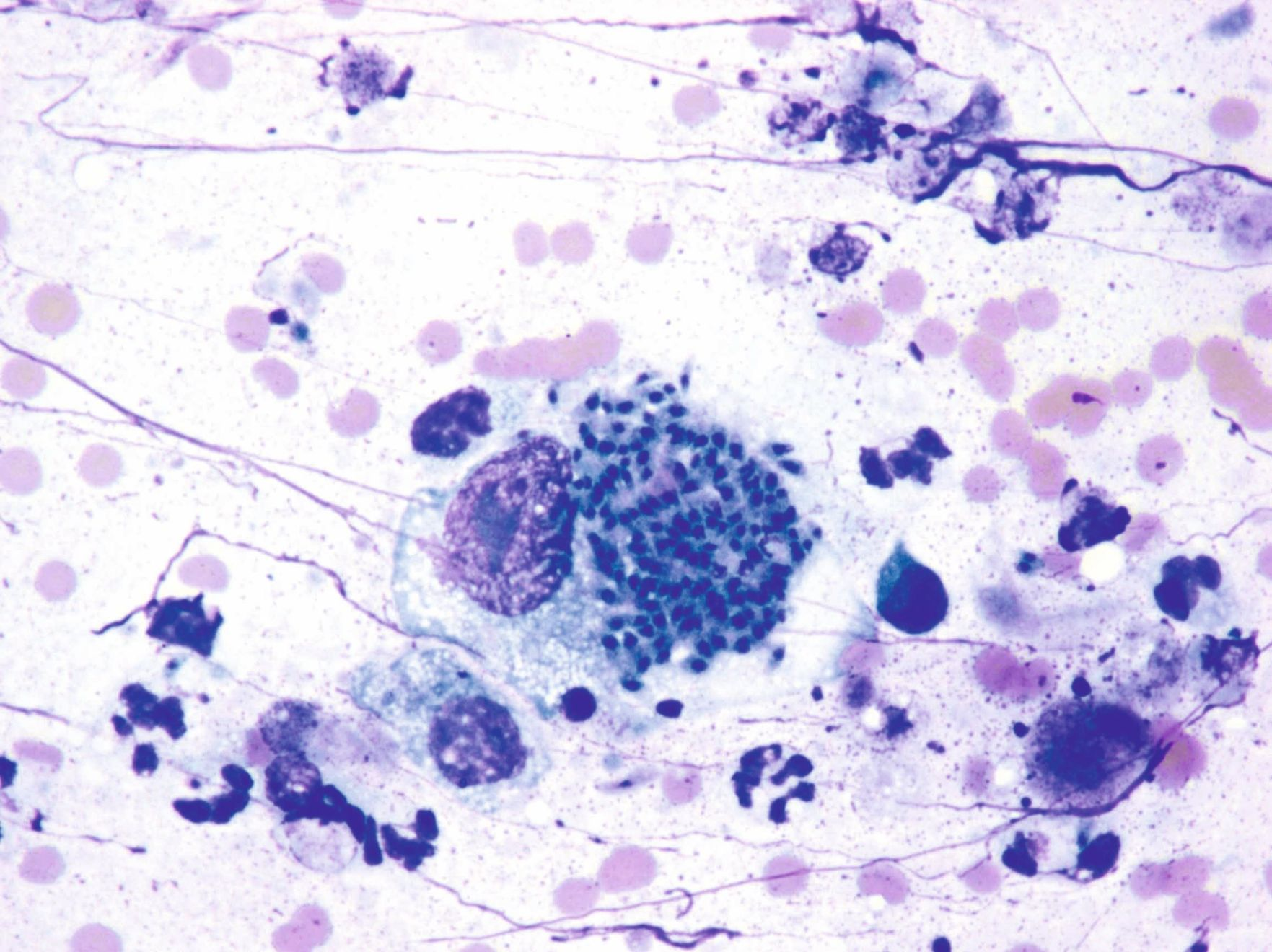
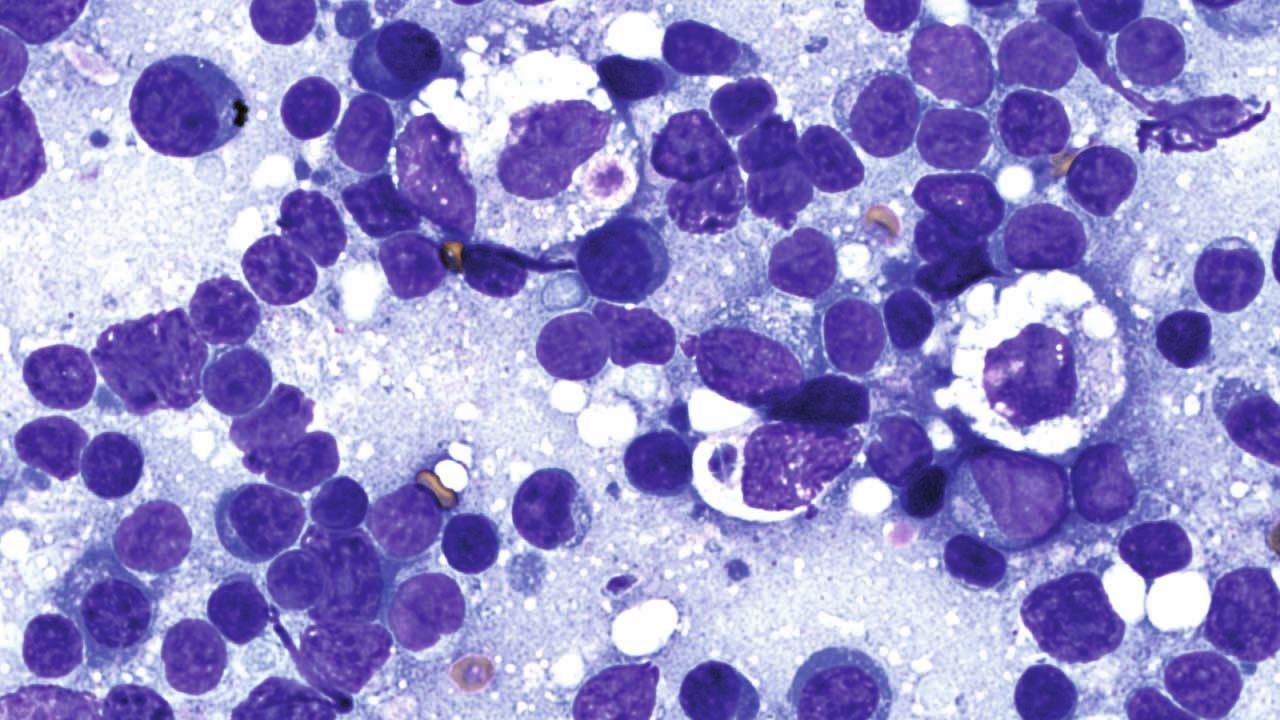
Zoonotische Implikationen
Für den Menschen besteht das Risiko einer T. gondii-Infektion bei oraler Aufnahme von mit Oozysten kontaminierter Nahrung oder Wasser, aber auch bei der Aufnahme von Gewebezysten in kontaminiertem, nicht durchgegartem Fleisch und nicht zuletzt auch durch Bluttransfusionen, Organtransplantationen und kongenitale Infektionen. Die meisten Infektionen bei Menschen verlaufen allerdings asymptomatisch, gelegentlich werden aber Fieber, Lymphadenopathie und Unwohlsein beschrieben. Ein signifikantes Risiko stellt T. gondii jedoch für den menschlichen Fötus während der Schwangerschaft dar. Eine kongenitale Toxoplasmose kann hochgradige okuläre und/oder neurologische Schäden hervorrufen, wenn Tachyzoiten transplazentar wandern und den menschlichen Fötus erreichen [1]. Im Allgemeinen werden die betroffenen Individuen zwar ohne Symptome geboren, sie können später im Leben aber hochgradige Sehstörungen, Anfallsleiden oder andere neurologische Probleme entwickeln [9]. Darüber hinaus besteht bei immunkompromittierten Menschen jeden Alters das Risiko der Entwicklung einer symptomatischen Toxoplasmose, die das Gehirn, die Lunge und/oder andere lebenswichtige Organe einbeziehen kann [5].
Die Untersuchung gesunder Katzen auf <i>T. gondii</i>-Antikörper wird nicht empfohlen, da serologische Tests kein genauer Prädiktor für die Ausscheidung von Oozysten sind, und die meisten Katzen, die aktiv Oozysten ausscheiden, zu diesem Zeitpunkt tatsächlich seronegativ sind.
Zunehmend berichtet wird, dass Toxoplasma-Oozysten weltweit Böden und Grundwasser kontaminieren. So kam zum Beispiel ein Review über 22 Studien zu dem Ergebnis, dass dies ein signifikanter Grund zur Besorgnis ist, da Abschwemmungen von infiziertem Katzenkot zu erheblicher Kontamination von Gewässern führen [3]. Untersuchungen zufolge führt eine entsprechende Kontamination von Meeren zur Infektion und zum Tod verschiedener Meeressäugetiere, wie zum Beispiel Robben, Wale, Delfine und Seeotter [10],[11]. Gefährdet ist auch das Trinkwasser für Menschen, und in einigen Ländern hat achtlos in Toiletten herunter gespülte Katzenstreu bereits zu einer Reihe von Toxoplasmose-Ausbrüchen bei Menschen beigetragen [12],[13].
Oozysten sind bemerkenswert robust und können in der Umwelt selbst unter für sie suboptimalen Bedingungen jahrelang überleben und infektiös bleiben [14]. Zudem sind wahrscheinlich nur sehr wenige Oozysten erforderlich, um einen Menschen erfolgreich zu infizieren. Studien an Schweinen haben gezeigt, dass bereits eine einzige Oozyste ausreicht, um eine Infektion auszulösen [15]. Vor diesem Hintergrund ist es wichtig, effektive Maßnahmen zur verantwortungsvollen Entsorgung von Katzenkot zu ergreifen.
Entgegen der landläufigen Meinung wurde festgestellt, dass der direkte Kontakt mit Katzen kein wesentlicher Risikofaktor für eine Infektion des Menschen mit Toxoplasma gondii ist [16]. Eine einfache Strategie zur Prävention von Infektionen ist bereits die tägliche Reinigung der Katzentoilette (Abbildung 9), da Oozysten nach ihrer Ausscheidung mindestens 24 Stunden benötigen, um infektiös zu werden [4]. Aus präventiver Sicht ist es zudem hilfreich, Katzen nach Möglichkeit „indoor“ zu halten. Tierärzte und Tierärztinnen spielen eine ganz entscheidende Rolle bei der Aufklärung von Katzenhaltern über geeignete Maßnahmen zur wirksamen Verringerung der Risiken von T. gondii-Infektionen, sowohl bei Katzen als auch im Allgemeinen (Tabelle 2).

Tabelle 2. Strategien zur Reduzierung des Zoonoserisikos durch T. gondii-Infektionen [1],[2],[3],[4].
| Allgemeine Strategien | Katzen-spezifische Strategien |
|---|---|
| Gründliches Händewaschen nach dem Umgang mit rohem Fleisch, Gartenarbeit oder anderen risikoreichen Tätigkeiten (z. B. Reinigen einer Katzentoilette) | Katzen „Indoor“ halten |
| Küchenmesser und Schneidebretter nach der Zubereitung von rohem Fleisch, Obst oder Gemüse sorgfältig abwaschen | Katzen ausschließlich mit kommerzieller Trocken- oder Feuchtnahrung oder gekochter Nahrung füttern |
| Fleisch vor dem Verzehr gründlich durchgaren | Katzentoilette täglich reinigen und Katzenstreu verantwortungsvoll entsorgen (z. B. in versiegelten Müllbeuteln) |
| Obst und Gemüse vor dem Verzehr waschen oder schälen | Schwangere oder immunkompromittierte Personen sollten Katzentoiletten nicht reinigen |
| Bei der Gartenarbeit Handschuhe tragen | Sandkästen und lose Erde in Spielbereichen im Freien abdecken, um zu verhindern, dass Katzen dort Kot absetzen |
Schlussfolgerung
Toxoplasma gondii ist bei Katzen eine häufige Ursache parasitärer Infektionen, die oft asymptomatisch verlaufen. Akute oder disseminierte Infektionen können jedoch die Augen, das Gehirn oder andere Organsysteme der Katze befallen. Clindamycin ist das Mittel der Wahl zur Behandlung von Toxoplasma gondii-Infektionen bei Katzen. Eine schlüssige endgültige Diagnose erfordert die serologische Bestimmung eines IgM-Titers oder eines gepaarten IgG-Titers. Als Zoonose ist die Toxoplasmose insbesondere für schwangere oder immunkompromittierte Menschen gefährlich. Das Halten einer Katze stellt per se jedoch kein nennenswertes Risiko für die Infektion des Menschen dar. Eine sehr viel größere und realere Gefahr ist dagegen die orale Aufnahme von mit Oozysten kontaminierter Nahrung oder Wasser oder die Aufnahme von Gewebezysten in nicht durchgegartem Fleisch. Ein weiteres signifikantes Gesundheitsrisiko stellt die fäkale Kontamination von Böden und Wasser mit Toxoplasmen dar. Mit Hilfe einfacher Hygienestrategien kann die Übertragung von T. gondii verhindert werden, und Katzenbesitzer können das Zoonoserisiko in erheblichem Maße reduzieren, indem sie ihre Tiere nach Möglichkeit Indoor halten und Katzentoiletten täglich reinigen.
Christopher Fernandez-Prada
DMV, MSc, PhD, Department of Pathology and Microbiology, University of Montreal, Kanada
Kanada
Dr. Fernandez-Prada ist Tierarzt und Molekularparasitologe und beschäftigt sich mit der Bekämpfung von Zoonoseparasiten. Er ist Associate Professor am Veterinary College der Université de Montréal (UdeM) und Leiter des dortigen Animal Parasitogy Diagnostic Lab sowie Adjunct Professor an der Medizinischen Fakultät der McGill-Universität. Seine Forschung konzentriert sich auf die Entdeckung von Mechanismen der Arzneimittelresistenz und die Entwicklung neuer diagnostischer Tests und Impfstoffe gegen protozoische Parasiten.
Victoria Wagner
DMV, MSc, Department of Pathology and Microbiology, University of Montreal, Kanada
Kanada
Dr. Wagner schloss ihr Studium 2020 am Veterinary College der UdeM ab und absolvierte anschließend ein Masterstudium in Veterinärparasitologie an derselben Einrichtung in Zusammenarbeit mit dem McGill University Health Centre, wobei ihr Schwerpunkt auf der Leishmaniose bei Hunden lag. Derzeit ist Dr. Wagner sowohl in der allgemeinen Kleintierpraxis als auch in der Labormedizin tätig und hat besonderes Interesse an Forschung und Ausbildung im Bereich zoonotischer Parasiten.
Literatur
- Mor GA. Toxoplasmosis in Animals. Merck Manual Veterinary Manual. 2022. https://www.msdvetmanual.com/generalized-conditions/toxoplasmosis/toxoplasmosis-in-animals accessed 17th January 2023
- Companion Animal Parasite Council (CAPC). CAPC Guidelines; Toxoplasma gondii. 2014. https://capcvet.org/guidelines/toxoplasma-gondii/ accessed 17th January 2023
- Torrey E. Sentinel seals, safe cats, and better treatments. In: Parasites, Pussycats and Psychosis. Springer, Cham. 2022;121-133.
- Cornell Feline Health Center. Toxoplasmosis in Cats. 2018 https://www.vet.cornell.edu/departments-centers-and-institutes/cornell-feline-health-center/health-information/feline-health-topics/toxoplasmosis-cats Accessed 17th January 2023
- Elmore SA, Jones JL, Conrad PA, et al. Toxoplasma gondii: epidemiology, feline clinical aspects, and prevention. Trends Parasitol. 2010;26(4):190-196.
- Barrs V. Feline Toxoplasmosis. In; Proceedings, WSAVA Congress 2013. Sydney, Australia.
- Abdul Hafeez M, Mehdi M, Aslam F, et al. Molecular characterization of Toxoplasma gondii in cats and its zoonotic potential for public health significance. Pathogens 2022;11(4):437.
- Castillo-Morales VJ, Acosta Viana KY, Guzmn-Marn EDS, et al. Prevalence and risk factors of Toxoplasma gondii infection in domestic cats from the Tropics of Mexico using serological and molecular tests. Interdiscip. Perspect. Infect. Dis. 2012;2012:529108.
- Center for Disease Control. Toxoplasmosis: An Important Message for Cat Owners. https://www.cdc.gov/parasites/toxoplasmosis/resources/printresources/catowners_2017.pdfaccessed 17th January 2023
- Iqbal A, Measures L, Lair S, et al. Toxoplasma gondii infection in stranded St. Lawrence Estuary beluga Delphinapterus leucas in Quebec, Canada. Dis. Aquat. Organ 2018;130(3):165-175.
- Miller MA, Grigg ME, Kreuder C, et al. An unusual genotype of Toxoplasma gondii is common in California sea otters (Enhydra lutris nereis) and is a cause of mortality. Int. J. Parasitol. 2004;34(3):275-284.
- Bowie, WR, King AS, Werker DH, et al. Outbreak of toxoplasmosis associated with municipal drinking water. The BC Toxoplasma Investigation Team. Lancet 1997;350(9072):173-177.
- Shapiro K, Bahia-Oliveira L, Dixon B, et al. Environmental transmission of Toxoplasma gondii: Oocysts in water, soil and food. Food Waterborne Parasitol. 2019;15;e00049.
- Yilmaz SM, Hopkins SH. Effects of different conditions on duration of infectivity of Toxoplasma gondii oocysts. J. Parasitol. 1972;58(5):938-939.
- Dubey JP, Lunney JK, Shen SK, et al. Infectivity of low numbers of Toxoplasma gondii oocysts to pigs. J. Parasitol. 1996;82(3):438-443.
- Dubey JP, Jones JL. Toxoplasma gondii infection in humans and animals in the United States. Int. J. Parasitol. 2008;38(11):1257-1278.
Andere Artikel in dieser Ausgabe
Auf sozialen Medien teilen