Pathologische Hypercalcämie beim Hund
Geschrieben von Jordan M. Hampel und Timothy M. Fan
Dieser Artikel befasst sich mit den Differentialdiagnosen und den therapeutischen Optionen bei einem Hund, der mit erhöhtem Calciumspiegel in der Praxis vorgestellt wird.
Article
Kernaussagen
Die Calciumhomostase wird eng reguliert durch Parathormon, Calcitonin und Vitamin D, die in erster Linie die Mobilisierung, die Ausscheidung bzw. die Absorption von Calcium im Skelett, in den Nieren bzw. im Darm beeinflussen.
Die hufigsten Ursachen einer Hypercalcmie bei Hunden sind Neoplasien, primrer Hyperparathyreoidismus und Hypoadrenokortizismus; eine idiopathische Hypercalcmie, wie sie hufig bei Katzen zu beobachten ist, kommt bei Hunden seltener vor.
Zu den klinischen Symptomen einer Hypercalcmie gehren primre Polyurie mit sekundrer Polydipsie, allgemeine Schwche, Lethargie, gastrointestinale Strungen und Gewichtsverlust.
Eine unmittelbare therapeutische Intervention zur Verbesserung der Calciurese kombiniert mit einer Diagnose und Behandlung der zugrundeliegenden Ursache der Hypercalcmie sind entscheidend fr ein optimales Management dieser Patienten und fr ein gnstiges Outcome.
Einleitung
Calcium ist das fünfthäufigste Element im Körper, kommt als essentielles Kation in Körperflüssigkeiten vor und wird auch in den Zellorganellen gespeichert. Es ist für viele lebenswichtige intra- und extrazelluläre Funktionen verantwortlich, darunter die neuromuskuläre Übertragung, enzymatische Reaktionen, die Blutgerinnung, der vasomotorische Tonus, die Hormonsekretion und der Knochenstoffwechsel. Calcium ist in zellulären Geweben breit verteilt, und schnelle Schwankungen des intrazellulären Calciums dienen als primärer Regulator zellulärer Reaktionen nach Aktivierung von Plasmamembranrezeptoren; zudem dient Calcium als ein sekundärer Botenstoff, der für die Weiterleitung externer Signale in die Zellen hinein verantwortlich ist, um nachgeschaltete biologische Funktionen zu steuern [1].
Während für die Aufrechterhaltung physiologischer zellulärer Aktivitäten das intrazelluläre Calcium von entscheidender Bedeutung ist, beschränkt sich die klinische Messung auf das Calcium in den Körperflüssigkeiten, wo es in drei verschiedenen Formen vorkommt, nämlich ionisiert, proteingebunden und komplexiert mit Anionen oder organischen Säuren. Das ionisierte Calcium (iCa) ist die biologisch aktive Form, die dank permeabler Ionenkanäle, aktiver Transporter und Kationenaustauscher Plasmamembranen passieren kann [2], und 50 % des gesamten Serumcalciums ausmacht. Die verbleibende Calciumfraktion verteilt sich zu etwa 40 % auf proteingebundene Formen und zu 10 % auf komplexierte Formen. Aufgrund der wichtigen Bedeutung des iCa für die Zellfunktionen muss die iCa-Konzentration im Körper sehr eng reguliert werden, um die physiologischen Aktivitäten einer Vielzahl von Zell-, Gewebe- und Organsystemen sicherzustellen; diese Regulation geschieht in erster Linie durch die konzertierten Wirkungen von Parathormon (PTH), 1,25-Dihydroxycholecalciferol (aktives Vitamin D3 oder Calcitriol) und Calcitonin [3]. Neben seiner zentralen Bedeutung für die intrazelluläre Signalübertragung reguliert Calcium in der extrazellulären Flüssigkeit auch die Zellfunktionen vieler lebenswichtiger Drüsen- und Epithelgewebe, einschließlich der Nebenschilddrüse, der C-Zellen der Schilddrüse und der Niere.
Calciumhomöostase
Die drei Hauptmediatoren PTH, Calcitonin und Calcitriol sind für das Gleichgewicht der Konzentration des Ganzkörpercalciums zuständig, indem sie komplementäre und/oder synergistische biologische Aktivitäten auf die drei entscheidenden Zielorgane der Calciumhomöostase ausüben, nämlich die Nieren, den Dünndarm und die anorganische Knochenmatrix (Hydroxylapatit) [3] (Abbildung 1).
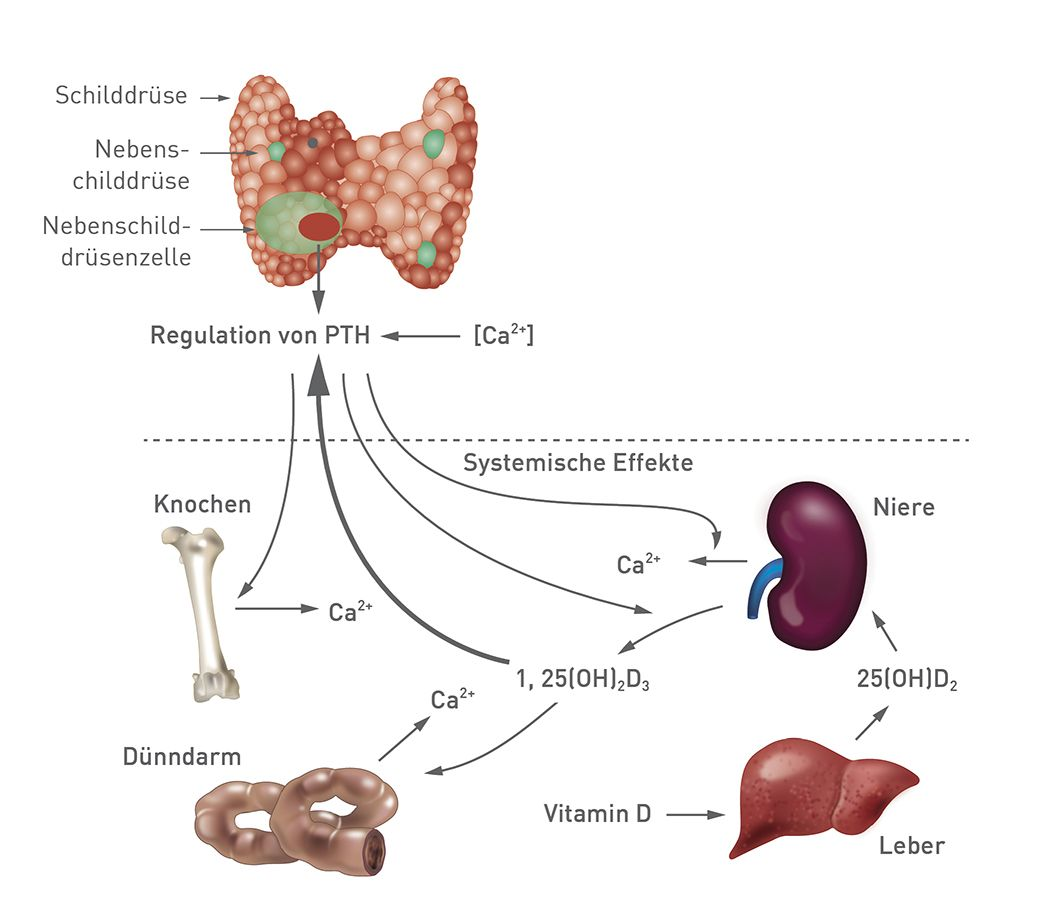
PTH dient als Hauptregulator und steuert die minütlichen Schwankungen des Calciumspiegels im Körper. Ist der Calciumspiegel erhöht, wird die PTH-Sekretion herunterreguliert, wodurch es zu einem Netto-Calciumverlust über die distalen Tubuli in den Nieren, einer verringerten intestinalen Calciumabsorption und einer verminderten osteoklastischen Knochenresorption kommt [4]. Umgekehrt schütten die Nebenschilddrüsen im Falle eines verminderten Serumcalciumspiegels vermehrt PTH aus, welches dann in den distalen Nierentubuli eine Calciumreabsorption und eine Phosphorausscheidung induziert. PTH trägt zudem indirekt zur Calciumabsorption im Dünndarm bei über die Umwandlung von Vitamin D in hochaktives Vitamin D3 (Calcitriol) in den proximalen Nierentubuli durch Hochregulierung der 1-alpha-Hydroxylase-Aktivität [4]. Darüber hinaus wirkt PTH auf das Skelettgewebe und stimuliert dort die Proliferation vorhandener knochenbildender Zellen (Osteoblasten); hierbei handelt es sich um einen frühen Effekt, der eine Erhöhung der Knochenmineraldichte hervorruft [5]. Chronische PTH-Signale können die Expression von RANKL (Protein aus der Familie der Tumornekrosefaktoren, das an der Regulation des Knochenumbaus beteiligt ist) in den Osteoblasten hochregulieren, deren Folge eine Aktivierung und ein Überleben von Osteoklasten ist, wodurch es wiederum zu gesteigerten knochenresorptiven Aktivitäten kommt [6].
Calcitriol ist an der Calciumregulation vor allem über eine erhöhte Synthese von Calbindin-D-Proteinen beteiligt, die die intestinale Absorption diätetischen Calciums im Dünndarm steigern und die anschließende Freisetzung von Calcium in den Blutkreislauf erhöhen [7]. Calcitriol kann auch als negativer Feedback-Regulator für sich selbst wirken, indem es in das weniger aktive 24,25-Dihydroxycholecalciferiol umgewandelt wird, aber auch indem es Calcium negativ reguliert durch eine Verringerung der PTH-mRNA-Transkription.
Calcitonin spielt bei langsamen / längerdauernden Änderungen des Calciumspiegels keine große Rolle, es dient aber als Notfallhormon zur Senkung des Serumspiegels im Falle akuter, schneller Anstiege des Calciumspiegels. Calcitonin wird von den C-Zellen der Schilddrüse freigesetzt nach Stimulation durch eine Hypercalcämie und die Aufnahme calciumreicher Mahlzeiten, die zur Sekretion enterischer Hormone (d. h. Gastrin und Cholecystokinin) führen. Die biologischen Aktivitäten von Calcitonin werden hauptsächlich durch Hemmung der osteoklastischen Knochenresorption vermittelt [8].
Da Hypercalcämie durch eine große Bandbreite unterschiedlicher Erkrankungsprozesse ausgelöst werden kann, hängen die adäquate Behandlung, der Schweregrad der klinischen Symptome und die Gesamtprognose von der zugrundeliegenden Ätiopathogenese ab.
Differentialdiagnosen
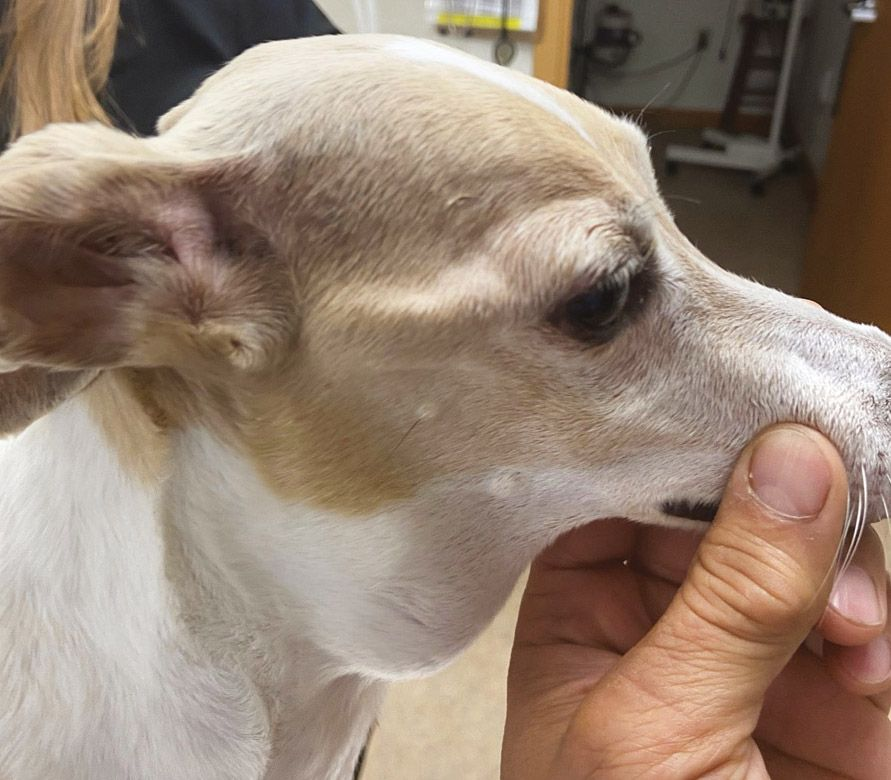
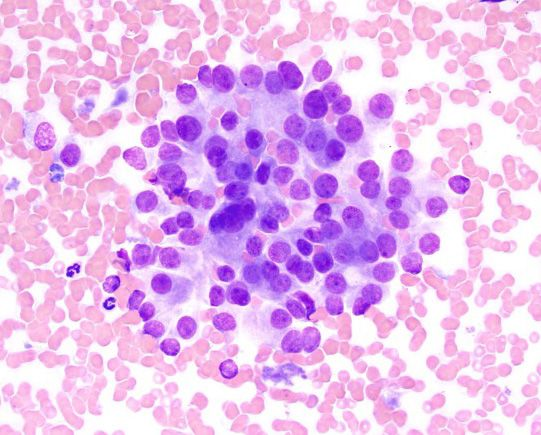
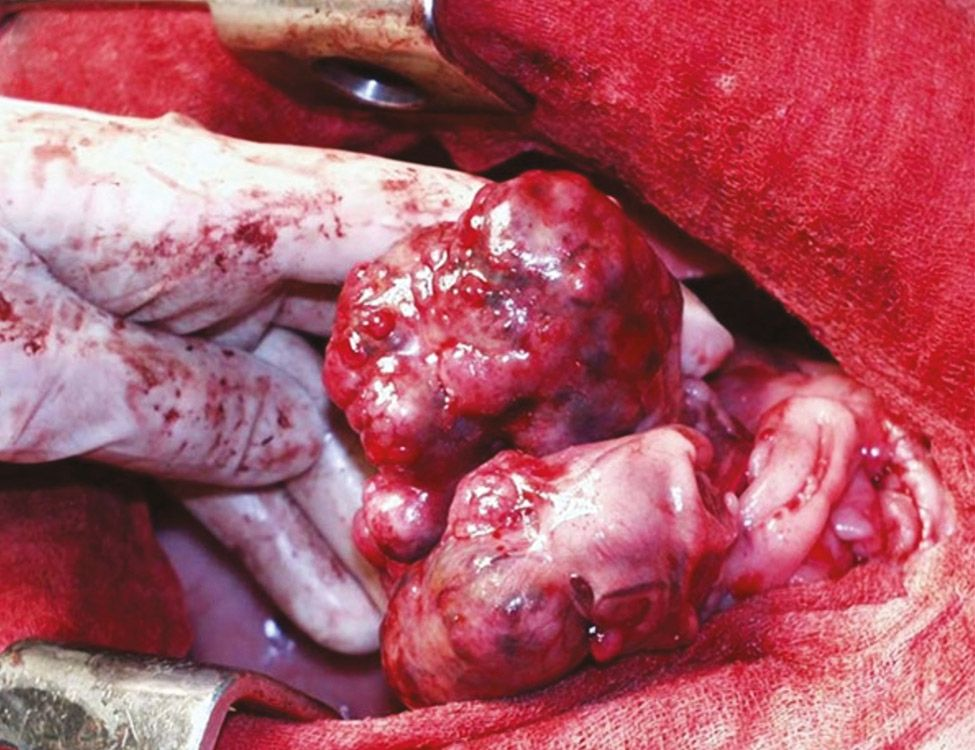
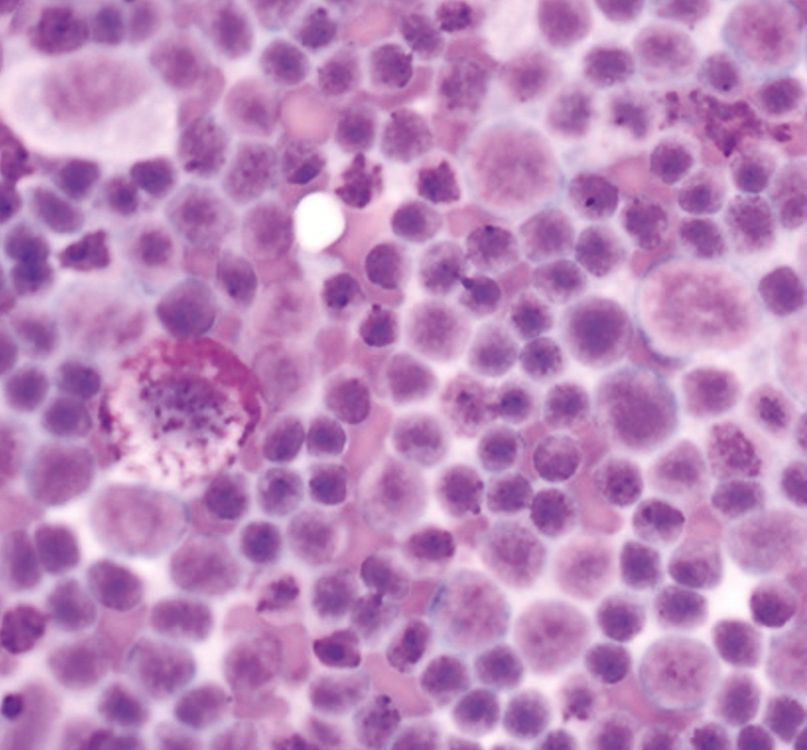
Hypercalcämie wird bei Hunden und Katzen mit einer Vielzahl von physiologischen und pathologischen Zuständen in Verbindung gebracht, die grob unterteilt werden können in nebenschilddrüsenabhängig und nebenschilddrüsenunabhängig. Nebenschilddrüsenabhängige Ursachen sind der primäre Hyperparathyreoidismus und (seltener) der sekundäre ernährungsbedingte oder renale Hyperparathyreoidismus. Alle anderen Ursachen von Hypercalcämie gelten als nebenschilddrüsenunabhängig und umfassen verschiedene pathologische Zustände wie tumorassoziierte (Abbildung 2 und 3), toxische, idiopathische, metabolische, skelettale und granulomatöse Erkrankungen [9]. In jüngsten Studien mit einer großen Anzahl von Kleintieren waren die häufigsten pathologischen Ursachen einer ionisierten Hypercalcämie bei Hunden verschiedene Neoplasien, primärer Hyperparathyreoidismus und Hypoadrenokortizismus, während bei Katzen Neoplasien (z. B. orale Plattenepithelkarzinome), chronische Nierenerkrankungen, idiopathische Hypercalcämie (sekundär infolge von Störungen im calciumsensitiven System) und (seltener) Hypervitaminose D als häufigste Ursachen festgestellt wurden [10],[11],[12],[13],[14]. Die insgesamt häufigste Ursache von Hypercalcämie bei Kleintieren sind aber Neoplasien, wobei eine neoplasieassoziierte Hypercalcämie bei etwa 60 % der betroffenen Hunde und bei 30 % der betroffenen Katzen diagnostiziert wird [11],[12],[13] (Abbildung 4 und 5). Es gibt unterschiedliche Mnemotechniken oder Akronyme, um sich die verschiedenen klinischen Szenarien im Zusammenhang mit Hypercalcämie in Erinnerung zu rufen. Da eine Hypercalcämie häufig die Diagnose signifikanter zugrundeliegender Krankheitspathologien gewissermaßen vorausahnen lassen kann, ist „GOSH, DARN IT“ eine sehr gut geeignete Eselsbrücke (Tabelle 1).
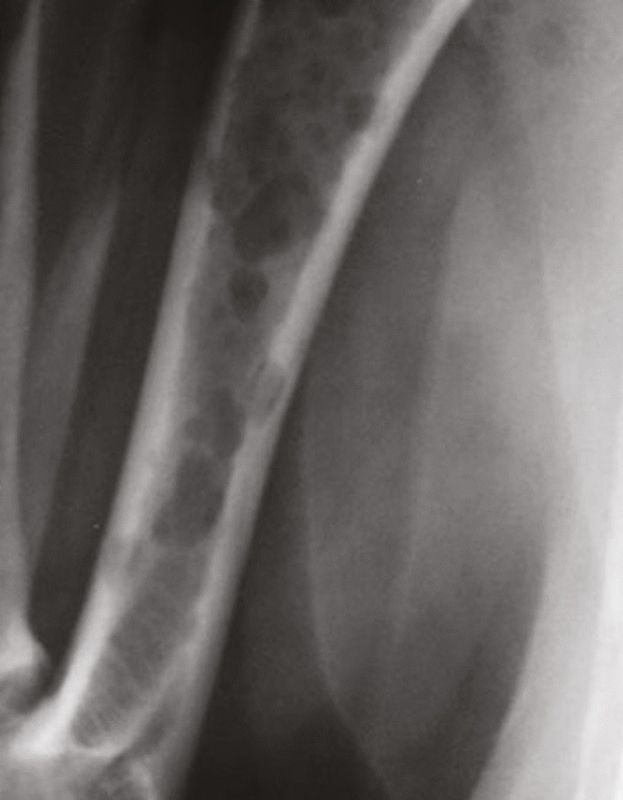
Erhöhte Calciumspiegel als Folge von Tumorerkrankungen treten zwar häufig auf, es können aber verschiedene Mechanismen verantwortlich sein [15],[16]. Die wichtigste und häufigste Ursache für die Entstehung einer Hypercalcämie ist die Bildung löslicher Faktoren durch Tumorzellen, die zu einer Knochenresorption führen. Dieser Mechanismus wird als humorale Hypercalcämie bei Malignomen bezeichnet oder verkürzt auch als maligne Hypercalcämie. Ein zweiter Mechanismus ist die direkte Invasion von Tumorzellen in den Knochen, die zu einer Osteolyse führt und häufig festzustellen ist bei Karzinomen oder hämatopoetischen Knochenmarkstumoren wie Leukämien, Lymphomen und multiplem Myelom. Und schließlich kommt es im Rahmen des dritten und am wenigsten häufigen Mechanismus infolge der Bildung der aktiven Form von Vitamin D durch 1-α-Hydroxylase-exprimierende Zellen zu einer Steigerung der intestinalen Absorption von Calcium.

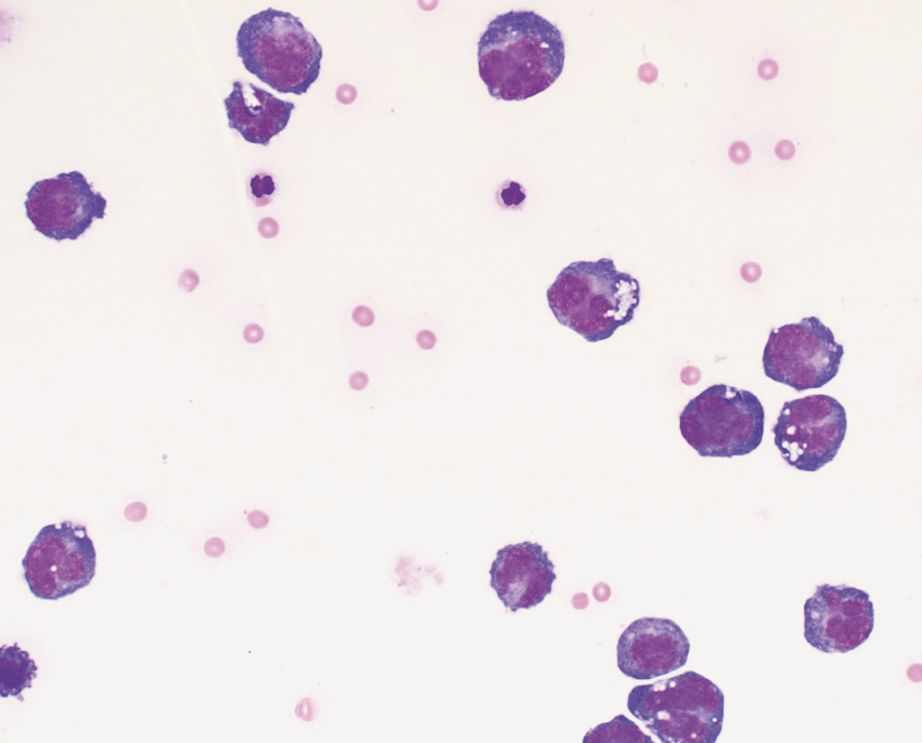
Tabelle 1. GOSH DARN IT - Eine hilfreiche Eselsbrücke für die Liste möglicher Ursachen einer Hypercalcämie.
|
Humorale Hypercalcämie bei Malignomen
Bei der humoralen Hypercalcämie bei Malignomen oder maligner Hypercalcämie kommt es zu einer malignen Sekretion von Parathormon-verwandtem Peptid (PTHrp), das strukturell dem PTH ähnlich ist [17], und von Zytokinen wie IL-1, IL-6 oder Tumor-Nekrose-Faktor [15]. Diese humoralen Faktoren führen zu einer generalisierten und diffusen osteoklastischen Resorption ohne radiologisch sichtbare Knochenläsionen. Da es sich bei PTHrp um ein sekretorisches Protein handelt, kann prinzipiell jeder Zelltyp sekretorischer Natur, der einer malignen Transformation unterliegt, potenziell übermäßige Mengen dieses Hormons freisetzen.
Das Lymphom ist die häufigste Ursache für maligne Hypercalcämie, insbesondere das mediastinale Lymphom. Weitere Tumoren, die für Hypercalcämie bei Hunden (und Katzen) verantwortlich sein können, sind das Adenokarzinom der apokrinen Drüsen der Analbeutel (AGASACA), das Schilddrüsenkarzinom, das multiple Myelom, multiossäre Knochentumore, das Thymom, Plattenepithelkarzinome, Karzinome/Adenokarzinome der Mamma, Melanome, primäre Lungentumore, die chronische lymphatische Leukämie, das renale Angiomyxom und Nebenschilddrüsentumore. Als allgemeine Faustregel gilt, dass eine Hypercalcämie bei 10-35 % der betroffenen Hunde mit Lymphom, bei ≥ 25 % der Hunde mit AGASACA und bei etwa 20 % der Hunde mit multiplem Myelom festzustellen ist.
Klinische Symptome
In Anbetracht des breiten und vielfältigen Spektrums physiologischer Funktionen von Calciumionen verursachen sowohl Hypercalcämie als auch Hypocalcämie multisystemische Effekte [10],[11]. Eine erhöhte Serumcalciumkonzentration führt durch Veränderungen der Permeabilität der Zellmembranen und der Aktivität der Zellmembranpumpen zu einer insgesamt herabgesetzten Zellfunktion. Ein Anstieg des intrazellulären iCa kann zu Störungen der Zellfunktion und verminderter Energieproduktion führen, und dadurch den Zelltod und eine dystrophische und/oder metastatische Mineralisierung zur Folge haben. Zahlreiche Gewebe des Körpers können von einer Hypercalcämie betroffen sein, die größte klinische Bedeutung haben jedoch die Auswirkungen erhöhter Calciumkonzentrationen auf das zentrale Nervensystem, den Gastrointestinaltrakt, das Herz und die Nieren. Unabhängig von der auslösenden Ursache ist eine eingeschränkte Nierenfunktion ein signifikantes klinisches Merkmal einer Hypercalcämie, insbesondere im Rahmen einer Neoplasie [18]. Klinische Symptome im Zusammenhang mit Hypercalcämie können unspezifischer und schleichender Natur sein und in ihrem Schweregrad erheblich variieren, häufige zu beobachtende Symptome sind aber eine primäre Polyurie mit kompensatorischer Polydipsie (PU/PD), Anorexie, Lethargie, Schwäche, Erbrechen, Depression, Muskelzuckungen, Herzarrhythmien und Anfälle [9]. Bei Katzen mit Hypercalcämie stehen gastrointestinale Symptome, insbesondere Anorexie und Erbrechen, im Vordergrund [19].
Diagnostische Herangehensweise an den hypercalcämischen Patienten
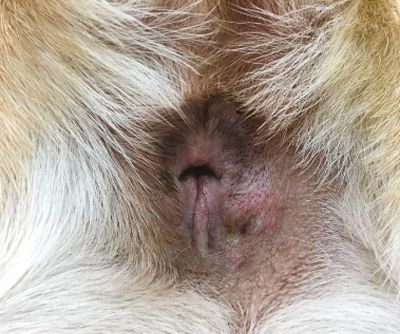
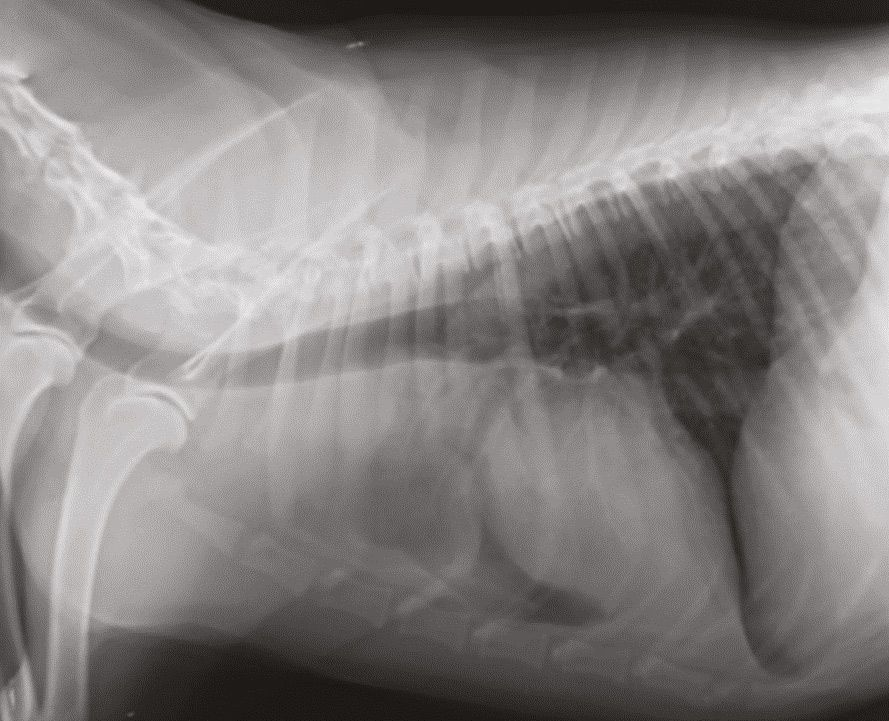
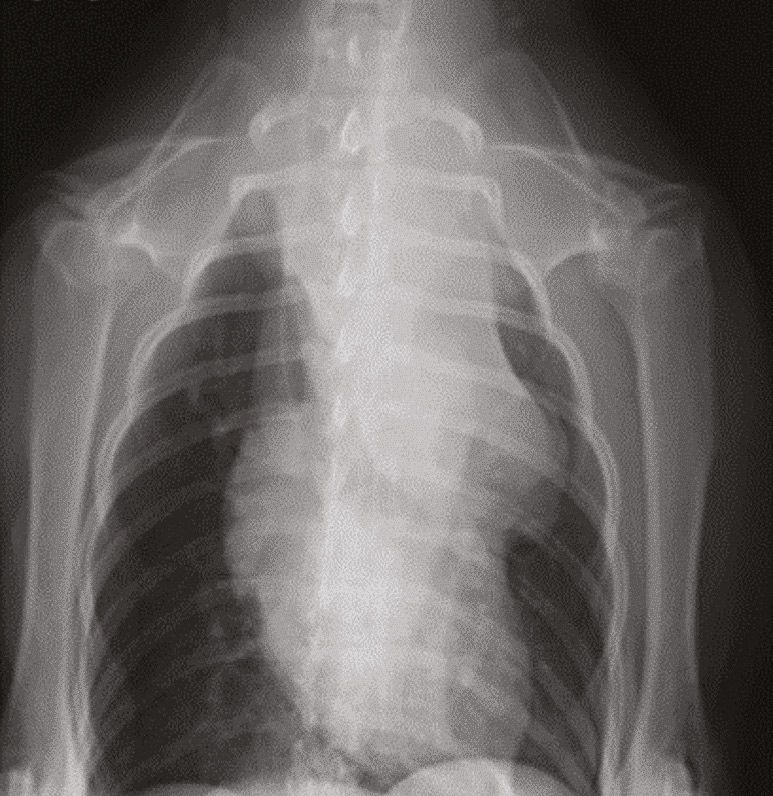
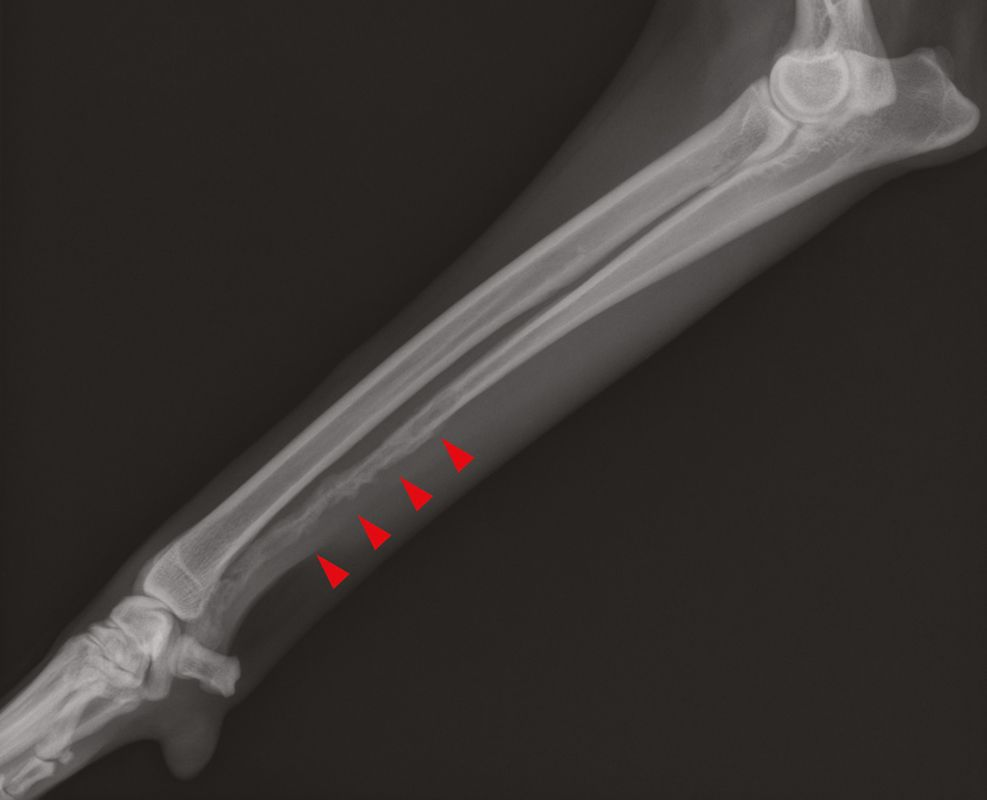
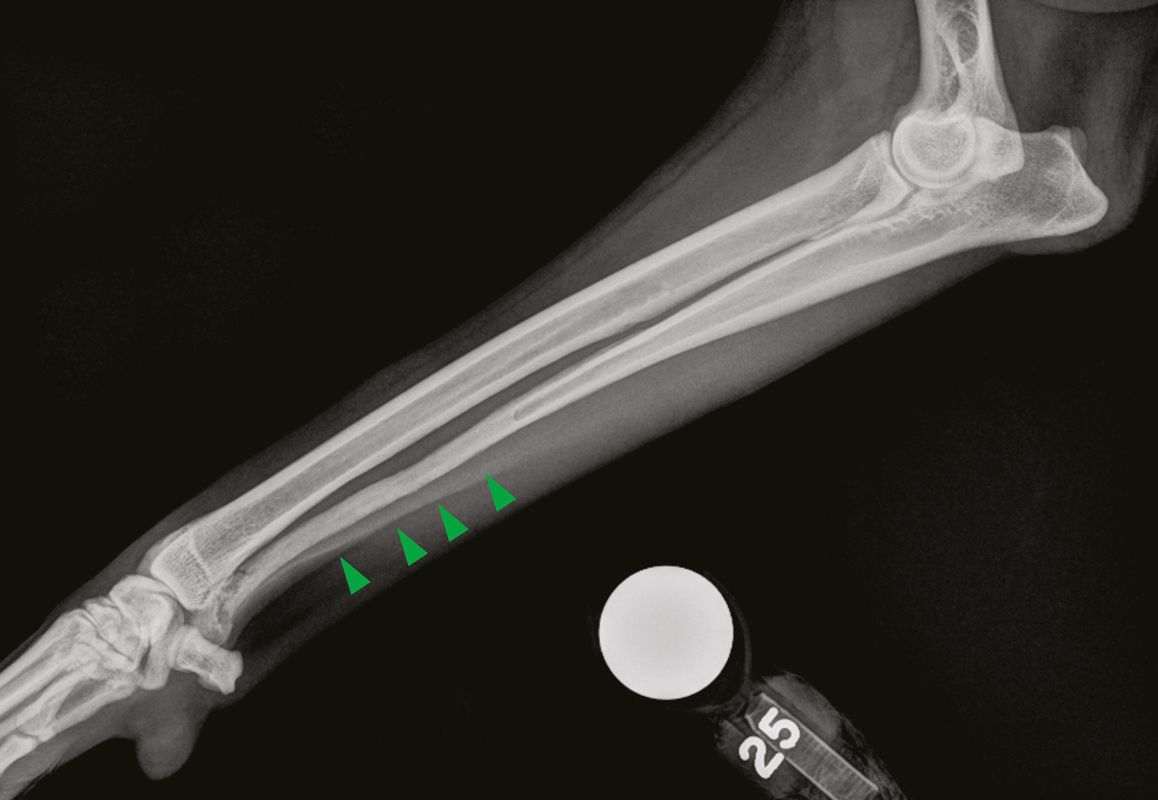
Die Messung des iCa ist bei Kleintieren aussagekräftiger als die Bestimmung des Gesamtcalciums. Interessanterweise ist die Magnitude der Erhöhung der Calciumkonzentration bei maligner Hypercalcämie tendenziell größer als bei anderen Ursachen [12],[13]. Die ersten Schritte bei einem Patienten mit Verdacht auf Hypercalcämie sind zunächst eine gründliche Anamnese und eine klinische Untersuchung, die eine sorgfältige Beurteilung der peripheren Lymphknoten und eine rektale Palpation (zur Überprüfung auf AGASACA) umfasst (Abbildung 6-8). Auf der Grundlage dieser Befunde können zusätzliche diagnostische Maßnahmen (großes Blutbild, klinisch-chemisches Profil, Harnanalyse, Thoraxröntgenaufnahmen und abdominaler Ultraschall) durchgeführt werden, um den klinischen Verdacht weiter zu erhärten oder pathologische Veränderungen nachzuweisen, die bei der klinischen Untersuchung zunächst nicht aufgefallen sind.
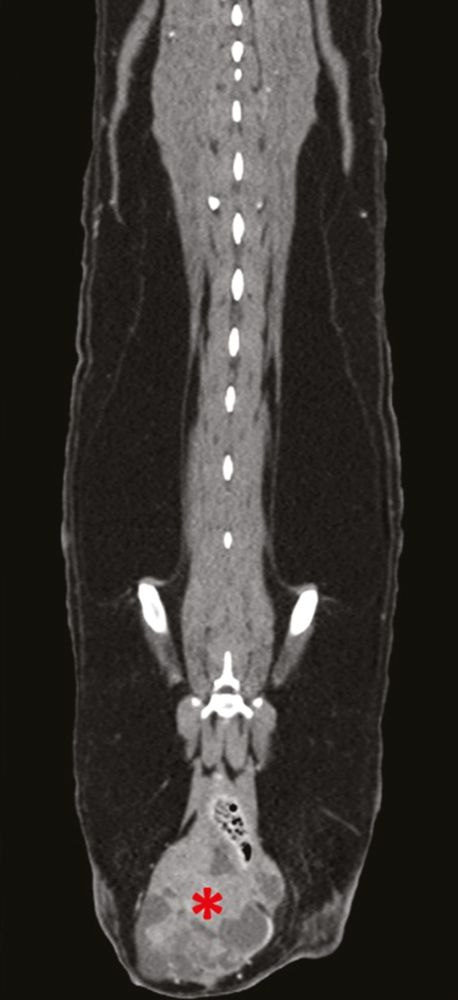
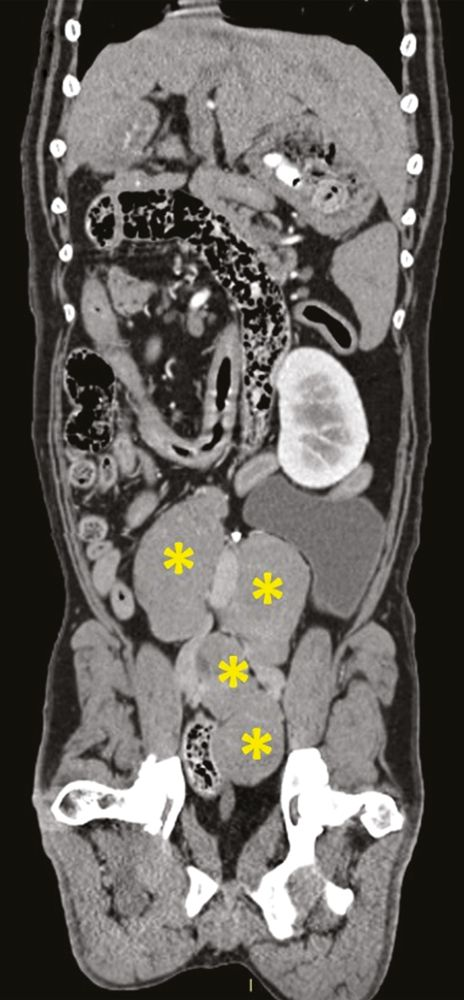
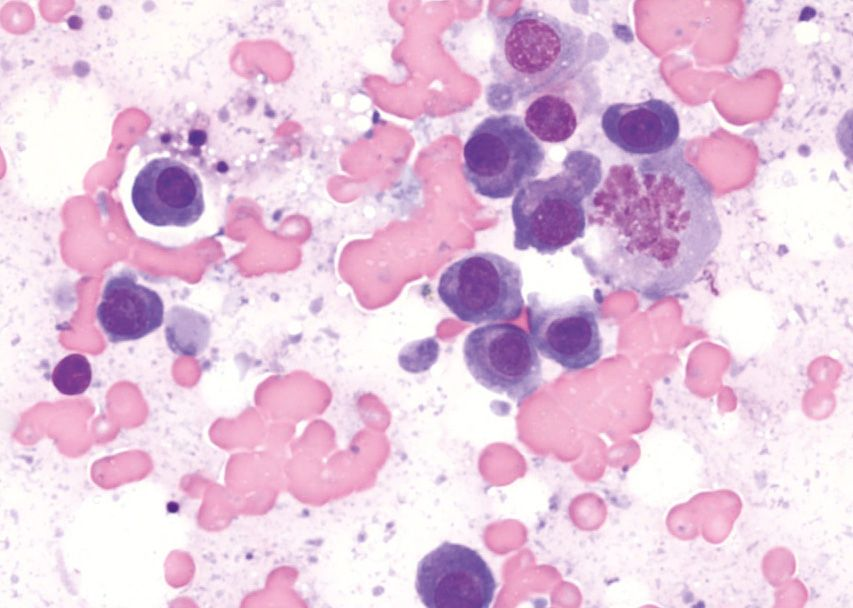
Lässt sich mit Hilfe dieser initialen diagnostischen Maßnahmen keine zugrundeliegende Ursache der Hypercalcämie feststellen, können weitere, spezifischere Tests durchgeführt werden wie die Messung der zirkulierenden Serumkonzentrationen von PTH, PTHrp und Calcitriol. Bei Patienten mit maligner Hypercalcämie sollten die PTH-Konzentrationen im Serum niedrig sein oder unter der Nachweisgrenze liegen, während der PTHrp-Spiegel im Serum messbar und/oder erhöht sein kann. Die Serumkonzentration von Calcitriol liegt in der Regel im physiologischen Bereich, sie kann aber auch erhöht oder herabgesetzt sein. Wird eine zugrunde liegende Ursache auch mit diesen weiterführenden Untersuchungen nicht gefunden, können über diese konventionelle Diagnostik hinaus zusätzliche Tests wie Übersichtsröntgenaufnahmen der Knochen, Knochenscans (Szintigraphie), eine Knochenmarkaspiration und eine Computertomographie (CT) in Erwägung gezogen werden (Abbildung 9-11).
Störungen der Calciumhomöostase können bei schweren und lebensbedrohlichen Erkrankungen auftreten, und unabhängig von der zugrundeliegenden Ursache kann eine unbehandelte Hypercalcämie zu lebensbedrohlichen Komplikationen führen [20]. Für die Messung von iCa sind spezielle Analysegeräte erforderlich, die in tierärztlichen Praxen oder Kliniken nicht immer ohne weiteres zur Verfügung stehen. Um diese Einschränkung zu umgehen, muss man sich oft auf die Entschlüsselung feiner Nuancen der Gesamtcalciumkonzentration (tCa) verlassen, die alle drei Serumcalciumfraktionen umfasst. Eine genaue und aussagekräftige Interpretation des Gesamtcalciumwertes kann jedoch schwierig sein, da dieser den iCa-Status nicht bei jedem Patienten exakt widerspiegelt. Vorgeschlagen werden deshalb Korrekturformeln für das Gesamtcalcium unter Berücksichtigung von Albumin und Gesamtprotein. Diese sollten jedoch nicht als verlässlich betrachtet werden, da sie die festzustellende diagnostische Diskordanz zwischen Gesamtcalcium und iCa bislang nicht validieren oder verbessern konnten [20],[21]. Empfohlen wird deshalb, jede Anomalie im Bereich des Gesamtcalciums mit Hilfe zusätzlicher diagnostischer Schritte weiterführend zu untersuchen, um die tatsächliche iCa-Konzentration direkt zu quantifizieren.
Behandlung
Da Hypercalcämie durch eine große Bandbreite unterschiedlicher Erkrankungsprozesse ausgelöst werden kann, hängen die adäquate Behandlung, der Schweregrad der klinischen Symptome und nicht zuletzt die Gesamtprognose in ganz entscheidendem Maße von der zugrundeliegenden Ätiopathogenese ab. Es gibt zwar nicht das einzelne, universelle Behandlungsprotokoll, das bei allen Ursachen gleichermaßen wirksam wäre, bei den meisten hypercalcämischen Patienten kann die Einleitung einer Calciurese aber einen unmittelbaren klinischen Nutzen bringen. Das endgültige und im Einzelfall optimale Management einer Hypercalcämie basiert aber auf der Diagnose und der gezielten Behandlung der zugrundeliegenden Ursache, obwohl sich eine genaue Identifizierung bestimmter Erkrankungsprozesse als sehr komplex und schwierig erweisen kann. Letztlich bestimmt der klinische Status des individuellen Patienten, wie aggressiv die Behandlung sein muss.
Die wirksamste Behandlung einer humoralen Hypercalcämie bei Malignomen besteht in der Entfernung der ursächlich zugrundeliegenden Neoplasie auf dem Wege eines chirurgischen Eingriffes, sofern die anatomischen Verhältnisse dies zulassen, in der Einleitung einer klinischen Remission durch eine Chemotherapie (am besten geeignet bei Hypercalcämie im Zusammenhang mit Lymphom) oder in einer Strahlentherapie. Empirisch wird eine Serumcalciumkonzentration von 16 mg/dl (4 mmol/l) oder höher als Basis für die Einleitung einer aggressiven Therapie empfohlen. Die Intensität des Patientenmanagements sollte jedoch stets auf individueller Basis gewählt werden und sich an einer Echtzeitbeurteilung des klinischen Status und der diagnostischen Befunde orientieren. Eine ungünstige Prognose ist bei stark beeinträchtigten Patienten zu erwarten, die eines der folgenden Merkmale aufweisen:
- Klinische Erkrankung aufgrund einer Hypercalcämie von über 16 mg/dl (4 mmol/l),
- Hochgradige renale Azotämie,
- Calcium- und Phosphorprodukt über 60, mit daraus resultierender metastatischer Mineralisierung,
- Maligne Hypercalcämie in Verbindung mit soliden Tumoren, die für eine chirurgische Resektion nicht zugänglich sind.
Als initiale Behandlungsmaßnahme empfiehlt sich eine aggressive Flüssigkeitstherapie mit isotonischer (0,9 %) Natriumchloridlösung, um eine bestehende Dehydratation zu korrigieren, eine häufige Folge der durch die Hypercalcämie ausgelösten primären Polyurie (auch als sekundärer nephrogener Diabetes insipidus bezeichnet). Eine Hämokonzentration infolge einer verminderten glomerulären Filtration führt zu zusätzlicher Calciumretention, da die Nieren versuchen, Natrium zu sparen, wodurch die Calciumausscheidung über den Harn weiter verringert wird [9]. Die umsichtige Verabreichung von intravenöser Kochsalzlösung dient aber nicht nur der Wiederherstellung der Hydratation, sondern hat zusätzlich den Vorteil, dass sie eine Volumenexpansion mit daraus resultierender erhöhter glomerulärer Filtrationsrate und folglich gesteigerter Calciurese fördert. Physiologische Kochsalzlösung enthält kein zusätzliches Calcium, und ihr hoher Natriumgehalt konkurriert mit Calcium um die tubuläre Absorption in der Niere, wodurch die Calciumausscheidung zusätzlich gefördert wird [22]. Sobald eine adäquate Rehydratation des Patienten erreicht ist, wird die Anwendung von Schleifendiuretika (z. B. Furosemid in einer Dosierung von 2-4 mg/kg zwei- oder dreimal täglich IV/SC/PO) in Verbindung mit einer fortgesetzten Flüssigkeitstherapie mit physiologischer Kochsalzlösung empfohlen, um die Calciumausscheidung über den Harn weiter zu fördern und die Gefahr einer iatrogenen Hypervolämie zu verringern. Bei diuretisch behandelten Patienten muss jedoch darauf geachtet werden, dass es nicht zu einer Dehydratation kommt, da eine Hämokonzentration den Effekt einer gewünschten Calciurese wettmachen kann.
Glukokortikoide können bei der Behandlung bestimmter Ursachen von Hypercalcämie schnell Vorteile bringen. Idealerweise sollte die zugrundeliegende Ursache jedoch vor der Verabreichung von Glukokortikoiden klar diagnostiziert sein, da eine wahllose Verabreichung von Glukokortikoiden unter Umständen die endgültige Diagnose stört (z. B. im Falle einer hämatopoetischen Neoplasie) oder sogar medizinisch kontraindiziert ist (z. B. bei einer infektiösen granulomatösen Erkrankung). Glukokortikoide tragen zur Senkung des Serumcalciumspiegels bei, indem sie die Knochenresorption vermindern, der intestinalen Calciumabsorption entgegenwirken und die renale Calciumausscheidung steigern [22]. Besonders vorteilhaft sind Glukokortikoide bei der Behandlung der humoralen Hypercalcämie bei Malignomen wie Lymphomen, AGASACA, multiplem Myelom, Thymom, aber auch bei Hypoadrenokortizismus oder Hypervitaminose D. Am häufigsten zum Einsatz kommen Prednison (1-2,2 mg/kg zweimal täglich IV/SC/PO) und/oder Dexamethason (0,1-0,22 mg/kg zweimal täglich), da beide Wirkstoffe kostengünstig und weithin verfügbar sind. Die initialen Dosierungen sollten in adäquater Weise ausgeschlichen werden, da die Patienten mit diesen hohen Dosierungen nicht langfristig behandelt werden sollten.
Bisphosphonate sind eine weitere Behandlungsoption bei Hypercalcämie. Entwickelt wurden diese Arzneimittel in erster Linie zur Hemmung der pathologischen Knochenresorption im Zusammenhang mit Osteoporose und Skelettmetastasen bei Menschen. Zoledronat und Pamidronat werden in der Humanmedizin am häufigsten eingesetzt und können den Calciumspiegel innerhalb von 4-10 Tagen normalisieren, wobei die Wirkung etwa 1-4 Wochen anhält [23]. In der Tiermedizin gibt es über die Anwendung von Pamidronat zurzeit zwar mehr Daten, Zoledronat ist bei Hunden aber nachweislich wirksam bei der Bekämpfung einer akuten Hypercalcämie [24]. Die Dosierungen der einzelnen Bisphosphonate variieren aufgrund der Unterschiede ihrer antiresorptiven Potenz und möglicher Nebenwirkungen (Abbildung 12). Die empfohlene Dosierung für Zoledronat beträgt 0,1-0,25 mg/kg, verdünnt in physiologischer Kochsalzlösung und verabreicht per Infusion mit konstanter Rate über 15-20 Minuten, während für Pamidronat eine Dosierung von 1,0-2,0 mg/kg, verdünnt in Kochsalzlösung, appliziert über 2-4 Stunden vorgeschlagen wird. Ein wichtiger Aspekt bei der Verabreichung dieser Bisphosphonate ist, dass Bolusinfusionen hoher Dosen in präklinischen Toxizitätsstudien das Potenzial aufweisen, akute Nierenschäden zu induzieren. Obwohl die oben für veterinärmedizinische Patienten empfohlenen Dosierungsschemata eine längere Infusionsdauer vorsehen und damit das Potenzial für Nierenschäden drastisch reduzieren, wird empfohlen, die Nierenfunktion entsprechend behandelter Patienten während der Therapie eng zu überwachen. Zu bemerken ist an dieser Stelle auch, dass bei Katzen mit persistierender idiopathischer Hypercalcämie die Anwendung von Alendronat, eines oralen Bisphosphonats, untersucht wurde und gut toleriert zu werden scheint [14],[25]. Weitere Untersuchungen sind jedoch erforderlich, um die Wirksamkeit dieser Substanz in Anbetracht ihrer extrem schlechten oralen Bioverfügbarkeit zu beurteilen und um festzustellen, ob sie bei Hunden bevorzugt vor anderen Bisphosphonaten empfohlen werden kann.
Mithramycin, Calcitonin und Galliumnitrat sind weitere theoretisch einsetzbare Arzneistoffe für die medikamentöse Behandlung der Hypercalcämie, die jedoch alle aufgrund ihrer Kosten, ihrer Nebenwirkungen und ihrer Applikationsschemata in der Veterinärmedizin nur von begrenztem Nutzen sind. Mithramycin (Plicamycin) ist ein Antitumor-Antibiotikum, das die RNA-Synthese in Osteoklasten hemmt, und damit zu einer schnellen Hemmung der Knochenresorption führt [22]. Dieser Wirkstoff ist aber sowohl in der Tier- als auch in der Humanmedizin in Ungnade gefallen, da die entsprechende Behandlung zu Thrombozytopenie, Nieren- und Lebernekrose und Hypocalcämie führen kann. Eine weitere Behandlungsmöglichkeit ist die Gabe von Calcitonin, da es die Knochenresorption durch Hemmung der Aktivität und der Bildung von Osteoklasten abschwächt. Erreicht wird dadurch eine im Vergleich zu jeder anderen Behandlungsstrategie schnellere Absenkung der Calciumkonzentration im Serum innerhalb von nur wenigen Stunden nach Verabreichung, die Wirkungen sind aufgrund einer kompensatorischen Downregulation der entsprechenden Rezeptoren nur relativ kurzlebig. Galliumnitrat ist ein antineoplastischer Wirkstoff, der Osteoklasten hemmt und die resorptive Löslichkeit von Hydroxylapatit durch Bindung an Hydroxylapatitkristalle verringert. In der Regel wird dieser Arzneistoff bei Patienten eingesetzt, die auf Bisphosphonate nicht ansprechen, und einige Studien zeigen, dass Galliumnitrat den Calciumspiegel bei maligner Hypercalcämie wirksamer senken kann als Bisphosphonate. Aufgrund seines nephrotoxischen Potenzials gilt Galliumnitrat aber nicht als First-Line-Behandlung.
Die Calciumhomöostase wird über physiologische Prozesse eng reguliert, um sicherzustellen, dass Steady-State-Konzentrationen von ionisiertem Calcium - der biologisch aktiven Form dieses Elektrolyts - aufrechterhalten werden.
Schlussfolgerung
Die Konzentration von ionisiertem Calcium wird im Körper sehr eng reguliert, und Veränderungen können zu signifikanten und schädlichen, systemischen Multi-Organ-Effekten führen. Die paraneoplastische Hypercalcämie ist eine schwerwiegende und relativ häufige Komplikation bei Hunden mit Tumorerkrankungen. Verschiedene Tumorarten können eine Hypercalcämie über Mechanismen auslösen, die die Calciumhomöostase stören und zu klinischen Erkrankungen führen. Die häufigste Hypercalcämie induzierende Neoplasie bei Hunden ist das T-Zell-Lymphom, bei einem Patient mit erhöhten Calciumkonzentrationen sollten aber auch andere Neoplasien und nicht-neoplastische Erkrankungen in Betracht gezogen werden. Die klinischen Symptome einer Hypercalcämie sind zwar oft unspezifisch, eine frühzeitige Diagnose der zugrundeliegenden Ursache ist aber wichtig. Sobald die Ursache klar ist, kann die Gefahr lebensbedrohlicher Komplikationen durch Einleitung einer endgültigen Behandlung und eines unterstützenden Managements minimiert und die Chancen auf ein günstiges Outcome maximiert werden.
Jordan M. Hampel
DVM, Department of Veterinary Clinical Medicine, University of Illinois at Urbana-Champaign (UIUC), Illinois, USA
Vereinigte Staaten von Amerika
Dr. Hampel schloss ihr Tiermedizinstudium 2020 an der University of Illinois ab und absolvierte anschließend ein rotierendes Internship im Kleintierbereich an der Michigan State University. Danach kehrte an die UIUC zurück für ein Internship im Bereich klinisch-onkologische Forschung. Gegenwärtig absolviert Dr. Hampel eine Residency in Medical Oncology und strebt einen Master of Science an mit Fokus auf zielgerichteten Strategien zur Amplifizierung der zytotoxischen Wirkungen der ionisierenden Strahlentherapie.
Timothy M. Fan
DVM, PhD, Dipl. ACVIM (Oncology, Internal Medicine), Department of Veterinary Clinical Medicine, University of Illinois at Urbana-Champaign, Illinois, USA
Vereinigte Staaten von Amerika
Dr. Fan schloss sein Tiermedizinstudium 1995 am Virginia-Maryland Regional College of Veterinary Medicine ab und errang die Diplome des ACVIM in den Bereichen Innere Medizin und Onkologie an der Cornell University bzw. an der UIUC. Anschließend promovierte er (PhD) an der Illinois University mit dem Schwerpunkt Tumorimmunologie und trat eine Stelle als Professor an der dortigen Fakultät an. Dr. Fan ist ein Kernmitglied bei „Anticancer Discovery from Pets to People“ und Programmleiter des Cancer Center an der Illinois University, in dem Gesellschaftstiere als hochentwickelte Modelle in Krebsstudien eingesetzt werden.
Literatur
- Clapham DE. Calcium signaling. Cell. 2007;131(6):1047-1058.
- Hajdu S, Leonard EJ. A calcium transport system for mammalian cells. Life Sci. 1975;17(10);1527-1533.
- Matikainen N, Pekkarinen T, Ryhnen EM, et al. Physiology of calcium homeostasis: an overview. Endocrinol. Metab. Clin. North Am. 2021;50(4):575-590.
- Potts JT. Parathyroid hormone: past and present. J. Endocrinol. 2005;187(3):311-325.
- Silva BC, Bilezikian JP. Parathyroid hormone: anabolic and catabolic actions on the skeleton. Curr. Opin. Pharmacol. 2015;22:41-50.
- Huang JC, Sakata T, Pfleger LL, et al. PTH differentially regulates expression of RANKL and OPG. J. Bone Miner. Res. 2004;19(2):235-244.
- Christakos S, Li S, de la Cruz J, et al. Vitamin D and the intestine: review and update. J. Steroid. Biochem. Mol. Biol. 2020;196:105501.
- Xie J, Guo J, Kanwal Z, et al. Calcitonin and bone physiology: in vitro, in vivo, and clinical investigations. Int. J. Endocrinol. 2020;2020:3236828.
- Daniels E, Sakakeeny C. Hypercalcemia: pathophysiology, clinical signs, and emergent treatment. J. Am. Anim. Hosp. Assoc. 2015;51(5):291-299.
- Coady M, Fletcher DJ, Goggs R. Severity of ionized hypercalcemia and hypocalcemia is associated with etiology in dogs and cats. Front. Vet. Sci. 2019;6;276.
- Elliott J, Dobson JM, Dunn JK, et al. Hypercalcemia in the dog a study of 40 cases. J. Small Anim. Pract. 1991;32(11):564-571.
- Messinger JS, Windham WR, Ward CR. Ionized hypercalcemia in dogs: a retrospective study of 109 cases (1998-2003). J. Vet. Intern. Med. 2009;23(3):514-519.
- Savary KCM, Price GS, Vaden SL. Hypercalcemia in cats: a retrospective study of 71 cases (1991-1997). J. Vet. Intern. Med. 2000;14(2):184-189.
- Hardy BT, de Brito Galvao JF, Green TA, et al. Treatment of ionized hypercalcemia in 12 cats (2006-2008) using PO-administered alendronate. J. Vet. Intern. Med. 2015;29(1):200-206.
- Goldner W. Cancer-related hypercalcemia. J. Oncol. Pract. 2016;12(5):426-432.
- Mirrakhimov AE. Hypercalcemia of malignancy: an update on pathogenesis and management. N. Am. J. Med. Sci. 2015;7(11):483-493.
- de Papp AE, Stewart AF. Parathyroid hormone-related protein a peptide of diverse physiologic functions. Trends Endocrinol. Metab. 1993;4(6):181-187.
- Weller RE, Hoffman WE. Renal function in dogs with lymphosarcoma and associated hypercalcemia. J. Small Anim. Pract. 1992;33(2):61-66.
- Galvao JFD, Parker V, Schenck PA, et al. Update on feline ionized hypercalcemia. Vet. Clin. North. Am. Small Anim. Pract. 2017;47(2);273-292.
- Lebastard M, Cuq B, Sharman MJ, et al. Diagnostic performance of predicted ionized calcium in dogs with total hypercalcemia and total hypocalcemia. Vet. Clin. Pathol. 2021;50(4):515-524.
- Groth EM, Chew DJ, Lulich JP, et al. Determination of a serum total calcium concentration threshold for accurate prediction of ionized hypercalcemia in dogs with and without hyperphosphatemia. J. Vet. Intern. Med. 2020;34(1):74-82.
- Schaer M. Therapeutic approach to electrolyte emergencies. Vet. Clin. North Am. Small Anim. Pract. 2008;38(3):513-533.
- Schenk A, Lux C, Lane J, et al. Evaluation of zoledronate as treatment for hypercalcemia in four dogs. J. Am. Anim. Hosp. Assoc. 2018;54(6);e54604
- Repasy AB, Selmic LE, Kisseberth WC. Canine apocrine gland anal sac adenocarcinoma: a review. Top. Companion Anim. Med. 2022;50;100682
- Kurtz M, Desquilbet L, Maire J, et al. Alendronate treatment in cats with persistent ionized hypercalcemia: a retrospective cohort study of 20 cases. J. Vet. Intern. Med. 2022;36(6):1921-1930.
Andere Artikel in dieser Ausgabe
Auf sozialen Medien teilen