Systemische Auswirkungen der parodontalen Erkrankung
Geschrieben von Alessandro De Simoi
Bei der parodontalen Erkrankung handelt es sich um die bei Kleintieren am häufigsten festzustellende infektiöse Erkrankung mit einer Prävalenz von nahezu 80%. Die Prävalenz steigt mit zunehmendem Alter und sinkt mit zunehmender Körpergröße...
Article
Kernaussagen
Bei der parodontalen Erkrankung handelt es sich um die bei Kleintieren am hufigsten auftretende infektise Erkrankung.
Vermutet wird, dass die parodontale Erkrankung ein zentraler Faktor bei verschiedenen systemischen Erkrankungen sein kann, so z.B. bei kardiovaskulren Problemen, bei Reproduktionsstrungen, bei Lebererkrankungen und bei Diabetes mellitus.
Es gibt verschiedene Hypothesen darber, auf welche Weise eine Parodontitis systemische Erkrankungen beeinflussen kann, einen definitiven Beweis einer entsprechenden Verbindung gibt es bislang aber noch nicht.
Die Entstehung der parodontalen Erkrankung kann mit Hilfe einer grndlichen Entfernung bakterieller Zahnbelge (Plaque) durch Zhneputzen und Zahn-/Maulhhlenhygiene verhindert werden.
Einleitung
Bei der parodontalen Erkrankung handelt es sich um die bei Kleintieren am häufigsten festzustellende infektiöse Erkrankung mit einer Prävalenz von nahezu 80% [1]. Die Prävalenz steigt mit zunehmendem Alter und sinkt mit zunehmender Körpergröße, das heißt, bei kleineren Tieren kommt die Erkrankung sehr viel häufiger vor als bei mittelgroßen oder großen Tieren [1]. Das auch als Zahnhalteapparat bezeichnete Parodont besteht aus dem Zahnfleisch, dem Wurzelzement, der Zahnwurzelhaut und dem Alveolarknochen. Gemeinsam sorgen diese anatomischen Strukturen für die Befestigung des Zahnes im Kieferknochen. Verursacht wird die parodontale Erkrankung durch einen auch als Plaque bezeichneten bakteriellen Zahnbelag. Die Erkrankung kann in zwei Teilelemente unterteilt werden: Gingivitis und Parodontitis. Bei der Gingivitis handelt es sich um eine reversible Entzündung des Zahnfleisches, die sich nach Beseitigung der Ursache, also der bakteriellen Plaque, wieder vollständig zurückbilden kann. Dagegen handelt es sich bei der Parodontitis um ein irreversibles entzündliches Geschehen des nicht-gingivalen Gewebes (Zahnwurzelhaut, Wurzelzement und Alveolarknochen). Die klinische Beurteilung einer Parodontitis erfolgt durch die Messung des Verlustes der Befestigung des Zahnes (epitheliales, desmodontales Attachment) im Kiefer. Eine Parodontitis kann entweder inaktiv (ruhende Phase) sein, ohne Hinweise auf eine Zahnfleischentzündung (wenn ein Attachmentverlust vorliegt, so kann dieser einige Zeit vorher eingetreten sein) oder aber es handelt sich um ein aktives Krankheitsgeschehen mit fortgesetzter Zerstörung des Zahnhaltegewebes (Abbildung 1). Obwohl unbestritten ist, dass es sich bei der Parodontitis um eine infektiöse Erkrankung handelt, und mehr als 700 Bakterienspezies mit der Fähigkeit zur Besiedlung des Biofilms im Sulcus gingivalis nachgewiesen sind, gelten die Koch’schen Postulate* hier nicht [2].
* 1. The microorganism must be found in abundance in an animal suffering from the disease, but should not be found in healthy animals. 2. The microorganism must be isolated from a diseased animal and grown in culture. 3. The cultured microorganism should then cause disease when introduced into a healthy animal. 4. The microorganism must be re-isolated from this experimentally infected animal and identified as being identical to the original causative agent.
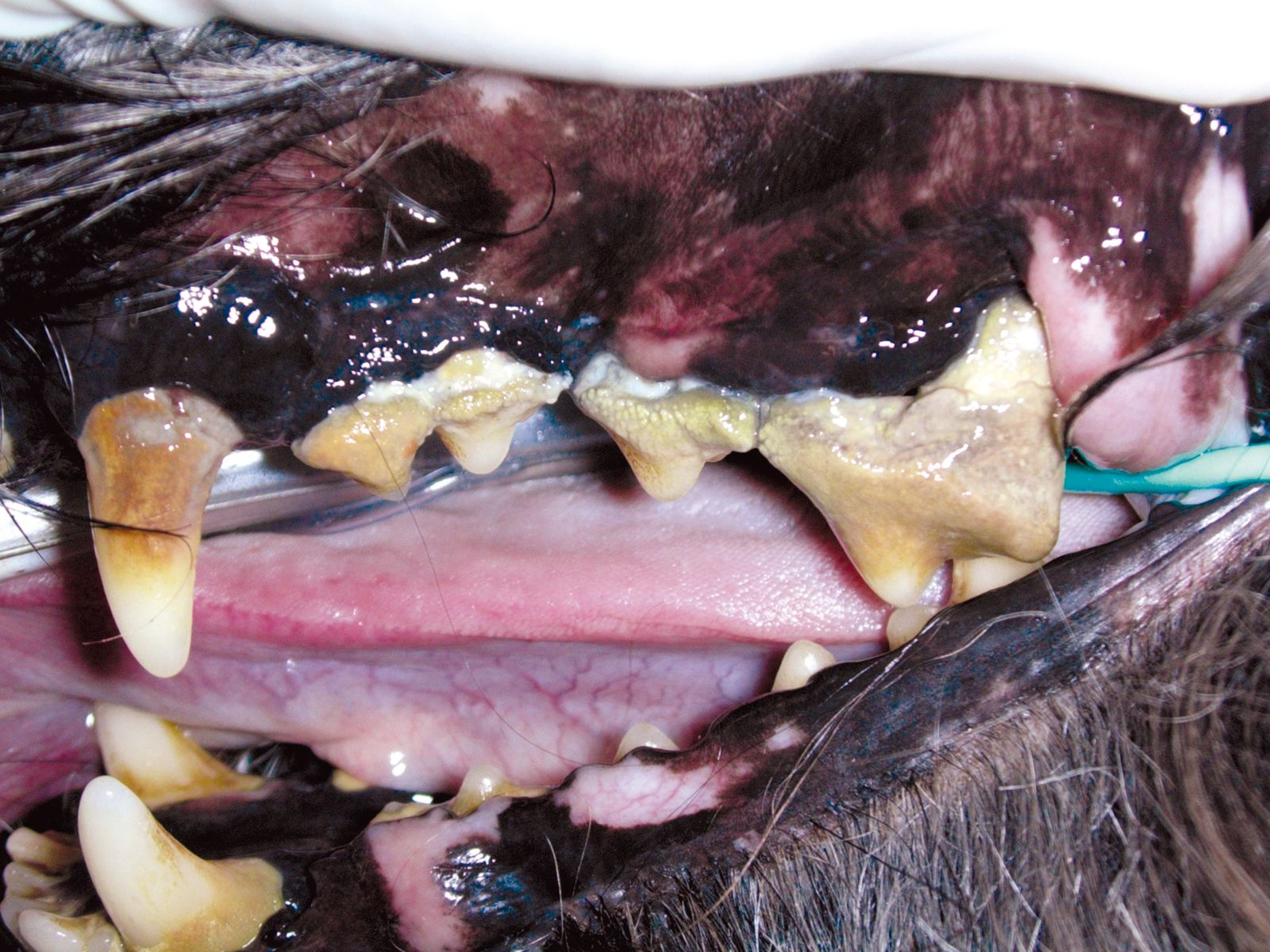
Eine Gingivitis, selbst wenn sie unbehandelt bleibt, führt nicht in jedem Fall zur Entstehung einer Parodontitis. In der Tat wird die Entwicklung der parodontalen Erkrankung in erster Linie durch ein Ungleichgewicht zwischen der bakteriellen Population und dem Immunsystem des Wirts bestimmt. Faktoren, die das Fortschreiten einer parodontalen Erkrankung unterstützen oder hemmen sind die Immunkapazität des Wirts, Stress, das Alter, der Ernährungs- und Stoffwechselstatus, die Rassezugehörigkeit und endokrine Erkrankungen. Schreitet die Erkrankung weiter fort, rufen die Zerstörung des Knochengewebes und die apikale Migration des stützenden Bindegewebes eine Lockerung des Zahnes hervor, die bis hin zum Verlust eines oder mehrerer Zähne reicht.
Bei der parodontalen Erkrankung handelt es sich um eine fokale Infektion. Diesem bereits vor mehr als einem Jahrhundert eingeführten Konzept zufolge handelt es sich um eine lokal begrenzte, chronische Erkrankung, die eine Quelle für Mikroorganismen, Toxine und Abbauprodukte von Bakterien und Gewebe darstellt, welche über den Blutkreislauf auch in weiter entfernt liegende Organe und Gewebe gelangen können [3]. Bei erkrankten Toy-Rassen hat man die von der Parodontitis betroffene Oberfläche gemessen und herausgefunden, dass diese zwischen 3,18 und 29,8 cm2 liegt [4]. Die Fläche des erkrankten Gewebes kann also einen nicht unbeträchtlichen Anteil der Gesamtkörperoberfläche des Hundes einnehmen.
Im Laufe der Entwicklung einer Parodontitis können die in den Parodontaltaschen siedelnden Bakterien in den Blutkreislauf gelangen und eine Bakteriämie hervorrufen. Bei gesunden Individuen wird diese Bakteriämie in aller Regel zwar mit Hilfe des retikulohistiozytären Systems gestoppt [5], eine fortgesetzte und dauerhafte bakterielle Exposition kann jedoch zur Entstehung systemischer Erkrankungen unter Einbeziehung weiter entfernt liegender Organe und Organsysteme führen [6] [7]. Die systemischen Auswirkungen einer parodontalen Erkrankung beschränken sich jedoch keineswegs nur auf die Folgen der bakteriellen Belastung. Chemische Entzündungsmediatoren, bakterielle Endotoxine und Toxine aus dem Gewebeabbau können ebenfalls an den Folgen beteiligt sein, entweder über direkte schädliche Wirkungen oder aber durch das Hervorrufen von Immunreaktionen in weiter entfernt von der Maulhöhle gelegenen Organen.
Auswirkungen auf das Herz-/Kreislaufsystem
Dies trifft auch auf die Veterinärmedizin zu, wo verschiedene Studien ebenfalls eine positive Korrelation zwischen dem Vorhandensein parodontaler Erkrankungen und histopathologischen Veränderungen im Herzen und anderen inneren Organen zeigen [4] [5] [6] [7][11] [12] [13] Dennoch herrscht in der internationalen wissenschaftlichen Meinung keine Übereinstimmung bezüglich der tatsächlichen Bedeutung oraler Infektionen bei der Entstehung systemischer Erkrankungen. Dies dürfte vor allem daran liegen, dass es gegenwärtig immer noch keine schlüssigen Evidenzen einer direkten Verbindung zwischen der parodontalen Erkrankung und anderen Erkrankungen gibt [14].
Reproduktionsstörungen
Nachgewiesen ist, dass schwangere Frauen mit Parodontitis ein um bis zu 7,5fach höheres Frühgeburtsrisiko haben, und dass Babys betroffener Mütter ein niedriges Geburtsgewicht aufweisen. Dieser Befund korreliert mit der durch zirkulierende bakterielle Lipoproteine hervorgerufenen Erhöhung proinflammatorischer Zytokine. In einigen Fällen konnten parodontopathische Bakterien auch direkt in der Amnionflüssigkeit nachgewiesen werden [15].
Diabetes mellitus
Lebererkrankungen
Ätiopathogenetische Hypothesen
In Anbetracht der Tatsache, dass ein klarer Nachweis von Mechanismen, die orale und systemische Erkrankungen eindeutig miteinander verbinden, sehr schwierig ist, wurden verschiedene Hypothesen zur Erklärung dieses Zusammenhangs entwickelt, namentlich die Hypothese der direkten Infektion, die Hypothese der systemischen Entzündung mit endothelialen Schäden und die Hypothese der molekularen Mimikry zwischen bakteriellen Antigenen und Autoantigenen.
Die Hypothese der direkten Infektion
Die Hypothese der systemischen Entzündung
Dieser Hypothese zufolge verursacht eine Parodontitis eine Erhöhung zirkulierender Zytokine, die das Endothel von Blutgefäßen direkt schädigen können und auf diesem Weg zur Entstehung von Läsionen im Herzen und anderen inneren Organen führen. In diesem Zusammenhang konnte gezeigt werden, dass proinflammatorische Zytokine wie TNF und IL6 durch eine Aktivierung intrazellulärer Signale anabole Mutationen in Myozyten hervorrufen können, die schließlich zu myokardialer Hypertrophie führen [20]. In mehreren Studien wurden bei Patienten mit chronischer Parodontitis hohe Konzentrationen an C-reaktivem Protein (CRP) beobachtet [21], und eine neuere Studie [22] zeigt, dass Menschen, die einer intensiven parodontalen Behandlung unterzogen wurden (Scaling und Root Planing) im Vergleich zu einer Kontrollgruppe 24 Stunden nach der Therapie eine signifikant herabgesetzte Elastizität der Arteria brachialis aufwiesen. Zurückgeführt wurde dieser Elastizitätsverlust auf den Anstieg von CRP und IL6 im Verlauf der parodontalen Therapie. Sechzig und 180 Tage nach der Zahnbehandlung war die Gefäßelastizität in der Gruppe mit parodontaler Therapie allerdings signifikant höher als in der unbehandelten Kontrollgruppe. Dieser Anstieg der Elastizität wurde auf die vorteilhaften Effekte der parodontalen Behandlung zurückgeführt.
Die Hypothese der molekularen Kreuzreaktivität
Diagnose der parodontalen Erkrankung
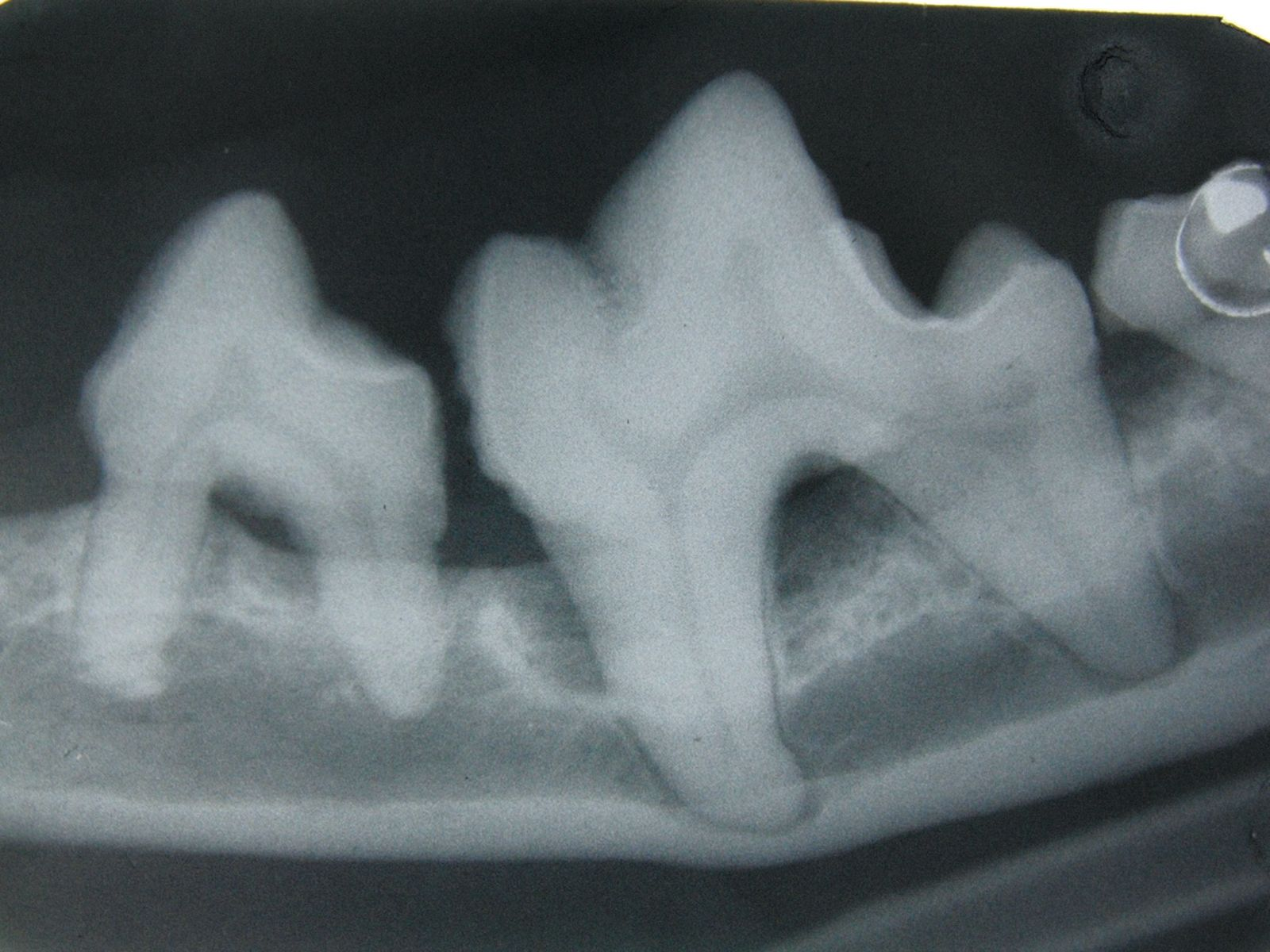
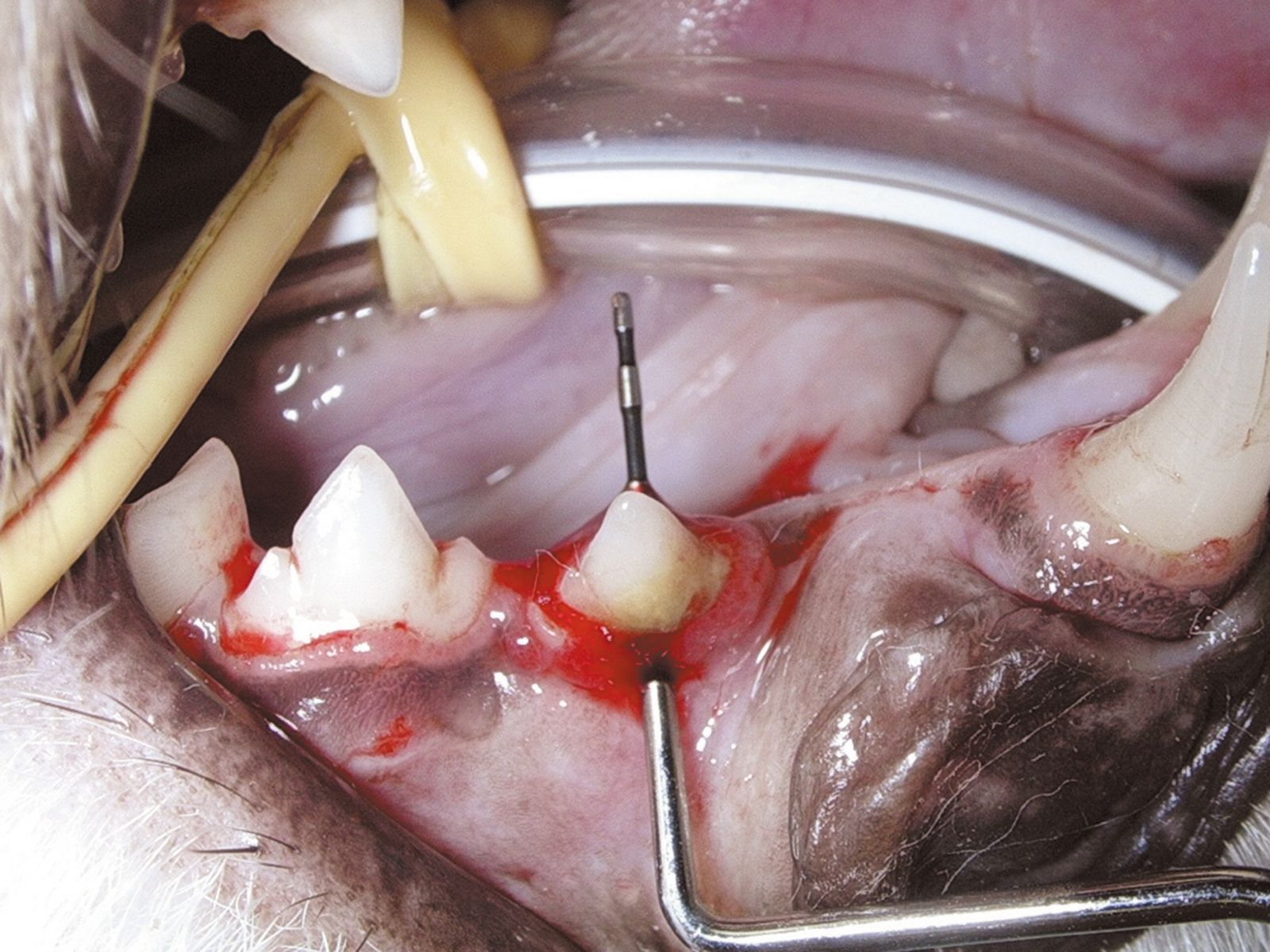
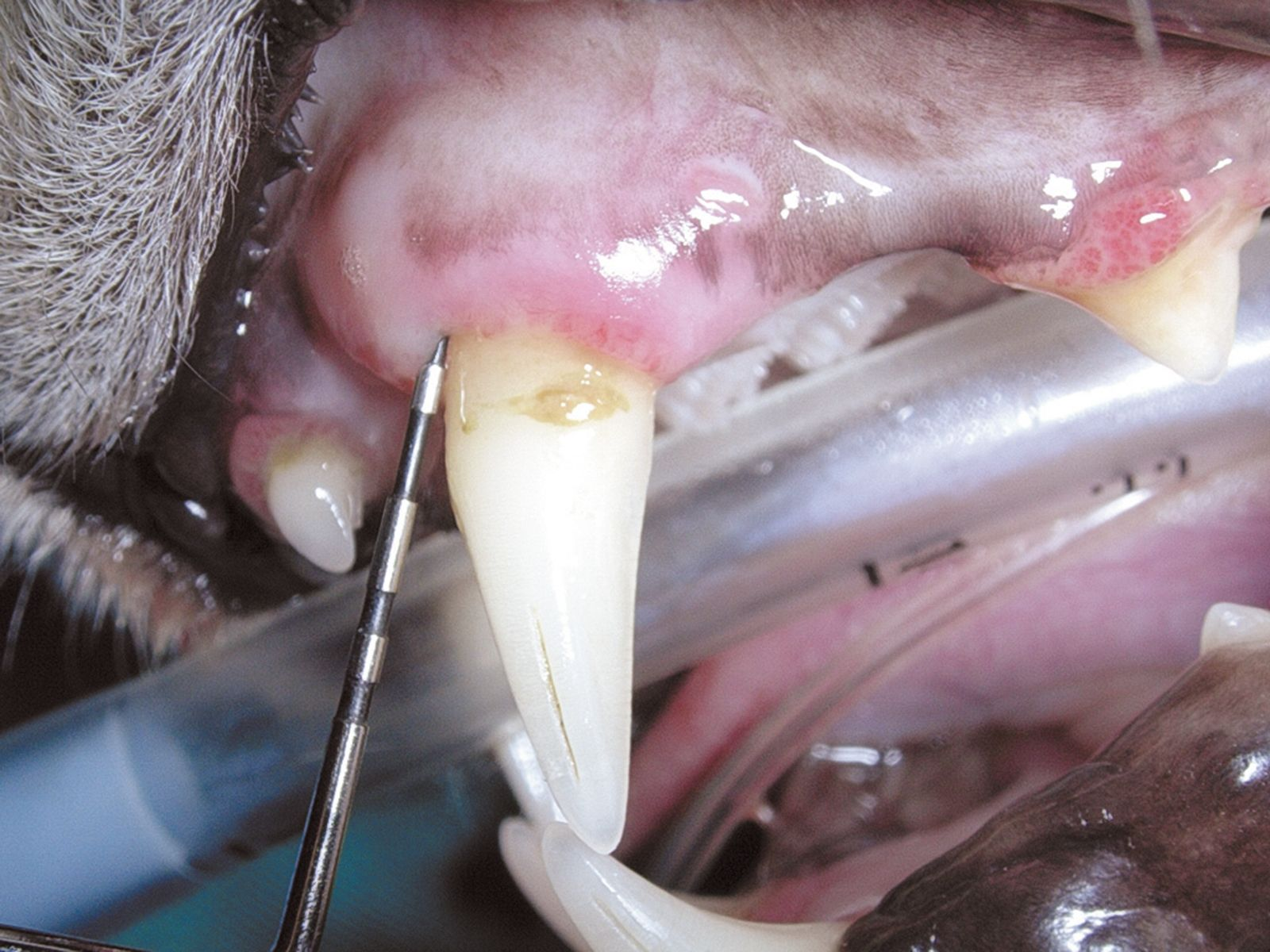
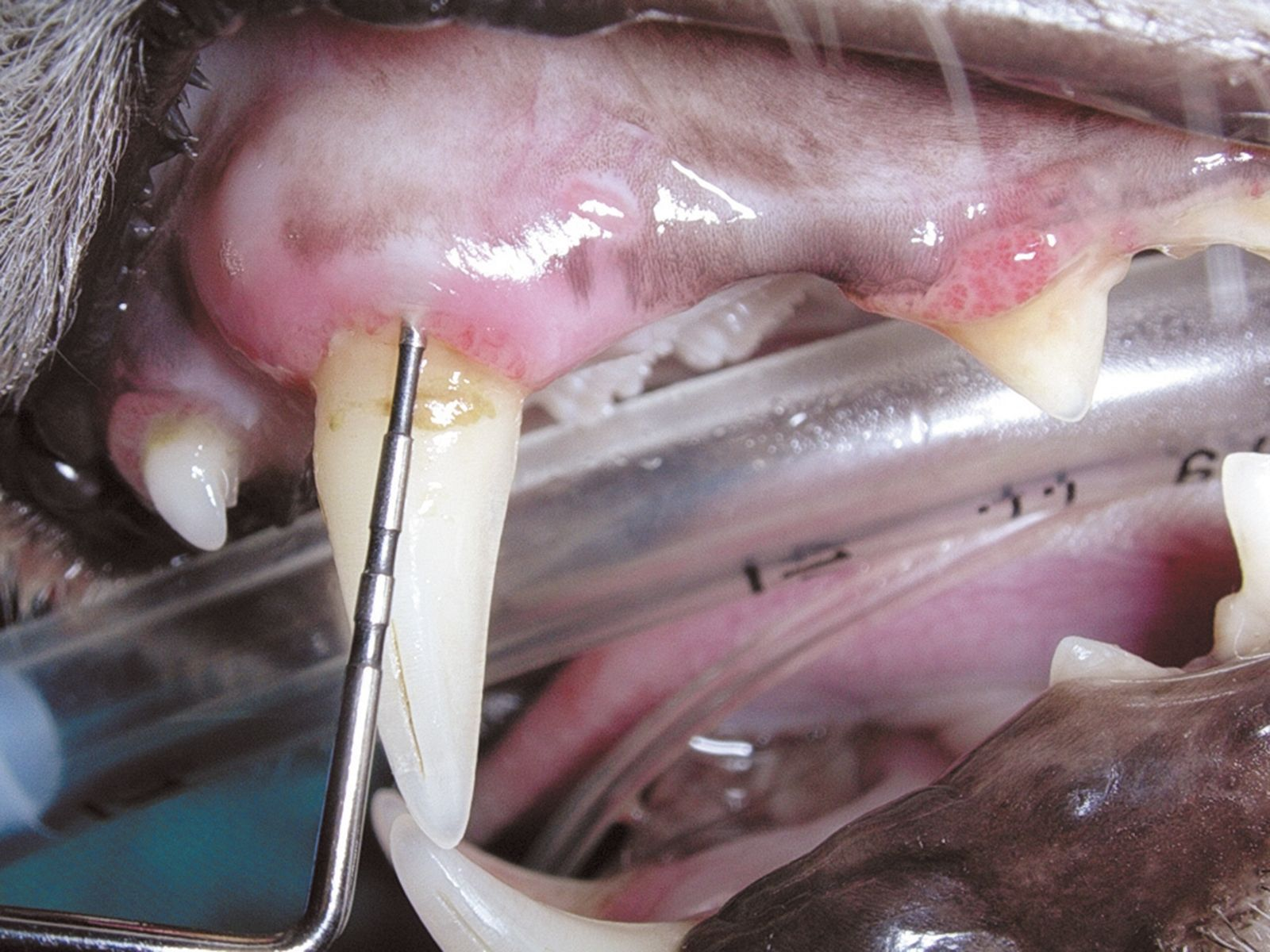
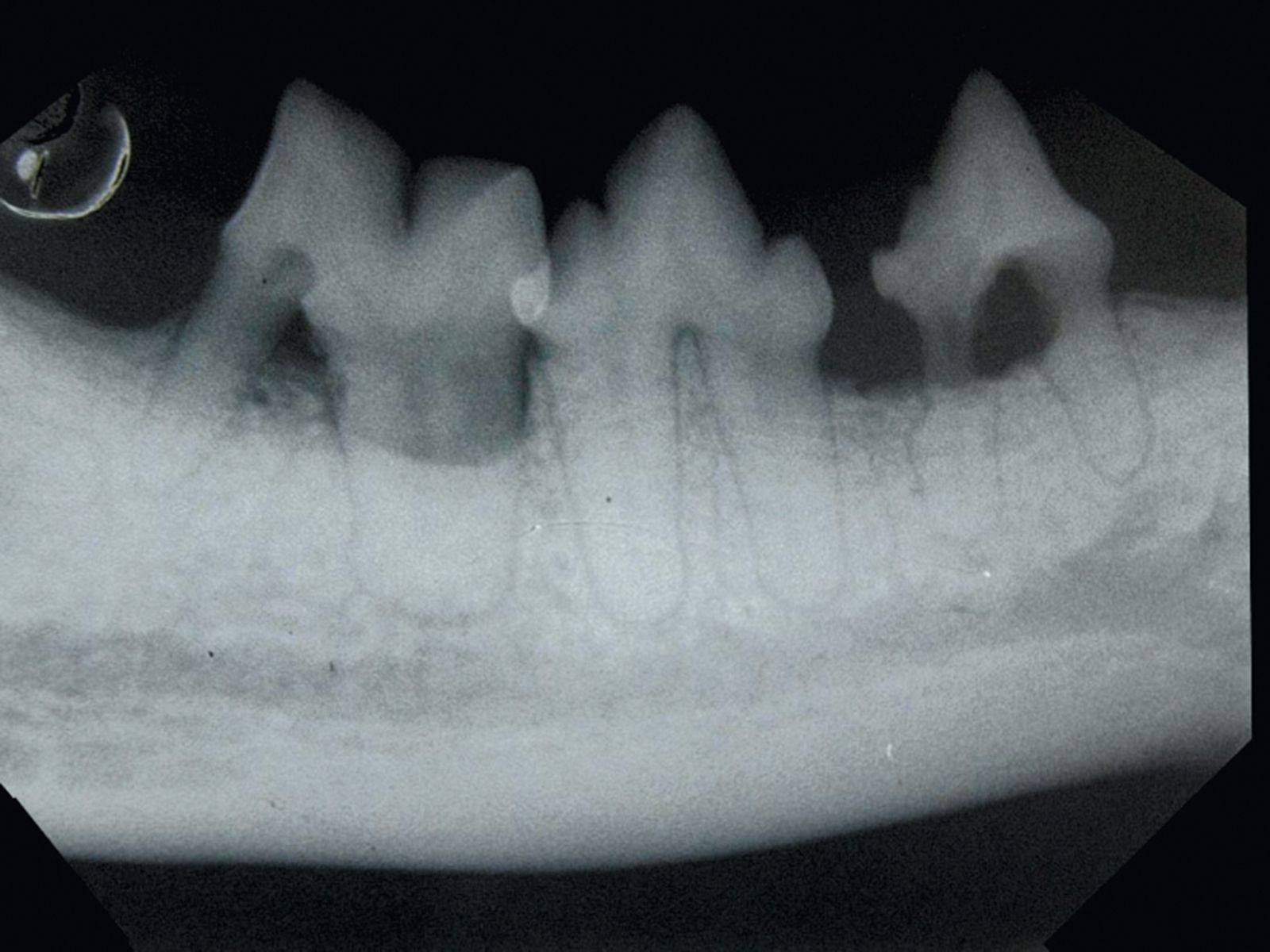
Im Allgemeinen beginnt eine parodontale Erkrankung mit nur wenigen oder gar keinen klinischen Symptomen. Der Hauptgrund, aus dem Besitzer beim Tierarzt eine Untersuchung der Maulhöhle ihres Tieres verlangen, ist Foetor ex ore. Eine genaue Diagnose kann sich in diesen Fällen aber nicht allein auf die Adspektion der Maulhöhle stützen. Ganz wesentlich ist eine sorgfältige parodontale Untersuchung einschließlich einer Untersuchung mit einer Parodontalsonde (Abbildung 2) und intraoraler Röntgenaufnahmen unter Allgemeinanästhesie. Erhältlich sind verschiedene Arten von Parodontalsonden, alle Sonden dienen letztlich jedoch der Messung der Tiefe der Parodontaltaschen und der Beurteilung von gingivaler Hyperplasie bzw. gingivaler Rezession. Mit der Parodontalsonde können zudem der Grad der Zahnlockerung und das Vorhandensein von Furkationsbefall in zwei- oder dreiwurzeligen Zähnen beurteilt werden (Abbildung 3). Für die Messung der Taschentiefe wird die Spitze der Sonde an mehreren Stellen vorsichtig in den Sulcus gingivalis eingeführt (Abbildung 4 und 5). Für eine vollständige Beurteilung wird der gesamte Umfang jedes einzelnen Zahnes an vier bis sechs Punkten sondiert, da zum Beispiel auf der bukkalen Seite offenbar gesunde Zähne palatinal oder lingual durchaus tiefe Taschen aufweisen können. Sämtliche Befunde werden sorgfältig auf einer Zahnbefundkarte dokumentiert, um schließlich den Zahnstatus des Patienten in seiner Gesamtheit beurteilen zu können.

Prävention und Behandlung der parodontalen Erkrankung
Die Entstehung einer parodontalen Erkrankung kann mit Hilfe einer sehr gründlichen Entfernung bakterieller Zahnbeläge (Plaque) durch regelmäßiges Zähneputzen und Zahn-/Maulhöhlenhygiene verhindert werden. Einige kommerzielle Futtermittelprodukte können die Reduzierung von Plaque im Bereich der Zahnkronen unterstützen, der entscheidende Faktor einer erfolgreichen Prophylaxe bzw. Behandlung ist allerdings die Entfernung der subgingivalen Plaque. Das Ziel ist dabei nicht die Keimfreiheit der Maulhöhle, sondern vielmehr das Verhindern einer Umwandlung des bakteriellen Biofilms von einer gemischten kommensalischen und von aeroben Bakterien dominierten Population zu einer überwiegend anaeroben Population. Die Behandlung der parodontalen Erkrankung sollte stets am anästhesierten Tier bei intubierter Luftröhre erfolgen. Sobald die Zahnbögen genau untersucht, die Befunde dokumentiert und intraorale Röntgenaufnahmen beurteilt sind (Abbildung 6 und 7), wird ein supra- und subgingivales Scaling durchgeführt, das je nach Indikation ergänzt wird um komplexere Maßnahmen wie die Extraktion von Zähnen oder parodontalchirurgische Eingriffe.

Der Einsatz von Antibiotika
Selbst eine hochgradige und ausgedehnte parodontale Erkrankung sollte bei einem ansonsten gesunden Tier nicht über einen längeren Zeitraum mit Antibiotika behandelt werden. Die richtige Behandlung ist vielmehr das Entfernen der Ursache (Plaque, Zahnstein, irreparabel geschädigte Zähne) durch Scaling und je nach Indikation durch Extraktion von Zähnen. Antibiotika sollten aus den beiden im Folgenden näher erläuterten Hauptgründen zum Einsatz kommen: Zur Behandlung lokaler Infektionen und zur Verhinderung einer Bakteriämie.Behandlung lokaler Infektionen
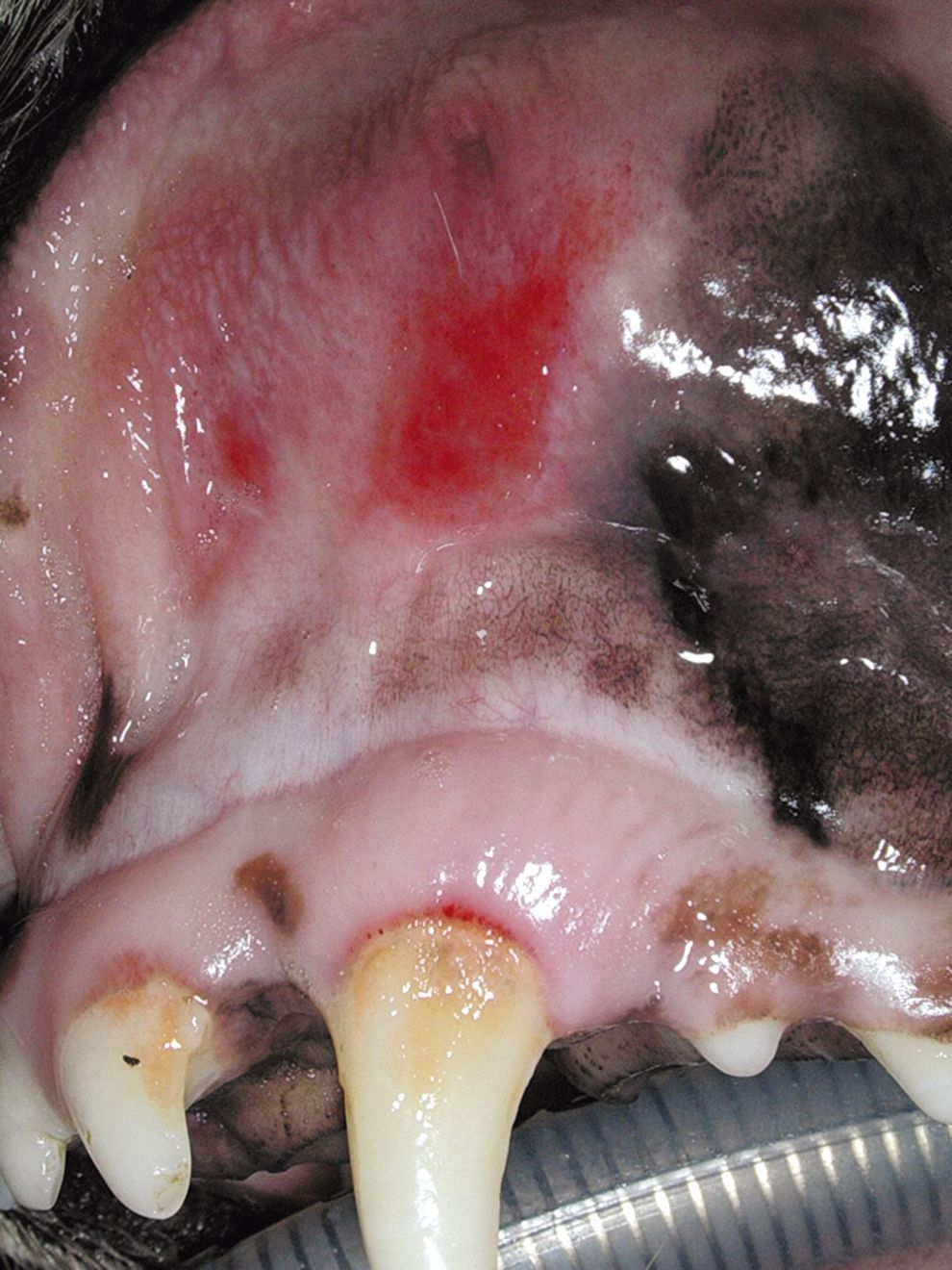
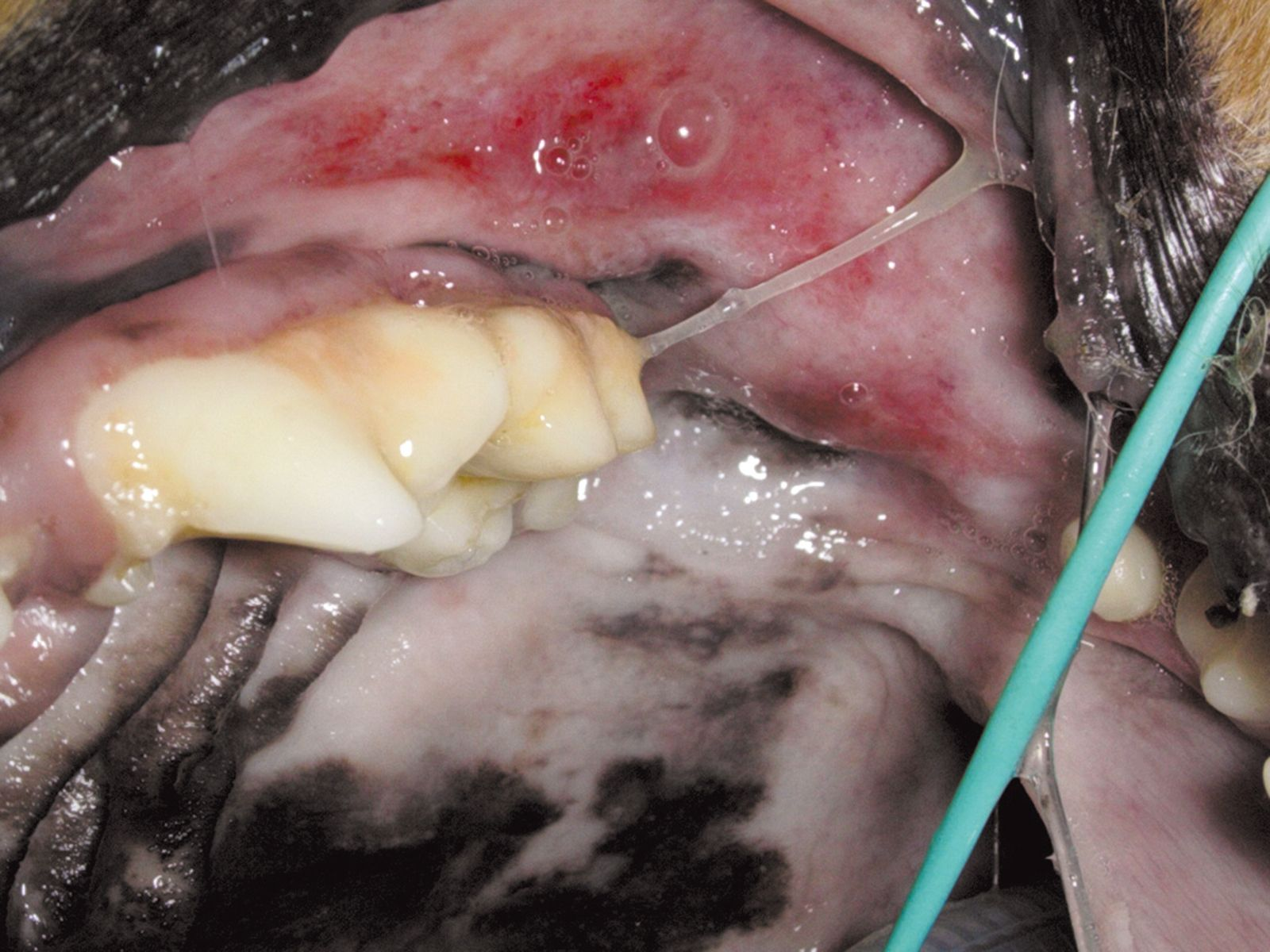
Eine antibiotische Therapie ist ratsam, wenn die parodontale Erkrankung eine Osteomyelitis der Maxilla oder der Mandibula hervorgerufen hat. Die antibiotische Behandlung wird einige Tage vor dem geplanten chirurgischen Eingriff eingeleitet und danach über mehrere Wochen fortgesetzt. Ein frühzeitiger Einsatz von Antibiotika bereits einige Tage vor dem chirurgischen Eingriff ist auch dann angezeigt, wenn sich ulzeröse Zahnfleischläsionen entwickelt haben (auch wenn nur geringgradige Zahnbeläge vorhanden sind), sowie bei Hunden mit einer chronisch ulzerösen paradentalen Stomatitis (Abbildung 8a und b) und schließlich auch bei Katzen mit Stomatitis.
Prophylaxe der Bakteriämie
Eine Bakteriämie kommt bei Patienten mit aktiver Gingivitis und Parodontitis häufig vor und entsteht im Rahmen normaler täglicher Aktivitäten wie Zahnpflege oder dem Kauen von Futter. Bei gesunden Tieren wird dieser Bakteriämie durch das retikulohistiozytäre System sehr schnell entgegengewirkt. Bei Parodontitis-Patienten mit schwerwiegenden systemischen Erkrankungen wie Herzproblemen, bei Individuen mit Gelenk- oder Augenersatz, bei splenektomierten Individuen oder bei Patienten mit Hyperadrenocorticismus sowie bei Individuen mit einem durch eine systemische Erkrankung unterdrückten Zellstoffwechsel, rechtfertigt das Risiko einer Infektion von Geweben außerhalb der Maulhöhle den perioperativen Einsatz von Antibiotika. Das Mittel der Wahl in diesen Fällen ist ein bakterizides Breitspektrumantibiotikum, das bei der Einleitung der Anästhesie intravenös verabreicht werden kann und entsprechend wiederholt wird, wenn die Operationsdauer zwei Stunden übersteigt. Eine Alternative ist die Gabe einer einzelnen oralen Dosis am Morgen des chirurgischen Eingriffes.Schlussfolgerung
Ungeachtet der Tatsache, dass verschiedene Hypothesen existieren, die mögliche Zusammenhänge zwischen parodontaler Erkrankung und systemischen Auswirkungen erklären, gibt es bislang keine eindeutigen Evidenzen einer direkten Verbindung zwischen diesen beiden Krankheitskomplexen. Es gibt jedoch sehr viele Hinweise, die dafür sprechen, dass eine parodontale Erkrankung Entzündungen in entfernt von der Maulhöhle gelegenen Organen fördern und aufrechterhalten kann. Beobachtet wird zudem, dass der Körper selbst in den frühen Stadien einer Parodontitis mit der Synthese von Akutphasenproteinen reagieren kann. Auch dies kann als ein Hinweis auf die Induzierung einer systemischen Erkrankung durch eine Entzündung in der Maulhöhle gewertet werden.
Die Gesundheit des Parodonts ist nicht nur wichtig für den Erhalt der Zähne. Ein parodontale Erkrankung kann auch signifikante Auswirkungen auf die Gesundheit insgesamt haben und für Morbidität und Mortalität verantwortlich sein, insbesondere bei bestimmten besonders empfänglichen Hunderassen. Präventive Maßnahmen wie eine Zahn- und Maulhöhlenpflege, der Einsatz von Kauspielzeug und die Fütterung von Produkten, die speziell für die Reduzierung der Akkumulation von bakterieller Plaque und Zahnstein entwickelt wurden, sollten im Rahmen eines umfassenden Parodontitismanagements in Betracht gezogen werden. Futtermittelprodukte zur Förderung der Zahngesundheit bestehen in der Regel aus Trockenfutterkroketten einer speziellen Textur, die beim Kauen einen mechanischen Abriebeffekt an der Zahnoberfläche erzeugt. Einige dieser Produkte enthalten auch Natriumpolyphosphat, eine Substanz, die das im Speichel vorhandene Calcium in Chelatkomplexen bindet und damit die Mineralisierung von Plaque, also die Zahnsteinbildung, verlangsamt. Diese Futtermittel können deshalb als unterstützende Maßnahme im Rahmen eines umfassenden Plans zur Bekämpfung der parodontalen Erkrankung empfohlen werden.
Alessandro De Simoi
Med Vet, Dip. EVDC
Italien
Dr. De Simoi schloss sein Studium 1990 an der Universität Bologna in Italien ab und erhielt im Jahr 2008 das Diplom des EVDC (European Veterinary Dentistry College). Sein Hauptinteresse gilt der Zahnheilkunde und der maxillofazialen Chirurgie bei Kleintieren und Pferden. In den Jahren 2001 bis 2003 absolvierte er eine Ausbildung an der European School for Advanced Veterinary Studies in Luxemburg und arbeitete mehrfach in Großbritannien (an der Bell Equine Veterinary Clinic und an der Royal Dick School of Veterinary Studies) und in den USA (an der University of Pennsylvania). Dr. De Simoi ist Teilnehmer an zahlreichen nationalen und internationalen Meetings und Kongressen über veterinärmedizinische Zahnheilkunde und hält Kurse zu diesem Themengebiet in der Schweiz und in Frankreich. Von 2001 bis 2004 war er Schriftführer der Italian Society of Veterinary Dentistry and Oral Surgery und ist gegenwärtig Vizepräsident dieser Vereinigung.
Literatur
- Lund EM, Armstrong PJ, Kirk CA, et al. Health status and population characteristics of dogs and cats examined at private veterinary practices in the United States. J Am Vet Med Assoc 1999;214:1336-1341.
- Haffajee AD, Socransky SS. Introduction to microbial aspects of periodontal biofilm communities, development and treatment. Periodontol 2000,2006; 42:7-12.
- Vieira CL, Caramels B. The history of dentistry and medicine relationship: could the mouth finally return to the body? Oral Dis 2009;15(8):538-46.
- Pavlica Z, Petelin M, Juntes P, et al. Periodontal disease burden and pathological changes in organs of dogs. J Vet Dent 2008;25(2):97-105.
- Silver JG, Martin L, McBride BC. Recovery and clearance of oral micro-organism following experimental bacteremia in dogs. Arch Oral Biol 1975;20:675-9.
- Glickman LT, Glickman NW, Moore GE, et al. Evaluation of the risk of endocarditis and other cardiovascular events on the basis of the severity of periodontal disease in dogs. J Am Vet Med Assoc 2009;234:486-494.
- DeBowes LJ, Mosier D, Logan E, et al. Association of periodontal disease and histologic lesions in multiple organs from 45 dogs. J Vet Dent 1996;13:57-60.
- Paquette DW. The periodontal infection-systemic disease link: a review of the truth or myth. J Int Acad Periodontol 2002;4(3):101-9.
- Janket SJ, Baird A, Chuang S, et al. Meta-analysis of periodontal disease and risk of coronary heart disease and stroke. Oral Surg Oral Med Oral Pathol 2003;95:559-596.
- Khader YS, Albashaireh ZSM, Alomari MA. Periodontal disease and the risk of coronary heart and cerebrovascular disease: a meta-analysis. J Periodontol 2004;75:1046-1153.
- Glickman LT, Glickman NW, Moore GE, et al. Association between chronic azotemic kidney disease and the severity of periodontal disease in dogs. Prev Vet Med. 2011 May 1;99(2-4):193-200. Epub 2011 Feb 23.
- Peddle GD, Drobatz KJ, Harvey CE, et al. Association of periodontal disease, oral procedures, and other clinical findings with bacterialendocarditis in dogs. J Am Vet Med Assoc. 2009 Jan 1;234(1):100-7.
- Yu G, Yu Y, Li YN, et al. Effect of periodontitis on susceptibility to atrial fibrillation in an animal model. J Electrocardiol. 2010 Jul-Aug;43(4):359-66. Epub 2009 Dec 29.
- O’Reilly PG, Claffey NM. A history of oral sepsis as a cause of disease. Periodontol 2000. 2000;23:13-18.
- Baskaradoss JK, Geevarghese A, Al Dosari AA. Causes of adverse pregnancy outcomes and the role of maternal periodontal status - a review of the literature. Open Dent J 2012;6:79-84. Epub 2012 May 9.
- van Nice E. Management of multiple dental infections in a dog with diabetes mellitus. J Vet Dent 2006;23(1):18-25.
- Yoneda M, Naka S, Nakano K, et al. Involvement of a periodontal pathogen, Porphyromonas gingivalis on the pathogenesis of non-alcoholic fatty liver disease. BMC Gastroenterol 2012;12:16.
- Ford PJ, GemmelE, Hamlet SM et al. Cross-reactivity of GroEL antibodies with human heat shock protein 60 and quantification of pathogens in arterosclerosis. Oral Microbiol Immunol 2005;20:296-302.
- Deshpande RG, KhanMB, Genco CA. Invasion of aortic and heart endothelial cells by Porphiromonas gingivalis. Infect Immun 1998;66:5337-5343.
- Franek E, Blach A, Witula A, et al. Association between chronic periodontal disease and left ventricular hypertrophy in kidney transplant recipients. Transplantation 2005;80:3-5.
- Amar S, Gokce N, Morgan S, et al. Periodontal disease is associated with brachial artery endothelial dysfunction and systemic inflammation. Arterioscler Thromb Vasc Biol 2003;23:1245-1249.
- Tonetti MS, D’Aiuto F, Nibali L, et al. Treatment of periodontitis and endothelial function. N Engl J Med 2007;356:911-920.
- Polla BS. A role for heat shock proteins in inflammation? Immunol Today 1988;9:134-137.
- Wick G, Perschinka H, Xu Q. Autoimmunity and atherosclerosis. Am Heart J 1999;138:444-449.
- Ando T, Kato T, Ishihara K,et al. Heat shock proteins in the human periodontal disease process. Microbiol Immunol 1995;39:321-327.
Andere Artikel in dieser Ausgabe
Auf sozialen Medien teilen