Disbiosis del microbioma canino
Escrito por Jan Suchodolski
Cada vez está más reconocida la involucración de un microbioma intestinal alterado en el origen de muchos trastornos gastrointestinales; en este artículo se describen los métodos de diagnóstico y las opciones de tratamiento en los casos de disbiosis.

Puntos clave
El microbioma intestinal es un rgano metablico con un gran impacto en la salud del husped.
La disbiosis es un marcador temprano de anomalas en el medio intestinal y es necesario tratar la enfermedad subyacente para lograr la resolucin a largo plazo.
La modificacin de la dieta debe ser el tratamiento de primera lnea de la disbiosis asociada a enteropatas crnicas, ya que suele ser clnicamente eficaz y los efectos secundarios son mnimos.
El trasplante de microbiota fecal (TMF) es un potencial tratamiento emergente de la disbiosis, aunque su aplicacin en perros todava se encuentra en fase de prueba.
Introducción
El microbioma intestinal es el término utilizado para designar al genoma colectivo de todos los microbios (p.e. bacterias, virus, hongos y protozoos) presentes en el tracto gastrointestinal (TG), siendo las bacterias los componentes más abundantes. El microbioma puede considerarse parte del sistema inmune, así como una entidad metabólica, ya que las bacterias producen metabolitos que afectan tanto al TG como a otros órganos del cuerpo. La disbiosis es el término que se utiliza para referirse a las alteraciones que se producen en el microbioma durante un proceso patológico e incluye una reducción de la diversidad de microbioma (p.ej., menor número de bacterias diferentes), un cambio en la cantidad de bacterias y cambios funcionales (p. ej., alteración en los metabolitos bacterianos). La disbiosis muchas veces se producen como consecuencia de enfermedades intestinales subyacentes y repercute negativamente en los signos clínicos en algunos pacientes [1]; por este motivo, es un marcador adicional en enfermedades intestinales y debe valorarse junto con la historia y presentación clínicas del paciente. El tratamiento de la disbiosis debe ir dirigido a resolver la patología subyacente, siendo la modificación de la dieta el tratamiento de primera línea.
Función del microbioma
Las bacterias sintetizan directamente nutrientes (vitaminas) o transforman componentes del alimento (fibras, proteínas, grasas) o del huésped (ácidos biliares) en metabolitos bacterianos, por lo que tienen muchos efectos beneficiosos para el huésped. Entre los metabolitos bacterianos más importantes se encuentran los ácidos grasos de cadena corta (AGCC), los indoles y los ácidos biliares secundarios. Los efectos de estos metabolitos son diversos, incluyendo efectos antiinflamatorios, la modulación de la motilidad intestinal, la inhibición de enteropatógenos, la mejora de la función barrera intestinal y el aumento de producción de mucina [2]. La disbiosis, que muchas veces es secundaria a factores luminales (Recuadro 1), da lugar a una alteración de la función de la microbiota lo que contribuye posteriormente al desarrollo de signos clínicos [1]. Los ácidos biliares intestinales (AB) tienen un papel particularmente interesante en la regulación de la microbiota. Brevemente, los AB primarios (ácidos cólico y quenodesoxicólico) son liberados al intestino delgado tras la ingestión de alimento para facilitar la digestión de las grasas. Hasta el 95% de los AB se reabsorben en el íleon a través de la circulación enterohepática [3] y el resto llega al colon para transformarse en AB secundarios por la acción de bacterias (principalmente Clostridium hiranonis en el perro y el gato) [4]. Esto tiene importantes consecuencias para la salud, ya que los AB secundarios, en la cantidad adecuada, tienen efectos beneficiosos. Actúan como agonistas en la señalización de varios receptores en múltiples órganos, induciendo un efecto antiinflamatorio y reductor de la glucemia, además de inhibir enteropatógenos [5].
Recuadro 1. Enfermedades y factores asociados con la disbiosis intestinal
|
Evaluación del microbioma
Existen diversos métodos para evaluar el microbioma del perro, aunque algunos son más efectivos que otros.
Cultivo bacteriano
Aunque muchos veterinarios realizan el cultivo bacteriano de heces para el diagnóstico de disbiosis, esta prueba no es útil para evaluar el microbioma, puesto que la mayoría de las bacterias intestinales son anaerobias estrictas y necesitan un medio de cultivo especial para crecer (Figura 1). Por tanto, los laboratorios de diagnóstico solo pueden obtener en el cultivo un pequeño porcentaje de especies bacterianas. En un estudio reciente, se enviaron a tres laboratorios de referencia diferentes alícuotas fecales de perros sanos y de perros con diarrea crónica para la detección de disbiosis [6]. Los resultados de los cultivos de los laboratorios no coincidieron entre sí y, de hecho, el resultado de disbiosis fue más frecuente en el grupo de perros sanos. Este estudio prueba que los cultivos bacterianos no se deberían utilizar para evaluar la microbiota en perros con diarrea crónica, excepto en el caso de algunos patógenos específicos como Salmonella spp.

Credit: Shutterstock
Secuenciación molecular del gen ARNr 16S
Las técnicas moleculares basadas en la secuenciación del gen ARNr 16S proporcionan una información completa sobre la composición microbiana de una muestra fecal y se utilizan en el ámbito de la investigación. Existen varios laboratorios que ofrecen, con fines comerciales, la secuenciación para evaluar el microbioma en animales, sin embargo, actualmente no existe una técnica estandarizada (extracción de ADN, uso de cebadores de PCR) entre laboratorios. Dado que no se han definido los intervalos de referencia en animales y que cada laboratorio incluye diferente información en sus informes, la interpretación de los resultados es compleja. Además, existe variabilidad entre pruebas y no se ha establecido una validación analítica para estas pruebas, por lo que actualmente, esta técnica de secuenciación no se recomienda para la evaluación del microbioma en pacientes individuales.
Índice de disbiosis de la microbiota canina (ID)
El índice de disbiosis (ID) es una prueba cuantitativa, basada en la PCR, actualmente disponible en Norteamérica y Europa y muy utilizada en estudios clínicos [4],[7] al ser la única prueba validada para evaluar la disbiosis del microbioma canino*. El ID mide la concentración de siete grupos de bacterias intestinales (Recuadro 2) que suelen estar alterados en perros con enteropatías crónicas (EC) o tras un tratamiento con antibióticos de amplio espectro (p.ej., tilosina, metronidazol) [8],[9].
* https://tx.ag/DysbiosisGI
Recuadro 2. Los siete grupos bacterianos incluidos en el Índice de Disbiosis y cómo se altera su concentración en caso de disbiosis.
| Grupo bacteriano | Alteración en disbiosis |
|---|---|
| Faecalibacterium spp. | ↓ |
| Turicibacter spp. | ↓ |
| Blautia spp. | ↓ |
| Fusobacterium spp. | ↓ |
| C. hiranonis | ↓ |
| Streptococcus spp. | ↑ |
| E. coli | ↑ |
Recuadro 3. Sensibilidad y especificidad del Índice de Disbiosis (ID) para las enteropatías crónicas; un ID entre 0-2 representa un cambio moderado en la microbiota, mientras que si es mayor que 2 el cambio es importante.
| Índice de disbiosis | Sensibilidad | IC (95%) | Especificidad | IC (95%) |
|---|---|---|---|---|
| -1 | 0,82 | 0,73-0,88 | 0,91 | 0,84-0,96 |
| 0 | 0,74 | 0,65-0,82 | 0,95 | 0,89-0,98 |
| 2 | 0,63 |
0,53-0,72
|
1 | 0,96-1,00 |
En esta prueba se tienen en cuenta los intervalos de referencia para este grupo de bacterias y combinando los datos se obtiene como resultado un solo número que indica el alcance de la disbiosis (Figura 2); un ID de entre 0 y 2 indica una alteración moderada de la microbiota, mientras que un ID>2 indica una alteración significativa. La sensibilidad y la especificidad de este método se muestran en el Recuadro 3.
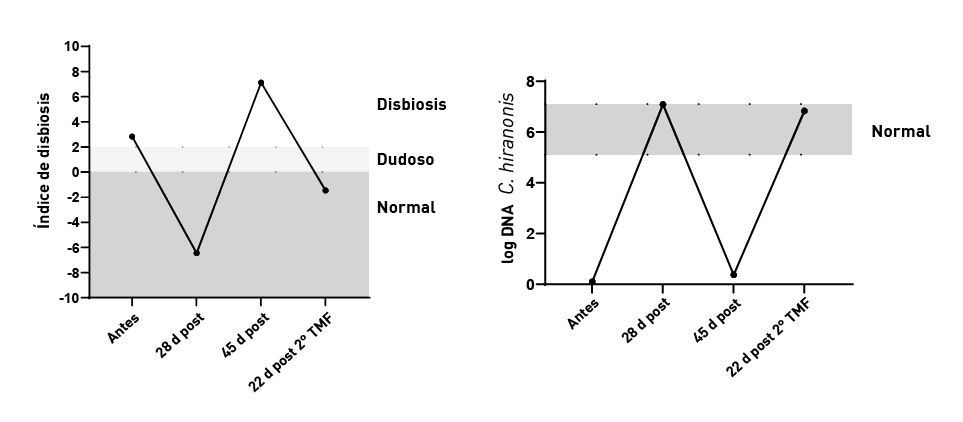
Además, al evaluar la concentración de C. hiranonis, el ID también predice la capacidad de la microbiota intestinal para convertir los AB primarios en AB secundarios [4]. Los ácidos biliares secundarios en cantidades normales son antimicrobianos e inhiben posibles enteropatógenos como C. difficile, C. perfringens y E. coli [10], por lo que la disminución de C. hiranonis y de la conversión de ácidos biliares está fuertemente asociada a la disbiosis intestinal y al sobrecrecimiento de enteropatógenos en el perro (Figura 2) [4],[7],[8],[11]. La identificación de algunos o de todos estos enteropatógenos en el perro con diarrea sugiere un sobrecrecimiento por disbiosis secundario a una enteropatía crónica más que una infección primaria. Hasta el 60% de los perros con enteropatía crónica (EC) tienen una disminución de C. hiranonis y, por tanto, una disminución de AB secundarios [12].
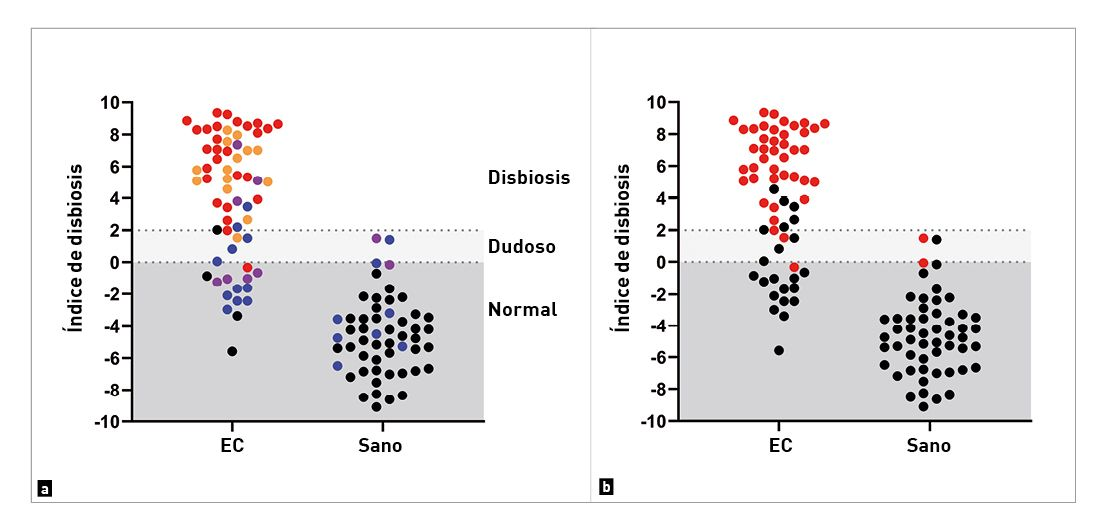
Datos de las mismas dos cohortes de perros, donde se observa cmo la cantidad de C. hiranonis afecta en gran medida al microbioma. Los puntos en rojo indican muestras con una cantidad disminuida de estas bacterias y, por tanto, una menor conversin intestinal de cidos biliares primarios a secundarios, lo que da lugar a una alteracin anormal del microbioma (derecha).
El microbioma en la enfermedad
En la Tabla 1 se resumen los distintos mecanismos por los que las bacterias intestinales pueden contribuir a la enfermedad, aunque las patologías subyacentes varían en cada individuo en función de la localización y la gravedad de la lesión intestinal. La microbiota está en contacto con la capa de mucus intestinal, el sistema inmune y los sustratos luminales, por lo que cualquier alteración en uno o varios de ellos afectará a su composición. Por este motivo, la disbiosis muchas veces es un marcador temprano de alteraciones patológicas en el medio intestinal (Figura 3).
Tabla 1. Mecanismos por los que las bacterias contribuyen a la enfermedad GI.
| Principales tipos de disbiosis | Posibles consecuencias |
|---|---|
| Sustrato anormal (p. ej., nutrientes sin digerir, fármacos) en la luz intestinal | Aumento de los metabolitos bacterianos que causan diarrea |
| Pérdida de la función de la microbiota por pérdida de bacterias comensales (p.ej., C. hiranonis) |
Disminución de la conversión de ácidos biliares primarios a secundarios que conduce al sobrecrecimiento de enteropatógenos
Ausencia de metabolitos anti-inflamatorios |
| Aumento del total de la carga bacteriana en el intestino delgado |
Aumento de metabolitos microbianos, dando lugar a diarrea
Aumento de la respuesta inmune inflamatoria |
| Aumento de bacterias adheridas a la mucosa | Aumento de la respuesta inmune inflamatoria |
La disbiosis suele estar limitada a la luz intestinal en pacientes con insuficiencia pancreática exocrina (IPE) [13] después de un tratamiento con antibióticos de amplio espectro [8],[9] o en animales más jóvenes con un sistema inmune inmaduro. Las enteropatías crónicas van acompañadas de inflamación y destrucción de la capa de mucus y de la estructura de la mucosa, causando la presencia de más oxígeno en la superficie de la mucosa, un incremento en el número de bacterias aeróbicas (E. coli) y una disminución de la flora anaeróbica normal. La pérdida de la arquitectura con las EC provoca una falta de transportadores de carbohidratos, aminoácidos, ácidos grasos y ácidos biliares, lo que resulta en la malabsorción de estos compuestos [14]. La mayor concentración de estas sustancias en la luz del TG puede causar directamente una diarrea osmótica o secretora, así como al sobrecrecimiento bacteriano.
Como consecuencia de la destrucción de la mucosa que recubre el epitelio, los perros con EC a menudo tienen un mayor número de bacterias adheridas a la mucosa [15]. Esto está relacionado con la disminución de C. hiranonis y, por tanto, con una conversión anormal de ácidos biliares, permitiendo el sobrecrecimiento secundario de C. difficile y C. perfringens que puede conducir a su vez a un aumento de las respuestas proinflamatorias del huésped.
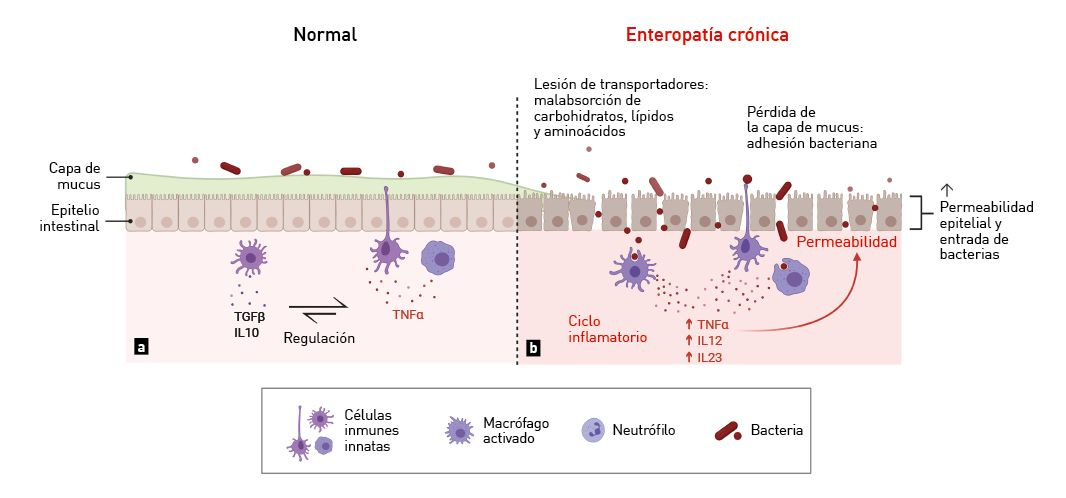
el microbioma pasa a ser disbitico;
prdida del mucus, con la consecuente adhesin de bacterias luminales a las clulas epiteliales, estimulando las citoquinas proinflamatorias;
ruptura de la barrera epitelial, dando lugar a la translocacin de antgenos alimentarios y bacterianos, lo que a su vez activa al sistema inmune;
prdida de transportadores en el borde en cepillo, lo que conduce a la malabsorcin de nutrientes y al sobrecrecimiento bacteriano.
La modificación de la dieta es el tratamiento de primera línea en las enfermedades intestinales, ya que no tiene ningún impacto negativo en la microbiota intestinal.
Aproximación diagnóstica a la disbiosis
La disbiosis suele ser secundaria a la alteración del entorno intestinal por una enfermedad intestinal y/o modificación de los factores del entorno, por lo que se debe evaluar teniendo en cuenta el historial farmacológico del paciente y la presentación clínica. La interpretación de los resultados del ID se debe realizar teniendo en cuenta la concentración individual de cada taxón bacteriano, y especialmente de C. hiranonis, ya que su disminución contribuye en gran medida a un microbioma anormal. Un ID superior a 2 indica disbiosis con una elevada especificidad, sin embargo, un ID en un rango dudoso indica un cambio menor en el microbioma fecal. Algunos perros con EC pueden tener un ID <0 con algunos taxones bacterianos fuera de los intervalos de referencia, lo que representa una forma leve de disbiosis. En general, un ID anormal sugiere una enfermedad intestinal subyacente y, por tanto, estaría indicado realizar un estudio diagnóstico de EC.
Hay que tener en cuenta que algunos fármacos pueden influir en el ID. Por ejemplo, el omeprazol puede provocar un aumento transitorio del ID, sin aumento de la concentración de C. hiranonis, y el ID se normaliza entre 1 y 2 semanas después de finalizar el tratamiento. Los antibióticos de amplio espectro (p. ej., metronidazol y tilosina) pueden inducir una disbiosis fecal grave (Figura 4), pero nuevamente, la microbiota se suele normalizar, en la mayoría de los perros, 2-4 semanas después del tratamiento, aunque algunos perros pueden presentar disbiosis persistente con falta de C. hiranonis durante varios meses [8],[11].
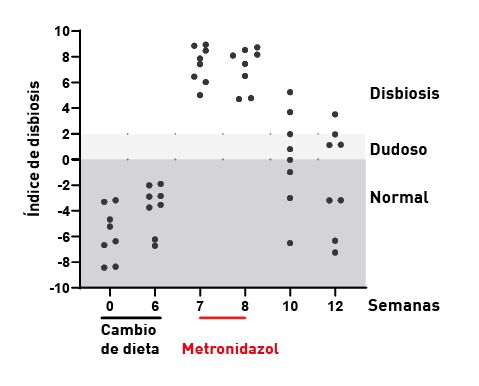
Los cambios en la composición de la microbiota del intestino delgado suelen dar lugar a cambios detectables en el microbioma fecal, según lo evaluado en el ID. En algunos pacientes, el aumento de bacterias en el intestino delgado puede resultar en enfermedad. Se puede sospechar una disbiosis de intestino delgado cuando en un panel GI, la concentración de folato sérico aumenta y la de cobalamina disminuye, pero hay que tener en cuenta que ambos marcadores tienen baja sensibilidad y especificidad.
Tratamiento de la disbiosis
La disbiosis muchas veces es solo un componente de la enfermedad intestinal y, generalmente, es necesario adoptar un tratamiento multimodal que aborde la causa subyacente. En algunos casos, como en la IPE, el tratamiento con suplementos de enzimas pancreáticas mejora los signos clínicos y, a menudo, el microbioma intestinal se normaliza pasadas varias semanas [13], pero en perros con EC no existe un marcador que prediga cuál es el mejor tratamiento para cada paciente en concreto, por lo que muchas veces es necesario realizar escalonadamente ensayos terapéuticos consecutivos [16]. Las opciones de tratamiento de la disbiosis incluyen la modificación de la dieta, pre- y probióticos, antimicrobianos y el trasplante de microbiota fecal (TMF). Cada una de estas opciones actúa sobre un mecanismo diferente (Tabla 2); por lo que la combinación de varios tratamientos conlleva mejores resultados.
Tabla 2. Opciones para el tratamiento de la disbiosis.
| Tratamiento | Posible mecanismo | Posibles efectos secundarios |
|---|---|---|
| Cambio de dieta |
|
|
| Prebióticos/fibras |
|
|
| Probióticos |
|
|
| Antibióticos |
|
|
| Trasplante de la microbiota fecal (TMF) |
|
|
Los cambios en la dieta deben ser siempre la primera opción en pacientes estables. En varios estudios se ha demostrado que entre el 50 y el 70% de los perros con EC responden a estrategias nutricionales [16], siendo las dietas de elevada digestibilidad, con proteína novel o hidrolizada, las utilizadas con más frecuencia. La mayoría de estas dietas son hipoalergénicas y al ser muy digestibles reducen la cantidad de nutrientes no digeridos en la luz GI, disminuyendo la posibilidad de sobrecrecimiento bacteriano. En la mayoría de las enteropatías que responden a la dieta, solo con la modificación nutricional se consigue la remisión clínica y una mejora gradual de la inflamación intestinal y de la disbiosis durante varios meses [10],[17].
Los probióticos pueden administrarse solos en casos leves o junto con la modificación dietética. Como la concentración bacteriana de cualquier probiótico es pequeña en comparación con la microbiota intestinal existente, el impacto directo en la composición de la microbiota es pequeño. Sin embargo, estas bacterias se adhieren a la mucosa y pueden tener efectos beneficiosos, como una menor duración de la diarrea aguda y la reducción de los efectos secundarios gastrointestinales asociados a los antibióticos, como los vómitos o la diarrea [18]. Se ha demostrado que los probióticos de alta potencia multicepa reducen el número de C. perfringens en perros con diarrea hemorrágica aguda [19] y refuerzan la barrera intestinal en perros con EC [20]. Sin embargo, dada la variedad de productos comerciales sin un control de calidad adecuado, es importante elegir un producto cuya eficacia se haya demostrado en estudios clínicos publicados.
Los prebióticos son carbohidratos no digestibles que favorecen el crecimiento de microorganismos beneficiosos. Se pueden dividir en fibras solubles o insolubles y en fibras fermentables o no fermentables. Los prebióticos fermentables se transforman en AGCC por la acción de las bacterias presentes en el colon. La mayoría de las dietas gastrointestinales comerciales contienen prebióticos y las dietas altas en fibra pueden ser beneficiosas en ciertas enfermedades (p. ej., colitis). La incorporación de psyllium (fibra soluble) en la dieta, a razón de 0,5-1 g/kg de peso corporal al día, puede mejorar la calidad de las heces en animales con enfermedad del intestino grueso. Primero se debe administrar en pequeñas cantidades y después se aumenta progresivamente hasta lograr la consistencia fecal deseada.
Aunque tradicionalmente se ha recomendado el uso de antibióticos como la tilosina o el metronidazol para el tratamiento de la EC, actualmente existe controversia sobre su administración como tratamiento de primera línea [16]. A pesar de producirse una mejoría de los signos clínicos, presumiblemente por la reducción de la carga bacteriana, muchas veces se produce una reaparición de los signos tras finalizar el tratamiento, una vez que las bacterias vuelven a desarrollarse, ya que los antibióticos rara vez resuelven el proceso patológico subyacente [15],[21],[22]. Entre las opciones más utilizadas se encuentra el metronidazol (10-15 mg/kg cada 12 h) y la tilosina (25 mg/kg cada 12 h) durante 4-6 semanas, pero como se ha señalado antes, ambos fármacos inducen una disbiosis en el intestino grueso que a veces puede durar meses [8],[9],[11]. En estudios se ha observado que el metronidazol favorece el desarrollo de una disbiosis duradera en perros con diarrea aguda [11] y la amoxicilina-ácido clavulánico puede favorecer un aumento de E. coli resistentes [23]. Generalmente, la antibioterapia no es recomendable como tratamiento de primera línea de la EC por varias razones: solo el 10-16% de los perros con EC responden a los antibióticos, la mayoría de ellos recae tras finalizar el tratamiento y los antibióticos afectan negativamente al microbioma. Sin embargo, es una opción que se debe considerar cuando no se obtiene una respuesta satisfactoria con la dieta y el tratamiento antiinflamatorio o en pacientes con signos de inflamación sistémica [16] e invasión y persistencia de bacterias en la mucosa intestinal (p. ej., en la colitis granulomatosa asociada a E. Coli). Un pequeño porcentaje de perros con EC puede no responder a ningún otro tratamiento, en cuyo caso puede ser necesaria la administración de antibióticos a largo plazo, disminuyendo la dosis hasta la mínima efectiva.
El trasplante de microbiota fecal (TMF) puede ayudar a restaurar la microbiota normal y a la mejoría de los signos clínicos [11] en algunos casos de disbiosis. Esta técnica consiste en la transferencia de heces de un donante sano al intestino de un receptor, utilizando cápsulas orales, endoscopia o enemas (Figuras 5 y 6). En medicina humana, la tasa de éxito del TMF es muy elevada (> 90%) en caso de infección recurrente por C. difficile, pero el éxito en la enfermedad inflamatoria intestinal es más limitado debido a la inflamación crónica subyacente.

Credit: Ewan McNeill
Credit: Ewan McNeill
El TMF es un tratamiento todavía emergente en veterinaria. En el Recuadro 4 se muestra un protocolo sencillo, aunque hasta la fecha existen pocos casos publicados, y parece que el éxito depende de la enfermedad subyacente [24]. Esta técnica ayuda a restablecer el metabolismo de los ácidos biliares al promover la población de C. hiranonis (Figura 7), por lo que puede ser útil en perros con una conversión anormal de AB por sobrecrecimiento asociado a enteropatógenos como C. difficile o C. perfringens y/o animales con disbiosis inducida por antibióticos y con una lesión subyacente leve de la mucosa intestinal. También se ha demostrado que mejora la puntuación fecal en perros con diarrea aguda y, junto con un tratamiento antimicrobiano estándar, en cachorros con infección por parvovirus y en perros jóvenes con diarrea crónica por una infección confirmada por C. difficile [25].
Recuadro 4. Protocolo del TMF mediante enema (basado en [24]).
|
El donante debe estar sano, sin historia previa de enfermedad gastrointestinal o de exposición reciente a antibióticos y no debe tener signos de enfermedad sistémica. Las heces del donante se deben examinar para detectar parásitos y enteropatógenos, y se debe evaluar previamente el ID (puesto que algunos perros clínicamente sanos carecen de bacterias C. hiranonis, necesarias para la conversión adecuada de AB). Almacenamiento: las heces pueden ser frescas o mantenerse refrigeradas a 4 ° C en bolsas de plástico hasta una semana. Cuando sea necesario congelar las heces durante más tiempo, se deben mezclar antes con glicerol para conservar las bacterias (10 gramos de heces con 35 ml de solución salina y 5 ml de glicerol, congeladas en alícuotas de 50 ml). |
| Materiales necesarios: solución de NaCl al 0,9%, catéter de caucho rojo de 12 o 14 F, jeringuilla con punta para catéter de 60 ml, licuadora y heces de donante y lubricante no bacteriostático. |
|
En perros con EC, la disbiosis muchas veces es un efecto secundario de la inflamación intestinal y de las lesiones estructurales y, si la patología subyacente no se resuelve, se producirá de nuevo la disbiosis y la aparición de los signos clínicos. Por tanto, la tasa de éxito del TMF es muy variable en la EC. En algunos reportes se ha sugerido que la puntuación fecal de muchos perros con EC mejora a los 2-3 días del tratamiento, pero después de unas semanas los perros vuelven a presentar diarrea recurrente. Por tanto, en estos pacientes es necesario instaurar un tratamiento dietético y antiinflamatorio adaptado a la enfermedad subyacente (ver más arriba) y el TMF se considera un tratamiento complementario en pacientes con una respuesta subóptima al tratamiento estándar (p. ej., heces blandas persistentes).
Conclusión
El microbioma intestinal desempeña un papel fundamental en la salud del huésped y muchos animales con enfermedad gastrointestinal desarrollan disbiosis, lo que conlleva la alteración de la función microbiana, contribuyendo a la aparición de signos clínicos. El índice de disbiosis es una herramienta de diagnóstico útil en muchos casos, pero al existir varias causas subyacentes posibles, es necesario adoptar un enfoque terapéutico multimodal y, muchas veces a largo plazo, para mejorar la composición de la microbiota.
Declaración
El autor trabaja en el Laboratorio Gastrointestinal A&M de Texas que ofrece pruebas comerciales de microbioma.
Jan Suchodolski
DVM, PhD, Dip. ACVM
Estados Unidos
El Dr. Jan Suchodolski es catedrático adjunto de medicina de pequeños animales, director adjunto de investigación y responsable de ciencias del microbioma en el Laboratorio gastrointestinal de la Universidad de Texas A&M. Obtuvo su doctorado en medicina veterinaria en la Universidad de Viena (Austria) y su doctorado en microbiología veterinaria en la Universidad de Texas A&M. Está certificado en inmunología por el American College of Veterinary Microbiologists (ACVM). Sus investigaciones se centran en el desarrollo de biomarcadores para enfermedades gastrointestinales y enfoques terapéuticos para la modulación de la microbiota intestinal. Es autor y coautor de más de 270 artículos revisados por homólogos en el area de la gastroenterología veterinaria y la investigación del microbioma.
Referencias
- Ziese AL, Suchodolski JS. Impact of changes in gastrointestinal microbiota in canine and feline digestive diseases. Vet. Clin. North. Am. Small. Anim. Pract. 2021;51(1):155-169.
- Whitfield-Cargile CM, Cohen ND, Chapkin RS, et al. The microbiota-derived metabolite indole decreases mucosal inflammation and injury in a murine model of NSAID enteropathy. Gut. Microbes 2016;7(3):246-261.
- Giaretta PR, Suchodolski JS, Blick AK, et al. Distribution of bile acid receptor TGR5 in the gastrointestinal tract of dogs. Histol. Histopathol. 2019;34(1):69-79.
- Li Q, Larouche-Lebel E, Loughran KA, et al. Gut dysbiosis and its associations with gut microbiota-derived metabolites in dogs with myxomatous mitral valve disease. MSystems. 2021;in press.
- Pavlidis P, Powell N, Vincent RP, et al. Systematic review: bile acids and intestinal inflammation-luminal aggressors or regulators of mucosal defence? Aliment. Pharmacol. Ther. 2015;42(7):802-817.
- Werner M, Suchodolski JS, Lidbury JA, et al. Diagnostic value of fecal cultures in dogs with chronic diarrhea. J. Vet. Intern. Med. 2021;35(1):199-208.
- Al Shawaqfeh MK, Wajid B, Minamoto Y, et al. A dysbiosis index to assess microbial changes in fecal samples of dogs with chronic inflammatory enteropathy. FEMS Microbiol. Ecol. 2017;93(11): DOI: 10.1093/femsec/fix136
- Pilla R, Gaschen FP, Barr JW, et al. Effects of metronidazole on the fecal microbiome and metabolome in healthy dogs. J. Vet. Intern. Med. 2020;34(5):1853-1866.
- Manchester AC, Webb CB, Blake AB, et al. Long-term impact of tylosin on fecal microbiota and fecal bile acids of healthy dogs. J. Vet. Intern. Med. 2019;33(6):2605-2617.
- Wang S, Martins R, Sullivan MC, et al. Diet-induced remission in chronic enteropathy is associated with altered microbial community structure and synthesis of secondary bile acids. Microbiome 2019;7(1):126.
- Chaitman J, Ziese AL, Pilla R, et al. Fecal microbial and metabolic profiles in dogs with acute diarrhea receiving either fecal microbiota transplantation or oral metronidazole. Front. Vet. Sci. 2020;7:192.
- Blake AB, Guard BC, Honneffer JB, et al. Altered microbiota, fecal lactate, and fecal bile acids in dogs with gastrointestinal disease. PLOS One 2019;14(10):e0224454.
- Isaiah A, Parambeth JC, Steiner JM, et al. The fecal microbiome of dogs with exocrine pancreatic insufficiency. Anaerobe 2017;45:50-58.
- Giaretta PR, Rech RR, Guard BC, et al. Comparison of intestinal expression of the apical sodium-dependent bile acid transporter between dogs with and without chronic inflammatory enteropathy. J. Vet. Intern. Med. 2018;32(6):1918-1926.
- Giaretta PR, Suchodolski JS, Jergens AE, et al. Bacterial biogeography of the colon in dogs with chronic inflammatory enteropathy. Vet. Pathol. 2020;57(2):258-265.
- Procoli F. Inflammatory bowel disease, food-responsive, antibiotic-responsive diarrhoea, protein losing enteropathy. Advance Small Anim. Care 2020;1:127-141.
- Bresciani F, Minamoto Y, Suchodolski JS, et al. Effect of an extruded animal protein-free diet on fecal microbiota of dogs with food-responsive enteropathy. J. Vet. Intern. Med. 2018;32(6):1903-1910.
- Torres-Henderson C, Suchodolski J, Lappin MR. Effect of Enterococcus faecium strain SF68 on gastrointestinal signs and fecal microbiome in cats administered amoxicillin-clavulanate. Top. Companion Anim. Med. 2017;32(3):104-108.
- Ziese AL, Suchodolski JS, Hartmann K, et al. Effect of probiotic treatment on the clinical course, intestinal microbiome, and toxigenic Clostridium perfringens in dogs with acute hemorrhagic diarrhea. PLOS One 2018;13(9):e0204691.
- White R, Atherly T, Guard B, et al. Randomized, controlled trial evaluating the effect of multi-strain probiotic on the mucosal microbiota in canine idiopathic inflammatory bowel disease. Gut Microbes 2017;8(5):451-466
- Westermarck E, Skrzypczak T, Harmoinen J, et al. Tylosin-responsive chronic diarrhea in dogs. J. Vet. Intern. Med. 2005;19(2):177-186.
- Westermarck E, Myllys V, Aho M. Effect of treatment on the jejunal and colonic bacterial flora of dogs with exocrine pancreatic insufficiency. Pancreas 1993;8:559-562.
- Werner M, Suchodolski JS, Straubinger RK, et al. Effect of amoxicillin-clavulanic acid on clinical scores, intestinal microbiome, and amoxicillin-resistant Escherichia coli in dogs with uncomplicated acute diarrhea. J. Vet. Intern. Med. 2020;34(3):1166-1176.
- Chaitman J, Gaschen F. Fecal microbiota transplantation in dogs. Vet. Clin. North. Am. Small Anim. Pract. 2021;51(1):219-233.
- Pereira GQ, Gomes LA, Santos IS, et al. Fecal microbiota transplantation in puppies with canine parvovirus infection. J. Vet. Intern. Med. 2018;32(2):707-711.
Otros artículos de este número
Compartir en las redes sociales