La maladie valvulaire dégénérative chez le chien
La maladie valvulaire dégénérative (MVD) est une cardiopathie acquise fréquente chez le chien, pouvant représenter jusqu’à 75 % des cas d’insuffisance cardiaque congestive (ICC) dans cette espèce.
Points clés
Les termes endocardiose valvulaire , valvulopathie myxomateuse et maladie valvulaire chronique servent tous dcrire la maladie valvulaire dgnrative (MVD) du chien, qui est la cardiopathie acquise la plus frquente dans cette espce.
Lutilisation du systme de classification de lACVIM permet dtablir le stade de cardiopathie et de dvelopper un plan de traitement.
La mesure domicile de la frquence respiratoire au repos est une mthode importante de suivi des cas de maladie valvulaire chronique.
Le traitement initial de linsuffisance cardiaque congestive due une MVD consiste habituellement en une trithrapie : furosmide, pimobendane plus un inhibiteur de lenzyme de conversion.
Introduction
La MVD, parfois aussi appelée « endocardiose valvulaire », « valvulopathie myxomateuse » ou « maladie mitrale dégénérative », provoque un épaississement et une déformation progressive des valvules cardiaques, la valvule mitrale étant la plus souvent touchée. Dans de nombreux cas, la valvule tricuspide présente des modifications similaires.
Épidémiologie
La MVD est une maladie du chien mature à âgé, bien que certaines races puissent être touchées de manière plus précoce (le Cavalier King Charles, par exemple). Malgré une étiologie encore floue chez la plupart des chiens, une tendance génétique au développement de la MVD a été démontrée chez le Cavalier King Charles et le Teckel [1],[2], et une base génétique est suspectée pour au moins quelques-unes des modifications observées dans d’autres races. Toutes les races peuvent être touchées, mais la maladie entraîne surtout des signes cliniques chez les races de petit et moyen format.
Anatomie pathologique
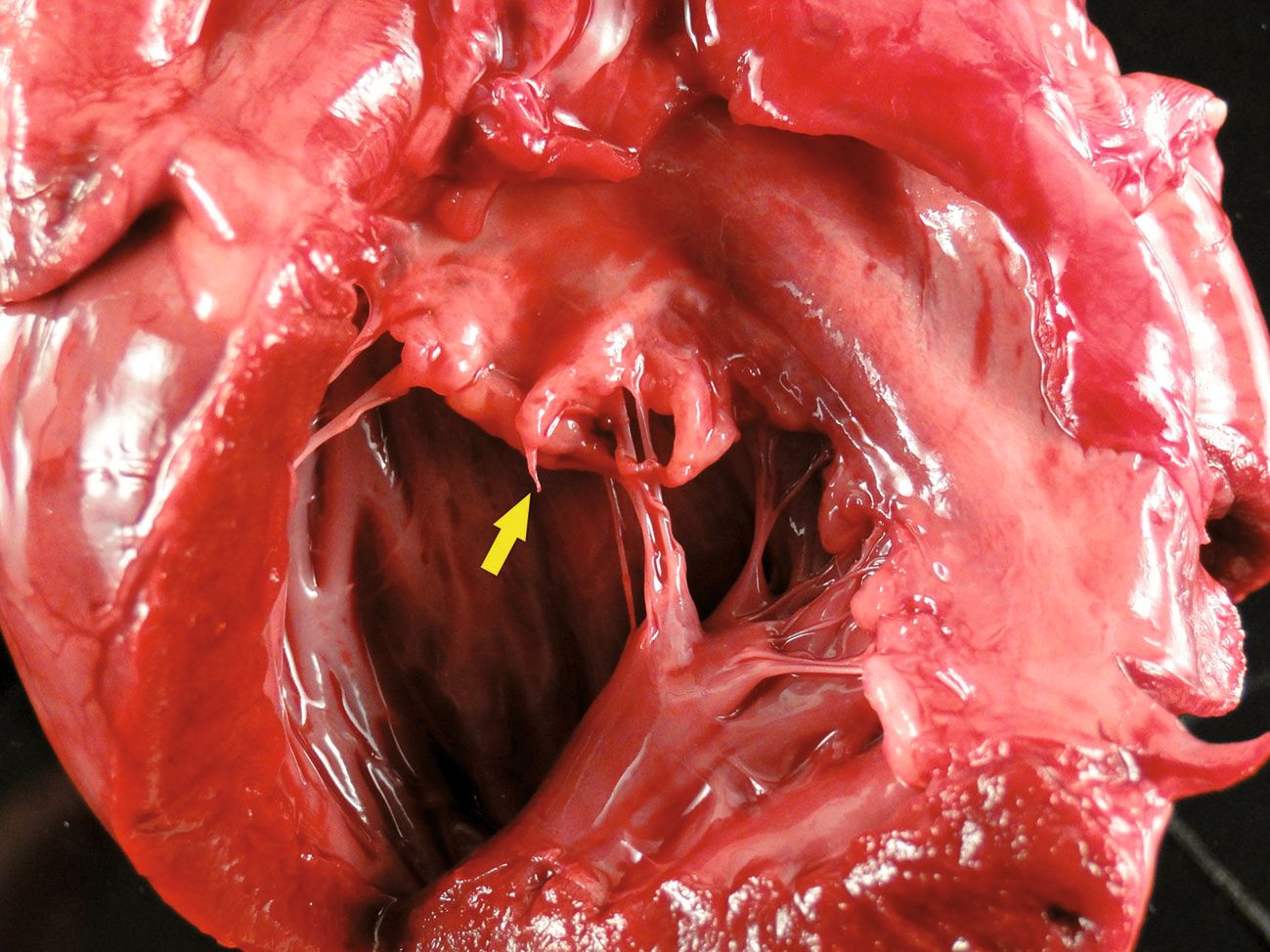
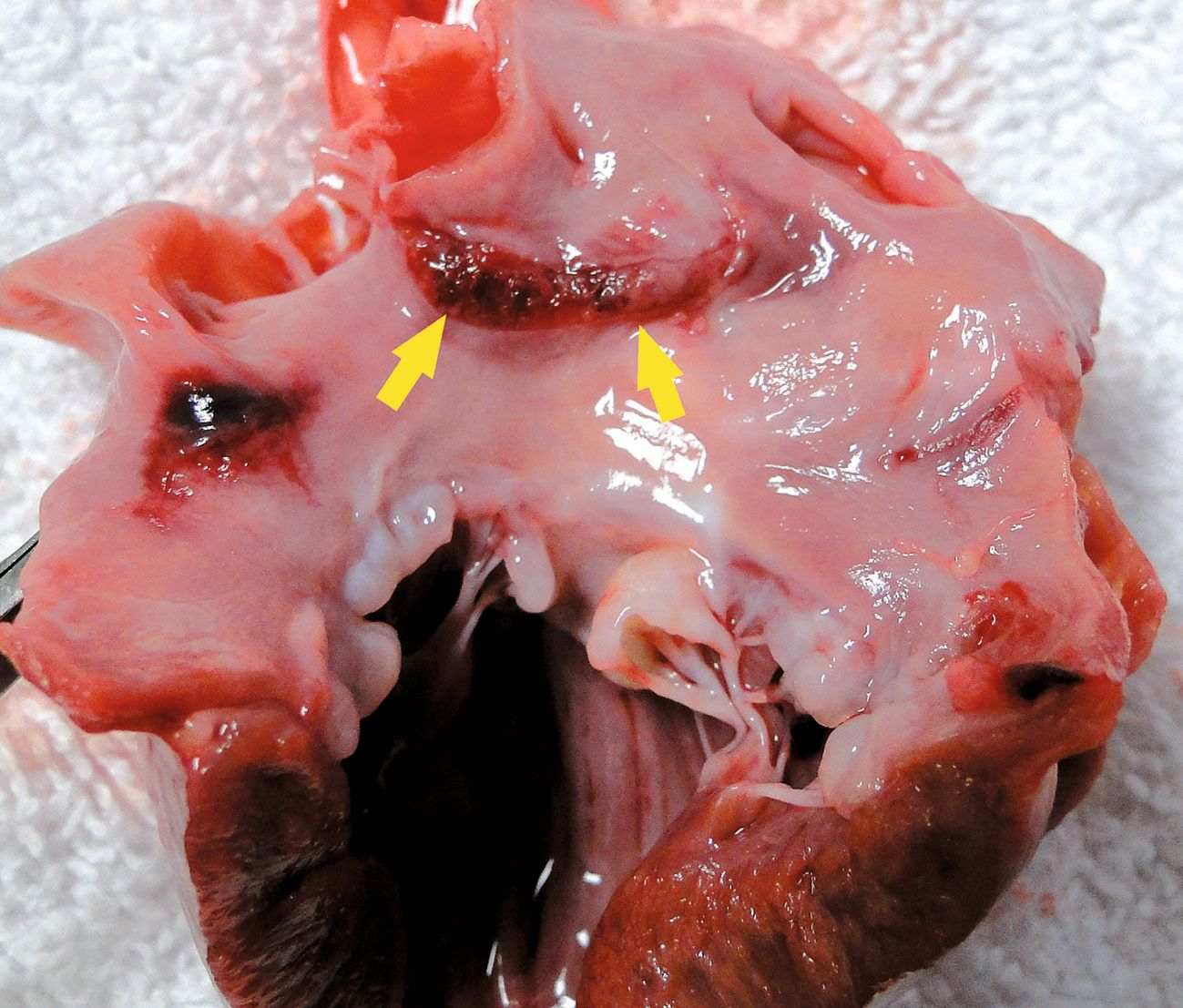
Les modifications histologiques observées au niveau de la valvule consistent en des modifications dégénératives du collagène (« dégénérescence myxomateuse ») avec développement d’une fibrose valvulaire. A l’examen macroscopique, les feuillets des valvules touchées sont épaissis, de couleur blanche ou jaune, à bords nodulaires et parfois recourbés [3]. Contrairement aux modifications valvulaires associées à l’infection des feuillets (endocardite bactérienne), la surface endocardique des feuillets irréguliers est habituellement intacte et lisse. Les modifications dégénératives touchent également souvent les cordages tendineux, dont l’élongation et l’épaississement peuvent aboutir à la rupture (Figure 1). Au niveau des valvules atrioventriculaires, la déformation des feuillets due à ce remodelage entraîne une fermeture incomplète des valvules, avec régurgitation de sang pendant la systole. A terme, la régurgitation mitrale et tricuspidienne entraîne une dilatation atriale et ventriculaire respectivement à gauche et à droite. L’atrium peut être le siège de lésions secondaires, notamment de « jet lesions » (zones de l’endocarde rugueuses apparaissant au point de contact avec le jet de régurgitation), et dans certains cas, d’une rupture partielle de l’endocarde atrial (Figure 2) ou d’une rupture complète de l’atrium gauche.
Dr. Rebecca L. Stepien
Dr. Rebecca L. Stepien
Observations échocardiographiques
Les modifications échocardiographiques observées lors de MVD canine peuvent être divisées en modifications anatomiques et fonctionnelles des feuillets ou de l’appareil valvulaire, et en modifications de taille, de forme et de fonction des chambres cardiaques survenant secondairement à la surcharge volumique due à la régurgitation valvulaire.
Modifications valvulaires
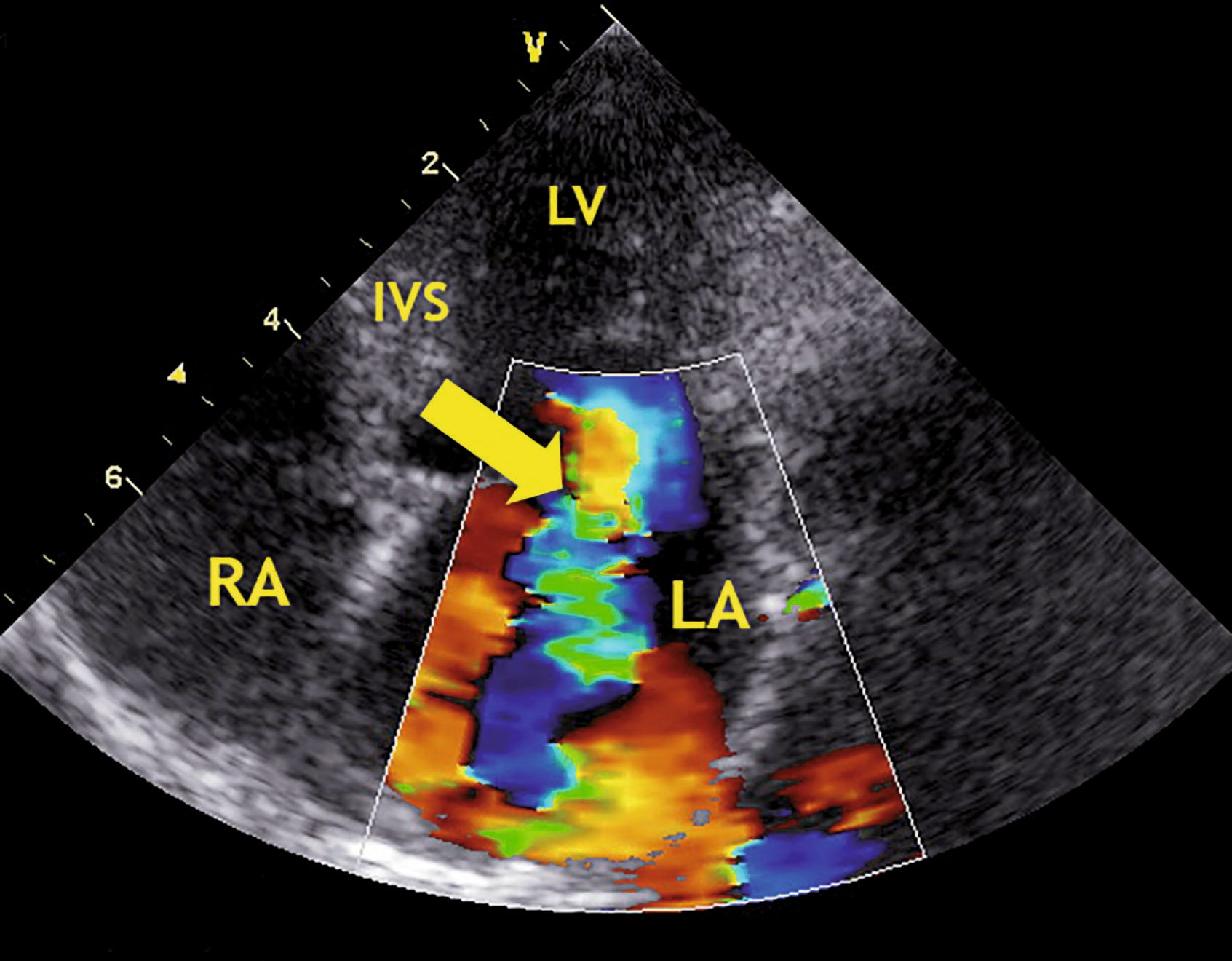
Les modifications anatomiques incluent l’épaississement des feuillets valvulaires et l’augmentation variable de leur échogénicité. Le feuillet antérieur de la valvule mitrale semble souvent plus déformé que le feuillet postérieur, et peut montrer un aspect replié ou « en crosse de hockey » quand la valvule est ouverte. Quand elle est fermée, un prolapsus peut s’observer, des portions du feuillet valvulaire faisant protrusion dans l’atrium lors de la systole. Un prolapsus mitral peut faire suite à une élongation ou à une rupture de cordages. La rupture d’un groupe important de cordages peut donner lieu à un feuillet mitral flottant (« flail leaflet »), son bord libre s’éversant dans l’atrium en systole, ce qui a pour conséquence d’aggraver de manière aiguë la fuite valvulaire (Figures 3 a-d). La régurgitation mitrale secondaire à ces modifications anatomiques peut s’objectiver par Doppler couleur (Figure 4 a,b).




Figure 3. Échocardiographies de chiens atteints de MVD, illustrant différentes caractéristiques échocardiographiques de la maladie. Pour toutes les images, LA : atrium gauche, LV : ventricule gauche.
(a) Coupe parasternale droite grand axe (en diastole). La flèche montre un épaississement du feuillet antérieur de la valvule mitrale. Notez l’aspect globuleux de l’atrium et du ventricule gauches, traduisant une hypertrophie excentrique due à une surcharge volumique chronique.
© Dr. Heidi B. Kellihan
(b) Coupe parasternale droite grand axe des valvules mitrale et tricuspide (en systole). Les flèches indiquent un épaississement et un prolapsus du feuillet septal de la valvule tricuspide. L’astérisque montre un segment prolabé de la valvule mitrale sur le feuillet antérieur.
© Dr. Heidi B. Kellihan
(c) Coupe parasternale droite grand axe de la valvule mitrale (en télédiastole). La flèche désigne un segment prolabé du feuillet antérieur de la valvule mitrale.
© Dr. Rebecca L. Stepien
(d) Coupe parasternale droite grand axe de la valvule mitrale (en systole). La flèche indique un segment flottant (« flail ») du feuillet antérieur de la valvule mitrale.
© Dr. Rebecca L. Stepien
La détermination du degré de sévérité des modifications valvulaires peut tenir compte du degré de remaniement anatomique de la valvule, de la présence ou de l’absence de prolapsus mitral et de valvule flottante, du diamètre du jet mitral au Doppler couleur (notamment à son origine) et de la présence d’une dilatation atriale gauche [4]. En cas de MVD tricuspidienne, le feuillet septal apparaît souvent plus modifié que le feuillet mural, avec des modifications similaires à celles de la valvule mitrale (épaississement, hyperéchogénicité, prolapsus, Figure 3b). Comme pour la valvule mitrale, l’observation d’une dilatation atriale droite indique généralement une régurgitation tricuspidienne plus sévère.


Figure 4.
(a) Coupe parasternale droite grand axe optimisée pour la chambre de remplissage du ventricule gauche (en systole). Les petites flèches désignent les feuillets de la valvule mitrale. Le jet de couleur observé dans l’atrium gauche pendant la systole indique la présence d’une régurgitation mitrale. LA : atrium gauche, LV : ventricule gauche.
© Dr. Rebecca L. Stepien
(b) Coupe parasternale apicale gauche grand axe optimisée pour la chambre de remplissage du ventricule gauche (en systole). La flèche indique l’endroit où la largeur du jet de régurgitation mitrale peut être évaluée pour en estimer la sévérité. LA : atrium gauche, LV : ventricule gauche, IVS : septum interventriculaire, RA : atrium droit.
© Dr. Rebecca L. Stepien
Autres observations échocardiographiques
Un remodelage cardiaque secondaire à la régurgitation atrio-ventriculaire chronique est couramment observé et son degré dépend de la sévérité de la fuite. Lors de régurgitation mitrale modérée à sévère, l’atrium gauche se dilate progressivement. Le ventricule gauche se dilate également et devient plus sphérique (hypertrophie excentrique, Figure 3a). Au début, la paroi libre du ventricule gauche peut être légèrement épaissie, mais à terme, quand le ventricule finit par être dilaté, la paroi libre ainsi que le septum interventriculaire peuvent s’amincir. La régurgitation tricuspidienne modérée à sévère entraîne des modifications similaires à droite (Figure 3b).
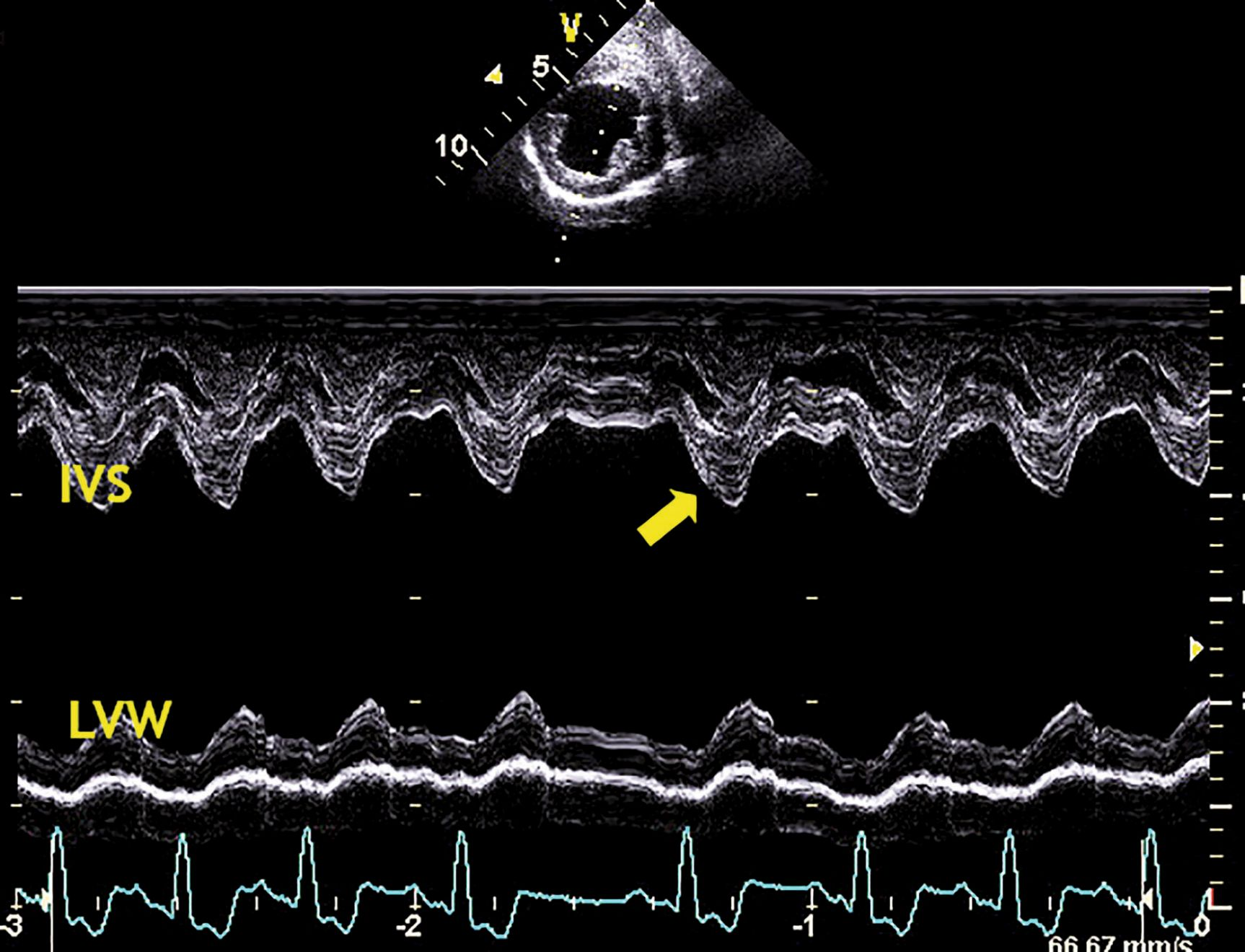
La fonction systolique, mesurée par la fraction de raccourcissement, peut paraître augmentée dans les stades modérés de régurgitation mitrale ; les connaissances actuelles ne permettent pas de dire s’il s’agit d’un artefact lié à la diminution de la postcharge ou d’une réelle amélioration de la fonction systolique (Figure 5). Au fur et à mesure de la progression de la MVD et de la dilatation du ventricule, la fraction de raccourcissement peut redevenir normale ; cela peut indiquer une insuffisance myocardique systolique débutante. La régurgitation mitrale sévère peut entraîner une hypertension pulmonaire secondaire, résultant de l’augmentation chronique de la pression sanguine dans l’atrium gauche. En présence d’une hypertension pulmonaire, l’atrium et le ventricule droits se dilatent et finissent par développer une insuffisance systolique (insuffisance cardiaque droite secondaire à une insuffisance cardiaque gauche).
Dr. Rebecca L. Stepien
Évaluation clinique
Les recommandations de l’ACVIM (Collège Américain de Médecine Interne Vétérinaire) pour la classification des cardiopathies chez le chien (Figure 6) offrent une bonne base de réflexion sur la MVD [5] et peuvent servir de référence à la fois pour son diagnostic et son traitement, les signes cliniques permettant d’établir le stade de la maladie et pouvant donc en orienter le traitement.
Approche des animaux à risque de MVD (Stade ACVIM A)
Il est couramment admis que les animaux à risque de MVD sont de race petite à moyenne et d’âge avancé, les mâles étant plus fréquemment touchés que les femelles. Il arrive de voir en consultation des races « à risque » à l’occasion de dépistages effectués en routine ou avant la mise à la reproduction. La population en stade A, c’est-à-dire les animaux jugés « à risque » d’après leur race ou type de race mais ne présentant aucune anomalie cardiaque à l’examen clinique, ne nécessite aucun traitement. Toutefois, les propriétaires ou les éleveurs doivent être informés du risque futur de MVD et des signes cliniques pouvant indiquer le développement de la maladie cardiaque ou d’une insuffisance cardiaque congestive (toux, augmentation de la fréquence ou de l’effort respiratoire, signes de fatigue, par exemple). Chez ces animaux, un examen clinique annuel avec auscultation minutieuse est particulièrement recommandé pour une détection précoce des souffles cardiaques pouvant traduire l’apparition de la MVD.
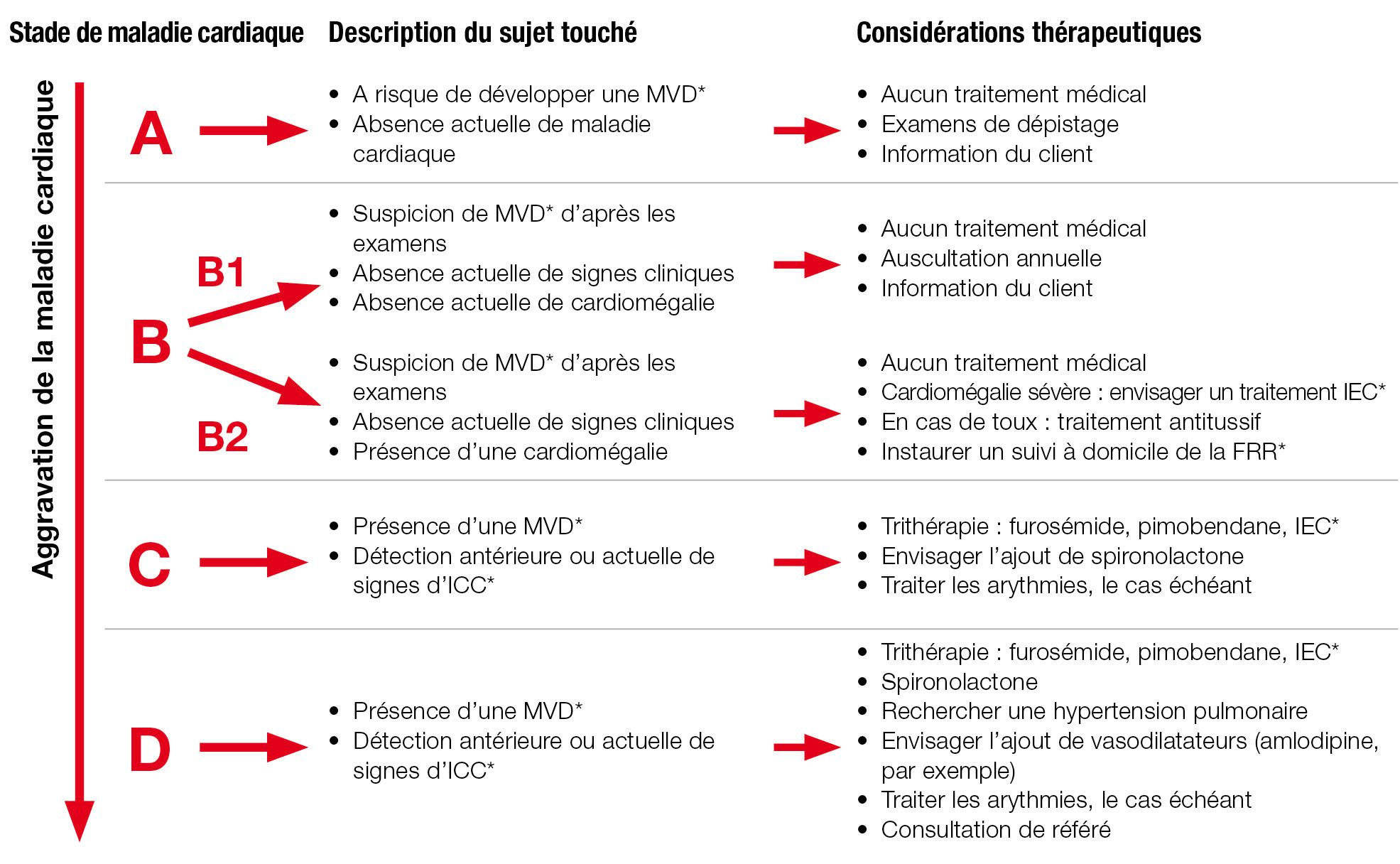
*MVD : maladie valvulaire dgnrative ; IEC : inhibiteur de lenzyme de conversion de langiotensine ; ICC : insuffisance cardiaque congestive ; FRR : frquence respiratoire au repos
Approche des cas avec souffle cardiaque mais sans signe clinique (Stade ACVIM B1 ou B2)
Anamnèse
Les chiens atteints de MVD peuvent présenter des anomalies détectables à l’auscultation (souffles systoliques, généralement) pendant 3 à 5 ans avant l’apparition de signes cliniques. Pendant cette phase préclinique, l’animal ne présente généralement ni toux, ni difficulté respiratoire, ni syncope, ni fatigue, et ces souffles sont détectés à l’occasion d’un examen clinique de routine. Parfois en fin de phase préclinique, des bruits de galop ou des arythmies (rythme cardiaque irrégulier associé à un déficit pulsatile) sont détectés. Le pouls est généralement normal. En cas de maladie des voies aériennes associée (trachéobronchite chronique ou bronchomalacie, par exemple), une toux sèche non productive peut se développer du fait de la compression de la bronche souche gauche par l’atrium gauche dilaté. Chez un chien à suspicion de régurgitation mitrale, la présence d’une toux paroxystique sèche non productive sans modification associée de la fréquence ou de l’effort respiratoire évoque généralement davantage une cardiomégalie qu’une ICC.
Examen clinique
La détection initiale de la MVD se fait le plus souvent par l’identification d’un souffle cardiaque à l’occasion d’un examen clinique de routine. Dans les premiers stades de MVD (stade B1 ou B2), la fréquence cardiaque est normale et il existe un rythme régulier voire une arythmie sinusale. Le souffle de régurgitation mitrale est généralement plus audible au niveau de l’apex gauche du cœur (là où le battement cardiaque est palpable) et il est systolique — confirmé par le synchronisme entre le souffle et le pouls fémoral. Les souffles sont classés par grades, de 1 à 6 chez le chien, où 1 et 2 correspondent à des souffles légers, 3 et 4 à des souffles d’intensité modérée et 5 et 6 aux souffles les plus intenses. Les souffles de grade 5 ou 6 s’accompagnent d’un « thrill » (frémissement) systolique palpable au niveau de la zone d’intensité maximale du souffle. Lors de MVD, l’intensité du souffle est corrélée à la sévérité de la régurgitation, les souffles de grades 4 à 6 correspondant aux stades plus sévères de la maladie. Dans le cas de la régurgitation tricuspidienne, un souffle systolique peut être décelé avec un point d’intensité maximale au niveau de l’apex droit du cœur (en région du 4e espace intercostal droit). En cas de régurgitation à la fois mitrale et tricuspidienne, il peut être difficile de distinguer le souffle de régurgitation tricuspidienne du souffle mitral projeté. La présence d’un pouls jugulaire synchrone avec les battements cardiaques corrobore le diagnostic de régurgitation tricuspidienne hémodynamiquement significative.
Il est possible de proposer au client des examens diagnostiques dans les premiers stades de MVD afin de confirmer le diagnostic, de déterminer la sévérité de la maladie et de recueillir une base de données (biochimie sérique, par exemple) pouvant servir de référence pour des comparaisons ultérieures ou permettant de vérifier que les fonctions organiques sont normales si un traitement est envisagé.
Radiographie
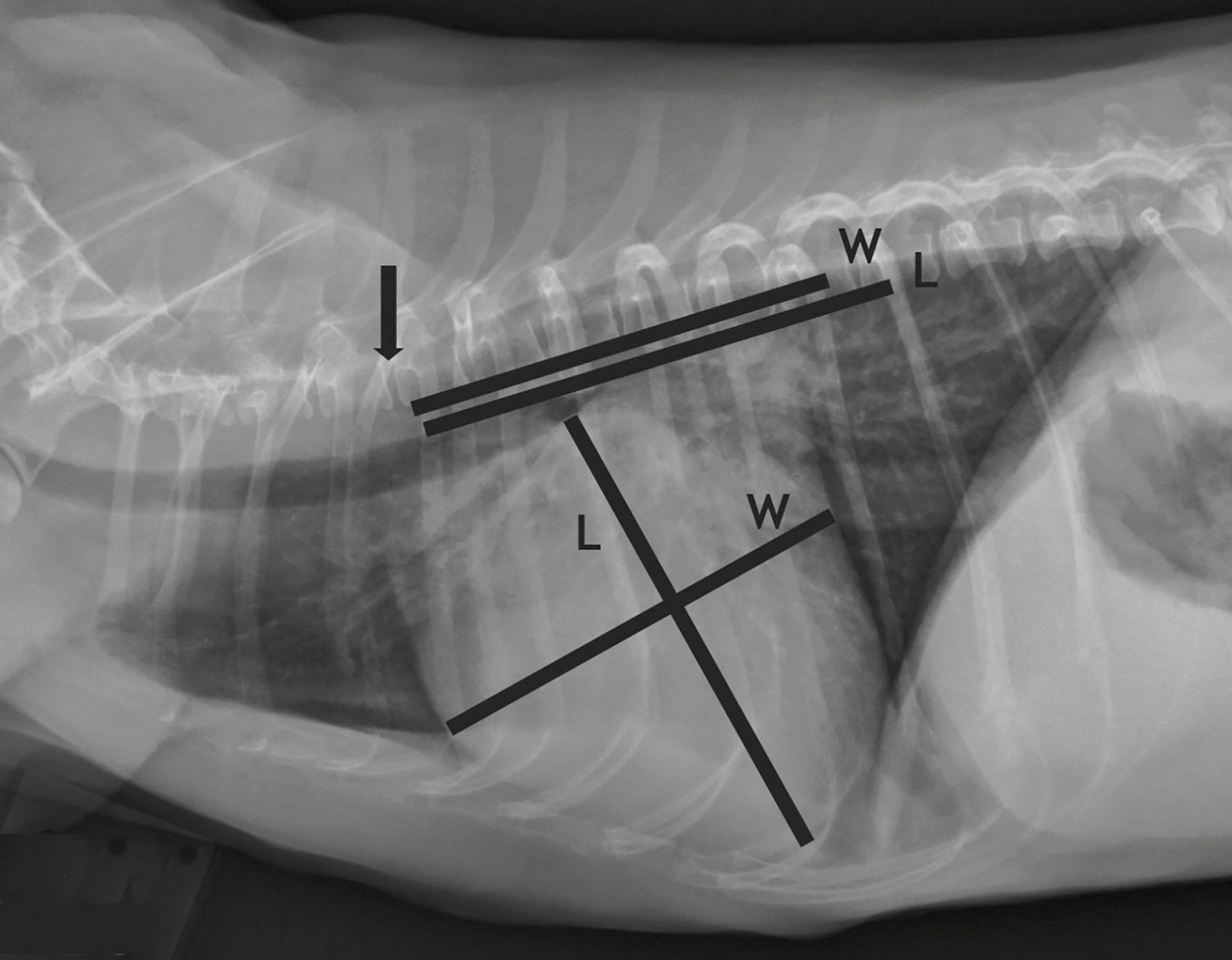
La radiographie thoracique est un élément essentiel de l’évaluation de l’animal, qui permet de déterminer la taille du cœur par le calcul du VHS (Vertebral Heart Score) ([6], Figure 7) et d’explorer les vaisseaux et le parenchyme pulmonaires à la recherche d’un œdème pulmonaire et de dilatations vasculaires caractéristiques de l’ICC. Chez l’animal asymptomatique, le suivi de la taille du cœur peut permettre d’estimer le risque de développement à court terme d’une ICC ; un VHS > 12 ou une augmentation du VHS entre deux visites de plus de 0,7 unités/mois environ indique une ICC imminente [7],[8]. En outre, la radiographie initiale peut révéler un cœur de taille normale (stade B1) ou une cardiomégalie (stade B2) qui peut être légère à sévère. En connaissant le degré de cardiomégalie, le vétérinaire pourra expliquer au client comment surveiller son animal afin de détecter les premiers signes d’ICC. Les animaux en stade B1 peuvent rester asymptomatiques pendant 2 à 4 ans, alors que ceux ayant déjà un certain degré de cardiomégalie peuvent développer des signes cliniques d’ICC plus rapidement. Le pronostic des cas de MVD asymptomatiques est assez optimiste ; dans une étude, 70 % des chiens en stade préclinique étaient encore vivants 6 ans plus tard [9].
University of Wisconsin
Échocardiographie
L’échocardiographie n’est pas requise pour établir un diagnostic provisoire de MVD débutante si le signalement et les résultats de l’examen clinique de l’animal asymptomatique sont compatibles avec une régurgitation mitrale et/ou tricuspidienne. Cet examen permet toutefois, lors de la détection initiale d’un souffle, de confirmer ce diagnostic présomptif. En outre, chez les chiens également à risque de cardiomyopathie dilatée occulte (grandes races, par exemple), l’échocardiographie est l’examen de choix pour différencier ces entités. Enfin, en présence d’observations cliniques inattendues (arythmie sans autre signe clinique, par exemple), cette technique peut fournir de précieuses informations complémentaires.
Autres examens diagnostiques
Le dosage des biomarqueurs, notamment celui du NT-proBNP, a été évalué dans de tels cas et pourrait s’avérer utile pour identifier les chiens particulièrement à risque de développer une ICC dans les 12 mois à venir [8] ; actuellement, cet examen n’est pas considéré comme diagnostique de la MVD préclinique mais il pourrait fournir des informations complémentaires [10]. D’autres examens peuvent être recommandés au cas par cas en fonction des résultats de l’examen clinique (ECG en cas d’arythmie détectée, par exemple) ou des maladies concomitantes diagnostiquées (mesure de la pression artérielle en cas de maladie rénale, par exemple).
Suivi
Face à un diagnostic de MVD de stade B2, il est utile d’expliquer la notion de suivi à domicile de la fréquence respiratoire au repos (FRR) (Tableau 1) ; il peut être conseillé aux propriétaires de réaliser ce suivi chez leur animal et de contacter leur vétérinaire si la fréquence observée dépasse les normes de référence (< 25 respirations par minute) [11].
Tableau 1. Le suivi à domicile de la FRR permet au propriétaire de détecter les problèmes de manière précoce et au vétérinaire d’évaluer l’efficacité du traitement. Les informations suivantes peuvent être utiles.
|
|
|
|
Approche des cas de MVD avec signes cliniques d’ICC (Stade ACVIM C ou D)
Anamnèse
Chez les chiens souffrant de MVD avec ICC associée, un souffle cardiaque peut avoir été détecté depuis un moment sans qu’aucun signe n’ait jamais été observé jusqu’à l’expression clinique de l’ICC. D’autres chiens souffrant de régurgitation mitrale peuvent avoir déjà présenté une toux sèche sans que leur qualité de vie n’en ait été dégradée. Des commémoratifs récents d’anomalies respiratoires (augmentation de la fréquence et de l’effort), de fatigue ou fatigabilité accrue à l’effort ou (rarement) de syncope, d’intensité variable et associés ou non, doivent faire suspecter une ICC. Des signes généraux de maladie systémique, incluant perte de poids et changements de comportement (animal moins joueur ou plus calme), peuvent également être présents. Notons que les cas de MVD ayant déjà présenté un épisode d’ICC sont toujours considérés en Stade C car un traitement est nécessaire pour maintenir l’état de compensation.
Examen clinique
Lors d’ICC déclarée (stade C ou D), un souffle cardiaque est toujours détectable, comme dans les premiers stades de la maladie, mais d’autres signes cliniques, traduisant une baisse du débit cardiaque ou une rétention hydrique, viennent s’ajouter. Chez les chiens en ICC gauche, un effort respiratoire accru et une toux peuvent s’observer, en raison de l’œdème pulmonaire. Lors d’ICC sévère, l’animal peut présenter une cyanose et une toux avec expectoration mousseuse blanche teintée de sang. Les bruits pulmonaires sont généralement anormaux, allant de bruits respiratoires augmentés jusqu’à des crépitements pulmonaires bien audibles, suggérant la présence d’une accumulation liquidienne alvéolaire. Une ascite et une dilatation des veines jugulaires indiquent généralement une ICC droite, pouvant être due à une MVD tricuspidienne, une hypertension pulmonaire secondaire à une cardiopathie gauche, ou les deux à la fois. Des arythmies peuvent accompagner les MVD sévères avec ICC associée ou non. Les arythmies courantes habituellement attribuées à la présence d’une dilatation atriale sévère incluent les extrasystoles atriales, la tachycardie atriale et la fibrillation atriale. Plus rarement, les animaux atteints de MVD peuvent développer une ectopie ventriculaire.
Une fois la suspicion d’ICC établie chez un animal présentant un souffle cardiaque compatible avec une MVD, d’autres examens doivent être réalisés pour estimer la sévérité de l’insuffisance cardiaque et établir le plan de traitement optimal. De manière générale, la radiographie thoracique renseigne sur la présence/l’absence/la sévérité de l’ICC, alors que l’échocardiographie renseigne davantage sur la cause sous-jacente et le développement de complications comme l’hypertension pulmonaire.
Radiographie
L’évaluation initiale de la taille du cœur associée à l’observation de signes radiographiques d’insuffisance cardiaque gauche (œdème pulmonaire interstitiel ou alvéolaire en présence d’une dilatation atriale gauche et d’une dilatation de la veine pulmonaire) chez un animal développant des signes cliniques permet d’établir le diagnostic d’ICC et sert de référence pour des comparaisons ultérieures une fois l’animal sous traitement (Figure 8). Chez les animaux présentant des signes cliniques d’ICC droite (ascite notamment), la radiographie permet de détecter un éventuel épanchement pleural et également d’évaluer les structures cardiaques droites (dont les artères pulmonaires) à la recherche de signes d’hypertension pulmonaire. Quand l’insuffisance cardiaque gauche a abouti au développement d’une hypertension pulmonaire et d’une insuffisance cardiaque droite consécutive, une cardiomégalie globale (droite et gauche) peut être visible. Les radiographies répétées sont précieuses pour évaluer l’efficacité du traitement aussi bien que pour suivre l’évolution de l’ICC.


Figure 8. Radiographies thoraciques en incidence latérale gauche chez un chien souffrant de MVD de stade C.
(a) Cliché réalisé en consultation d’urgence ; notez la cardiomégalie marquée et les densifications pulmonaires sévères formées d’opacités alvéolaires cotonneuses correspondant à un œdème pulmonaire aigu (flèches).
© University of Wisconsin
(b) Le même animal après un traitement de 48 heures associant furosémide et oxygène. Les densifications pulmonaires ont disparu. Notez la compression de la bronche souche gauche par l’atrium gauche très dilaté (flèche).
© University of Wisconsin
Échocardiographie
La réalisation d’une échocardiographie au moment du diagnostic de l’ICC (une fois l’animal stabilisé) permet d’ajouter des informations utiles au dossier médical. En l’absence d’échocardiographie antérieure, ce premier examen permet d’établir le diagnostic anatomique et fonctionnel précis de la MVD et sert à estimer la sévérité de la maladie et à détecter d’éventuelles complications de type hypertension pulmonaire, rupture des cordages tendineux ou rupture atriale gauche. Pour les cas de MVD, l’échocardiographie sert plus souvent d’outil diagnostique à certains moments spécifiques, que d’outil de suivi de l’insuffisance cardiaque.
Biomarqueurs
Le dosage du NT-proBNP sérique peut être utile pour établir un diagnostic d’ICC chez le chien souffrant de MVD diagnostiquée avec détresse respiratoire associée, quand la cause de cette dernière n’est pas claire (ICC ou maladie respiratoire). Même si les études montrent une certaine variabilité des valeurs seuils, une concentration de NT-proBNP élevée (> 1000 pmol/L environ, par exemple) évoque une ICC comme cause de la dyspnée, alors qu’une concentration normale suggère une cause respiratoire [12]. Dans tous les cas, le dosage du NT-proBNP doit être considéré comme un test à valeur indicative plutôt que diagnostique [10].
Traitement des cas de MVD canine
Cardiopathie de stade ACVIM A
Comme nous l’avons déjà indiqué, les animaux à risque de MVD qui ne présentent pas de signes cliniques ne nécessitent aucun traitement spécifique, et aucun médicament n’a démontré qu’il pouvait prévenir ou retarder le développement de la maladie chez ces animaux. Chaque examen clinique doit être l’occasion de rechercher des signes de MVD (souffle systolique, par exemple) et de discuter des risques.
Cardiopathie de stade ACVIM B1
Comme les animaux en stade A, ceux en stade B1 ne nécessitent aucun traitement spécifique, mais il sera encore plus essentiel d’informer les propriétaires, la maladie étant déjà présente, et ce sera le bon moment pour optimiser le poids et la condition physique de l’animal si besoin était. Le fait de discuter alimentation et exercice avec les propriétaires, et de les alerter des signes probables de MVD, les encouragera à mieux prendre en charge et à mieux observer leur animal.
Cardiopathie de stade ACVIM B2
Au fur et à mesure de la progression de la MVD, une cardiomégalie se développe et progresse à un rythme variable, particulier à chaque chien. En début de stade B2, une cardiomégalie est détectable à la radiographie ou l’échocardiographie, mais n’est pas nécessairement sévère. La majorité des cardiologues ne recommandent aucun traitement spécifique à ce stade.
Quand la cardiomégalie s’aggrave, les recommandations thérapeutiques commencent à diverger. Les facteurs importants à prendre en compte sont le degré de cardiomégalie et les autres signes radiographiques, et la présence ou l’absence de toux liée à la compression de la bronche souche avec ou sans anomalies sous-jacentes des voies respiratoires supérieures. Lorsque la cardiomégalie est sévère et qu’il y a un risque d’ICC à court terme, l’auteur recommande habituellement d’instaurer un traitement IEC (inhibiteur de l’enzyme de conversion de l’angiotensine) [13]. Chez les animaux présentant une toux liée à la cardiomégalie, il est possible d’administrer un traitement IEC, un traitement antitussif (butorphanol, par exemple) ou les deux à la fois. Il n’existe actuellement aucune preuve de l’intérêt de l’utilisation systématique de pimobendane à ce stade.
Cardiopathie de stade ACVIM C (ICC)
Le diagnostic d’une ICC chez un chien atteint de MVD est généralement l’occasion de commencer un traitement spécifique de l’ICC. Le traitement d’urgence de l’animal en détresse respiratoire est légèrement différent du traitement chronique de l’ICC (voir ci-dessous). La majorité des traitements de l’ICC sont administrés à vie, même si le nombre et la nature des produits utilisés, ainsi que leur posologie, peuvent évoluer avec le temps.
ICC aiguë
Les chiens souffrant d’ICC aiguë liée à une MVD arrivent généralement en détresse respiratoire. Une oxygénothérapie (cage à oxygène ou supplémentation en oxygène au masque, par exemple) doit être mise en place immédiatement tout en tentant d’établir le diagnostic préliminaire. Si l’anamnèse et l’examen clinique font suspecter une ICC, une radiographie thoracique pourra mettre en évidence une densité liquidienne évoquant un œdème pulmonaire, mais elle ne sera pas forcément réalisable si l’animal est instable.
Dans ce cas, une administration parentérale immédiate de furosémide pourra être salvatrice. Les chiens capables de tolérer un traitement par voie orale pourront recevoir du pimobendane dès que possible. Une forme injectable de pimobendane, à administrer par voie intraveineuse, est disponible dans certains pays et pourrait être une bonne alternative pour les chiens incapables de supporter un traitement oral. Une fois la première dose de furosémide administrée, l’animal devra être observé avec un minimum de manipulation jusqu’à l’amélioration de la fréquence et de l’effort respiratoires. Une seconde dose parentérale de furosémide pourra être administrée si aucune miction n’est observée dans les 30 à 60 minutes suivant la première injection. Chez les sujets très anxieux, il est possible d’administrer des petites doses de butorphanol en SC ou IM pour obtenir une très légère sédation. En cas d’ascite importante avec inconfort associé, une abdominocentèse pourra être réalisée pour diminuer la pression sur le diaphragme susceptible de limiter la ventilation. Certains chiens développeront une hypotension après ponction totale de l’ascite ; la ponction de 75 % du liquide d’ascite environ est généralement bien tolérée. Un repos en cage avec limitation des mouvements et supplémentation en oxygène est recommandé jusqu’à ce que l’œdème pulmonaire aigu soit résorbé.
Traitement chronique de l’ICC
Une fois son état amélioré au point de ne plus nécessiter d’oxygénothérapie, l’animal pourra être rendu à son propriétaire avec un traitement à administrer par voie orale ; plusieurs médicaments ont montré un bénéfice sur la survie [14],[15],[16],[17]. Le traitement initial de l’ICC gauche consiste en une « trithérapie » (furosémide, pimobendane et IEC), avec spironolactone ajoutée de manière chronique dans de nombreux cas. Parmi ces médicaments, le furosémide et le pimobendane doivent être administrés en premier, et ils sont essentiels au traitement précoce de l’œdème pulmonaire dû à une ICC gauche. Une fois l’animal réhydraté (confirmé par le retour de l’appétit), un IEC pourra être administré sans danger. Les sujets déshydratés peuvent développer une azotémie pré-rénale sous IEC ; dans ce cas, l’IEC devra être arrêté pendant la réhydratation, puis repris une fois l’animal stabilisé. Comme les ICE, la spironolactone est davantage considérée comme un traitement de l’ICC chronique que de l’ICC aiguë. L’administration de spironolactone comme inhibiteur neurohormonal en début d’ICC chronique permet de diminuer la rétention hydrosodée et peut améliorer la survie [17]. Une fois l’animal stabilisé à son domicile, un retour progressif à une activité physique normale pourra être envisagé, bien qu’un effort intense (long jeu de balle, compétition sportive, par exemple) puisse ne pas être toléré.
Cardiopathie de stade ACVIM D (ICC réfractaire)
Un animal atteint de MVD qui s’est stabilisé sous traitement chronique peut devenir à terme réfractaire au traitement. Cela peut se traduire par une récidive d’insuffisance cardiaque malgré un traitement stable, ou par une résolution incomplète de l’insuffisance cardiaque sous trithérapie. Les propriétaires doivent être scrupuleusement interrogés sur les posologies réellement administrées, en insistant sur tous les éventuels oublis accidentels d’administration. En outre, l’examen approfondi de l’animal peut révéler d’autres signes évocateurs d’une maladie systémique, d’une arythmie ou du développement de complications de type hypertension pulmonaire. Des anomalies métaboliques telles que la déshydratation ou l’hypokaliémie peuvent interférer avec le traitement de l’ICC. Les complications de type arythmie ou hypertension pulmonaire justifient des examens pour une évaluation diagnostique complète et, si nécessaire, un traitement spécifique. Si l’ICC récidive du fait de la progression de la MVD (les autres causes ayant été exclues), il peut être nécessaire d’ajouter des vasodilatateurs artériels par voie orale, comme l’amlodipine, pour soulager encore davantage le cœur gauche. Les animaux souffrant d’ICC sévère peuvent nécessiter une hospitalisation courte avec apport d’oxygène et administration parentérale temporaire d’inotropes comme la dobutamine. Il peut être bénéfique de consulter, ou d’en référer à un spécialiste pour la prise en charge de ces cas. Un consensus a été publié sur le diagnostic et le traitement de la MVD canine [5] ; le Tableau 2 dresse la liste des médicaments couramment utilisés, avec leurs indications et leur posologie, et il existe des fiches pratiques consultables sur internet*.
* https://cardiaceducationgroup.org/resource/formularies/
Tableau 2. Posologie des médicaments utilisés pour le traitement aigu ou chronique de la MVD chez le chien.
| Molécule | Indications (stade ACVIM) | Actions lors de MVD | Posologie |
|---|---|---|---|
| Furosémide | Stage C/D | Stimulation de la diurèse en cas d’ICC aiguë ou chronique, réduction de l’œdème pulmonaire, de l’épanchement thoracique ou abdominal | Voie parentérale : 2 à 4 mg/kg toutes les 1 à 6 heures en IV/IM/SC. Voie orale : 1 à 6 mg/kg toutes les 8 à 12 heures jusqu’à une dose totale maximale de 12 mg/kg/j |
| Pimobendane | Stage C/D | Inotrope positif, vasodilatateur mixte en cas d’ICC aiguë ou chronique | Voie orale : 0,25 à 0,3 mg/kg toutes les 12 heures |
| Bénazépril | Stage B2 Stage C/D | Réduction de la précharge et de la postcharge, réduction de la rétention hydrosodée en cas d’ICC aiguë ou chronique | Voie orale : 0,25 à 0,5 mg/kg toutes les 12 à 24 heures |
| Énalapril | Stage B2 Stage C/D | Réduction de la précharge et de la postcharge, réduction de la rétention hydrosodée en cas d’ICC aiguë ou chronique | Voie orale : 0,25 à 0,5 mg/kg toutes les 12 heures |
| Spironolactone | Stage C/D | Réduction de la rétention hydrosodée en cas d’ICC chronique | Voie orale : 1 à 2 mg/kg toutes les 12 heures ou 2 mg/kg toutes les 24 heures |
| Amlodipine | Stage C/D | Réduction de la postcharge lors d’ICC de stade D |
Voie orale : 0,1 à 0,2 mg/kg toutes les 12 heures ou 0,2 à 0,4 mg/kg toutes les 24 heures
|
| Butorphanol | Stade B2 contre la toux Stade C/D | Antitussif, anxiolytique lors d’ICC aiguë | Voie parentérale : 0,1 à 0,5 mg/kg en IV/ IM/SC. Voie orale : 0,5 à 1 mg/kg toutes les 4 à 6 heures |
Considérations nutritionnelles pour les cas de MVD
Les recommandations alimentaires en cas de MVD canine sont en constante évolution. Par le passé, une restriction alimentaire sévère en sodium et en protéines était couramment envisagée, mais des considérations plus récentes suggèrent qu’une alimentation riche en protéines de qualité et modérément restreinte en sodium, associée à une supplémentation en acides gras oméga-3, serait utile pour la prise en charge de la MVD. La supplémentation en acides gras oméga-3, administrée seule ou intégrée à un aliment préparé, aurait des effets bénéfiques chez le chien à la fois avant [18] et pendant [19] la phase d’insuffisance cardiaque clinique, probablement en raison des effets anti-inflammatoires et anti-cachectiques de ces acides gras essentiels [20]. La consommation d’un régime modérément réduit en sodium et enrichi en acides gras oméga-3 et en acides aminés tels que la taurine et la carnitine pourrait être bénéfique même en début de maladie valvulaire (stade B) avant le développement de l’insuffisance cardiaque congestive [18].
Pronostic de la MVD
L’évolution clinique de la MVD canine est impossible à prédire, surtout dans les premiers stades. Bien qu’il faille informer les clients sur cette maladie et ses possibles signes cliniques au moment de son diagnostic (détection d’un souffle, par exemple), il faut aussi leur dire que beaucoup de chiens atteints de MVD ne développeront jamais d’ICC. Cette maladie a tendance à progresser avec le temps, mais sa vitesse de progression est propre à chaque animal. Le délai jusqu’à l’apparition de l’ICC, si toutefois elle apparaît, est également lié à la précocité de détection de la maladie ; les animaux présentant de très légers souffles de régurgitation mitrale (grade ≤ 2/6) sans cardiomégalie associée restent asymptomatiques généralement plus longtemps que ceux montrant des souffles sonores (grade ≥ 4/6) ou une cardiomégalie au moment du diagnostic. Globalement, les chiens atteints de MVD préclinique peuvent rester indemnes de signes cliniques d’ICC pendant 2 à 4 ans [9],[21],[22].
Une fois l’ICC déclarée, la survie dépend du choix du traitement [14],[15], mais aussi d’autres facteurs. Les chiens ayant des propriétaires qui les surveillent étroitement et détectent rapidement les problèmes, ainsi que les chiens qui tolèrent bien leur traitement, auront tendance à avoir une survie plus longue et une meilleure qualité de vie. De manière générale, la survie estimée des chiens traités de manière optimale par trithérapie varie de 6 à 18 mois après l’apparition de l’ICC.
| Nous remercions le Dr Pierre Ménaut, Dip. ECVIM, pour sa relecture attentive de la version française de cet article. |
Rebecca L. Stepien
DVM, MS, Dip ACVIM (Cardiology), University of Wisconsin School of Veterinary Medicine, Madison, Wisconsin, USA
États-Unis
Le Dr Stepien est diplômée de la Faculté de médecine vétérinaire de l'Université du Wisconsin et a obtenu son master à l'Université d'État de l'Ohio. Elle est professeure clinicienne à l'Université du Wisconsin depuis 1994 et a été présidente de la spécialité de cardiologie de l'ACVIM. Ses recherches portent notamment sur la valvulopathie myxomateuse chez les whippets, l'hypertension artérielle systémique et le traitement de l'insuffisance cardiaque congestive.
Références
- Swenson L, Hggstrm J, Kvart C, et al. Relationship between parental cardiac status in Cavalier King Charles spaniels and prevalence and severity of chronic valvular disease in offspring. J. Am. Vet. Med. Assoc. 1996;208:2009-2012.
- Oyama MA. Using cardiac biomarkers in veterinary practice. Vet. Clin. North Am.: Small Anim. Pract. 2013;43:1261-1272.
- Rishniw M, Ljungvall I, Porciello F, et al. Sleeping respiratory rates in apparently healthy adult dogs. Res. Vet. Sci. 2012;93:965-969.
- Oyama MA, Rush JE, Rozanski EA, et al. Assessment of serum N-terminal pro-B-type natriuretic peptide concentration for differentiation of congestive heart failure from primary respiratory tract disease as the cause of respiratory signs in dogs. J. Am. Vet. Med. Assoc. 2009;235(11):1319-1325.
- Atkins CE, Brown WA, Coats JR, et al. Effects of long-term administration of enalapril on clinical indicators of renal function in dogs with compensated mitral regurgitation. J. Am. Vet. Med. Assoc. 2002;221(5):654-658.
- Hggstrm J, Boswood A, OGrady M, et al. Effect of pimobendan or benazepril hydrochloride on survival times in dogs with congestive heart failure caused by naturally occurring myxomatous mitral valve disease: The QUEST study. J. Vet. Int. Med. 2008;22(5):1124-1135.
- Ettinger SJ, Benitz AM, Ericsson GF. Effects of enalapril maleate on survival of dogs with naturally acquired heart failure. The Long-term Investigation of Veterinary Enalapril (LIVE) Study Group. J. Am. Vet. Med. Assoc. 1998;213:1573-1577.
- BENCH Study Group. The effect of benazepril on survival times and clinical signs of dogs with congestive heart failure: Results of a multicenter, prospective, randomized, double-blinded, placebo-controlled, long-term clinical trial. J. Vet. Cardiol. 1999;1(1):7-18.
- Bernay F, Bland JM, Hggstrm J, et al. Efficacy of spironolactone on survival in dogs with naturally occurring mitral regurgitation caused by myxomatous mitral valve disease. J. Vet. Int. Med. 2010;24(2):331-341.
- Freeman LM, Rush JE, Markwell PJ. Effects of dietary modification in dogs with early chronic valvular disease. J. Vet. Intern. Med. 2006;20(5):1116-1126.
- Freeman LM, Rush JE, Kehayias JJ, et al. Nutritional alterations and the effect of fish oil supplementation in dogs with heart failure. J. Vet. Intern. Med. 1998;12(6):440-448.
- Olsen LH, Fredholm M, Pedersen HD. Epidemiology and inheritance of mitral valve prolapse in Dachshunds. J. Vet. Int. Med. 1999;13(5):448-456.
- Freeman LM. Beneficial effects of omega-3 fatty acids in cardiovascular disease. J. Small. Anim. Pract. 2010;51(9):462-470.
- Atkins CE, Keene BW, Brown WA, et al. Results of the veterinary enalapril trial to prove reduction in onset of heart failure in dogs chronically treated with enalapril alone for compensated, naturally occurring mitral valve insufficiency. J. Am. Vet. Med. Assoc. 2007;231(7):1061-1069.
- Kvart C, Hggstrm J, Pedersen HD, et al. Efficacy of enalapril for prevention of congestive heart failure in dogs with myxomatous valve disease and asymptomatic mitral regurgitation. J. Vet. Int. Med. 2002;16(1):80-88.
- Fox PR. Pathology of myxomatous mitral valve disease in the dog. J. Vet. Cardiol. 2012;(14):103-126.
- Chetboul V, Tissier R. Echocardiographic assessment of canine degenerative mitral valve disease. J. Vet. Cardiol. 2012;(14):127-148.
- Atkins C, Bonagura J, Ettinger S, et al. Guidelines for the diagnosis and treatment of canine chronic valvular heart disease. J. Vet. Int. Med. 2009;23(6):1142-1150.
- Buchanan JW, Bcheler J. Vertebral scale system to measure canine heart size in radiographs. J. Am. Vet. Med. Assoc. 1995;20(2):194-199.
- Lord P, Hansson K, Kvart C, et al. Rate of change of heart size before congestive heart failure in dogs with mitral regurgitation. J. Small Anim. Pract. 2010;51(4):210-218.
- Reynolds CA, Brown DC, Rush JE, et al. Prediction of first onset of congestive heart failure in dogs with degenerative mitral valve disease: The PREDICT cohort study. J. Vet. Cardiol. 2012;14:193-202.
- Borgarelli M, Savarino P, Crosara S. Survival characteristics and prognostic variables of dogs with mitral regurgitation attributable to myxomatous valve disease. J. Vet. Cardiol. 2008;22:120-128.
Autres articles de ce numéro
Partager sur les réseaux sociaux