Les diarrhées de sevrage chez le chiot
Ecrit par Aurélien Grellet
Les maladies gastro-intestinales sont l’un des problèmes le plus fréquemment rapportés dans l’espèce canine, les chiots étant plus à risque de diarrhée que les chiens adultes.
Article

Points clés
Les diarrhées de sevrage sont un phénomène complexe d’origine multifactorielle. Différentes causes infectieuses et non infectieuses peuvent simultanément, et en synergie, altérer la santé du tube digestif.
Le parvovirus canin de type 2 est l’un des principaux agents impliqués dans les diarrhées de sevrage. Bien qu’il puisse provoquer des signes systémiques sévères, il peut aussi n’engendrer qu’une modification de la qualité des selles sans retentir sur l’état général.
La prévention des diarrhées de sevrage passe par une prophylaxie médicale et par la mise en œuvre de protocoles de gestion d’élevage visant à préserver la santé.
Introduction
Les maladies gastro-intestinales sont l’un des problèmes le plus fréquemment rapportés dans l’espèce canine [1] [2] [3], les chiots étant plus à risque de diarrhée que les chiens adultes. Environ 10 à 25 % des chiots développent des problèmes digestifs au cours de leur première année de vie [4] [5]. L’objectif de cet article est de présenter les facteurs pouvant altérer la santé digestive du chiot, et de discuter des conduites à tenir pour la gestion et la prévention de ce problème.
Le sevrage : une étape critique
Le sevrage est une étape critique pour le chiot. Au niveau digestif, le passage d’une alimentation lactée à une alimentation solide entraîne des modifications de l’architecture de la muqueuse digestive (augmentation de la profondeur des cryptes intestinales), du transport des nutriments, de l’activité enzymatique (diminution de l’activité des lactases et augmentation de l’activité des amylases et lipases) et de la flore digestive (diminution des bactéries aérobies). Le chiot traverse parallèlement une période de trou immunitaire au cours de laquelle il est réfractaire à la vaccination en raison de la persistance des anticorps maternels [6], mais sensible aux infections, notamment digestives. En outre, la séparation d’avec sa mère induit un stress considérable, pouvant retentir sur son métabolisme, son système immunitaire et sa fonction intestinale. Tous ces phénomènes peuvent expliquer la plus forte prévalence des diarrhées chez le chiot que chez l’adulte.Diarrhées de sevrage – les risques
Les diarrhées de sevrage sont à la fois un problème pour les chiots et un risque pour la santé publique. Les diarrhées peuvent réduire la croissance pondérale et augmenter les risques de mortalité [7], les troubles gastro-intestinaux représentant la première cause de mortalité chez les chiots de moins d’un an [8]. Il est donc nécessaire de traiter efficacement et rapidement tous les chiots présentant des troubles digestifs. En outre, les affections digestives représentent un risque pour la santé publique. En effet, certains des agents infectieux excrétés par les chiots diarrhéiques sont potentiellement zoonotiques, comme par exemple Giardia duodenalis et Toxocara canis [9]. Le rôle joué par le vétérinaire dans le traitement et la prévention de ces diarrhées est donc crucial.Définir une diarrhée
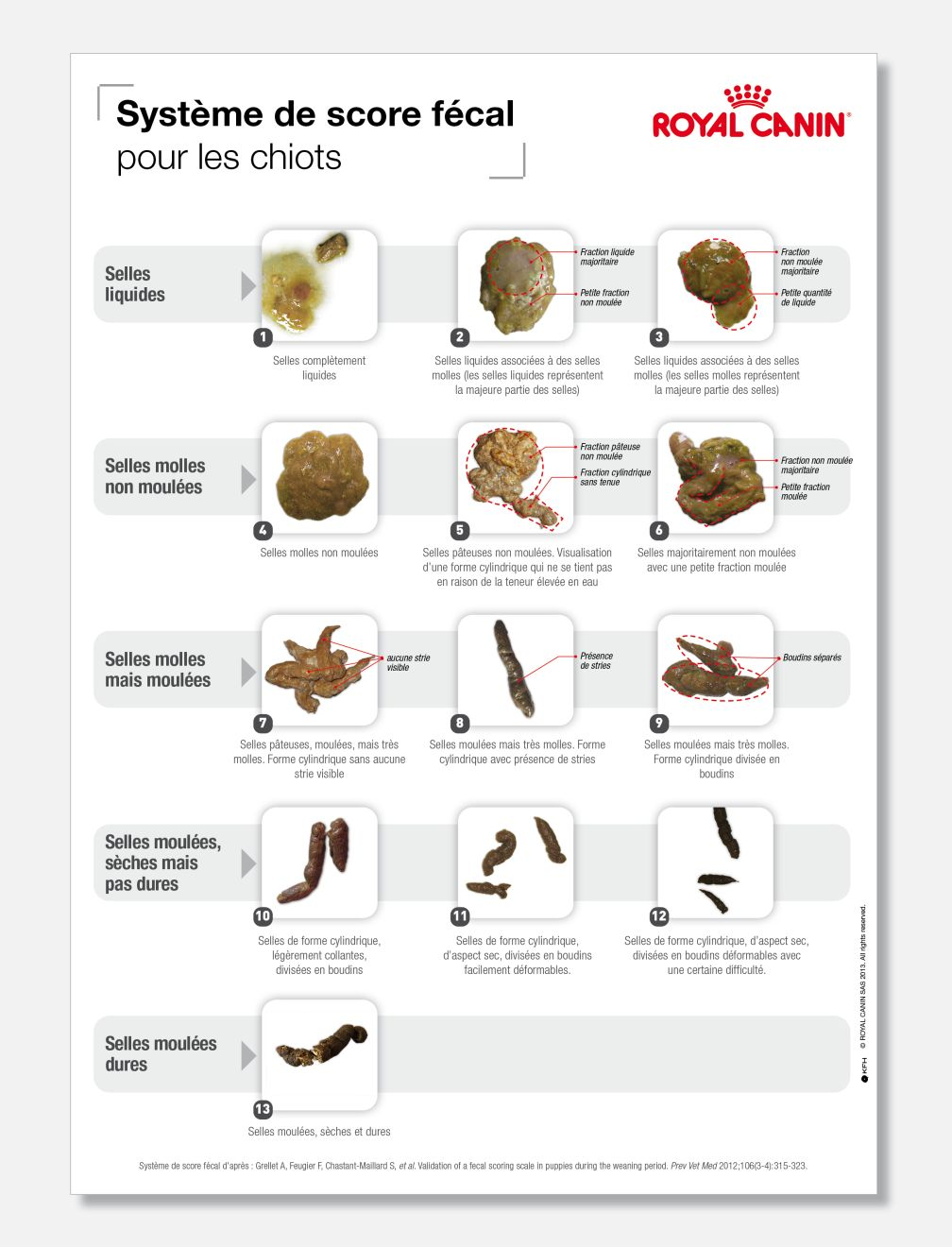
Au-delà d’une évaluation subjective de ce qui peut être qualifié de « selles molles », la première difficulté consiste déjà à définir ce qu’est une selle anormale. La qualité d’une selle de chiot peut s’évaluer en déterminant son score fécal sur une échelle visuelle à 13 points (Figure 1) où 1 = selles liquides et 13 = selles moulées et très sèches [7]. Cette échelle diffère de celle utilisée chez l’adulte. La définition d’un score fécal anormal doit tenir compte des variations physiologiques.
Une approche systémique du problème
Les diarrhées de sevrage sont un phénomène complexe pour plusieurs raisons. Premièrement, les chiots sont fréquemment infectés par différents agents infectieux (Tableau 1), mais la présence d’un entéropathogène n’est pas systématiquement associée à des problèmes digestifs. En effet, 18 à 54 % des chiens excrètent des parasites ou virus digestifs sans pour autant développer de signes cliniques [5] [10] [11].| Agents pathogènes | Age de la population étudiée | Nombre de chiots | Prévalence (%) |
| Parvovirus canin de type 2 | Entre 5 et 8 semaines | 266 | 14,7 |
| Coronavirus canin | Entre 5 et 8 semaines | 266 | 20,3 |
| Toxocara canis | Entre 5 et 8 semaines Variable* < 3 mois |
266 143 2661 |
22,2 12 12 |
| Cystoisospora ohioensis complex | Entre 5 et 8 semaines < 3 mois |
266 2661 |
25,6 15,6 |
| Cystoisospora canis | Entre 5 et 8 semaines < 3 mois |
266 2661 |
13,2 11,8 |
| Cystoisospora spp. | Variable* | 143 | 9 |
| Giardia duodenalis | Entre 5 et 8 semaines Variable* < 3 mois |
266 143 2661 |
41 34 37,5 |
| Cryptosporidium parvum | Entre 5 et 8 semaines | 266 | 25,9 |
* Chiots d’animalerie, donc d’âges différents
Deuxièmement, un même entéropathogène n’induit pas nécessairement les mêmes signes cliniques chez tous les chiots. La pathogénicité d’un agent infectieux et son impact clinique dépendent de l’âge et du statut immunitaire du chiot, ainsi que de la souche de l’entéropathogène [12] [13]. Par exemple, le parvovirus canin (CPV2) est classiquement décrit chez le chiot comme un agent de diarrhée entraînant des signes généraux sévères (vomissements, anorexie, prostration, déshydratation) et parfois même la mort. Chez certains chiots néanmoins, ce virus peut n’entraîner qu’une modification de la qualité des selles sans retentir sur l’état général de l’animal, ou même n’entraîner aucun signe clinique [5]. De même, le coronavirus peut engendrer une variété de signes cliniques, et une nouvelle souche du virus récemment identifiée (coronavirus pantropique) semble provoquer une maladie clinique bien plus sévère, voire létale dans certains cas. La coccidiose peut aussi engendrer des problèmes intestinaux, mais de degrés variables. Cystoisospora ohioensis complex peut entraîner des troubles digestifs chez des animaux très jeunes (âgés de moins de 7 jours), mais n’affecte pas les chiots au sevrage, tandis que C. canis induit essentiellement des signes cliniques sur les chiots en période de sevrage et plus particulièrement après un stress (adoption du chiot, par exemple) [14].
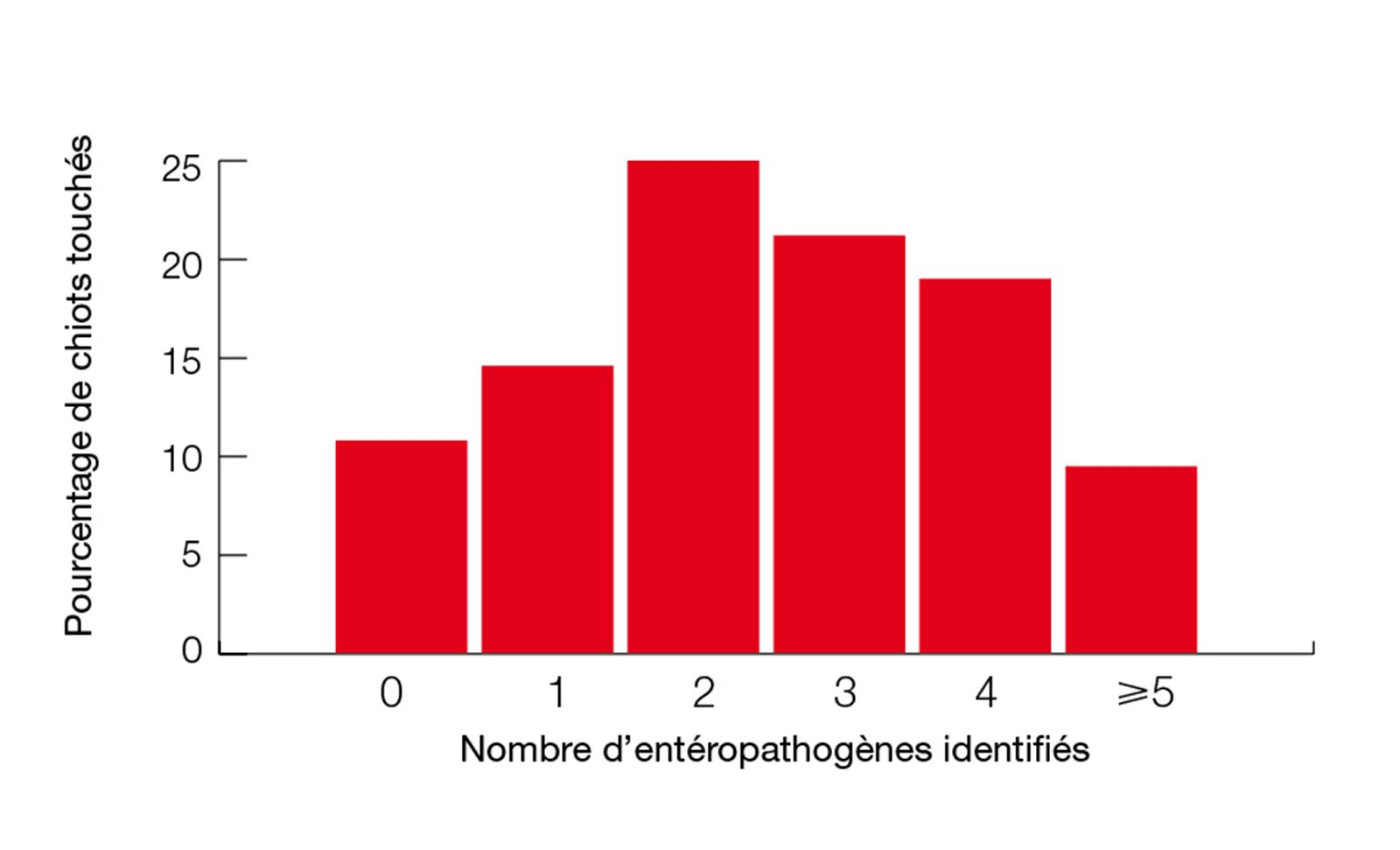
Troisièmement, les pluri-infections et les interactions entre entéropathogènes sont fréquentes. Une étude réalisée sur 316 chiots a révélé que 75 % d’entre eux étaient pluri-infectés (Figure 2) [5]. Certains de ces agents infectieux peuvent interagir et amplifier la sévérité des signes cliniques. Par exemple, le coronavirus aggrave les signes cliniques lors de co-infection avec le CPV2 [15].
Enfin, de nouveaux entéropathogènes sont régulièrement identifiés. Récemment, différents virus et parasites digestifs ont été isolés chez le chien (astrovirus [16], norovirus [17] ou trichomonadidés [18] [19], par exemple). Malgré leur forte prévalence chez le chiot (entre 5 et 23 % selon le pathogène et l’origine des animaux), leur implication dans les diarrhées de sevrage n’est pas clairement établie [16] [18] [20] et la majorité des études ayant recherché ces agents infectieux ne tiennent pas compte d’éventuelles co-infections.
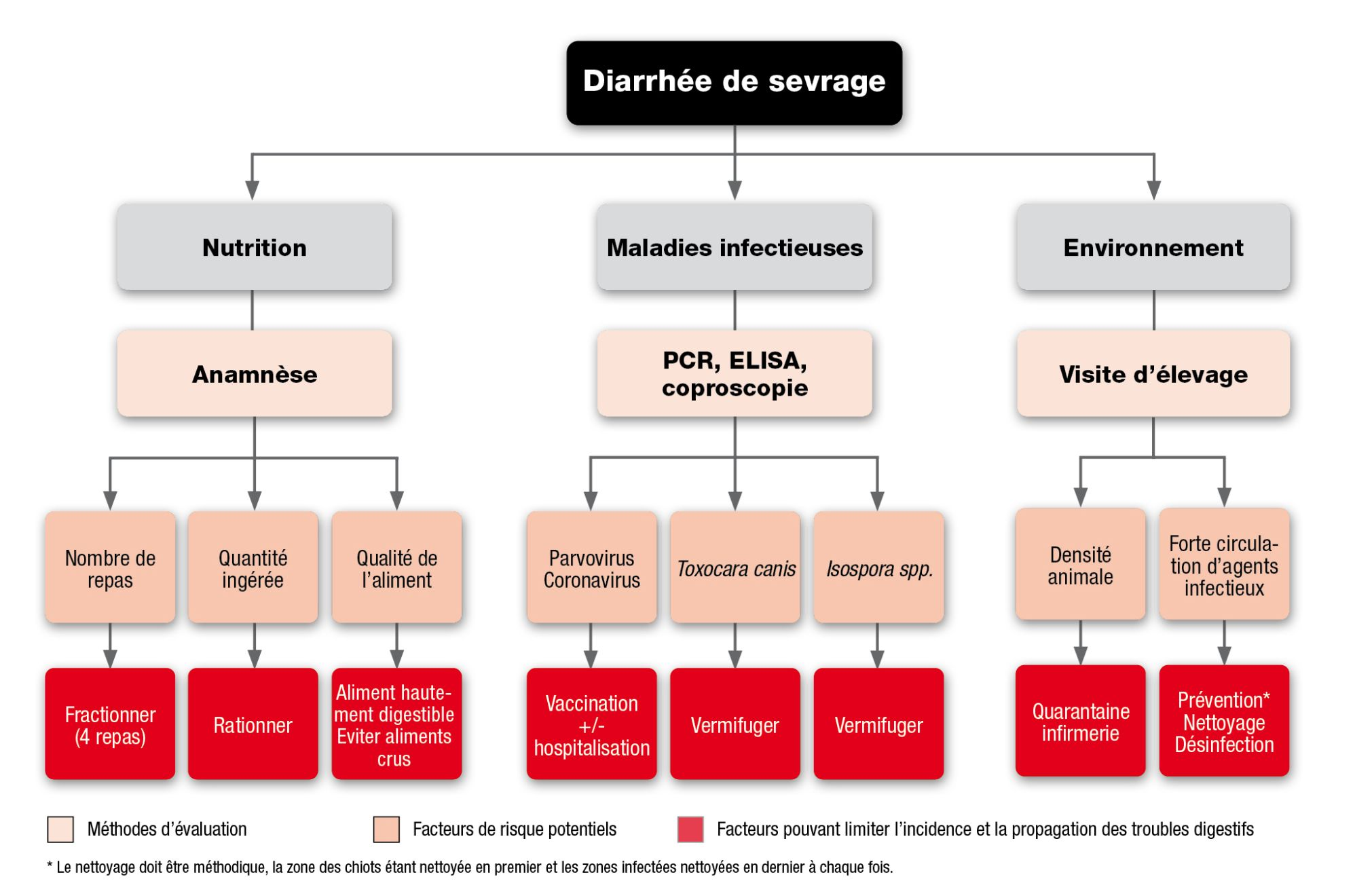
Contrairement à certains troubles qui peuvent être appréhendés de manière simple (un agent = une maladie), les diarrhées de sevrage constituent un phénomène biologique complexe nécessitant une approche dite systémique. Les diarrhées de sevrage sont essentiellement influencées par une triade incluant :
- L’hôte (âge, génétique et immunité digestive et systémique).
- Le pathogène (virulence, souche, dose).
- L’environnement (densité de population, stress, degré d’hygiène, température/humidité) et une approche multidisciplinaire est nécessaire, incluant l’évaluation de trois facteurs principaux : nutrition, entéropathogènes en cause et environnement (Figure 3).
Evaluation nutritionnelle
D’un point de vue nutritionnel, une anamnèse complète est nécessaire. Il est notamment important de questionner le propriétaire sur :
- Les aliments consommés, de manière à évaluer leur qualité (certains cas de diarrhée de sevrage sont liés à l’ingestion de viande crue contaminée par Salmonella enterica [23]).
- Le nombre de repas donnés (fractionner la ration alimentaire en 4 repas quotidiens peut permettre de diminuer les risques de diarrhée chez les jeunes chiots [5]).
- La quantité d’aliment distribué (éviter le surrationnement) et sa qualité (digestibilité élevée).
Evaluation des entéropathogènes
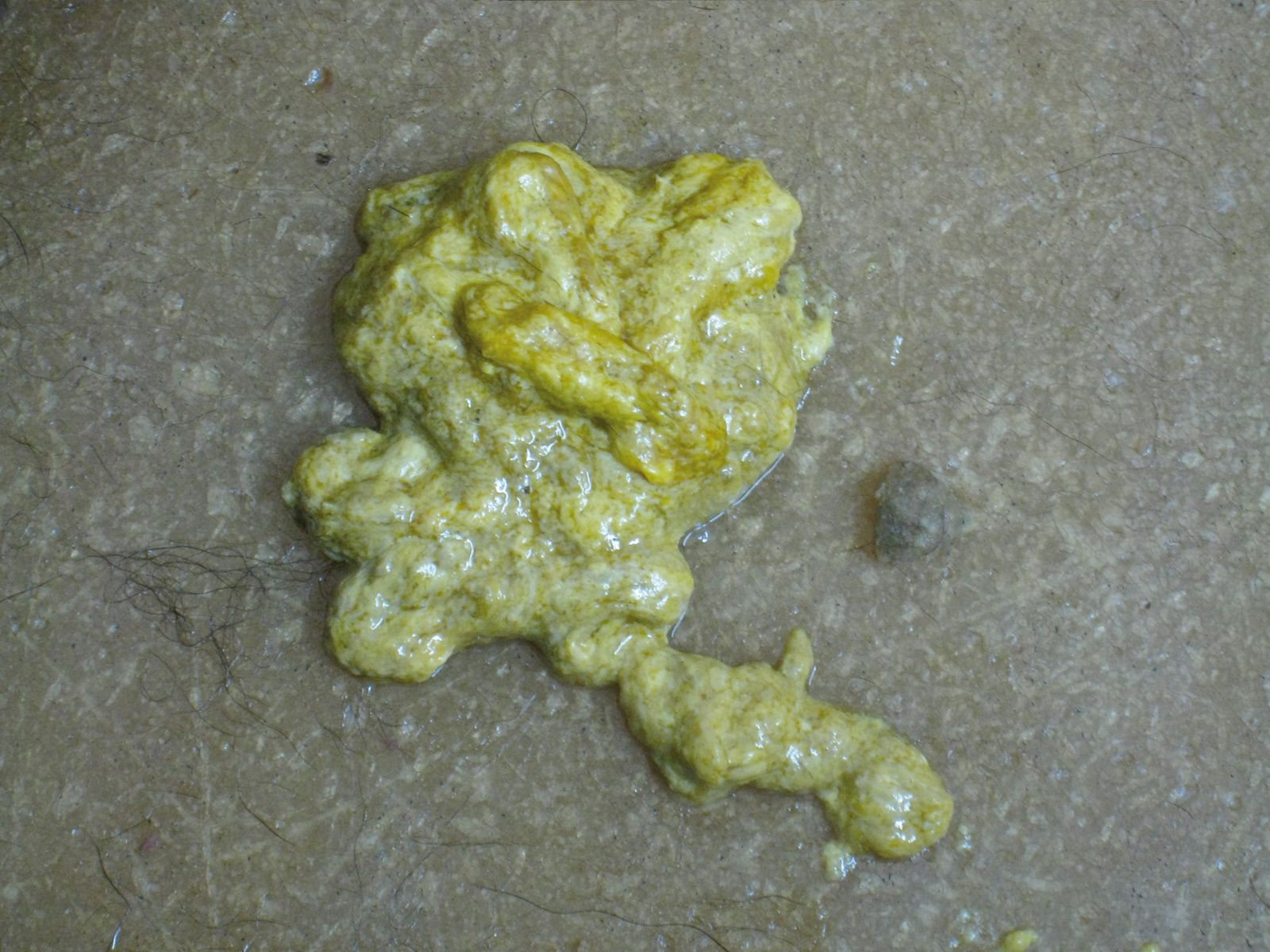
Il est également important de déterminer si l’animal excrète un ou plusieurs entéropathogènes et en quelle quantité. La couleur des selles de l’animal peut être un élément d’orientation des pathogènes responsables de la diarrhée. Par exemple, la giardiose provoque une atrophie partielle des villosités intestinales et une réduction de l’activité des disaccharidases, entraînant une diminution de la capacité d’absorption digestive et une stéatorrhée. Les selles peuvent prendre une coloration jaune (Figure 4) et de la coprophagie peut être observée (l’augmentation de la teneur en lipides des selles les rend plus appétentes). Des selles non moulées contenant du mucus et du sang orienteront davantage vers une coccidiose (Figure 5). Enfin, dans certains cas, il est possible de visualiser directement le parasite (Figure 6).


Ces différences d’aspect ne permettent cependant pas d’établir un diagnostic de certitude et des examens complémentaires sont nécessaires. Diverses options, incluant la coproscopie, les tests ELISA et PCR, sont utilisables en fonction des moyens du propriétaire, de l’expérience du vétérinaire et des suspicions cliniques. L’évaluation microscopique des selles est utile en cas de suspicion de parasitose, mais doit être réalisée à partir de selles fraîches et pas trop liquides (en particulier pour la recherche des protozoaires). En raison de l’élimination potentiellement intermittente de l’agent en cause, il est recommandé de répéter les examens sur 3 jours consécutifs car un seul examen négatif a peu de valeur. Si une portée ou un groupe de chiots est atteint(e), une coproscopie collective pourra être réalisée, limitant ainsi les risques de faux négatifs liés à la période prépatente et à l’excrétion parasitaire intermittente. Différents kits sont disponibles dans le commerce pour la recherche ciblée de parasites (Giardia spp., par exemple) et ils sont relativement peu coûteux, rapides et ne nécessitent pas de matériel spécifique. Cependant, ils ne permettent de rechercher qu’un seul agent infectieux à la fois, ce qui peut être limitant en cas de parasitoses multiples.
Le parvovirus (CPV2) devra toujours être suspecté lors de diarrhée de sevrage ou de mort subite chez le chiot, et il sera impératif de le rechercher quel que soit le statut vaccinal de l’animal. Les tests ELISA sont simples et rapides, et présentent une haute spécificité mais une sensibilité variable (18-82 % [24] [25] [26]) qui est liée à la charge virale excrétée. Des résultats faussement négatifs sont fréquents en cas de faible excrétion virale, et un résultat négatif ne permettra donc pas d’exclure une parvovirose. Il existe également un risque de résultat faussement positif si le test est réalisé quelques jours après la vaccination, bien que le résultat soit généralement plus faiblement positif que chez un animal atteint de parvovirose. La PCR en temps réel présente une sensibilité et une spécificité supérieures et constitue la méthode de choix pour le diagnostic de la parvovirose, car elle permet de distinguer une excrétion post-vaccinale (charge virale faible à très faible) d’une infection clinique (charge virale en général élevée à très élevée).
La culture bactérienne fécale présente peu d’intérêt pour l’évaluation des diarrhées de sevrage. En effet, les bactéries décrites comme agents de diarrhée sont fréquemment isolées chez des individus cliniquement sains. Toutefois, si une bactérie pathogène spécifique est suspectée, une culture sera possible pour certains agents (tels que Salmonella spp., Campylobacter jejuni, Clostridium perfringens, et C. difficile).
Face à des problèmes de diarrhée de sevrage chez un chiot issu d’un élevage, il sera particulièrement important d’effectuer une visite d’élevage. Notons que si un groupe de chiots est touché, tous les problèmes ne se résoudront pas nécessairement avec un seul traitement, et il est parfois plus payant de lutter contre les facteurs favorisants plutôt que contre le(s) agent(s) pathogène(s). Une visite d’élevage va donc permettre au vétérinaire d’appréhender l’élevage dans son ensemble, en s’intéressant notamment à :
- L’éleveur et ses méthodes d’élevage.
- Les animaux et leur environnement (structure du cheptel, logement, alimentation…).
- La conduite du cheptel (reproduction, élevage des jeunes).
- L’état sanitaire global.
En raison des nombreux facteurs influençant la santé digestive, une approche globale sera recommandée pour prendre en charge et traiter les diarrhées de sevrage. Les exemples suivants illustrent cette approche :
Situation 1 : chiot avec diarrhée sans atteinte de l’état général
Situation 2 : chiot avec diarrhée de sevrage associée à d’autres signes cliniques
Dans cette situation, les mesures citées ci-dessus devront être mises en place, mais l’animal devra également être hospitalisé. Le risque de déshydratation et d’hypovolémie est considérable, et une fluidothérapie (préférentiellement IV) est essentielle. En cas de diarrhée profuse, l’animal peut également présenter une hypoglycémie secondaire à une profonde malnutrition, un hypermétabolisme, une fonction hépatique inadéquate et/ou un sepsis. Chez les patients sévèrement atteints, un premier bolus IV d’une solution cristalloïde isotonique pourra être administré, suivi d’une perfusion. Le calcul du volume à administrer devra tenir compte du déficit liquidien du chiot, de ses besoins d’entretien et des pertes engendrées par les diarrhées et vomissements persistants. L’hypokaliémie est un risque ; même si l’animal présente une kaliémie normale le jour de l’hospitalisation, celle-ci devra être réévaluée quelques heures après le début de la fluidothérapie et corrigée si nécessaire. Notons que les solutés riches en potassium ne doivent pas être administrés en bolus et que la vitesse de perfusion du potassium ne devra pas dépasser 0,5 mEq/kg/h [28].
Dans cette situation, il sera important non seulement de gérer la diarrhée de sevrage chez ce chiot (voir ci-dessus) mais aussi de mettre en place des programmes pour éviter que le problème ne se répète sur d’autres animaux. Cela nécessite à la fois des mesures médicales et sanitaires.
Le protocole vaccinal dépend en partie de la situation individuelle. Si plusieurs animaux sont logés ensemble, le protocole devra être réajusté au besoin si une parvovirose est mise en évidence. Des études ont montré que l’utilisation d’un vaccin parvovirus monovalent à l’âge de 4 semaines entraînait une séroconversion au-dessus du seuil de protection chez 80 % des chiots [29], et la vaccination précoce systématique des chiots pourrait donc permettre de réduire l’impact de ce virus dans les élevages.
Nouvelles techniques d’évaluation de la santé digestive
Comme nous l’avons déjà vu, les diarrhées de sevrage résultent d’une interaction complexe hôte/pathogène/environnement. Des recherches récentes se sont intéressées à divers marqueurs digestifs et sanguins non invasifs afin d’évaluer comment certains facteurs (stress, agents infectieux, changement alimentaire, modification de la flore, par exemple) peuvent altérer la santé digestive. Des marqueurs de la perméabilité intestinale (inhibiteur de l’alpha1-protéinase), de l’inflammation intestinale (calprotectine et protéine S100A12), de la fonction entérocytaire (citrulline) et de l’immunité locale (immunoglobuline A) ont ainsi été évalués chez le chiot et les premiers résultats sont prometteurs. En effet, une modification de la concentration de ces marqueurs a été observée chez des chiots souffrant de problèmes digestifs (parvovirose notamment), mais ces résultats varient avec l’âge et/ou la race de l’animal. L’intérêt de ces marqueurs dans le diagnostic, le pronostic et le suivi des chiots souffrant de diarrhée de sevrage reste à déterminer, mais ils pourraient à l’avenir jouer un rôle significatif dans l’approche de ce problème.
Le microbiome digestif (flore intestinale) joue un rôle important dans la santé des individus en stimulant le système immunitaire, en influençant la structure du tube digestif, en participant aux défenses contre les principaux pathogènes et en apportant des bénéfices nutritionnels à l’hôte (comme la production d’acides gras à chaîne courte). L’étude de cette diversité bactérienne n’est pas simple, car une culture bactérienne simple ne permet pas d’identifier la totalité des espèces présentes dans le tube digestif d’un animal. Mais de nouvelles techniques (principalement basées sur le séquençage de l’ARN 16S ribosomal bactérien) permettent d’identifier toutes les bactéries intestinales (microbiote) et de mieux comprendre la complexité de la flore digestive.
Parallèlement à ces études, de nouvelles recherches portent sur l’interaction entre le microbiome et son hôte, en analysant les métabolites bactériens et ceux de l’hôte dans différents fluides tels que le sérum et l’urine. Cette technique, appelée métabolomique, a permis d’identifier différents problèmes, dont une dysbiose intestinale associée à une altération du profil métabolique global chez des chiens adultes atteints de diarrhée aiguë [30], et une modification du microbiome chez des chiens porteurs sains de Giardia spp. [31]. Bien que ces techniques restent du domaine de la recherche, l’analyse du microbiome et la métabolomique pourront à l’avenir être utiles pour évaluer la santé digestive chez le chiot en périsevrage.
Conclusion
Remerciement : L’auteur tient à remercier le Pr Sylvie Chastant-Maillard pour sa relecture constructive de cet article.
Aurélien Grellet
Dr Vétérinaire, PhD
France
Le Dr Grellet est vétérinaire diplômé de l’Ecole Vétérinaire de Liège (Belgique) en 2005. Après un internat dans cette même école, il passe cinq ans à l’Ecole Nationale Vétérinaire d’Alfort, d’abord au Centre d’Etude en Reproduction des Carnivores, puis au sein de l’Unité de Médecine de l’Elevage et du Sport. En 2011, il présente sa thèse de PhD sur les facteurs de risque des diarrhées de sevrage chez le chiot. Il travaille actuellement au Département Recherche et Développement chez Royal Canin à Aimargues.
- Freeman LM, Abood SK, Fascetti AJ, et al. Disease prevalence among dogs and cats in the United States and Australia and proportions of dogs and cats that receive therapeutic diets or dietary supplements. J Am Vet Med Assoc 2006;229(4):531-534.
- Jones PH, Dawson S, Gaskell RM, et al. Surveillance of diarrhoea in small animal practice through the Small Animal Veterinary Surveillance Network (SAVSNET). Vet J 2014;201(3):412-418.
- Hubbard K, Skelly BJ, McKelvie J, et al. Risk of vomiting and diarrhoea in dogs. Vet Rec 2007;161(22):755-757.
- Tupler T, Levy JK, Sabshin SJ, et al. Enteropathogens identified in dogs entering a Florida animal shelter with normal feces or diarrhea. J Am Vet Med Assoc 2012;241(3):338-343.
- Grellet A, Chastant-Maillard S, Robin C, et al. Risk factors of weaning diarrhea in puppies housed in breeding kennels. Prev Vet Med 2014;117(1):260-265.
- Day MJ. Immune system development in the dog and cat. J Comp Pathol 2007;137 Suppl 1:S10-15.
- Grellet A, Feugier F, Chastant-Maillard S, et al. Validation of a fecal scoring scale in puppies during the weaning period. Prev Vet Med 2012;106(3-4):315-323.
- Fleming, JM, Creevy KE, Promislow DE. Mortality in North American dogs from 1984 to 2004: an investigation into age-, size-, and breed-related causes of death. J Vet Intern Med 2011;25(2):187-198.
- Inpankaew T, Traub R, Thompson RCA, et al. Canine parasitic zoonoses in Bangkok temples. Southeast Asian J Trop Med Public Health 2007;38(2):247-255.
- Schulz BS, Strauch C, Mueller RS, et al. Comparison of the prevalence of enteric viruses in healthy dogs and those with acute haemorrhagic diarrhoea by electron microscopy. J Small Anim Pract 2008;49(2):84-88.
- Hackett T, Lappin MR. Prevalence of enteric pathogens in dogs of North-central Colorado. J Am Anim Hosp Assoc 2003;39(1):52-56.
- Rice JB, Winters KA, Krakowka S, et al. Comparison of systemic and local immunity in dogs with canine parvovirus gastroenteritis. Infect Immun 1982;38(3):1003-1039.
- Decaro N, Campolo M, Lorusso A, et al. Experimental infection of dogs with a novel strain of canine coronavirus causing systemic disease and lymphopenia. Vet Microbiol 2008;128(3-4):253-260.
- Lindsay DS, Dubey JP, Blagburn BL. Biology of Isospora spp. from humans, non-human primates, and domestic animals. Clin Microbiol Rev 1997;10(1):19-34.
- Appel MJG. Does canine coronavirus augment the effects of subsequent parvovirus infection? Vet Med 1988;360-366.
- Grellet A, De Battisti C, Feugier A, et al. Prevalence and risk factors of astrovirus infection in puppies from French breeding kennels. Vet Microbiol 2012;157(1-2):214-219.
- Ntafis V, Xylouri E, Radogna A, et al. Outbreak of canine norovirus infection in young dogs. J Clin Microbiol 2010;48(7):2605-2608.
- Grellet A, Polack B, Feugier A, et al. Prevalence, risk factors of infection and molecular characterization of trichomonads in puppies from French breeding kennels. Vet Parasitol 2013;197(3-4):418-426.
- Gookin JL, Birkenheuer, AJ, St John V, et al. Molecular characterization of trichomonads from feces of dogs with diarrhea. J Parasitol 2005;91(4):939-943.
- Caddy S, Goodfellow I. Complete genome sequence of canine astrovirus with molecular and epidemiological characterisation of UK strains. Vet Micro 2015;177:206-213.
- Stehr-Green JK, Murray G, Schantz P, et al. Intestinal parasites in pet store puppies in Atlanta. Am J Pub Health 1987;77:345-346.
- Barutzki D, Schaper R. Results of parasitological examinations of faecal samples from cats and dogs in Germany between 2003 and 2010. Parasitol Res 2011;109 Suppl 1:S45-60.
- Morley PS, Strohmeyer RA, Tankson JD, et al. Evaluation of the association between feeding raw meat and Salmonella enterica infections at a Greyhound breeding facility. J Am Vet Med Assoc 2006;228(10):1524- 1532.
- Markovich JE, Stucker KM, Carr AH, et al. Effects of canine parvovirus strain variations on diagnostic test results and clinical management of enteritis in dogs. J Am Vet Med Assoc 2012;241(1):66-72.
- Desario C, Decaro N, Campolo M, et al. Canine parvovirus infection: which diagnostic test for virus? J Virol Methods 2005;126(1-2):179-185.
- Schmitz S, Coenen C, Matthias K, et al. Comparison of three rapid commercial canine parvovirus antigen detection tests with electron microscopy and polymerase chain reaction. J Vet Diagn Invest 2009;21(3):344-345.
- Mohr AJ, Leisewitz AL, Jacobson LS, et al. Effect of early enteral nutrition on intestinal permeability, intestinal protein loss, and outcome in dogs with severe parvoviral enteritis. J Vet Intern Med 2003;17(6):791-798.
- Brown AJ, Otto CM. Fluid therapy in vomiting and diarrhea. Vet Clin North Am Small Anim Pract 2008;38(3):653-675,xiii.
- De Cramer KG, Stylianides E, van Vuuren M. Efficacy of vaccination at 4 and 6 weeks in the control of canine parvovirus. Vet Microbiol 2011;149(1-2):126-132.
- Guard BC, Barr JW, Reddivari L, et al. Characterization of microbial dysbiosis and metabolomic changes in dogs with acute diarrhea. PLoS One 2015;10(5);e0127259.
- Šlapeta J, Dowd SE, Alanazi AD, et al. Differences in the faecal microbiome of non-diarrhoeic clinically healthy dogs and cats associated with Giardia duodenalis infection: impact of hookworms and coccidia. Int J Parasit 2015;45(9-10):585-594.
Autres articles de ce numéro
Partager sur les réseaux sociaux