Le lymphome cutané félin
Ecrit par Hannah Lipscomb et Filippo De Bellis
Le lymphome cutané félin est un cancer rare mais potentiellement mortel qu’il est justifié d’envisager lors du diagnostic différentiel de nombreux cas de dermatologie ; cet article fait le point sur les connaissances actuelles à propos de cette affection et des options thérapeutiques.
Article
Points clés
Le lymphome cutané félin est une tumeur rare et maligne qui se présente sous forme épithéliotrope ou non épithéliotrope, cette dernière étant la plus fréquente chez le chat.
Les lésions dermatologiques sont des taches, des plaques et des nodules, pouvant être localisés ou généralisés, sans site de prédilection.
Le traitement est malheureusement très peu documenté mais il doit d’abord cibler la peau avant d’entreprendre une chimiothérapie systémique, avec un ou plusieurs agents anticancéreux.
Les chats atteints de la forme épithéliotrope de la maladie ont une durée médiane de survie de 10 mois. Le pronostic d’un lymphome non épithéliotrope est plus sombre, avec une durée médiane de survie de 4 à 8 mois.
Introduction
Le lymphome est le cancer le plus souvent diagnostiqué chez le chat : il est à l’origine d’environ 50 % des tumeurs observées dans cette espèce. De ce pourcentage global, les lymphomes cutanés représentent 0,2 à 3 % des cas, ce qui montre qu'il s'agit d'une tumeur rare, mais qui est cependant maligne [1]. À ce jour, un très faible nombre de cas de lymphome cutané félin ont été publiés alors que chez le chien et chez l’Homme, cette maladie est connue et bien documentée [2][3].
Selon la classification utilisée en médecine humaine, le lymphome cutané se présente sous deux formes principales : épithéliotrope et non épithéliotrope. Cette distinction précise si des lymphocytes néoplasiques ont infiltré l'épiderme, le derme et ses annexes (forme épithéliotrope) ou seulement le derme et le tissu sous-cutané (forme non épithéliotrope) [4]. Pour être plus précis, le lymphome cutané épithéliotrope félin (LCE) n'implique pas les glandes annexes [2].
Le LCE félin est un sous-ensemble du lymphome cutané à cellules T (LCCT) qui peut se présenter sous trois formes : mycosis fongoïde, syndrome de Sézary (variante leucémique) ou réticulose pagétoïde [2][3][4], mais chez le chat, cette dernière forme n'a pas encore été décrite [2]. Dans cette espèce, le lymphome cutané non épithéliotrope (LCNE) est plus fréquent et comprend le lymphome indolent à cellules T (ou lymphocytose cutanée), le lymphome diffus à cellules T, le lymphome à grandes cellules B riche en cellules T et le lymphome lymphoplasmocytaire [1]. Plus récemment, plusieurs sous-groupes de LCNE félins ont été identifiés : lymphome cutané au point d'injection, lymphome du tarse et lymphome associé à un site de fracture. Aucun ne présente d'épithéliotropisme, d'où leur regroupement, mais ils se distinguent par des caractéristiques cliniques et pathologiques qui en font des entités pathologiques séparées [1][5][6]. Chez le chien et l'Homme, le LCE est en revanche la forme la plus fréquente, et cela a donc influencé les recherches sur le chat [1].
Étiologie et facteurs prédisposants
En général, le lymphome cutané touche les chats âgés (âge médian d'apparition de 10 ans) et il n'y a pas de prédispositions raciales ou sexuelles apparentes [3][7]. Comme le lymphome cutané félin est rare, l'étiologie est encore mal connue [3][7]. Dans les lymphomes félins plus courants (médiastinal et multicentrique, par exemple), il existe une association évidente avec des virus (par exemple, celui de la leucose féline [FeLV] et celui de l'immunodéficience féline [FIV]) mais une telle relation n'a pas été établie pour le lymphome cutané félin [1][2][3][8]. Une étude [9] a cependant mis en évidence, par la technique PCR, le provirus FeLV intégré dans l'ADN tumoral d'un chat atteint de LCNE. Cette observation, associée à d'autres dans ce domaine, ne permet pas d’exclure le FeLV ou d'autres virus félins comme des causes possibles [3]. Des tests diagnostiques moléculaires sophistiqués pourraient être nécessaires pour éclaircir définitivement ce lien [9].
D'autres facteurs de risque ont été proposés. Bien que peu d'informations soient disponibles à propos de cette dermatose extrêmement rare qu'est la mucinose folliculaire (une maladie à médiation immunitaire suspectée), deux chats présentant cette maladie ont ensuite développé un LCE [7][10]. Bien qu'il ne soit pas possible de prédire si une mucinose folliculaire évoluera vers un LCE, la première pourrait être un facteur prédisposant chez le chat ou l’indicateur d'une maladie plus grave à venir. De plus, chez le chien et l’Homme atteints de LCCT, le rôle prédisposant d’une dermatite chronique préexistante à un cancer cutané a été étudié mais (chez le chien, l’Homme et le chat), la possible évolution d'une maladie inflammatoire cutanée (par exemple, la dermatite atopique) vers la cancérisation du tégument n'a pas été prouvée [3].
Les facteurs prédisposant au LCNE félin ont également été évalués : une étude portant sur 17 chats présentant un LCNE au point d'injection a été reliée au cas publié d'un chat présentant un LCNE associé à un site de fracture. L'étude et le cas clinique ont été mis en relation, car les deux auteurs ont proposé l'inflammation chronique (respectivement après l'injection et la fracture) comme cause possible de transformation maligne [1][5]. L'inflammation chronique est bien documentée chez l'Homme comme un foyer potentiel pour le lymphome à cellules B et d'autres origines possibles sont citées comme exemples : la chirurgie, les traumatismes, les implants métalliques et les infections virales [1].
Présentation clinique et diagnostic
Lymphome cutané épithéliotrope
Dans la plupart des cas rapportés, le LCE félin se présente sous la forme d’un mycosis fongoïde [3]. Lorsque la tumeur apparaît, elle progresse lentement et, au moment de la présentation, il peut ne pas y avoir de signes systémiques significatifs, ni d'anomalies hématologiques et biochimiques sur un bilan sanguin de routine [3][11]. De plus, les chats atteints du syndrome de Sézary présentent généralement un prurit intense et une lymphadénomégalie ; la cytologie montre des lymphocytes néoplasiques circulants (leucémie) [2][11].
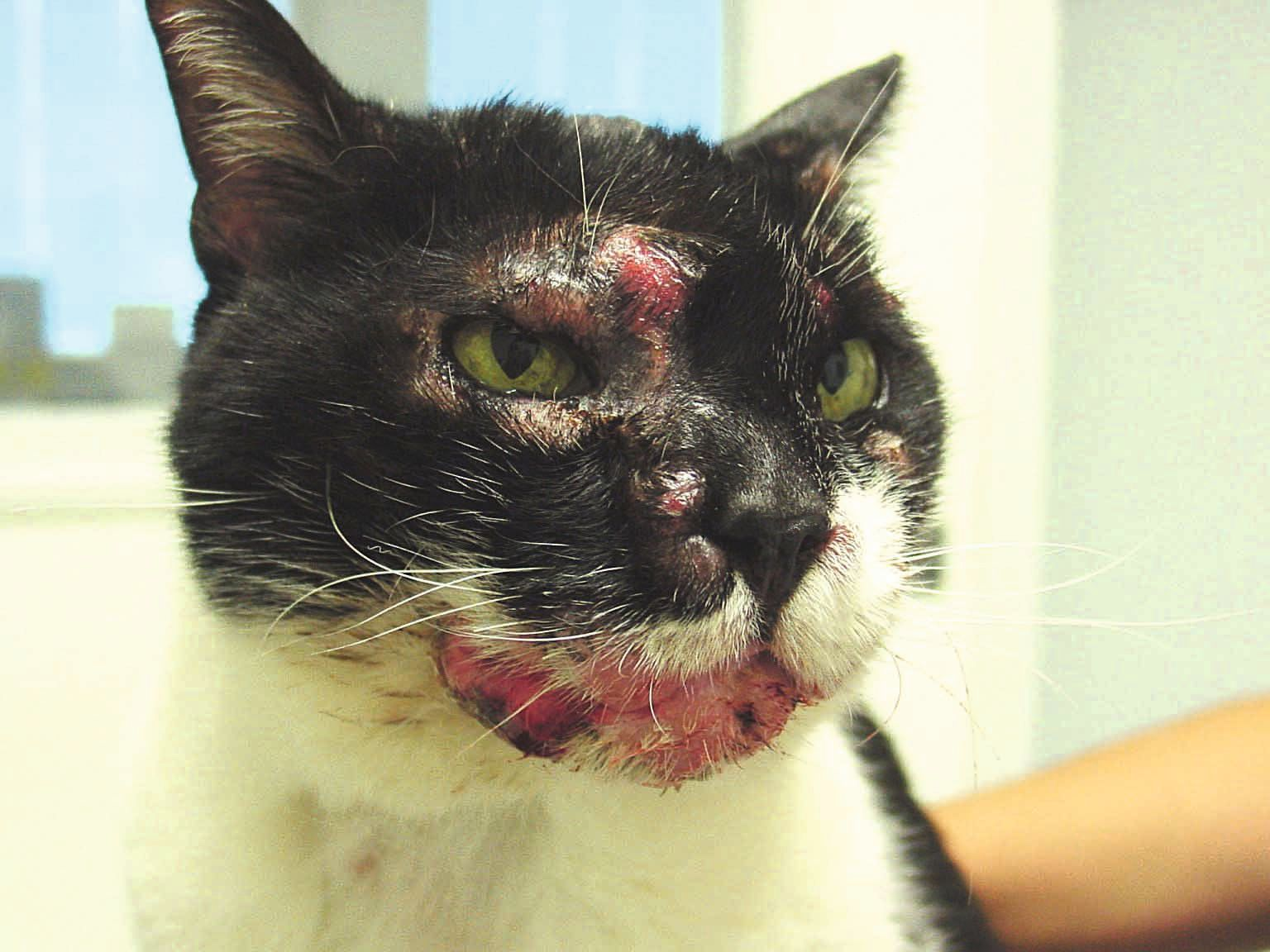
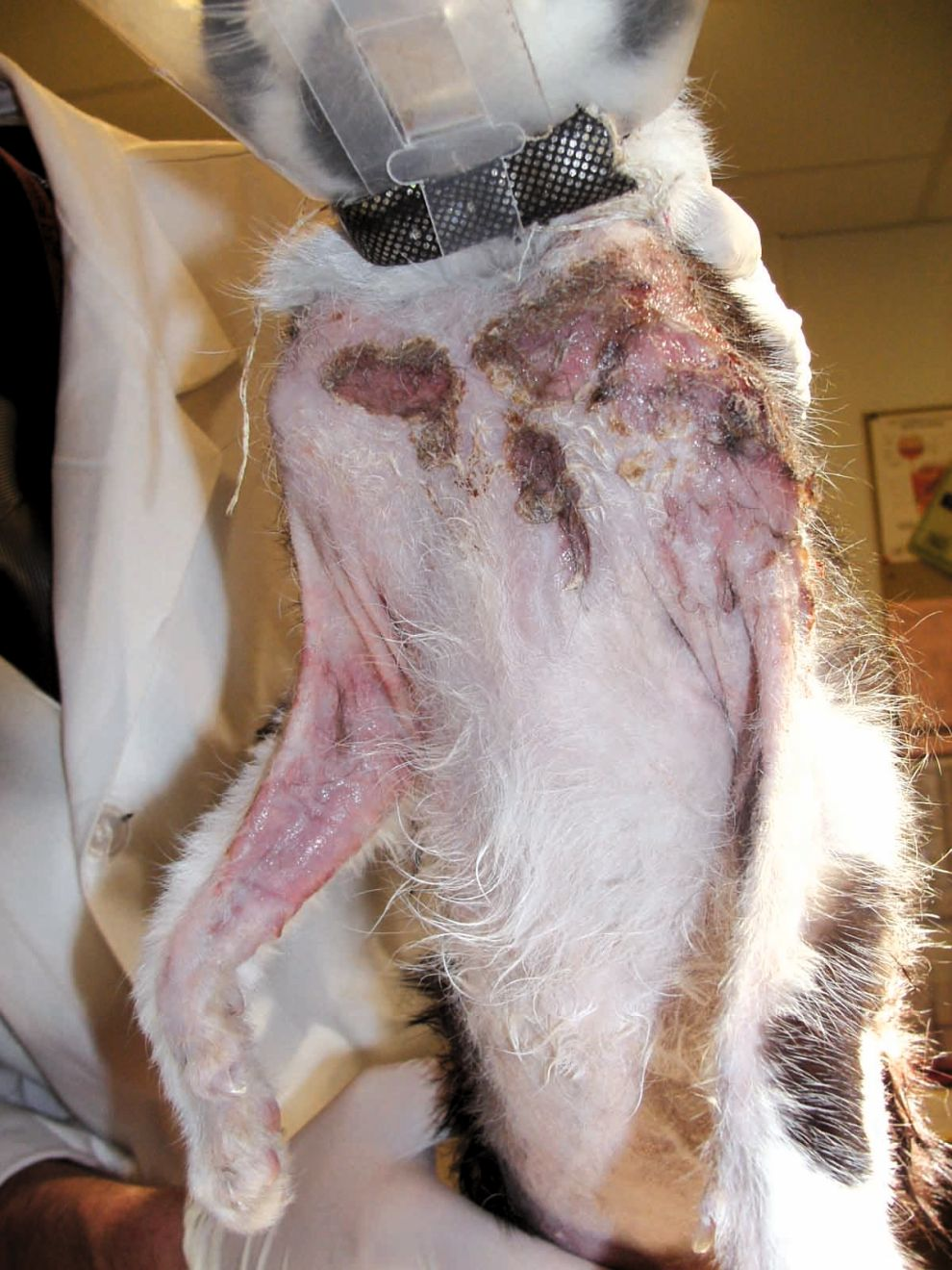
À l'examen dermatologique, les lésions peuvent être localisées ou généralisées, développées n'importe où sur le corps. Les lésions cutanées incluent l'érythrodermie dermatite exfoliative, des taches, des plaques, des érosions et des ulcères (Figure 1), ainsi que des lésions aux jonctions muco-cutanées (Figure 2) et dans la cavité buccale (Figure 3) [3][12]. En conséquence, les lésions cutanées peuvent ressembler à celles causées par des parasites (par exemple, Demodex spp.), des infections (telles qu’une dermatophytose) et des maladies cutanées allergiques (comme le complexe granulome éosinophilique félin) [7][12]. Cependant, un cas publié a mentionné un chat présentant un LCE aigu dont les lésions étaient très différentes, avec des lésions nodulaires se développant à partir de la queue [13]. Cela complique encore le diagnostic différentiel, car la présentation clinique du LCE semble être imprévisible.
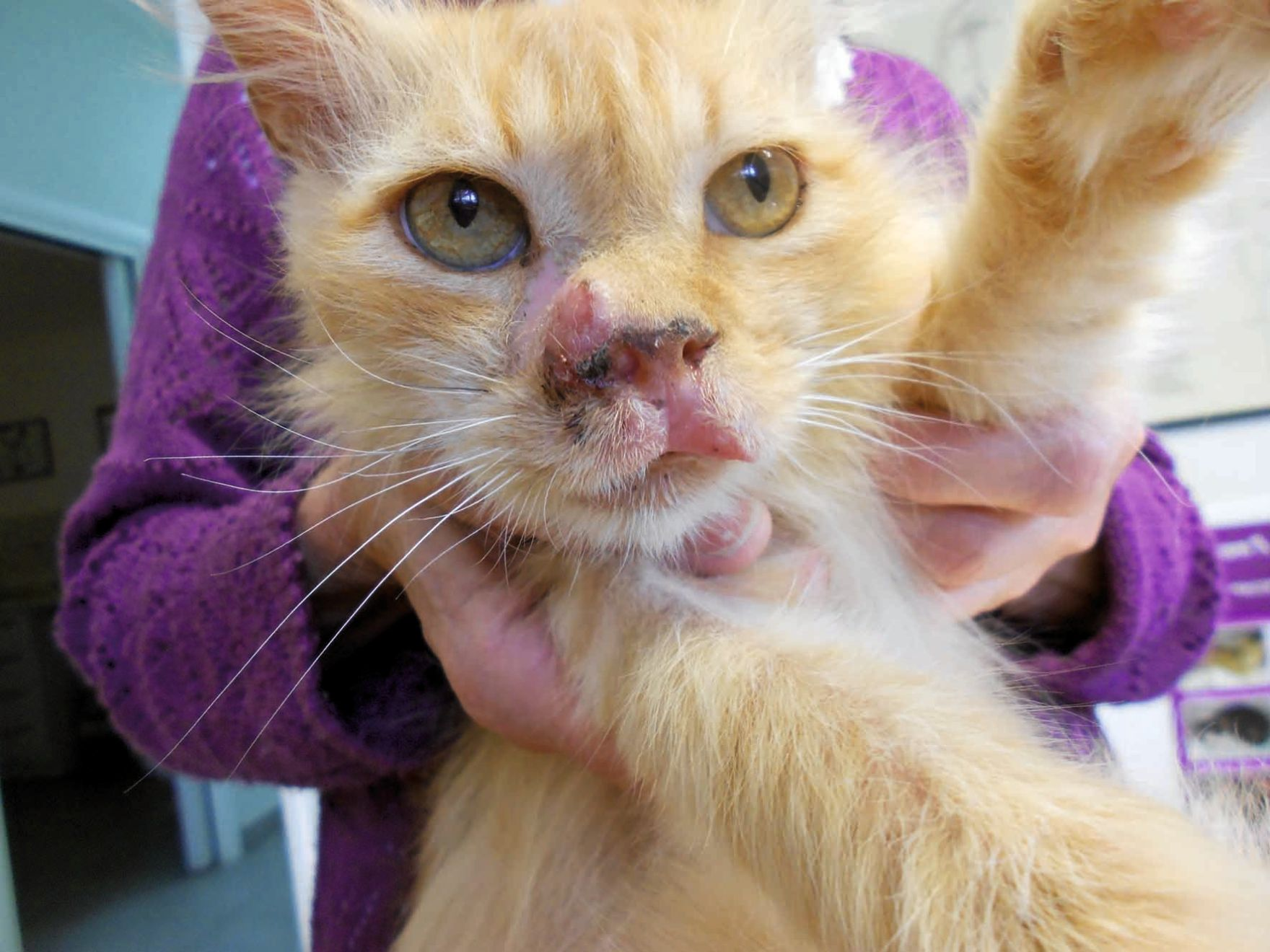
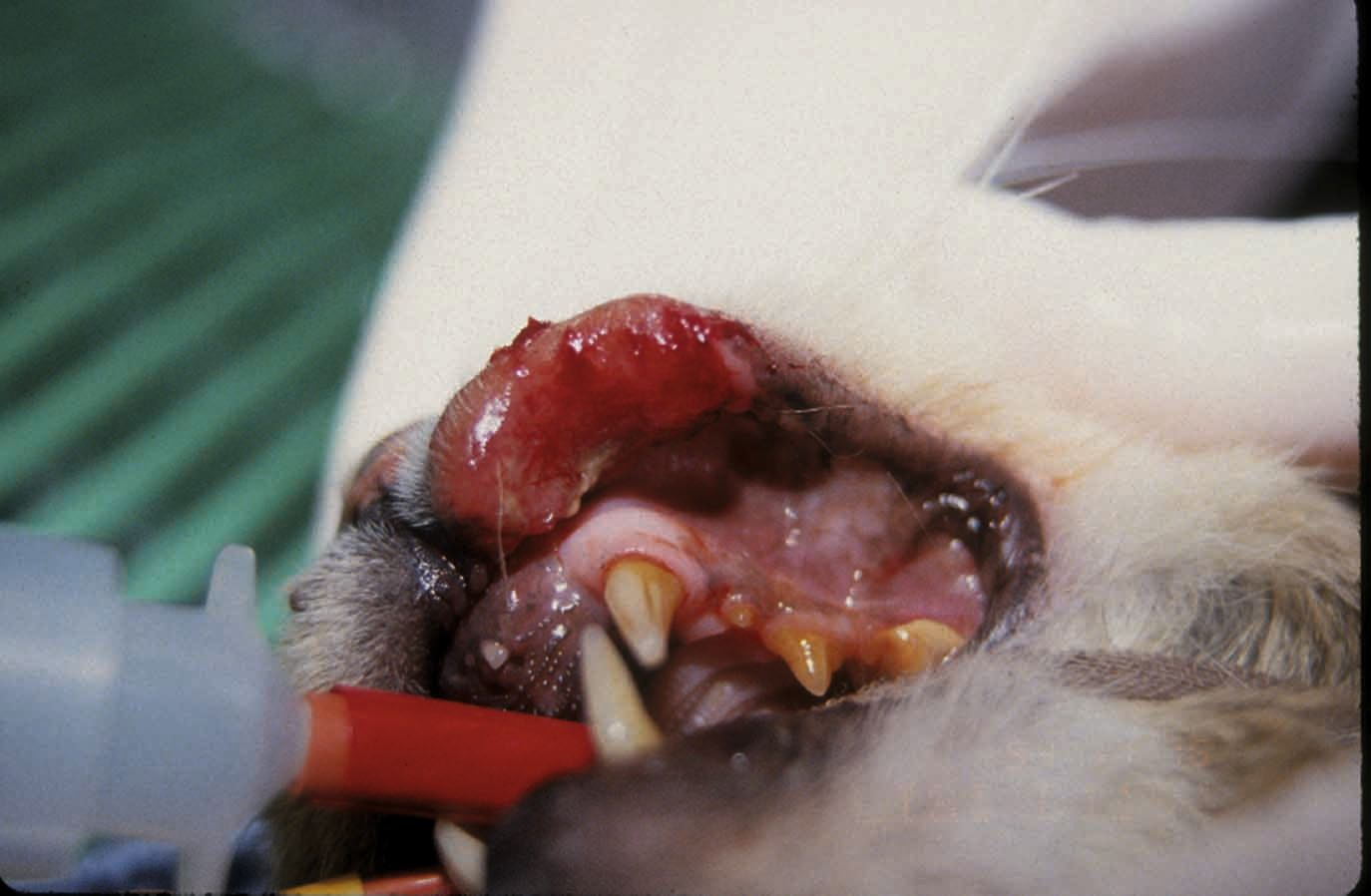
Le diagnostic est basé sur l'histopathologie. Pour un diagnostic de certitude, il faut repérer des lymphocytes de petite à moyenne, ou de moyenne à grande taille avec un tropisme épidermique [12]. Le pathologiste pourra aussi parfois décrire une micro-abcédation de Pautrier, une spongiose et une apoptose des kératinocytes, une réaction inflammatoire mixte ainsi qu’une orthokératose ou une parakératose de l'épiderme [3]. L'histopathologie seule ne permet pas de distinguer clairement le mycosis fongoïde du syndrome de Sézary [7][11].
Il est largement admis que des cellules T sont presque toujours à l’origine du LCE mais au-delà, peu de recherches ont été faites pour préciser l'immunophénotype et l'immunopathologie du LCE félin. Certains pathologistes pensent que l'immunophénotype du LCE félin ressemble beaucoup à celui du mycosis fongoïde chez l'Homme, car les cellules T impliquées sont considérées comme des cellules T auxiliaires (cellules CD4) [3]. Cela a cependant été contesté par la mise en évidence de perforine dans les cellules T néoplasiques d'un chat atteint de LCE. La perforine est une protéine qui perfore les membranes ; elle est stockée dans les granules cytoplasmiques des cellules T cytotoxiques (cellules CD8) et elle joue un rôle dans la destruction cellulaire ciblée. Malheureusement, l'expression des CD8 n'a pas été étudiée mais, en comparant avec des études humaines fiables, il a été suggéré que les cellules T étaient très probablement des cellules CD8 [13]. Des recherches supplémentaires sont nécessaires pour identifier l'immunophénotype du LCE félin.
Lymphome cutané non épithéliotrope
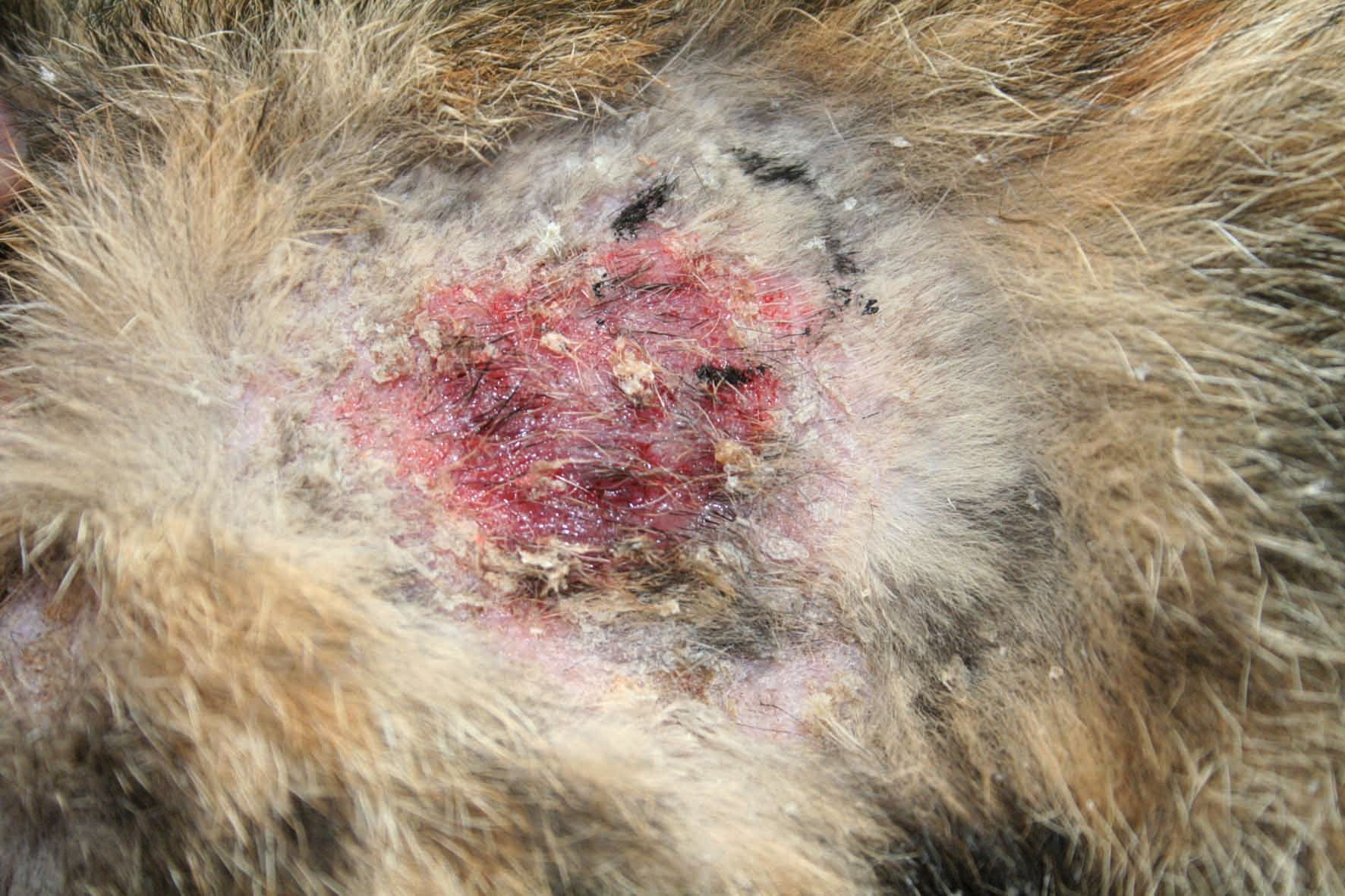
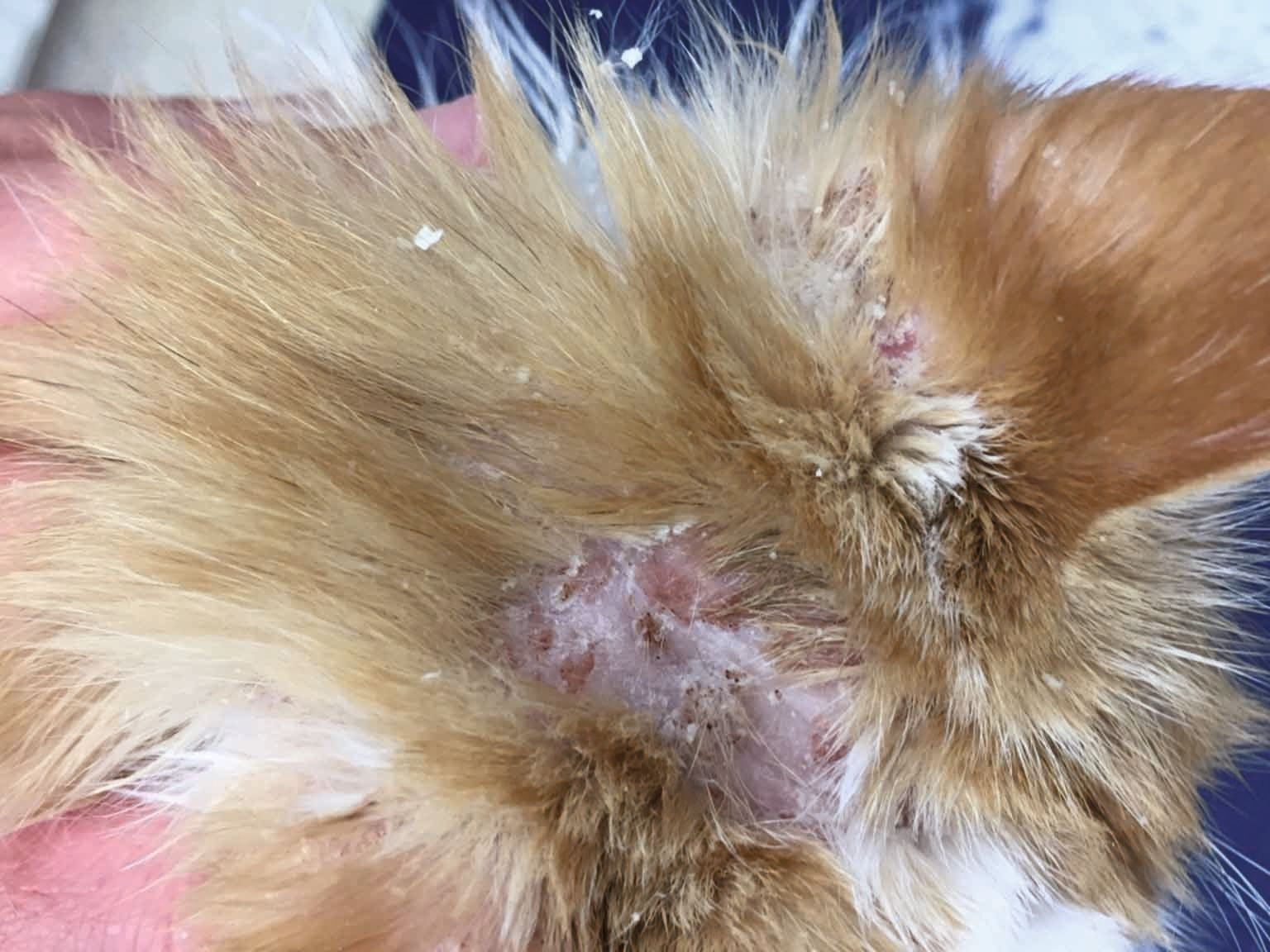
Cliniquement, un LCNE se présente sous la forme de plaques ou de nodules isolés ou multifocaux, non prurigineux, qui sont souvent ulcérés (Figures 4 et 5) ; l'érythème, la formation de croûtes et la desquamation apparaissent sporadiquement (Figure 6) [2][14]. Aucun site de prédilection n'est répertorié mais une recherche bibliographique suggère que des lésions peuvent se développer sur les zones périphériques, aux sites d'injection courants (lymphome cutané au point d'injection), sur le tarse (lymphome cutané du tarse) et là où une fracture a pu se produire (LCNE associé au site de fracture) [1][5][6][14]. Un gonflement œdémateux, un nodule ou une masse sous-cutanée peuvent être visibles [1][5][6]. Les chats présentant ces lésions plus atypiques présentent des formes particulières de lymphome cutané, ce qui met l’accent sur l’importance de toujours faire un diagnostic différentiel en présence d’un gonflement, d’un nodule ou d’une masse, situés dans le derme ou le tissu sous-cutané, quelle que soit la localisation. En outre, il est difficile de savoir quand les lésions sont apparues avant qu’un diagnostic intervienne ; cela peut aller de quelques mois à des années, sauf en cas de progression rapide : la dissémination lymphatique et systémique peut avoir lieu en quelques jours [1][2][5][6][14].
Le LCNE a été défini comme un lymphome lymphocytaire diffus et peu différencié [2], ce qui le rend difficile à distinguer des autres tumeurs cutanées à cellules rondes, des troubles prolifératifs histiocytaires et du mycosis fongoïde avancé. Des cas publiés plus récemment, s’appuyant sur l'histopathologie, décrivent le développement infiltrant de cellules tumorales lymphocytaires bien différenciées, de taille moyenne à grande, entre le derme et le tissu sous-cutané [5][14]. En outre, pour les sous-groupes du LCNE, les résultats histopathologiques classiques montrent des cellules néoplasiques disposées en feuillets, avec un indice mitotique élevé et des zones de nécrose [1][5][6].
Le LCNE est une maladie d'immunophénotype T ou B et cela a été clairement démontré par deux études distinctes. Dans la première, davantage de chats présentaient un lymphome à cellules B qu’à cellules T [6] alors que l'inverse s'est produit dans la seconde [1]. L'immunophénotypage a été réalisé par immunohistochimie et par identification spécifique des antigènes de surface exprimés par les lymphocytes néoplasiques : CD3 pour les lymphocytes T et CD79 pour les lymphocytes B [1][6]. Un phénotype à cellules T est cependant dominant lors de LCNE et le diagnostic d'une tumeur à cellules B est en général considéré comme extrêmement rare [1][6][7].
Traitement du LCE
À propos du LCE félin, les données de médecine basées sur des preuves sont rares et le traitement a donc été adapté de la médecine canine ou humaine. Chez les patients présentant des lésions localisées, superficielles ou précoces, le traitement est d’abord dirigé sur les lésions présentes sur la peau, en utilisant des topiques, la photothérapie, la thérapie photodynamique et la radiothérapie. La chimiothérapie systémique sera utilisée comme traitement de deuxième intention, à réserver aux cas avancés et aux soins palliatifs [15]. Ce qui suit décrit les modalités de traitement actuellement utilisées ou envisagées chez l’Homme et le chien ; la plupart des médicaments cités ne sont cependant pas autorisés chez le chat et leur intérêt dans cette espèce n’est donc que théorique.
Traitements topiques
Les corticostéroïdes topiques sont initialement utilisés chez les personnes atteintes de LCCT ; ils inhibent la liaison des lymphocytes sur l’endothélium et induisent l'apoptose. Leur taux de réponse est excellent (82 à 94 %) [15]. Les chats présentant des lésions précoces pourraient être traités de la même manière, l'objectif principal étant d'obtenir une rémission ou au moins d’alléger les symptômes [7]. La chimiothérapie topique par la mécloréthamine a également été utilisée avec succès, tant chez l'Homme que chez le chien : dans une étude chez l'Homme, une réponse complète a été observée chez 75 % des participants (155 au total) présentant des lésions précoces et une bonne réponse a été décrite chez les chiens présentant des lésions en plaques et en taches [7][15]. L'application de gel de trétinoïne a été n’a été utile que chez quelques chiens atteints de LCCT. Ce traitement a été inspiré par celui au bexarotène, un rétinoïde de synthèse utilisé chez l'Homme [7][15]. Les rétinoïdes topiques se lient et activent en effet sélectivement le rétinoïde X (RX), régulant la différenciation, la prolifération et l'apoptose cellulaires [15]. L'imiquimod est potentiellement un autre médicament topique, qui nécessiterait des recherches plus approfondies en médecine humaine et vétérinaire, mais cet agent immunomodulateur a montré une activité antitumorale lors de carcinome basocellulaire [15].

Lorsqu’un lymphome cutané félin est suspecté, le diagnostic précoce est essentiel pour améliorer le pronostic. Dans la mesure du possible, une biopsie cutanée devrait être effectuée dès le début des investigations diagnostiques.
Photothérapie, thérapie photodynamique et irradiation
En médecine humaine, la photothérapie (rayonnement ultraviolet) a été plus étudiée que la thérapie photodynamique pour traiter un LCCT, et diverses études confirment son efficacité dans les cas précoces [15]. En médecine vétérinaire, la thérapie photodynamique, bien que balbutiante, a donné des résultats intéressants pour obtenir une rémission lors de carcinome épidermoïde facial et de petites tumeurs chez les chats. La technique consiste à administrer un photosensibilisateur (topique, oral ou intraveineux) se localisant dans la tumeur ; l’activation par la lumière entraîne ensuite des lésions tissulaires [16].
L’irradiation par faisceau d’électrons utilise des électrons de faible énergie mais elle requiert du matériel spécifique. En médecine humaine, lorsque toute la surface de la peau est traitée, on parle de « total skin electron beam » (TSEB) et cette technique est activement utilisée chez les personnes présentant des lésions superficielles, des plaques et des tumeurs qui n'ont pas répondu au traitement topique [15]. Dans certains cas, la réponse initiale au TSEB est bonne. Cependant, les rechutes sont fréquentes et il semble y avoir une corrélation entre le stade du LCCT et le taux de récidive : plus le LCCT est avancé, plus le taux de rechute est élevé [15][17]. En médecine vétérinaire, le traitement par le TSEB est étudié depuis plusieurs années et a été appliqué à certains patients ; un cas publié décrit son utilisation chez un chien atteint d'un LCCT chimiorésistant, ayant induit une rémission pendant 19 mois [18] ; son utilisation chez le chat n’est en revanche pas documentée.
Agents modificateurs de la maladie et chimiothérapie systémique
Dans le LCCT humain, à mesure que la tumeur progresse, les lymphocytes T malins prolifèrent et produisent un déséquilibre en cytokines, qui constitue la cible des agents modificateurs de la maladie. Ces agents sont utilisés comme traitement de deuxième intention, lorsque le traitement cutané a échoué ou que la maladie est plus avancée [15]. En médecine vétérinaire, l'utilisation de rétinoïdes de synthèse a été étudiée et le résultat s'est révélé favorable, car il n’y a pas d’effet toxique cumulatif lorsque le traitement est associé avec un agent cytotoxique standard. Les rétinoïdes systémiques sont des analogues naturels ou synthétiques de la vitamine A, qui influencent profondément la croissance, la maturation et la différenciation cellulaires [19]. Dans une étude sur des chiens atteints de LCCT, le traitement par un mélange de rétinoïdes synthétiques (isotrétinoïne et érétinate) a produit un taux de réponse de 42 % [20]. Malheureusement, leur utilisation ne s'est pas développée à cause de la phase de latence entre le début de la thérapie et l'effet clinique, et aussi du coût [20].
En médecine vétérinaire, c’est la chimiothérapie systémique qui a été l'option thérapeutique la plus étudiée pour le LCE : il existe divers protocoles, s’appuyant sur un ou plusieurs agents. Cela s'explique en partie par le fait que la maladie a déjà souvent atteint un stade avancé au moment du diagnostic, nécessitant une approche plus agressive. Les lymphocytes néoplasiques restent sensibles aux corticostéroïdes oraux qui auraient des effets cliniques et palliatifs [2][19]. Malheureusement, le traitement uniquement basé sur les corticostéroïdes est rarement efficace à long terme ; son efficacité augmente lorsqu'il est associé avec un protocole de chimiothérapie basé sur plusieurs agents [19].
Les protocoles de chimiothérapie pour le LCE félin n'ont pas encore été établis ; chez le chien, la chimiothérapie repose le plus souvent sur un seul agent. Une première étude pilote a estimé la réponse de 7 chiens à la lomustine, dont 5 atteints de lymphome épithéliotrope : une rémission complète (de 2 mois à plus d'un an) a été observée chez tous les chiens [21]. Deux études rétrospectives publiées en 2006 ont aussi évalué la réponse des chiens atteints de LCCT à la lomustine et, dans les deux cas, une réponse mesurable a été constatée chez environ 80 % des chiens. Inévitablement, les taux de réponse élevés étaient accompagnés d'effets secondaires (myélosuppression et augmentation des enzymes hépatiques) ; en outre, certains chiens dans ces études avaient déjà reçu d'autres types de chimiothérapie et/ou étaient traités avec des corticostéroïdes [19][22][23]. Par conséquent, bien que ces études aient encouragé les vétérinaires oncologues et dermatologues à utiliser la lomustine lors de LCCT canin, des études supplémentaires sont nécessaires avant de recommander des protocoles chez les patients présentant une chimiorésistance, par rapport à ceux n’ayant jamais bénéficié de la chimiothérapie [19]. En raison de son efficacité chez le chien, l’utilisation de la lomustine a été recommandée chez les chats atteints de LCCT [3].
Une chimiothérapie basée seulement sur la L-asparaginase ou la doxorubicine a également été étudiée mais jusqu'ici, uniquement chez le chien. Une étude avec la L-asparaginase pégylée (capsule de polyéthylène glycol) a porté sur 7 chiens atteints de LCCT ; au départ, l’état clinique s’est amélioré chez tous, mais à long terme, les réponses ont été partielles et de courte durée [24]. Une autre étude prospective a évalué la toxicité et la réponse à la doxorubicine pégylée chez des chiens présentant diverses tumeurs ; dans 9 cas, il s’agissait d’un LCCT, et une rémission complète a été observée chez 3 d'entre eux (avec une médiane de 90 jours). L’étude a noté qu’avec la doxorubicine pégylée, les effets cardiotoxique et myélosuppresseur étaient nettement réduits par rapport à la doxorubicine libre, mais le coût de ce traitement est prohibitif [25].
En médecine humaine, des protocoles de chimiothérapie avec plusieurs agents ont été décrits pour le LCCT mais ils ne paraissent pas donner de meilleurs taux de survie [15]. Une chimiothérapie combinée a été testée chez des chiens atteints de LCCT (avec diverses associations de prednisolone, vincristine, cyclophosphamide et doxorubicine) et une réponse modérée a été notée, la durée de survie allant de 2 à 6 mois [7][19]. Les protocoles COP (cyclophosphamide, vincristine et prednisolone) et CHOP (cyclophosphamide, doxorubicine, vincristine et prednisolone) ont également été testés dans une petite série de cas de LCCT canin et dans un cas de LCE félin, avec un succès modéré [4][7][13][19].
En général, le lymphome cutané touche les chats âgés, avec un âge médian d'apparition de 10 ans, et il n'y a pas de prédispositions raciales ou sexuelles apparentes. Le lymphome cutané félin étant rare, son étiologie est encore mal connue.
Autres options
Les autres options thérapeutiques du lymphome cutané félin comprennent le lysat plaquettaire, l'excision chirurgicale des lésions isolées et la fibronectine (locale et intraveineuse) [3][6]. La fibronectine est une glycoprotéine ayant un effet antitumoral, par opsonisation des cellules cibles qui conduit à leur destruction par les macrophages et les monocytes [3]. Malgré la publication de différentes modalités de traitement, aucune n'a été étayée par une série fiable de cas présentant une bonne réponse au traitement et un bon taux de survie [6]. Des études supplémentaires sont donc nécessaires.
Traitement multimodal et symptomatique
Un traitement multimodal ne semble pas améliorer le taux de survie chez les patients atteints de LCCT mais il permet d'augmenter le taux de réponses complètes. Néanmoins, associer des traitements dont la toxicité ne se cumule pas (par exemple, l'excision d'une masse avec une chimiothérapie d'appoint) est un protocole rationnel qui peut être adopté chez certains animaux. Il est important de noter qu’un traitement symptomatique (incluant par exemple des analgésiques et des antibiotiques) doit être initié parallèlement au protocole thérapeutique conventionnel pour optimiser la qualité de vie, en particulier lors de soins palliatifs [19].
Traitement du LCNE
Le LCNE étant moins fréquent chez le chat que chez le chien, les études réalisées sont insuffisantes pour donner des recommandations thérapeutiques générales ; il n'existe donc pas de traitement standard pour le LCNE félin. Malgré cela, des publications validées peuvent aider à prendre une décision fondée sur des preuves en matière de traitement. Dans deux cas publiés sur des chats à LCNE, l'approche thérapeutique choisie et les réponses obtenues ont été détaillées : un chat traité par la lomustine est entré en rémission complète pendant environ 4 mois ; l'autre a reçu un protocole CHOP modifié, suivi d’une rémission de 4 semaines [5][14].
Une étude rétrospective portant sur 23 chats atteints de LCNE du tarse a montré qu’un traitement associant la radiothérapie et la chimiothérapie, ou la chirurgie (avec ou sans chimiothérapie), conduit à une durée moyenne de survie significativement plus longue qu’un traitement basé uniquement sur les corticostéroïdes ou la chimiothérapie (316 jours versus 155 jours) [6]. Les chats traités pour un LCNE doivent bien sûr aussi recevoir un traitement multimodal et symptomatique (voir ci-dessus) lorsque cela est approprié.
Pronostic
Avec aussi peu d'informations disponibles sur le lymphome cutané félin, il est difficile d’évaluer le pronostic. Chez l'Homme, le taux de survie est déterminé par le type de LCCT diagnostiqué. Par exemple, le pronostic du syndrome de Sézary est moins favorable que celui du mycosis fongique (33 % contre 89-93 % de taux de survie à 5 ans) [3]. En général, le pronostic du LCCT chez l'Homme est cependant considéré comme bon [15]. Lorsqu’un LCCT est diagnostiqué précocement chez le chien, et qu’il est traité de manière appropriée, la survie peut dépasser 12 mois. Lorsque le diagnostic est tardif, la survie ne sera que de 6 mois, quelle que soit la réponse au traitement [19]. Chez le chat, la durée médiane de survie rapportée pour le LCE est d'environ 10 mois mais pour le LCNE, le pronostic est plus grave : la durée médiane de survie est de 4 à 8 mois [3][7].
Conclusion
Le lymphome cutané est un cancer rare chez le chat et peu de publications ont été faites à propos des manifestations, du traitement et du pronostic des deux formes. Cependant, lors de suspicion de lymphome cutané félin, le diagnostic précoce est essentiel pour améliorer le pronostic ; dans la mesure du possible, une biopsie cutanée sera effectuée dès le début des investigations diagnostiques. Au sujet du traitement, des recommandations générales n'ont pas encore été définies et des recherches supplémentaires sont indéniablement nécessaires. Dans les publications disponibles, les chats ont généralement été traités par chimiothérapie systémique et une approche multimodale pourra aussi être adoptée pour optimiser la réponse au traitement. En outre, parallèlement au traitement principal, un traitement symptomatique devrait être mis en place pour améliorer la qualité de vie des chats, en particulier chez ceux qui reçoivent des soins palliatifs.
Hannah Lipscomb
BVet Med, MRCVS
Le Dr Lipscomb est diplômée du Royal Veterinary College de Londres depuis 2016 et a été la première interne en dermatologie à travailler aux côtés du spécialiste Filippo De Bellis, au sein du Southern Counties Veterinary Specialists (SCVS). Après sa qualification, elle a d'abord travaillé dans une clinique généraliste pour animaux de compagnie pendant 18 mois, où elle a développé un intérêt pour la dermatologie, puis elle a effectué un internat dans une clinique privée de cas référés avant de continuer sa formation par un internat en dermatologie au SCVS.
Filippo De Bellis
Dr Vétérinaire, CertVD, Dip. ECVD, MRCVS
Le Dr De Bellis est diplômé de l’Université de Bari, en Italie, depuis 2001 et s'est installé au Royaume-Uni pour effectuer un résidanat en dermatologie au Royal Veterinary College en 2006. Il a obtenu le certificat de dermatologie vétérinaire du RCVS en 2009 et un an plus tard, le diplôme du Collège européen de dermatologie vétérinaire. Il s'intéresse particulièrement aux maladies des oreilles et aux allergies, et il dirige actuellement les services de dermatologie chez Davies Veterinary Specialists, Southfields Veterinary Specialists, et London Vet Specialists.
Références
- Roccabianca P, Avallone G, Rodriguez A, et al. Cutaneous lymphoma at injection sites: pathological, immunophenotypical, and molecular characterization in 17 cats. Vet Pathol 2016; 53(4):823-832.
- Moore PF, Olivry T. Cutaneous lymphoma in companion animals. Clin Dermatol 1994;12(4):499-505.
- Fontaine J, Heimann M, Day MJ. Cutaneous epitheliotropic T-cell lymphoma in the cat: a review of the literature and five new cases. Vet Dermatol 2011;22(5):454-461.
- Schmidt V. Epitheliotropic T-cell cutaneous lymphoma in dogs. UK Vet Comp Anim 2011; 16(3):49-54.
- Jegatheeson S, Wayne J, Brockley LK. Cutaneous non-epitheliotropic T-cell lymphoma associated with a fracture site in a cat. J Feline Med Surgery Open Reports 2018;4(1):1-6.
- Burr HD, Keating JH, Clifford CA, et al. Cutaneous lymphoma of the tarsus in cats: 23 cases (2000-2012). J Am Vet Med Assoc 2014;244(12):1429-1434.
- Miller Jr WH, Griffin CE, Campbell KL. Neoplastic and Non-Neoplastic Tumours. In: Duncan L, Rudolph P, Graham B, et al (eds). Muller and Kirks Small Animal Dermatology. 7th ed. Missouri: Elsevier Mosby, 2013;810-815.
- Beatty J. Viral causes of feline lymphoma: retroviruses and beyond. Vet J 2014;201(2):174-180.
- Tobey JC, Houston DM, Breur GJ, et al. Cutaneous T-cell lymphoma in a cat. J Am Vet Med Assoc 1994;204(4):606-609.
- Scott DW. Feline Dermatology 1983-1985: the secret sits. J Am Anim Hosp Assoc 1987;23:255-274.
- Wood C, Almes K, Bagladi-Swanson M, et al. Szary syndrome in a cat. J Am Anim Hosp Assoc 2008;44(3):144-148.
- Rook KA. Canine and feline cutaneous epitheliotropic lymphoma and cutaneous lymphocytosis. Vet Clin North Am Small Anim Pract 2019;49(1):67-81.
- Neta M, Naigamwalla D, Bienzle D. Perforin expression in feline epitheliotropic cutaneous lymphoma. J Vet Diagn Invest 2008;20(6):831-835.
- Komori S, Nakamura S, Takahashi K, et al. Use of lomustine to treat cutaneous nonepitheliotropic lymphoma in a cat. J Am Vet Med Assoc 2005;226(2):237-239.
- Knobler E. Current management strategies for cutaneous T-cell lymphoma. Clin Dermatol 2004;22(3):197-208.
- Buchholz J, Heinrich W. Veterinary photodynamic therapy: a review. Photodiagnosis Photodyn Ther 2013;10(4):342-347.
- Jones GW, Hoppe RT, Glatstein E. Electron beam treatment for cutaneous T-cell lymphoma. Hematol Oncol Clin North Am 1995;9(5):1057-1076.
- Santoro D, Kubicek L, Lu B, et al. Total skin electron therapy as treatment for epitheliotropic lymphoma in a dog. Vet Dermatol 2017;28(2):246-e65.
- De Lorimier LP. Updates on the management of canine epitheliotropic cutaneous T-cell lymphoma. Vet Clin North Am Small Anim Pract 2006;36(1):213-228.
- White SD, Rosychuk RA, Scott KV, et al. Use of isotretinoin and etretinate for the treatment of benign cutaneous neoplasia and cutaneous lymphoma in dogs. J Am Vet Med Assoc 1993;202(3):387-391.
- Graham JC, Myers RK. Pilot study on the use of lomustine (CCNU) for the treatment of cutaneous lymphoma in dogs. In: Proceedings, 17th Annual Meeting Veterinary Internal Medicine Forum 1999;723.
- Risbon RE, De Lorimier LP, Skorupski K, et al. Response of canine cutaneous epitheliotropic lymphoma to lomustine (CCNU): a retrospective study of 46 cases (1999-2004). J Vet Intern Med 2006;20(6):1389-1397.
- Williams LE, Rassnick KM, Power HT, et al. CCNU in the treatment of canine epitheliotropic lymphoma. J Vet Intern Med 2006;20(1):136-143.
- Moriello KA, MacEwen EG, Schultz KT. PEG-L-asparaginase in the treatment of canine epitheliotropic lymphoma and histiocytic proliferation dermatitis. In: Ihrke PJ, Mason IS, White SD (eds). Advances in Veterinary Dermatology Vol. 2. UK: Pergamon Press, 1993;293-299.
- Vail DM, Kravis LD, Cooley AJ, et al. Preclinical trial of doxorubicin entrapped in sterically stabilized liposomes in dogs with spontaneously arising malignant tumours. Cancer Chemother Pharmacol 1997;39(5):410-416.
Autres articles de ce numéro
Partager sur les réseaux sociaux