La toxoplasmose féline
Écrit par Christopher Fernandez-Prada, Victoria Wagner
La répartition mondiale de la toxoplasmose est maintenant confirmée et, bien que le chat soit le seul hôte définitif, cette parasitose est une zoonose qui peut jouer un rôle important en santé humaine et animale.
Article

Points clés
Des chats sont infectés par Toxoplasma gondii dans le monde entier mais la plupart restent asymptomatiques.
L’infection humaine par T. gondii peut avoir lieu via l’ingestion d’oocystes (présents dans les aliments, le sol et l’eau contaminée) ou de kystes tissulaires (viande mal cuite).
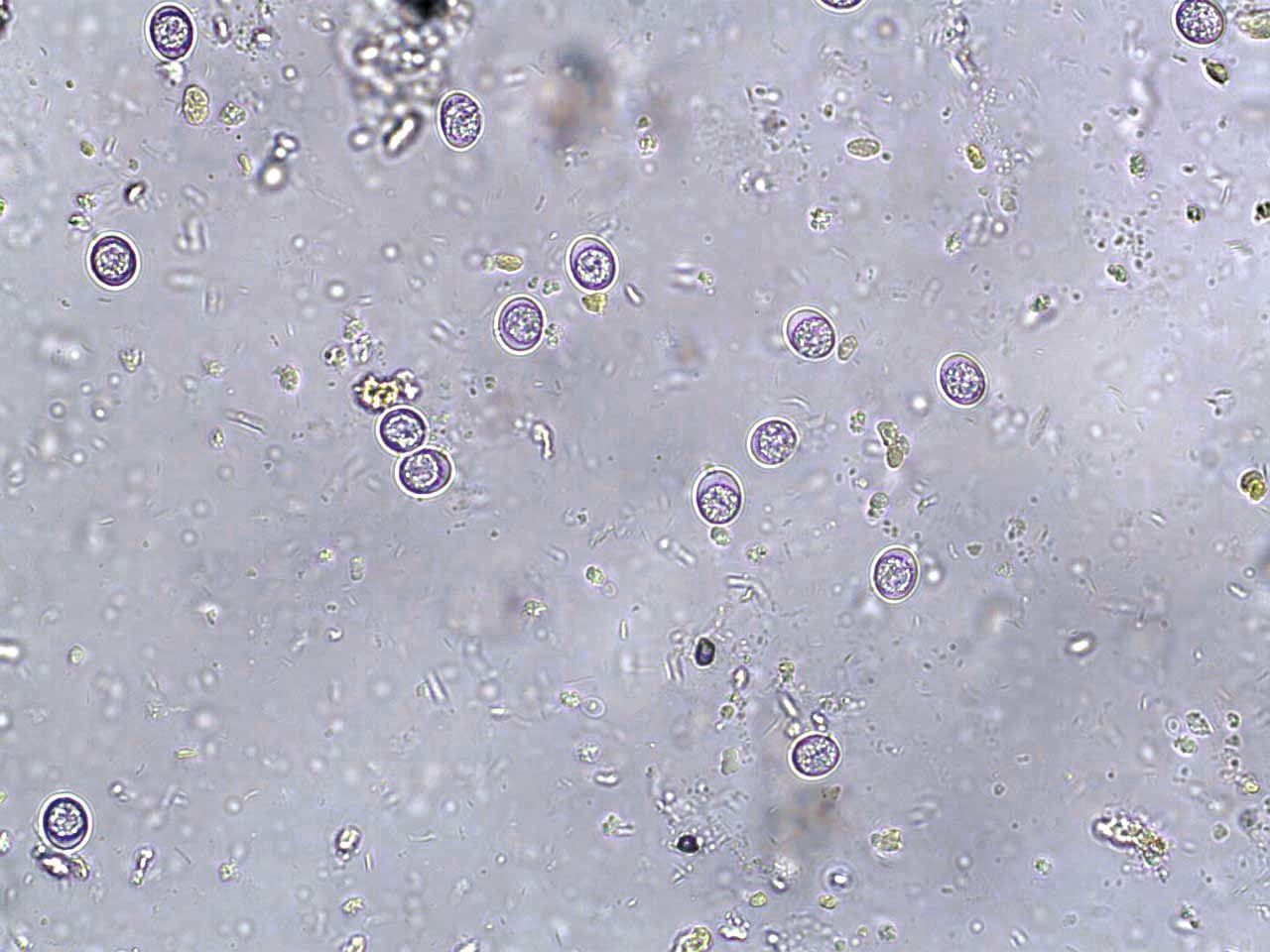
En raison de la courte période d’excrétion des oocystes de T. gondii et de leur ressemblance avec d’autres parasites, la recherche de ces oocystes dans les fèces du chat ne constitue pas un test diagnostique suffisant.
Comme les oocystes ne deviennent infectieux que 24 heures après leur excrétion, le nettoyage quotidien du bac à litière est une mesure efficace pour prévenir la transmission domestique.
Introduction
Le parasite protozoaire intracellulaire Toxoplasma gondii peut infecter la majorité des espèces animales vertébrées. Bien que les félins soient ses seuls hôtes définitifs, il est de plus en plus reconnu comme une menace majeure dans de nombreux écosystèmes. L’ingestion du parasite par un hôte définitif ou intermédiaire aboutit généralement à une infection chronique, subclinique ou asymptomatique. Cependant, chez les sujets sensibles ou immunodéprimés, la toxoplasmose peut entraîner des avortements et des troubles de la reproduction, voire une défaillance d’organe potentiellement fatale [1]. La toxoplasmose est actuellement présente dans le monde entier ; selon les pays, 0,7 à 41 % des chats excrètent des oocystes à un moment donné. Aux États-Unis, le nombre de chats présentant un test sérologique positif (présence d’anticorps anti-T. gondii) varie de 14 à 100 % [2]. De nombreux humains sont également infectés (par exemple, environ 40 millions aux États-Unis) ; la plupart sont asymptomatiques mais des problèmes oculaires ou neurologiques sont notamment observés chez les personnes immunodéprimées [3].
Le cycle biologique de Toxoplasma gondii
Toxoplasma gondii a un cycle de vie complexe : pour sa reproduction sexuée et asexuée, il a respectivement besoin d’un hôte définitif et d’un d’hôte intermédiaire (Figure 1). Le parasite existe sous trois formes distinctes : tachyzoïte, bradyzoïte et sporozoïte (dans l’oocyste), et toutes peuvent être infectieuses pour l’Homme. Les tachyzoïtes correspondent à la forme asexuée qui permet la division rapide du parasite, et ils peuvent être présents dans les tissus de n’importe quel hôte vertébré. Les bradyzoïtes sont également très répandus et présents dans les tissus de l’hôte mais à ce stade de vie, les divisions sont lentes et le parasite reste enkysté.
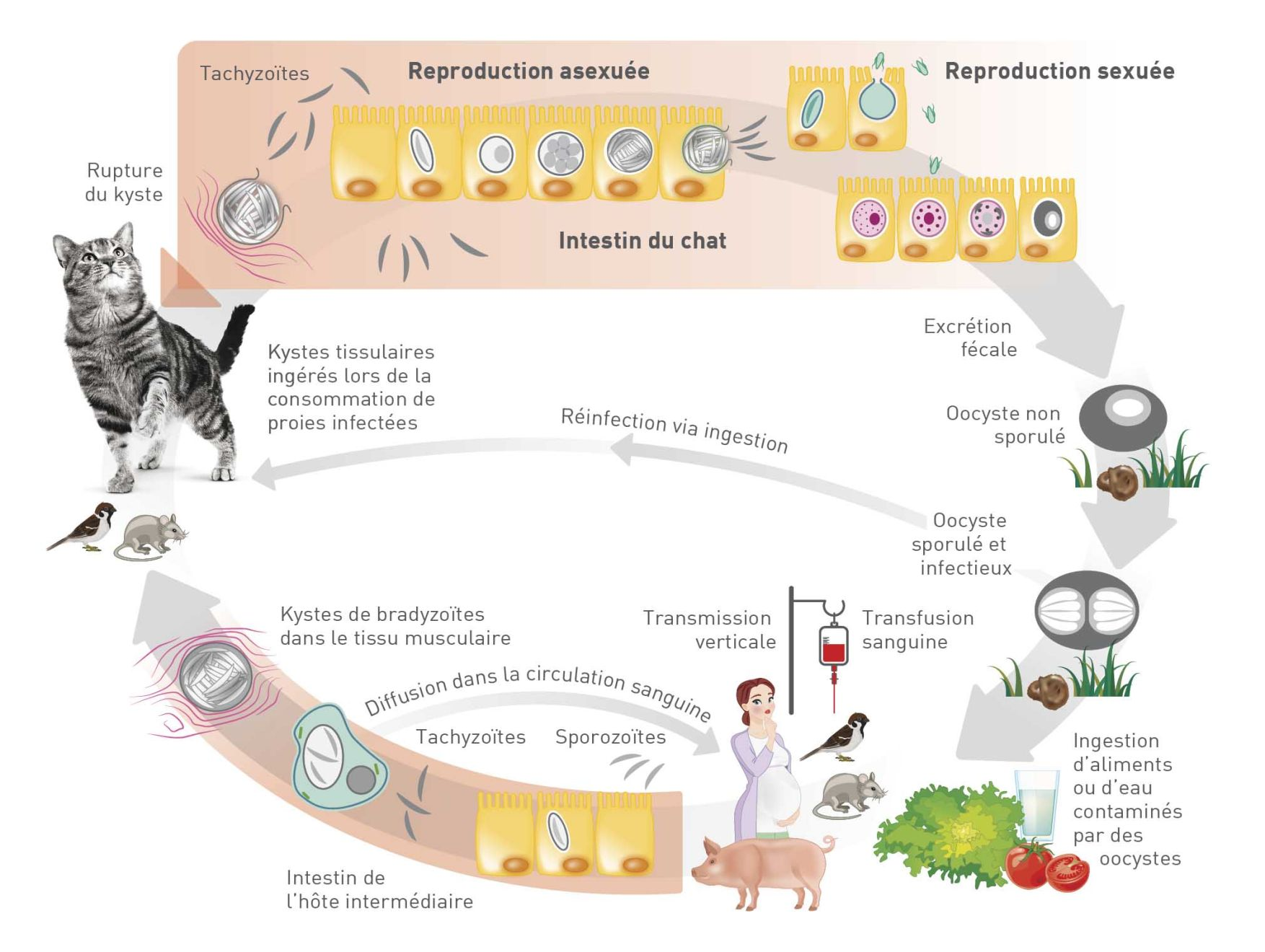
L’hôte définitif de T. gondii, le chat, s’infecte en ingérant des kystes tissulaires, par exemple lorsqu’il chasse et consomme ses proies (Figure 2), ou avale des oocystes sporulés ou infectieux (présents sur le sol, dans l’eau ou sur des plantes contaminées par les fèces de félins). Dans cette espèce, le parasite peut se reproduire par voie sexuée et les chats infectés par des bradyzoïtes commencent à excréter des oocystes par voie fécale 3 à 10 jours après l’ingestion (le délai est de 19 à 48 jours après ingestion d’oocystes) ; la durée d’excrétion peut aller jusqu’à 2 semaines (Figure 3) [2],[4]. Oocysts sporulate and become infective 1-5 days following excretion, and are extremely resistant in the environment.

Chez l’Homme, les principales voies d’infection par T. gondii sont la consommation de viande insuffisamment cuite contenant des kystes parasitaires, ou l’ingestion accidentelle d’oocystes via une contamination fécale des aliments, des mains, etc. [4],[5].
Signes cliniques de la toxoplasmose féline
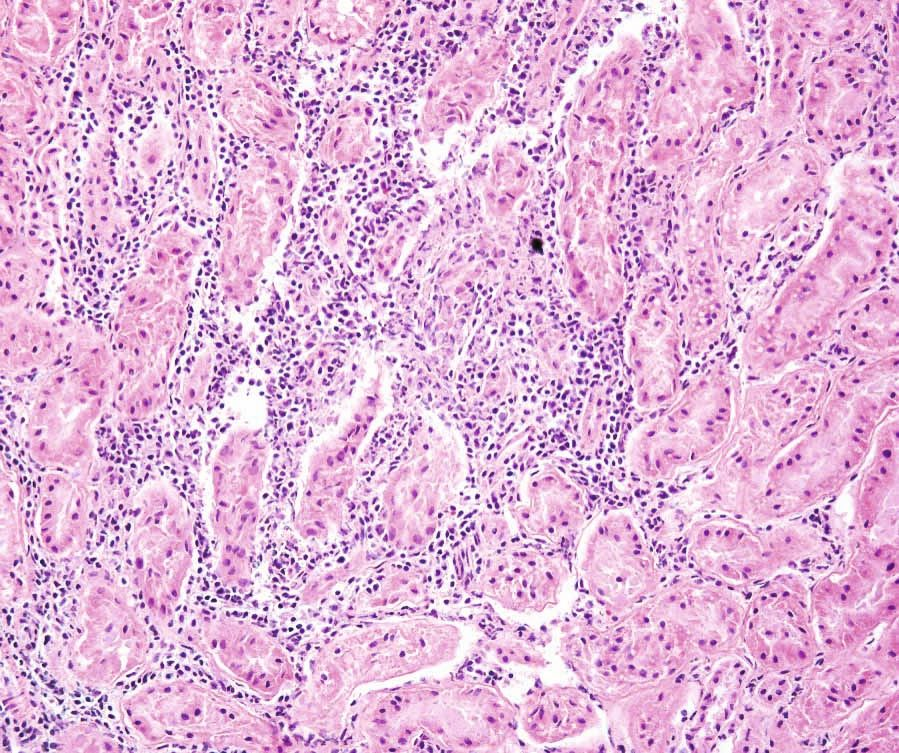
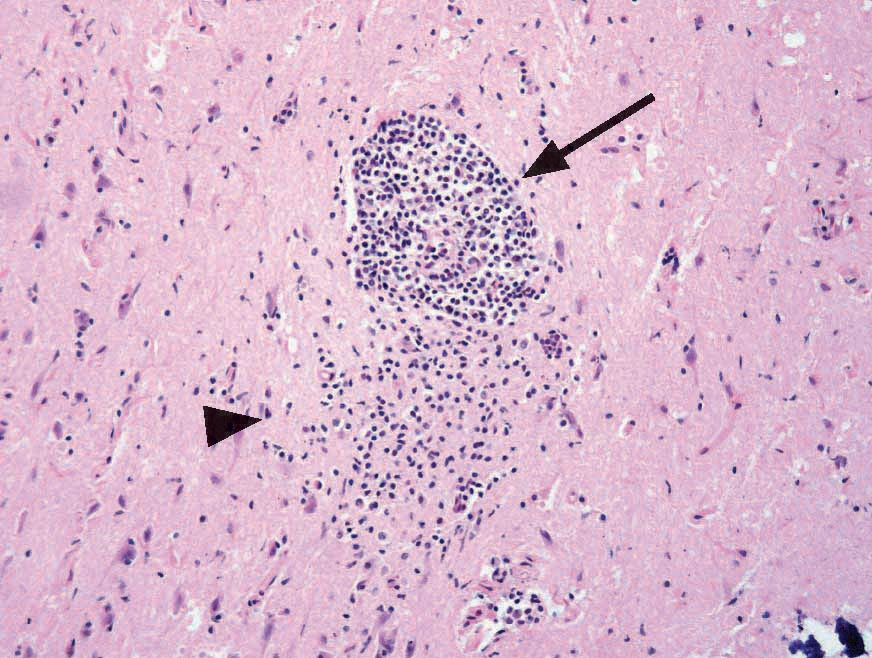
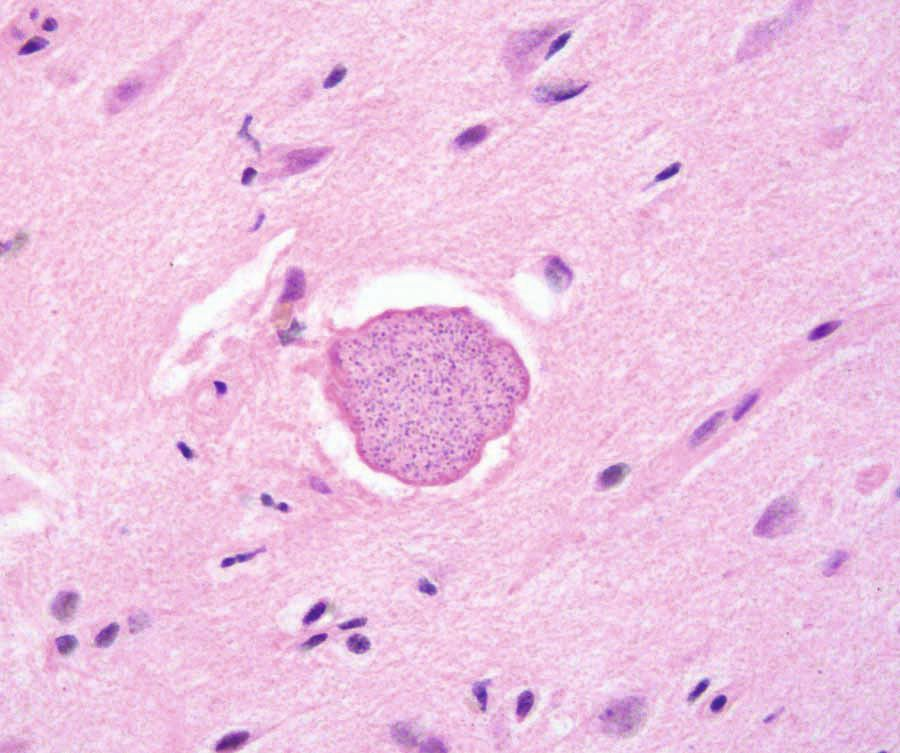
La toxoplasmose peut être difficile à remarquer chez un chat car la plupart des infections sont asymptomatiques : fièvre, anorexie et léthargie sont les signes cliniques les plus fréquents si le chat en manifeste. Comme la croissance intracellulaire du parasite entraîne des effets cytopathiques directs, avec inflammation et nécrose cellulaires, l’apparition de signes plus spécifiques dépend de la localisation des tachyzoïtes dans l’organisme (Figures 4-6) ; il peut s’agir de troubles oculaires, neurologiques, d’une pneumonie ou d’un ictère [4]. Les infections par les virus de la leucose féline ou de l’immunodéficience féline, les tumeurs et l’administration de médicaments immunosuppresseurs (tels que la ciclosporine) sont autant de facteurs de risque pour le développement d’une maladie clinique. Les infections aiguës sont généralement fatales, en particulier chez les chatons [6].
Diagnostic
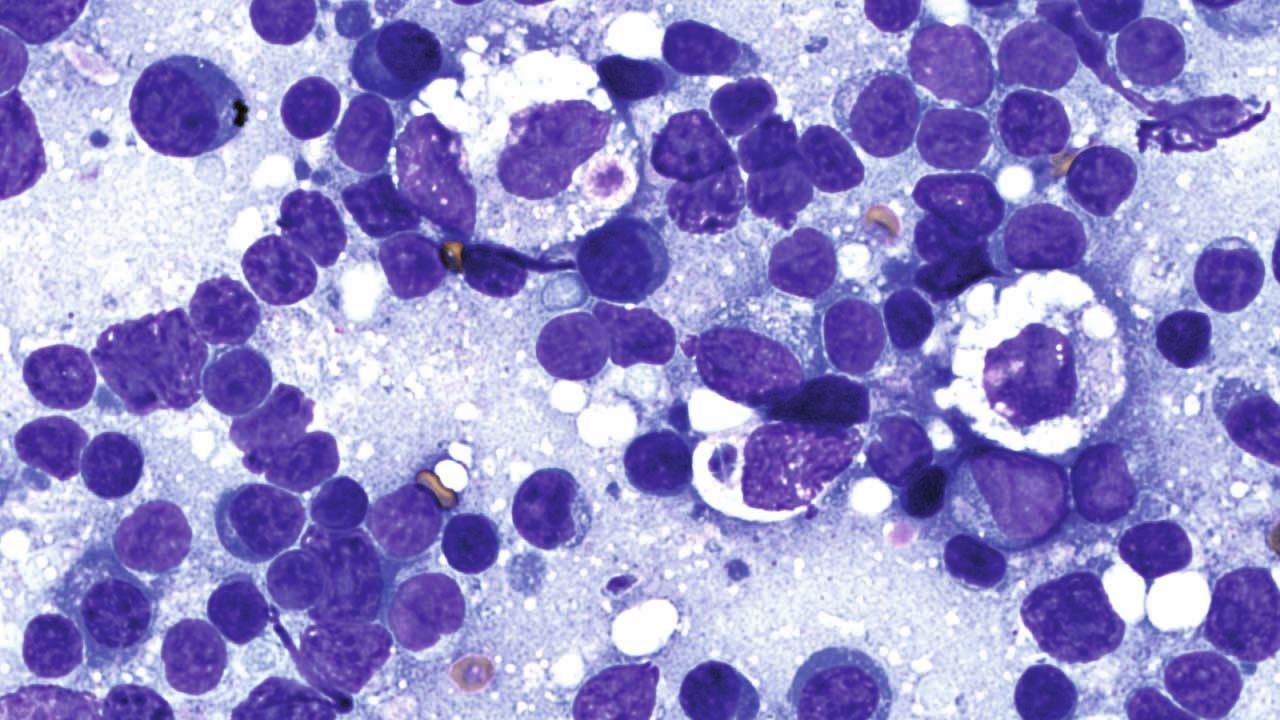
Faire un diagnostic fiable de toxoplasmose peut être délicat. Les anomalies hématologiques observées chez les chats atteints incluent une anémie non régénérative, une leucocytose, une lymphocytose, une monocytose et une éosinophilie. Les infections graves peuvent également provoquer une leucopénie, en particulier une neutropénie avec déviation dégénérative vers la gauche. Les modifications biochimiques dans le sérum et l’urine dépendent des organes concernés [6].
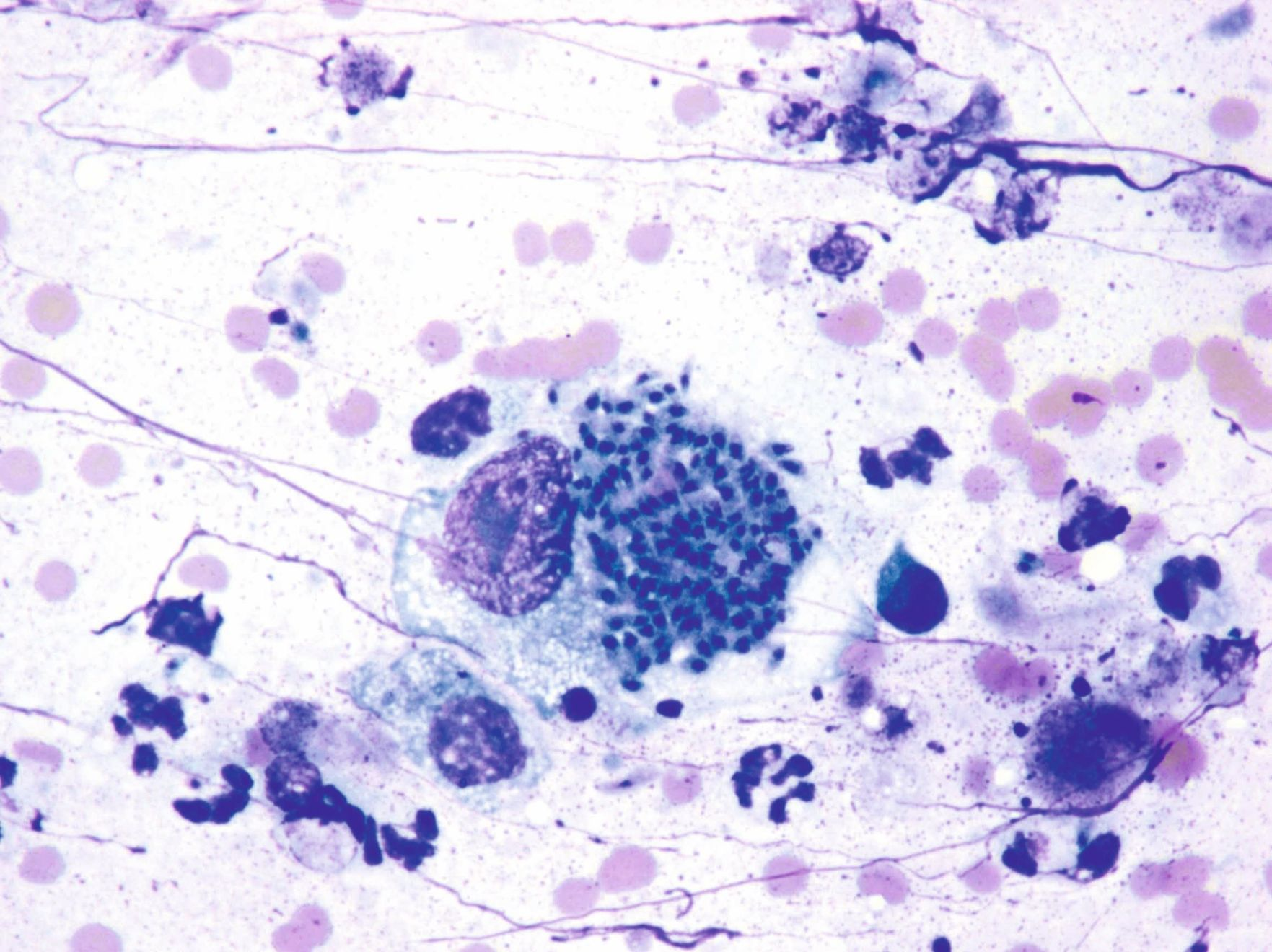
La seule recherche des oocystes de T. gondii dans les fèces n’est pas recommandée pour faire le diagnostic car la période d’excrétion est courte chez le chat, et parce que les oocystes de T. gondii peuvent être confondus avec d’autres parasites [4],[7]. En outre, la présence d’oocystes dans les fèces n’est pas corrélée avec le développement de la maladie clinique chez le chat [2]. Il est donc plutôt recommandé de procéder à des tests sérologiques pour établir un diagnostic ante mortem définitif ; des titres élevés d’IgM (> 1:256) sont généralement compatibles avec une infection récente par T. gondii. Il est également possible de comparer les taux d’IgG de prélèvements faits à 2-4 semaines d’intervalle mais l’interprétation des résultats peut être complexe (Tableau 1) [1],[2]. Certains chats présentent également une toxoplasmose chronique, au cours de laquelle des kystes tissulaires se rompent et libèrent à nouveau des bradyzoïtes dans la circulation ; ces épisodes peuvent être associés ou non à l’excrétion d’oocystes, selon le statut immunitaire de l’animal infecté [8].
Il n’est pas recommandé de rechercher des anticorps anti-T. gondii chez un chat sain [6] car ce dépistage sérologique n’est pas un indicateur précis du moment de l’excrétion d’oocystes chez le chat. La plupart des chats excrétant activement des oocystes sont en fait séronégatifs durant cette période [2].
Tableau 1. Interprétation des résultats du dosage sérologique d’Ig G anti-T. gondii [6].
| Résultat sérologique | Interprétation/analyse |
|---|---|
| Multiplication par un facteur ≥ 4 du taux d’anticorps dans les prélèvements de sérum appariés | Vrai positif (infection récente/active) |
| Multiplication par un facteur < 4 du taux d’anticorps dans les prélèvements de sérum appariés | Vrai négatif (pas d’infection récente ou active) OU faux négatif (infection en recrudescence) |
| Un seul résultat positif élevé (par exemple, 1:1000) | Présence de kystes de bradyzoïtes dans les tissus |
La toxoplasmose peut être difficile à repérer chez un chat car la plupart des infections sont asymptomatiques. Si des signes cliniques sont présents, fièvre, anorexie et léthargie sont les plus fréquents.
Traitement et pronostic
Il n’existe pas de traitement officiel pour la toxoplasmose féline mais, pour les cas aigus ou diffus, la clindamycine est le médicament de choix (10-12,5 mg/kg PO q12h jusqu’à 4 semaines), en prodiguant des soins appropriés en parallèle [6]. Pour réduire l’excrétion d’oocystes, la pyriméthamine (0,25-0,5 mg/kg PO q12h) ainsi que des sulfamides (15-30 mg/kg PO q12h) peuvent être administrés pendant 4 semaines maximum. Ces médicaments s’avèrent généralement bénéfiques pendant la phase aiguë de l’infection mais ils permettent rarement de l’éliminer. Une option alternative consiste à utiliser le triméthoprime et un sulfonamide associés (15 mg/kg PO q12h pendant 4 semaines) [2] ; des médicaments anticoccidiens (par exemple, toltrazuril, ponazuril) peuvent également être envisagés. Il convient de noter qu’aucun traitement ne s’est avéré significativement efficace au stade de l’infection par les bradyzoïtes [1].
Chez les chats qui présentent des signes cliniques de toxoplasmose, le pronostic dépend de plusieurs facteurs, notamment des organes affectés (Figures 7 et 8) et du temps écoulé entre l’infection et le début du traitement. Si les signes cliniques s’améliorent 2 à 3 jours après le démarrage du traitement, le pronostic est en général favorable, ce qui n’est pas le cas si l’infection par la toxoplasmose affecte les poumons ou le foie [4].
Conséquences zoonotiques
Chez l’Homme, une infection par T. gondii peut se produire à la suite de l’ingestion d’aliments ou d’eau contaminés par des oocystes, de kystes tissulaires présents dans des viandes insuffisamment cuites, ou via une transfusion sanguine, une transplantation d’organe ou une infection congénitale. La plupart des infections sont asymptomatiques mais des cas occasionnels de fièvre, de lymphadénopathie et d’inconfort ont été rapportés. T. gondii représente en revanche un sérieux risque pour la santé du fœtus durant la gestation, lorsque les tachyzoïtes migrent par voie transplacentaire. Une toxoplasmose congénitale peut provoquer des lésions oculaires ou neurologiques sévères [1]. En général, aucun symptôme n’apparaît à la naissance mais de graves troubles de la vision, des crises d’épilepsie ou d’autres troubles neurologiques peuvent apparaître ultérieurement chez ces individus [9]. Les personnes immunodéprimées, quel que soit leur âge, risquent aussi de développer des signes cliniques de toxoplasmose liés à une atteinte du cerveau, des poumons ou d’autres organes vitaux [5].
Il n’est pas utile de rechercher des anticorps contre T. gondii chez les chats sains : le test sérologique n’est pas un indicateur précis de l’excrétion d’oocystes et la plupart des chats sont séronégatifs au moment où ils excrètent activement des oocystes.
La contamination du sol et des eaux souterraines par des oocystes de Toxoplasma est de plus en plus souvent signalée dans le monde, et une méta-analyse de 22 études a conclu qu’il s’agissait d’un grave sujet de préoccupation. Les fèces de chats infectés peuvent contaminer des masses d’eau considérables [3]. Dans les océans, cette contamination a entraîné l’infection et la mort de nombreux mammifères marins, notamment des phoques, des baleines, des dauphins et des loutres de mer [10],[11]. L’eau potable est également menacée : un certain nombre d’épidémies de toxoplasmose humaine dans divers pays sont dues au fait que les litières de chat sont jetées dans les toilettes [12],[13].
Les oocystes sont remarquablement résistants ; ils peuvent survivre et rester infectieux pendant des années, même dans des conditions suboptimales [14]. En outre, il est probable que très peu d’oocystes suffisent pour infecter un humain ; des études menées sur des porcs ont montré qu’un seul oocyste suffisait pour induire l’infection [15]. Il est donc indispensable de prendre des mesures pour encourager l’élimination responsable des litières de chats.
Contrairement à une idée reçue, le contact direct avec les chats n’est pas un facteur de risque significatif d’infection humaine par Toxoplasma gondii [16]. De toute façon, le nettoyage quotidien du bac à litière est une mesure simple qui prévient l’infection (Figure 9) car les oocystes nécessitent au moins 24 heures pour devenir infectieux [4]. Il est également utile de garder le chat à l’intérieur quand c’est possible. Les vétérinaires ont un rôle essentiel à jouer pour informer leurs clients sur les mesures à prendre pour atténuer les risques d’infection par T. gondii, qu’il s’agisse du chat ou des humains (Tableau 2).

Tableau 2. Mesures destinées à limiter le risque zoonotique d’infection par T. gondii [1],[2],[3],[4].
| Mesures générales | Mesures spécifiques pour les chats |
|---|---|
| Se laver soigneusement les mains après avoir manipulé de la viande crue, jardiné ou réalisé d’autres activités à risque (par exemple, vider ou nettoyer une litière) | Garder les chats à l’intérieur |
| Laver soigneusement les couteaux de cuisine et les planches ayant servi à découper de la viande, des fruits ou des légumes crus | Ne nourrir les chats qu’avec des aliments préparés, secs ou humides, ou avec des ingrédients cuits |
| Bien cuire la viande avant de la consommer | Nettoyer le bac à litière tous les jours et éliminer la litière de manière responsable (par exemple, dans des sacs poubelles fermés) |
| Laver ou éplucher les fruits et les légumes avant de les consommer | Éviter que les femmes enceintes ou les personnes immunodéprimées ne nettoient la litière |
| Porter des gants pour jardiner | Couvrir les bacs à sable et la terre des aires de jeux extérieures pour empêcher les chats d’y déféquer |
Conclusion
Toxoplasma gondii est une infection parasitaire fréquente chez les chats mais elle est souvent asymptomatique, bien que des infections aiguës ou diffuses puissent affecter les yeux, le cerveau ou d’autres organes. Le traitement de prédilection passe par l’administration de clindamycine. Le diagnostic s’appuiera sur un dosage d’IgM ou une cinétique d’évolution des IgG. La toxoplasmose est une zoonose particulièrement dangereuse pour les femmes enceintes ou les personnes immunodéprimées mais posséder un chat n’est pas un facteur de risque important vis-à-vis de l’infection humaine. La consommation d’eau ou d’aliments contaminés par des oocystes, ou de kystes tissulaires dans des viandes insuffisamment cuites, représente une menace bien plus réelle. La contamination fécale du sol et de l’eau présente également un risque sanitaire sérieux. Des mesures d’hygiène simples peuvent pourtant prévenir la transmission de T. gondii : pour limiter considérablement le risque zoonotique, les propriétaires de chats seront incités à garder leur animal à l’intérieur et à nettoyer quotidiennement le bac à litière.
Christopher Fernandez-Prada
DMV, MSc, PhD, Département de Pathologie et Microbiologie, Université de Montréal, Canada
Canada
Dr vétérinaire et chercheur en parasitologie moléculaire, Christopher Fernandez-Prada se consacre à la lutte contre les parasites zoonotiques. Il est professeur associé au Collège vétérinaire de l’Université de Montréal (UdeM), directeur du laboratoire de diagnostic en parasitologie animale de l’Université, et professeur auxiliaire à la Faculté de médecine de l’Université McGill. Ses recherches portent sur les mécanismes de résistance aux médicaments, ainsi que sur le développement de nouveaux tests diagnostiques et de vaccins contre les protozoaires parasites.
Victoria Wagner
DMV, MSc, Département de Pathologie et Microbiologie, Université de Montréal, Canada
Canada
La Dre Wagner est diplômée du Collège vétérinaire de l’UdeM depuis 2020. Elle a ensuite obtenu un master en parasitologie vétérinaire dans la même institution, en collaboration avec le Centre universitaire de santé McGill, et en se concentrant sur la leishmaniose canine. La Dre Wagner travaille actuellement en clientèle généraliste pour animaux de compagnie et en médecine des animaux de laboratoire. Elle s’intéresse particulièrement à la recherche et à l’éducation en matière de parasites zoonotiques.
Références
- Mor GA. Toxoplasmosis in Animals. Merck Manual Veterinary Manual. 2022. https://www.msdvetmanual.com/generalized-conditions/toxoplasmosis/toxoplasmosis-in-animals accessed 17th January 2023
- Companion Animal Parasite Council (CAPC). CAPC Guidelines; Toxoplasma gondii. 2014. https://capcvet.org/guidelines/toxoplasma-gondii/ accessed 17th January 2023
- Torrey E. Sentinel seals, safe cats, and better treatments. In: Parasites, Pussycats and Psychosis. Springer, Cham. 2022;121-133.
- Cornell Feline Health Center. Toxoplasmosis in Cats. 2018 https://www.vet.cornell.edu/departments-centers-and-institutes/cornell-feline-health-center/health-information/feline-health-topics/toxoplasmosis-cats Accessed 17th January 2023
- Elmore SA, Jones JL, Conrad PA, et al. Toxoplasma gondii: epidemiology, feline clinical aspects, and prevention. Trends Parasitol. 2010;26(4):190-196.
- Barrs V. Feline Toxoplasmosis. In; Proceedings, WSAVA Congress 2013. Sydney, Australia.
- Abdul Hafeez M, Mehdi M, Aslam F, et al. Molecular characterization of Toxoplasma gondii in cats and its zoonotic potential for public health significance. Pathogens 2022;11(4):437.
- Castillo-Morales VJ, Acosta Viana KY, Guzmn-Marn EDS, et al. Prevalence and risk factors of Toxoplasma gondii infection in domestic cats from the Tropics of Mexico using serological and molecular tests. Interdiscip. Perspect. Infect. Dis. 2012;2012:529108.
- Center for Disease Control. Toxoplasmosis: An Important Message for Cat Owners. https://www.cdc.gov/parasites/toxoplasmosis/resources/printresources/catowners_2017.pdfaccessed 17th January 2023
- Iqbal A, Measures L, Lair S, et al. Toxoplasma gondii infection in stranded St. Lawrence Estuary beluga Delphinapterus leucas in Quebec, Canada. Dis. Aquat. Organ 2018;130(3):165-175.
- Miller MA, Grigg ME, Kreuder C, et al. An unusual genotype of Toxoplasma gondii is common in California sea otters (Enhydra lutris nereis) and is a cause of mortality. Int. J. Parasitol. 2004;34(3):275-284.
- Bowie, WR, King AS, Werker DH, et al. Outbreak of toxoplasmosis associated with municipal drinking water. The BC Toxoplasma Investigation Team. Lancet 1997;350(9072):173-177.
- Shapiro K, Bahia-Oliveira L, Dixon B, et al. Environmental transmission of Toxoplasma gondii: Oocysts in water, soil and food. Food Waterborne Parasitol. 2019;15;e00049.
- Yilmaz SM, Hopkins SH. Effects of different conditions on duration of infectivity of Toxoplasma gondii oocysts. J. Parasitol. 1972;58(5):938-939.
- Dubey JP, Lunney JK, Shen SK, et al. Infectivity of low numbers of Toxoplasma gondii oocysts to pigs. J. Parasitol. 1996;82(3):438-443.
- Dubey JP, Jones JL. Toxoplasma gondii infection in humans and animals in the United States. Int. J. Parasitol. 2008;38(11):1257-1278.
Autres articles de ce numéro
Partager sur les réseaux sociaux