Le syndrome dilatation-torsion de l’estomac
Ecrit par Emma Donnelly et Daniel Lewis
Le syndrome dilatation-torsion de l’estomac (SDTE) met en jeu le pronostic vital et nécessite un diagnostic et un traitement précoces. Bien que des cas aient été décrits chez le chat, ce syndrome est plus fréquent chez le chien et implique une dilatation gazeuse de l’estomac associée à une rotation autour de son axe longitudinal.
Points clés
La dilatation-torsion de l’estomac est un syndrome potentiellement mortel ; un diagnostic et un traitement précoces sont essentiels pour réduire la morbidité et la mortalité associées.
La physiopathologie de la dilatation gastrique est un sujet complexe et non entièrement élucidé.
La décompression gastrique est une étape cruciale du traitement, et se fait soit par sondage gastrique soit par trocardisation percutanée.
Le taux sérique de lactate est un bon indicateur de la réponse au traitement ; sa baisse de plus de 50 % dans les 12 heures suivant le début du traitement serait un indicateur positif de survie.
Introduction
Le syndrome dilatation-torsion de l’estomac (SDTE) met en jeu le pronostic vital et nécessite un diagnostic et un traitement précoces. Bien que des cas aient été décrits chez le chat, ce syndrome est plus fréquent chez le chien et implique une dilatation gazeuse de l’estomac associée à une rotation autour de son axe longitudinal. Historiquement, le taux de mortalité associé au SDTE a longtemps été considéré comme élevé ; différentes études le situant entre 15 % et 68 % [1] [2] [3] [4] [5], mais une meilleure compréhension de ce syndrome devrait permettre de réduire la morbidité et la mortalité qui lui sont associées.
Facteurs prédisposants
Les facteurs prédisposants du SDTE incluent des facteurs génétiques et environnementaux. Ce syndrome est plus fréquemment observé chez des chiens de races grandes ou géantes, mais peut aussi toucher des races plus petites. Des prédispositions raciales ont été identifiées, les races à risque incluant le Dogue Allemand, le Berger Allemand, le Caniche moyen et le Setter Irlandais, mais cette liste est loin d’être exhaustive. Selon une étude, ce syndrome serait plus prévalent chez le Grand Bleu de Gascogne [6], cette race étant toutefois peu rencontrée en pratique. Le risque de développer ce syndrome augmente avec l’âge, quelle que soit la race ; une étude (centrée sur les Setters Irlandais) a montré que le risque augmentait de 33 % pour chaque année de vie supplémentaire [7]. La distension du ligament hépato-gastrique autoriserait une plus grande mobilité de l’estomac chez le chien âgé [8] [9]. Les chiens à thorax profond sont également plus à risque de SDTE ; cela pourrait être dû à une différence de rapport anatomique entre l’estomac et l’œsophage qui rend plus difficile l’évacuation de l’air de l’estomac [7]. Le caractère anxieux est également perçu comme un facteur prédisposant, souvent mentionné par les propriétaires de chiens ayant développé un SDTE [8], tandis que les animaux décrits comme sereins semblent moins à risque de développer ce syndrome [7]. Les chiens ayant des antécédents familiaux de SDTE au premier degré (parents, enfants ou frères et sœurs) sont également considérés comme plus à risque [7]. Tous ces facteurs sont probablement liés à des facteurs génétiques qui prédisposent à la maladie.
Le risque de SDTE a été associé à un certain nombre de facteurs environnementaux incluant des facteurs alimentaires, tels que la consommation d’un seul repas volumineux par jour, le fait de manger en hauteur et différents ingrédients de la ration, mais les relations de cause à effet n’ont pas été totalement établies [10].
Un risque accru de SDTE après splénectomie a été décrit [11]. L’étude en question ne suggère pas qu’il existe un lien entre la cause de la splénectomie et le SDTE, mais plutôt que l’exérèse de la rate libère de la place dans l’abdomen autorisant une plus grande mobilité de l’estomac, ce qui augmente le risque de SDTE [12]. La torsion splénique est une complication potentielle du SDTE, et s’explique probablement par le fait que l’estomac pousse la rate en tournant sur lui-même.
Physiopathologie du SDTE
Les chiens atteints de SDTE arrivent souvent en état de choc et peuvent être victimes de plusieurs types de choc à la fois – obstructif, distributif, cardiogénique et hypovolémique, par exemple. L’estomac dilaté peut bloquer la circulation dans la veine cave caudale, entraînant une baisse du volume sanguin qui retourne au cœur. Cela entraîne une baisse de la précharge et du volume d’éjection systolique, qui diminue le débit cardiaque ; ce phénomène est souvent qualifié de choc obstructif. Les animaux sont souvent présentés à la consultation avec une tachycardie, qui est une réaction compensatoire destinée à maintenir le débit cardiaque. Le stress et la douleur doivent également être considérés comme des facteurs contributifs de la tachycardie [15].
Une augmentation de la pression veineuse dans l’abdomen induit une séquestration de sang dans les veines splanchniques et portes. Ce phénomène, associé à l’augmentation de l’expression de la NO synthase inductible (iNOS) et à la libération de cytokines vasoactives résultant de l’inflammation gastrique, entraîne une vasodilatation périphérique qui risque d’aggraver l’accumulation sanguine et, par voie de conséquence, une dégradation de l’état de l’animal [15]. Ces facteurs provoquent ensemble un choc distributif.
Le choc hypovolémique ne joue pas un rôle majeur chez ces animaux, bien qu’une torsion splénique puisse, comme nous l’avons dit, avoir lieu et que les artères et veines gastriques courtes puissent se déchirer et entraîner un hémoabdomen. Une baisse de la consommation orale de liquides peut contribuer à la déshydratation, mais il est peu probable qu’elle soit suffisamment importante pour altérer la pression artérielle [15].
L’atteinte cardiaque est étroitement liée à la morbidité et la mortalité de ces chiens. Une ischémie myocardique peut se développer du fait de l’hypoperfusion globale ; en outre, certaines des cytokines pro-inflammatoires libérées lors du SDTE ont un effet dépresseur direct sur le myocarde. Le suivi ECG peut renseigner sur la présence éventuelle de lésions myocardiques [16], par la détection de modifications de l’activité électrique. Le dosage de la troponine cardiaque sérique peut permettre d’évaluer l’atteinte cardiaque, l’augmentation de ce biomarqueur étant de mauvais pronostic, mais son intérêt est limité si le prélèvement doit être envoyé à un laboratoire extérieur.
Parmi les chiens souffrant de SDTE, 40 % présenteraient une arythmie cardiaque et un certain degré de dysfonction myocardique [1] [2] [15]. Des arythmies potentiellement mortelles ne sont pas forcément présentes avant la correction chirurgicale du SDTE, elles peuvent se développer jusqu’à 72 heures après. Selon une étude, un diagnostic d’arythmie cardiaque établi avant la chirurgie serait associé à une augmentation de 25 à 38 % du taux de mortalité [2]. La présence d’une arythmie n’est pas nécessairement un critère déterminant dans la décision chirurgicale ou d’euthanasie, mais c’est un critère à prendre en compte conjointement avec l’examen clinique complet et l’anamnèse pour affiner le pronostic.
Les animaux peuvent montrer des signes de détresse respiratoire, tels qu’une augmentation de la fréquence et de l’effort respiratoires. Ces signes peuvent être dus à l’augmentation de taille de l’estomac. Normalement, le diaphragme se déplace caudalement pendant l’inspiration mais peut en être empêché si l’estomac est dilaté [17], et la réduction du volume intrathoracique peut diminuer la capacité respiratoire totale et entraîner une inadéquation entre ventilation et perfusion pulmonaire. La pneumonie par fausse déglutition est aussi un risque ; elle peut préexister à la chirurgie ou en être une complication, et elle peut assombrir le pronostic. Si la fonction pulmonaire est sévèrement altérée par l’un ou l’autre de ces problèmes, une hypoxémie risque de se développer, encore au détriment de l’animal.
Diagnostic

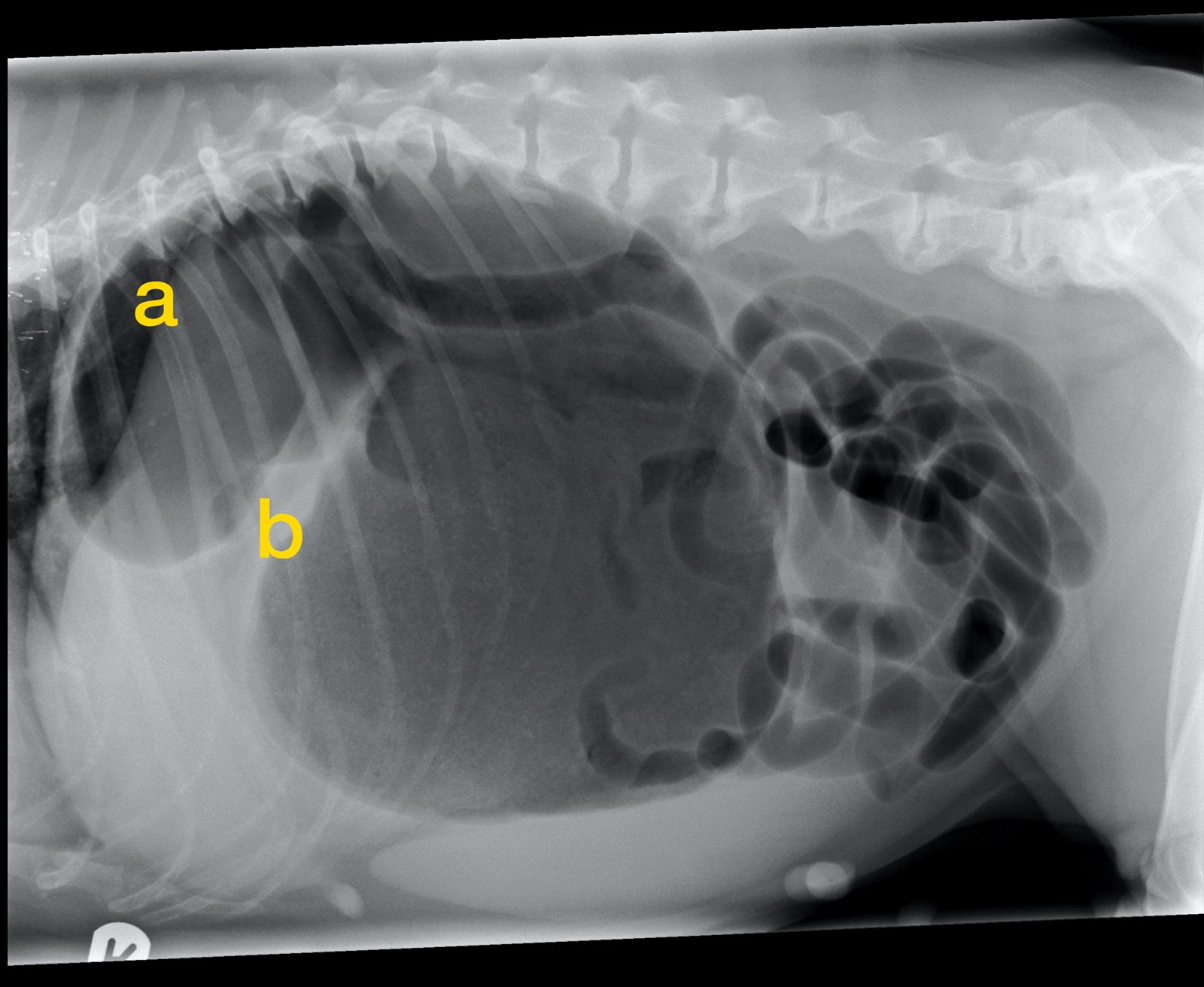
L’imagerie diagnostique permet de confirmer la présence d’une torsion, ou d’une dilatation gastrique seule ; cette distinction est importante car la dilatation ne nécessite pas forcément une chirurgie immédiate. Une radiographie abdominale latérale droite suffit généralement pour établir le diagnostic. En cas de SDTE classique, deux structures remplies de gaz sont alors visibles dans l’abdomen crânial (Figure 3) : la plus grande structure correspond au fundus, et la petite, située dorsalement, au pylore. Les deux zones remplies de gaz peuvent être séparées par une bande de tissu mou. La radiographie du thorax est également utile car elle peut renseigner de manière précoce sur la présence d’une pneumonie par fausse déglutition et permettre ainsi d’instaurer rapidement un traitement antimicrobien [18].

Traitement initial
Il est important de bien noter les résultats de l’examen clinique initial pour pouvoir évaluer la réponse au traitement : fréquence cardiaque, fréquence respiratoire, qualité du pouls, couleur des muqueuses, temps de remplissage capillaire et, si possible, pression artérielle. Un cathéter intraveineux de gros diamètre doit être mis en place (normalement dans la veine céphalique) le plus rapidement possible pour débuter la fluidothérapie.
Chez les grands chiens, il peut être difficile d’administrer assez rapidement un volume de liquide suffisant pour augmenter la précharge avec un seul cathéter, et la pose d’un deuxième cathéter dans l’autre veine céphalique peut s’avérer utile. La vitesse de perfusion dépend des signes cliniques et de la présence éventuelle d’un autre problème sous-jacent, mais il est généralement recommandé d’administrer les cristalloïdes à raison de 90 mL/kg/h (traitement du choc), les paramètres vitaux étant évalués toutes les 15 minutes. Il peut toutefois être préférable d’administrer de plus petits volumes en bolus (20 mL/kg en 15 minutes, par exemple), et de réévaluer fréquemment en ajustant la posologie si nécessaire. Un agoniste complet des récepteurs opioïdes (méthadone à 0,2-0,3 mg/kg IV, par exemple) doit être administré le plus tôt possible [19].
La décompression gastrique rapide revêt une importance capitale car le risque d’hypoxémie est immense. A cet égard, la pose d’une sonde gastrique ou la trocardisation percutanée constituent deux bonnes options. Une étude comparant ces deux techniques a conclu qu’aucune n’était associée à un taux de complications élevé et qu’elles étaient toutes les deux globalement efficaces [20]. La chirurgie ne devra être mise en œuvre qu’après stabilisation de l’animal, qui sera déterminée par les résultats de l’examen clinique, tels que la résolution de la tachycardie ou la normalisation des paramètres cardiovasculaires.
Résultats de laboratoire
Chirurgie
Le choix de la prémédication et de l’induction est à la discrétion du vétérinaire. La méthadone suffit généralement à l’analgésie initiale. L’anesthésie est maintenue avec l’isoflurane ou le sévoflurane ; il ne faut pas administrer de N2O en cas de SDTE, car il s’accumule dans les espaces gazeux et risque donc d’aggraver la dilatation gastrique. Comme le chien peut régurgiter une fois que son estomac a été remis en place, il peut être utile d’avoir un équipement d’aspiration prêt à servir. Sachant que le reflux gastro-œsophagien est un facteur de risque connu d’œsophagite et de sténose œsophagienne post-opératoire, l’administration d’oméprazole (1 mg/kg IV) avant l’induction peut permettre de réduire ce risque [17].
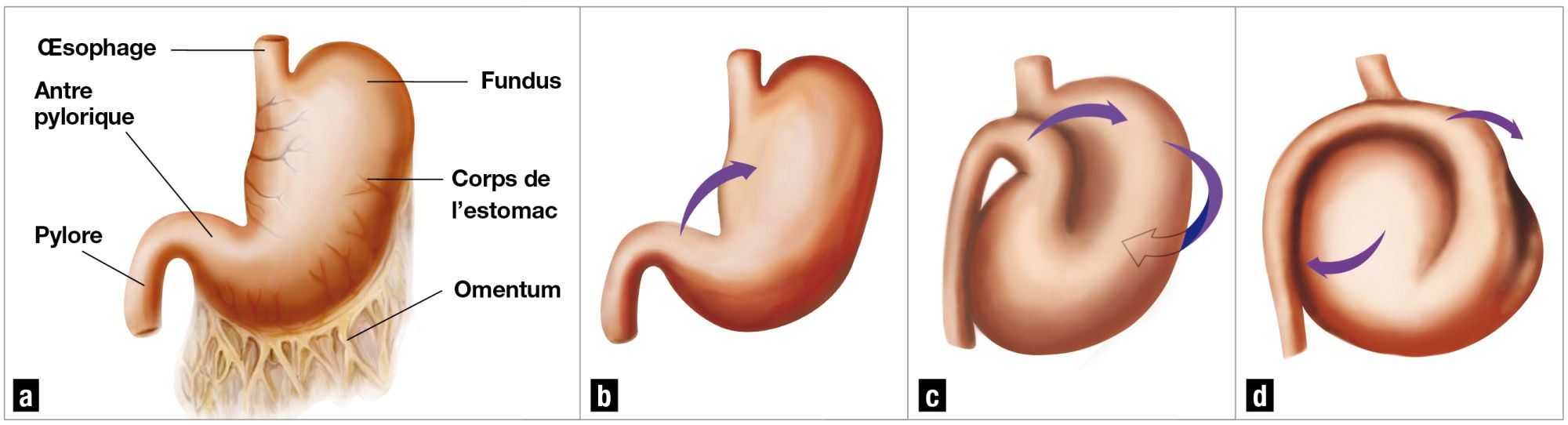
L’objectif de la chirurgie est de détordre l’estomac. La torsion se fait habituellement dans le sens horaire (vu de l’arrière de l’animal) et, à l’incision, l’épiploon recouvre généralement l’estomac. La dilatation gazeuse alors observée peut facilement être réduite en fixant une aiguille ou une canule au système d’aspiration chirurgicale. Le chirurgien doit localiser le pylore (souvent situé dorsalement et à gauche dans l’abdomen), et le saisir d’une main tandis qu’il tient le fundus de l’autre. Le fundus doit alors être repoussé vers la table d’opération tandis que le pylore est remonté vers l’incision et ramené vers la droite de l’abdomen. Ce pousser-tirer simultané doit permettre de corriger la position de l’estomac (Figure 4).
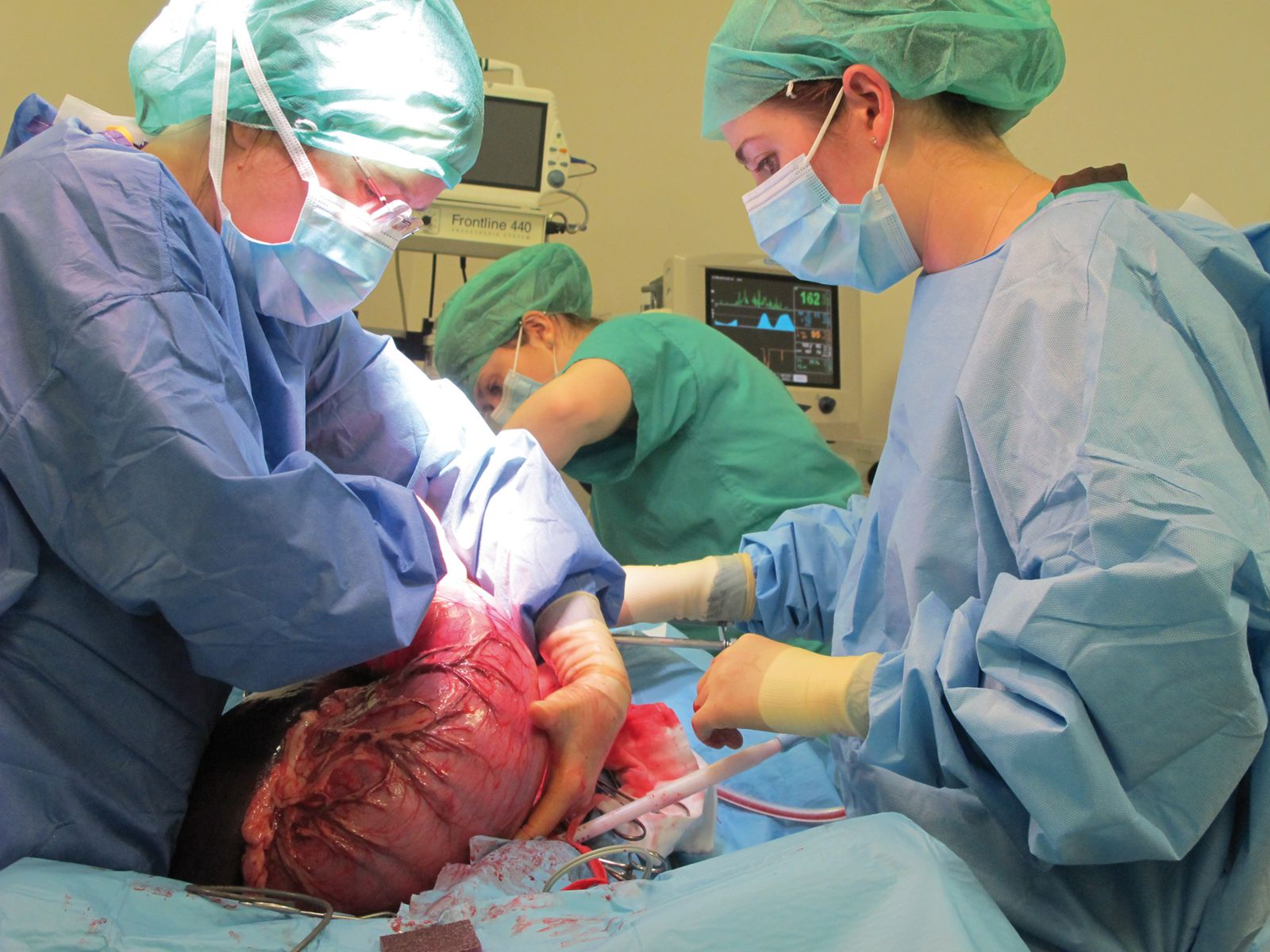
Une fois l’estomac remis en place, il doit être fixé à la paroi abdominale pour prévenir toute récidive. Différentes techniques de gastropexie sont décrites dans la littérature, la plus utilisée étant la gastropexie incisionnelle. Pour cette technique, une incision est réalisée dans la séro-musculeuse de la paroi gastrique, parallèlement au grand axe de l’estomac, au niveau de l’antre pylorique. Une autre incision de la même longueur est réalisée dans le muscle abdominal transverse droit et les deux incisions sont suturées ensemble avec un fil monofilament résorbable, dans le but de former une adhérence empêchant toute torsion ultérieure [22].
Complications influençant le pronostic
Lors de la chirurgie, l’estomac doit être évalué en termes de couleur, d’épaisseur de paroi et de perfusion sanguine, et la viabilité tissulaire doit être déterminée ; toute zone de nécrose doit être réséquée. La rate doit également être examinée ; si l’artère ou la veine splénique est lésée, ou si une hémorragie active est observée, une splénectomie devra être effectuée. La mortalité post-opératoire est significativement augmentée chez les animaux nécessitant une résection gastrique ou une splénectomie ; une étude a montré que la gastrectomie partielle n’était pas associée à un risque accru de décès mais que le risque de complications post-opératoires était augmenté [3]. En cas de nécrose gastrique prononcée excluant toute possibilité de résection, une euthanasie sera nécessaire. Il faut souligner que l’euthanasie peut être la solution choisie dans certains cas, soit pour raisons économiques soit parce qu’il existe une maladie concomitante sévère. Le vétérinaire devra discuter en détail avec le propriétaire des risques, des coûts et des résultats possibles avant de s’engager dans une chirurgie.
Soins post-opératoires
Les animaux sévèrement hypoperfusés avant l’anesthésie peuvent mettre du temps à récupérer de la chirurgie et nécessiter des soins intensifs. Après rétablissement de la perfusion, des complications post-opératoires liées à des lésions d’ischémie-reperfusion peuvent se développer. Celles-ci sont associées à une hausse de la mortalité, car les lésions myocardiques peuvent entraîner le développement d’arythmies. Le suivi ECG doit être maintenu en post-opératoire car les arythmies cardiaques sont fréquentes après un SDTE ; les plus fréquentes sont d’origine ventriculaire, bien qu’il puisse également y avoir des arythmies supra-ventriculaires. Si celles-ci sont jugées significatives, le traitement de choix est la lidocaïne administrée d’abord en bolus de 2 mg/kg (renouvelable jusqu’à un total de 8 mg/kg) puis en perfusion continue (CRI) à 25-75 μg/kg/minute. Au moins une étude a évalué l’utilisation de la lidocaïne en préventif lors de SDTE chez le chien [23]; administrée en bolus avant la décompression gastrique et la fluidothérapie, la lidocaïne permettait de réduire les lésions d’ischémie-reperfusion, les risques de complications, et le taux de mortalité.
Chez les animaux ayant nécessité une résection gastrique extensive, la pose d’une sonde œsophagienne peut être bénéfique. Les nausées post-opératoires peuvent être traitées avec des médicaments de type maropitant. Une analgésie sera décidée au cas par cas ; des opioïdes comme la méthadone pourront être administrés en post-opératoire précoce, avec une transition vers la buprénorphine au moment opportun. Les AINS sont à proscrire en raison du risque d’effets indésirables sur la paroi gastrique et la fonction rénale. La fluidothérapie sera maintenue jusqu’à ce que l’animal se remette à manger et à boire.
Conclusion
Emma Donnelly
BSc, BVMS, Dip. ECVECC, MRCVS, Vets Now 24/7, Centre hospitalier vétérinaire d’urgences, Glasgow, Royaume-Uni
La Dre Donnelly est diplômée de l’Université de Glasgow depuis 2013 et a fait son internat à la clinique Vets Now de cette ville, une structure dédiée aux interventions spécialisées pendant les périodes de gardes. C’est à cette occasion qu’elle a pris goût à la médecine d’urgence et aux soins intensifs. Elle a continué à se former et se spécialiser dans cette discipline, notamment via une résidence. Elle a réintégré le réseau Vets Now en 2020, où elle travaille actuellement en tant que consultante et où elle supervise le programme de résidence. Ses principaux domaines d’intérêt sont la médecine néonatale et pédiatrique.
Daniel Lewis
MA, VetMB, CertVA, Dip. ACVECC, MRCVS
Diplômé de l’Ecole Vétérinaire de Cambridge en 1995, le Dr Lewis exerce en clientèle mixte pendant cinq ans, puis obtient son Certificat d’Anesthésie Vétérinaire. Il travaille ensuite pendant huit ans dans une grande clinique hospitalière d’urgence de Manchester, avant d’effectuer un résidanat au Royal Veterinary College de Londres, et devient diplômé du Collège Américain d’Urgences et de Soins Intensifs en 2011. Le Dr Lewis rejoint le centre de référé Vets-Now en 2015 et s’intéresse tout particulièrement à la médecine féline et aux animaux septiques.
Références bibliographiques
- Brockman DJ, Washabau RJ, Drobatz KJ. Canine gastric dilatation-volvulus syndrome in a veterinary critical care unit: 295 cases (1986-1992). J Am Vet Med Assoc 1995;207:460-464.
- Bourman JD, Schertel ER, Allen DA, et al. Factors associated with perioperative mortality in dogs with surgically managed gastric dilatationvolvulus: 137 cases (1988-1993). J Am Vet Med Assoc 1996;208:1855- 1858.
- Beck JJ, Staatz AJ, Pelsue DH, et al. Risk factors associated with short-term outcome and development of perioperative complications in dogs undergoing surgery because of gastric dilatation-volvulus; 166 cases (1992-2003). J Am Vet Med Assoc 2006;299:1934-1939.
- Muir WW. Gastric dilatation-volvulus in the dog, with emphasis on cardiac arrhythmias. J Am Vet Med Assoc 1982;180:739-742.
- Glickman LT, Lantz GC, Schellenberg DB, et al. A prospective study of survival and recurrence following the acute gastric dilatation volvulus syndrome in 136 dogs. J Am Anim Hosp Assoc 1998;34(3):253-259.
- Evans KM, Adams VJ. Mortality and morbidity due to gastric dilatation-volvulus syndrome in pedigree dogs in the UK. J Small Anim Pract 2010;51;376-381.
- Schellenberg DB, Yi Q, Glickman NW, et al. Influence of thoracic conformation and genetics on the risks of gastric dilatation and volvulus in Irish Setters. J Am Anim Hosp Assoc 1998;34:64-73.
- Bell JS. Inherited and predisposing factors in the development of gastric dilatation and volvulus in dogs. Topics Comp Anim Med 2014;29(3):60-63.
- Hall JA, Willer RI, Seim HB, et al. Gross and histological evaluation of hepatogastric ligaments in clinically normal dogs and dogs with gastric dilatation-volvulus. Am J Vet Res 1995;56:1611-1614.
- Raghavan M, Glickman NW, Glickman LT. The effect of ingredients in dry dog foods on the risk of gastric dilatation-volvulus in dogs. J Am Anim Hosp Assoc 2006;42:28-36.
- Sartor AJ, Bentley AM, Brown DC. Association between previous splenectomy and gastric dilatation-volvulus in dogs: 453 cases (2004-2009). J Am Vet Med Assoc 2013;242:1381-1384.
- Millis DL, Nemzek J, Riggs C. Gastric dilatation-volvulus after splenic torsion in two dogs. J Am Vet Med Assoc 1995;207:314-315.
- Van Kruiningen HJ, Gargamelli C, Havier J, et al. Stomach gas analyses in canine acute gastric dilatation and volvulus. J Vet Intern Med 2013;27;1260- 1261.
- Glickman LT, Glickman NW, Schellenberg DB, et al. Non-dietary risk factors for gastric dilatation-volvulus in large and giant breeds of dogs. J Am Vet Med Assoc 2000;217(10):1492-1499.
- Sharp CR, Rozanski EA. Cardiovascular and systemic effects of gastric dilatation and volvulus in dogs. Topics Comp Anim Med 2014;29(3):67-70.
- Adamik KN, Burgener IA, Kovacevic A, et al. Myoglobin as a prognostic indicator for outcome in dogs with gastric dilatation and volvulus. J Vet Emerg Crit Care 2009;19(3):247-253.
- Sharp CR. Gastric dilatation-volvulus. In: Silverstein DC, Hopper K (eds). Small Animal Critical Care Medicine. Missouri, Elsevier Inc. 2009;584-588.
- Green JL, Cimino Brown D, Agnello KA. Preoperative thoracic radiographic findings in dogs presenting for gastric dilatation-volvulus (2000-2010): 101 cases. J Vet Emerg Crit Care 2012;22:595-600.
- Ramsay I. BSAVA Small Animal Formulary 8th Ed. Gloucester: BSAVA 2014;248-249.
- Goodrich ZJ, Pavell L, Hulting KJ. Gastric decompression. J Small Anim Pract 2013;54:75-79.
- Green TI, Tonozzi CC, Kirby R, et al. Evaluation of plasma lactate values as a predictor of gastric necrosis and initial and subsequent plasma lactate values as a predictor of survival: 84 dogs (2003-2007). J Vet Emerg Crit Care 2011;21(1):36-44.
- Radlinsky MAG. Gastric Dilatation-volvulus. In: Fossum TW (ed). Small Animal Surgery (4th ed) Missouri: Mosby, Inc. 2013;482-487.
- Bruchim Y, Itay S, Shira BH, et al. Evaluation of lidocaine treatment on frequency of cardiac arrhythmias, acute kidney injury and hospitalization time in dogs with gastric dilatation volvulus. J Vet Emerg Crit Care 2012;22:419- 427.
- Monnet E. Gastric dilatation-volvulus syndrome in dogs. Vet Clin North Am Small Anim Pract 2003;33(5):987-1005.
Autres articles de ce numéro
Partager sur les réseaux sociaux