Les traumatismes crâniens chez le chat
Ecrit par Simon Platt
Il est crucial de savoir reconnaître les signes cliniques d’une dégradation de l’état neurologique pour bien prendre en charge les chats ayant subi un traumatisme crânien. Les traumatismes qui ont été suffisamment importants pour provoquer des lésions cérébrales sont responsables d’effets systémiques, susceptibles d’engager le pronostic vital.

Points clés
Une évaluation systémique approfondie chez tous les chats ayant subi un traumatisme est essentielle avant de se concentrer sur le système nerveux.
L’examen neurologique du chat traumatisé crânien peut se réduire à une évaluation de la vigilance, du fonctionnement des membres et des réflexes pupillaires photomoteurs.
L’imagerie du cerveau peut aider à identifier les causes d’une dysfonction neurologique chez le traumatisé crânien, mais aboutit rarement à un traitement chirurgical.
La fluidothérapie est essentielle dans tous les cas de traumatisme crânien et doit viser à rétablir la pression artérielle systémique.
Une oxygénothérapie est recommandée en première intention en cas de traumatisme cérébral.
Introduction
Il est crucial de savoir reconnaître les signes cliniques d’une dégradation de l’état neurologique pour bien prendre en charge les chats ayant subi un traumatisme crânien [1] [2] [3] [4]. Les traumatismes qui ont été suffisamment importants pour provoquer des lésions cérébrales sont responsables d’effets systémiques, susceptibles d’engager le pronostic vital. En outre, les lésions systémiques et le choc dégradent encore l’état du traumatisé crânien, et il est donc nécessaire d’effectuer, en plus d’une évaluation neurologique complète, une évaluation systémique complète et une stabilisation de l’animal, comme le résume le Tableau 1.
| Paramètre | Objectif proposé | Traitement proposé |
|---|---|---|
| Examen neurologique | Score de coma de Glasgow > 15 |
Veiller à ce que la tête soit surélevée (à 30°)
Veiller à traiter tous les points ci-dessous Envisager d’administrer du mannitol (voir ci-dessous) Envisager une chirurgie (voir texte) |
| Pression artérielle | PAM 80-120 mmHg |
Ajuster la fluidothérapie
Soutien de la pression artérielle (dopamine 2-10 μg/kg/min) |
| Gaz du sang |
PaO2 ≥ 90 mmHg
PaCO2 < 35-40 mmHg
|
Supplémentation en oxygène
Envisager une ventilation assistée |
| Pulsoxymétrie | SPO2 ≥ 95% |
Supplémentation en oxygène
Envisager une ventilation assistée |
| Fréquence et rythme cardiaques |
Eviter la tachycardie et la bradycardie
Eviter les arythmies |
Ajuster la fluidothérapie
Traiter la douleur Traiter l’HTIC Traiter les arythmies de manière spécifique |
| Pression veineuse centrale | 5-12 cm H2O | Ajuster la fluidothérapie |
| Fréquence et rythme respiratoires | 10-25/min | Ventiler si nécessaire |
| Température corporelle | 37-38.5 °C | Réchauffement ou refroidissement passif |
| Ionogramme | (Voir les normes de référence du laboratoire) | Ajuster la fluidothérapie |
| Glycémie | 4-6 mmol/L (67-168 mg/dL) |
Ajuster la fluidothérapie
Envisager l’administration de dextrose si hypoglycémie |
| Pression intracrânienne | 5-12 mmHg | Comme pour les anomalies du score de coma de Glasgow (voir plan d’action en Figure 4) |
Evaluation générale
L’évaluation initiale doit inclure les systèmes respiratoire et cardiovasculaire du chat. Les voies aériennes doivent être dégagées et une intubation endotrachéale mise en place au besoin. La respiration peut être modifiée directement par un traumatisme thoracique, ou indirectement par un traumatisme cérébral. L’auscultation du thorax peut révéler un problème pulmonaire ou une arythmie cardiaque. Le système cardiovasculaire doit être évalué grâce à un suivi de la fréquence cardiaque, de la pression artérielle et du tracé électrocardiographique (ECG). Ce tracé peut révéler des arythmies cardiaques secondaires à une myocardite traumatique, un choc systémique ou une atteinte cérébrale. L’analyse du sang artériel et des concentrations de lactate peut apporter des informations supplémentaires sur la perfusion systémique et la fonction respiratoire [1] [2] [3] [4].
Une fois l’animal stabilisé, des radiographies du thorax et de l’abdomen sont recommandées pour rechercher des atteintes pulmonaires, un pneumothorax ou des lésions abdominales. Les contusions pulmonaires sont fréquentes après un traumatisme et leur sévérité peut n’être maximale qu’après 24 heures. Le traumatisme peut également léser des organes abdominaux ; l’abdomen doit être évalué par palpation, radiographie et échographie pour détecter un éventuel épanchement liquidien, sanguin ou urinaire, nécessitant un traitement supplémentaire. Une radiographie des vertèbres cervicales doit également être envisagée, car les traumatismes crâniens s’accompagnent souvent de fractures et de luxations vertébrales.
Evaluation neurologique
Une évaluation neurologique doit être réalisée chez tous les traumatisés crâniens [1] [2] [3] [4] [5]. L’état neurologique doit initialement être évalué toutes les 30-60 minutes, car cela permet de suivre l’efficacité du traitement et de détecter rapidement une éventuelle dégradation.
Un système de score, l’échelle de coma de Glasgow modifiée, a été développé en médecine vétérinaire pour proposer une évaluation objective et permettre une prise de décisions diagnostiques et thérapeutiques raisonnées. Cette échelle évalue trois catégories – activité motrice, réflexes du tronc cérébral et état de conscience – permettant de faire un bilan initial puis de suivre de façon régulière les animaux après le traumatisme (Tableau 2). Chaque catégorie est évaluée à l’aide de critères objectifs et est notée de 1 à 6, les scores étant inversement proportionnels à la sévérité des signes cliniques. Les scores de chaque catégorie sont ensuite additionnés pour déterminer le score de Glasgow de l’animal, compris entre 3 et 18, qui sert notamment à orienter les décisions thérapeutiques et le pronostic [5].
| Activité motrice | Score | Réflexes du tronc cérébral | Score | Etat de conscience | Score |
|---|---|---|---|---|---|
| Démarche normale, réflexes médullaires normaux | 6 | Réflexes pupillaires photomoteurs et oculocéphaliques normaux | 6 | Périodes de vigilance et de réactivité à l’environnement | 6 |
| Hémiparésie, tétraparésie ou activité de décérébration | 5 | Réflexes pupillaires photomoteurs lents et réflexes oculocéphaliques normaux ou réduits | 5 | Dépression ou délire, animal capable de réagir mais sa réaction peut être inadaptée | 5 |
| Décubitus latéral, rigidité intermittente des extenseurs | 4 | Myosis bilatéral aréflectif avec réflexes oculocéphaliques normaux ou réduits | 4 | Semi-comateux, réactivité aux stimuli visuels | 4 |
| Décubitus latéral, rigidité constante des extenseurs | 3 | Micropupilles avec réflexes oculocéphaliques réduits ou absents | 3 | Semi-comateux, réactivité aux stimuli auditifs | 3 |
| Décubitus latéral, rigidité constante des extenseurs avec opisthotonos | 2 | Mydriase unilatérale aréflective avec réflexes oculocéphaliques réduits ou absents | 2 | Semi-comateux, réactivité aux stimuli nociceptifs répétés uniquement | 2 |
| Décubitus latéral, hypotonie musculaire, réflexes médullaires diminués ou absents | 1 | Mydriase bilatérale aréflective avec réflexes oculocéphaliques réduits ou absents | 1 | Comateux, absence de réactivité aux stimuli nociceptifs répétés | 1 |
Evaluation du fonctionnement des membres
La première catégorie décrit l’activité motrice de l’animal, son tonus musculaire et sa posture. L’activité motrice volontaire peut être qualifiée de « normale », « parésie », ou « décubitus ». Les animaux conservent généralement un certain degré d’activité motrice volontaire, même lors d’altération de l’état de conscience, sauf lors d’état comateux. Une fonction motrice anormale traduit habituellement une lésion localisée soit au tronc cérébral soit à la moelle épinière, cette dernière localisation risquant de compliquer l’évaluation du traumatisé crânien [5].
La posture de l’animal après le traumatisme peut également renseigner sur la localisation et le degré de l’atteinte cérébrale. Une rigidité de décérébration (Figure 1) peut s’observer à la suite d’un traumatisme crânien et suggère une atteinte cérébrale sévère. Cette posture est de mauvais pronostic, car elle traduit une perte de communication entre les hémisphères cérébraux et le tronc cérébral. Les animaux sont en opisthotonos avec hyperextension des quatre membres, et en état de stupeur ou de coma avec des réflexes pupillaires photomoteurs anormaux. Cette posture ne doit pas être confondue avec la rigidité de décérébellation, qui suggère une atteinte cérébelleuse aiguë et peut entraîner soit une flexion soit une extension des membres postérieurs ; l’état de conscience peut néanmoins être normal.

Evaluation des réflexes du tronc cérébral
La taille des pupilles, le réflexe pupillaire photomoteur, et le réflexe oculocéphalique doivent être immédiatement évalués chez tous les traumatisés crâniens. La taille, la symétrie et la réactivité des pupilles peuvent renseigner sur la sévérité de l’atteinte cérébrale et sur le pronostic, et ces paramètres doivent être fréquemment réévalués car ils peuvent signaler une dégradation de l’état neurologique. La contraction des pupilles en réponse à une source lumineuse indique un bon fonctionnement de la rétine, des nerfs optiques, du chiasma optique et du tronc cérébral rostral. Une mydriase bilatérale aréflective peut indiquer une atteinte mésencéphalique permanente ou une hernie cérébrale et s’accompagne d’un mauvais pronostic (Figure 2). Un myosis qui évolue en mydriase indique une dégradation de l’état neurologique et nécessite un traitement agressif immédiat. Des anomalies unilatérales de la taille des pupilles peuvent s’observer dans les premiers stades de dégradation. Une paralysie du nerf crânien oculomoteur (NC III) peut entraîner une mydriase, une perte du réflexe pupillaire photomoteur direct, une ptose et un strabisme ventrolatéral. Le noyau de ce nerf étant situé dans le mésencéphale, une atteinte de ce noyau peut indiquer une lésion ou une compression du mésencéphale secondaire à une hernie transtentorielle [5].

Evaluation de l’état de conscience
L’état de conscience d’un animal renseigne sur le fonctionnement du cortex cérébral et du système activateur réticulé ascendant du tronc cérébral. L’état de conscience peut être qualifié de « normal », « dépression » ou « apathie », « stupeur » ou « coma ». Un animal en état de stupeur est partiellement ou totalement inconscient, mais répond aux stimuli nociceptifs. Un individu dans le coma est inconscient et ne réagit pas aux stimuli nociceptifs. Le coma indique généralement une lésion cérébrale ou une atteinte du tronc cérébral sévère, de pronostic très réservé.
Confirmation d’une lésion et diagnostic
Le diagnostic d’une lésion cérébrale traumatique repose principalement sur des commémoratifs compatibles et des signes cliniques de dysfonction neurologique intracrânienne. Toutefois, d’autres tests peuvent être utilisés pour confirmer la localisation et l’étendue de la lésion. Il est important de souligner que l’imagerie de pointe du cerveau — scanner et imagerie par résonnance magnétique (IRM) — doit être réservée aux animaux qui ne répondent pas au traitement initial ou qui se dégradent malgré un traitement agressif. Ces deux techniques d’imagerie nécessitent une anesthésie, qui risque de déstabiliser le traumatisé crânien, sauf s’il est déjà dans le coma.
Radiographie du crâne
La radiographie du crâne peut révéler des fractures de la voûte crânienne, mais ne fournit aucune information sur le parenchyme cérébral. Les clichés peuvent être difficiles à interpréter en raison de l’irrégularité des os du crâne. En outre, le bon positionnement de l’animal nécessite une anesthésie, qui peut être contre-indiquée chez le traumatisé aigu. Mais la radiographie ne doit pas se limiter à la tête suite à un traumatisme crânien ; des clichés de la colonne vertébrale, du thorax et de l’abdomen sont indiqués pour évaluer la présence d’autres lésions.
Scanner
Le scanner permet une meilleure évaluation des structures osseuses et il est préféré à la radiographie classique, notamment pour ses capacités d’imagerie 3D [6]. En outre, le scanner peut permettre de diagnostiquer une hémorragie intracrânienne, des anomalies de taille ou de forme des ventricules, une déviation de la ligne médiane du cerveau ou un œdème. Il n’offre pas un bon degré de détail pour le parenchyme cérébral, mais constitue souvent la technique de choix chez les patients humains traumatisés crâniens nécessitant une intervention chirurgicale en raison de la rapidité d’acquisition des images.
Imagerie par résonnance magnétique (IRM)
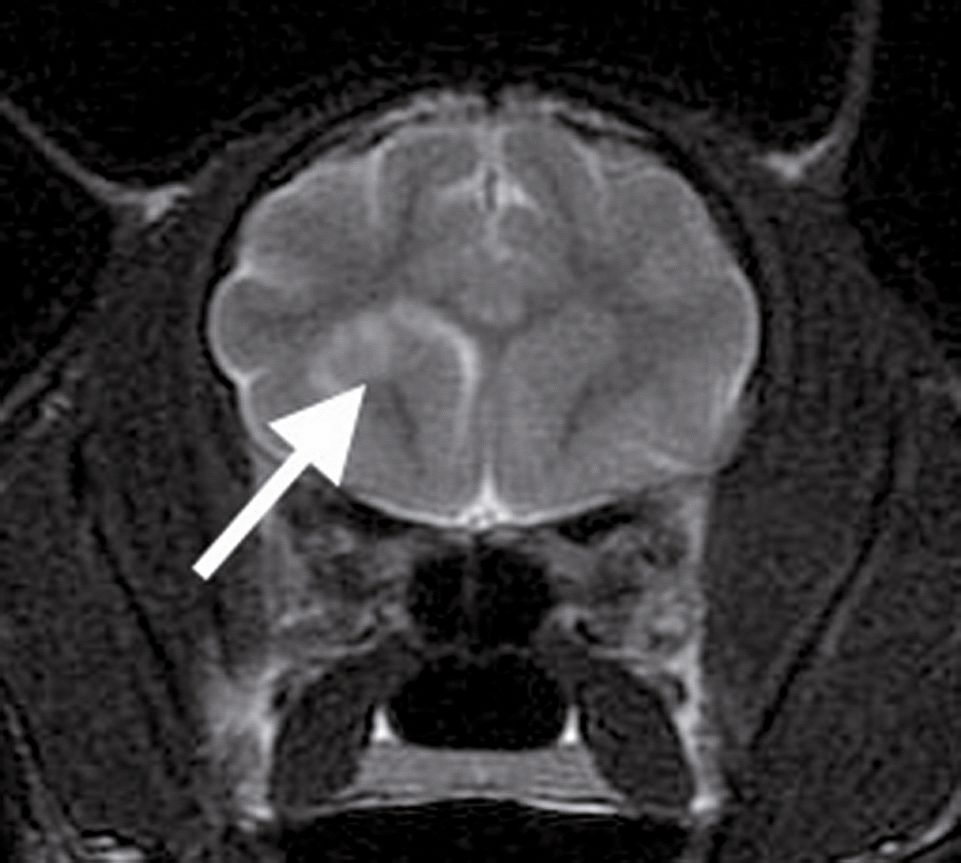
L’IRM offre un meilleur degré de détail pour les tissus mous et elle est préférée pour l’évaluation du cerveau, notamment pour la fosse postérieure que le scanner ne permet pas bien de visualiser. L’IRM peut mettre en évidence des anomalies parenchymateuses minimes potentiellement invisibles au scanner et peut fournir des informations pronostiques. Elle permet de visualiser facilement des hématomes ou une hémorragie, des contusions parenchymateuses ou un œdème (Figure 3). Une étude récente a montré une bonne corrélation entre les résultats d’IRM et le pronostic chez les animaux traumatisés crâniens et son utilisation pourrait donc s’avérer d’autant plus intéressante [7]. En particulier, l’identification d’un effet de masse et d’une compression ventriculaire par une lésion parenchymateuse peut constituer un indicateur pronostique défavorable et, dans ce type de cas, une décompression chirurgicale est à envisager.
Traitement
Le traitement proposé des traumatismes crâniens suit un schéma à niveaux croissants d’intervention basé sur la sévérité des lésions et la réponse au traitement initial (Figure 4). Les traitements de niveau 1 sont administrés à tous les animaux ; les traitements de niveau 2 sont administrés à tous les animaux ayant un score de coma de Glasgow < 8 et n’ayant pas répondu aux traitements de niveau 1 ; les traitements de niveau 3 sont administrés à tous les animaux ayant un score de coma Glasgow < 8 et n’ayant pas répondu aux traitements de niveau 2.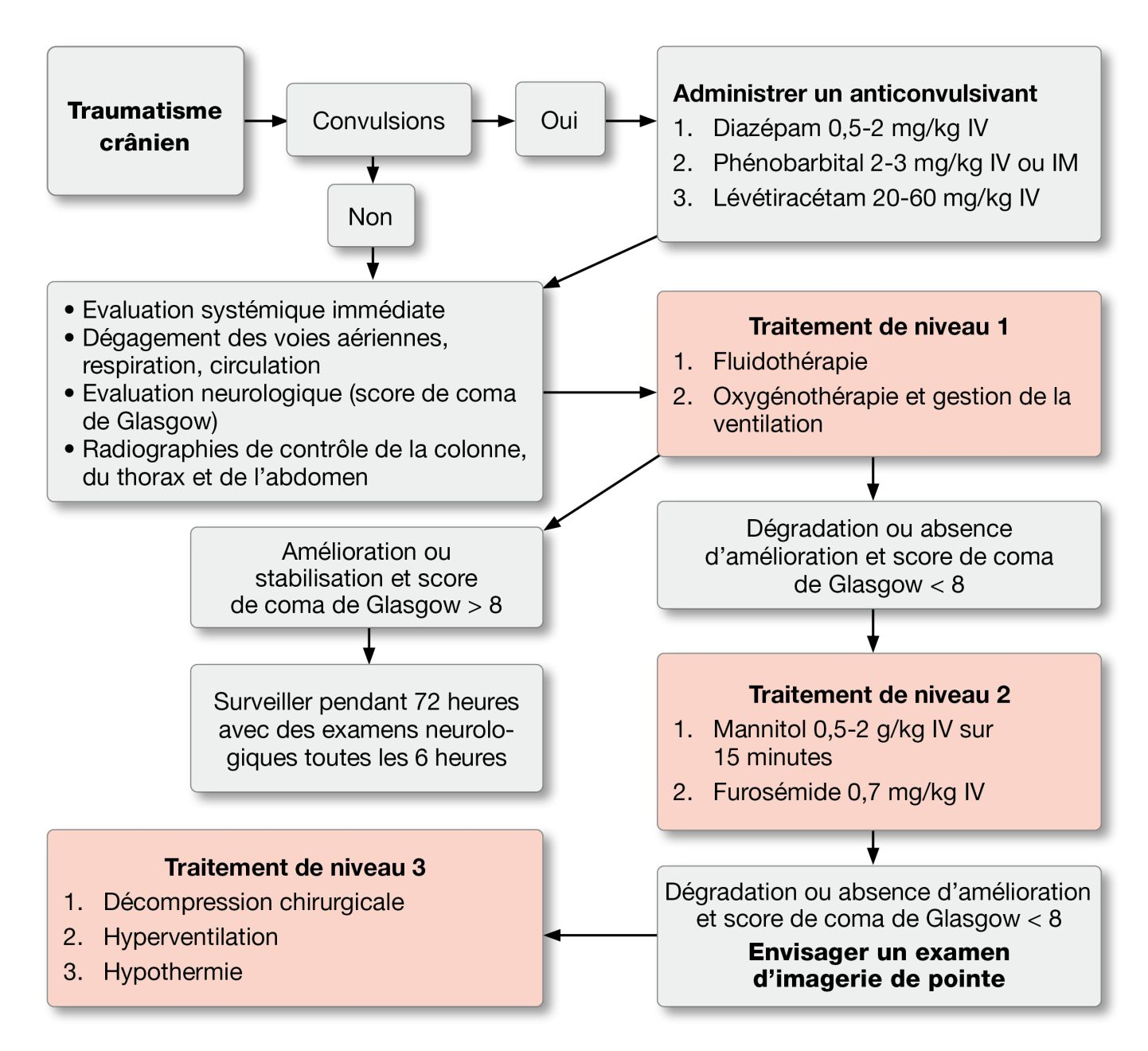
Traitement de niveau 1
Fluidothérapie
L’objectif de la fluidothérapie chez le traumatisé crânien est de rétablir la normovolémie ; il est dangereux de déshydrater un animal pour tenter de réduire un œdème cérébral. Une fluidothérapie agressive et un suivi systémique sont nécessaires pour garantir la normovolémie et maintenir une pression de perfusion centrale suffisante [1] [2] [3] [4] [8].
Des solutés cristalloïdes, hypertoniques et colloïdes doivent être associés pour aider à rétablir et à maintenir le volume sanguin après un traumatisme. Les cristalloïdes sont généralement administrés en premier pour le traitement du choc systémique. La dose des cristalloïdes en cas de choc est de 50-60 mL/kg [1] [2] [3] [4] [8], il est recommandé de fractionner la dose calculée pour administrer d’abord 25-33 % du volume total, puis de réévaluer fréquemment (toutes les 15 minutes) l’animal pour contrôler que sa pression artérielle, sa vigilance et sa pression veineuse centrale (si elle est suivie) se normalisent, et d’administrer des fractions supplémentaires au besoin.
Les solutés hypertoniques et colloïdes permettent de rétablir rapidement la volémie avec de faibles volumes d’administration ; en outre, les colloïdes restent plus longtemps dans la circulation que les cristalloïdes. Ces solutés doivent être utilisés avec prudence, car ils peuvent entraîner une déshydratation s’ils ne sont pas associés à des cristalloïdes. Les autres bénéfices des solutés hypertoniques incluent leur capacité à améliorer le débit cardiaque, à rétablir la normovolémie et à réduire l’inflammation post-traumatique. Les solutés hypertoniques peuvent être préférés chez les individus hypovolémiques et hypotendus avec une hypertension intracrânienne (HTIC), car ils améliorent la pression de perfusion et le débit sanguin dans le cerveau en rétablissant rapidement le volume sanguin intravasculaire. En outre, leur teneur élevée en sodium crée un appel d’eau depuis les espaces interstitiels et intracellulaires, entraînant une réduction de la pression intracrânienne (PIC). Les solutés hypertoniques sont contre-indiqués en cas de déshydratation systémique et d’hypernatrémie. Ces solutés ne restent dans la circulation que pendant une heure environ ; il faut ensuite administrer des colloïdes pour optimiser leurs effets. Une dose de 2-4 mL/kg de NaCl à 7,5 % doit être administrée en 5 à 10 minutes chez le chat [1] [2] [3].
Les colloïdes (Hetastarch, Dextran-70, Voluven par exemple) permettent une correction de la volémie notamment si les taux de protéines totales sont inférieurs à 50 g/L ou 5 g/dL. Ils créent aussi un appel d’eau depuis les espaces interstitiels et intracellulaires, mais ont l’avantage supplémentaire de rester plus longtemps dans le compartiment intravasculaire que les cristalloïdes. L’Hetastarch est généralement administré à la dose de 2-4 mL/kg en 5-10 minutes, avec réévaluation fréquente de l’animal, la dose totale maximale étant de 15 mL/kg/jour chez le chat et 20 mL/kg/jour chez le chien. Outre la correction volémique, il faut tenir compte de la capacité du sang à transporter l’oxygène, notamment si l’hématocrite (Ht) est bas.
Les traumatisés crâniens doivent être positionnés de façon à optimiser la circulation artérielle vers le cerveau et à améliorer le drainage veineux, la meilleure technique consistant à relever la tête de l’animal à 30°. Il est important de veiller à ce que les veines jugulaires ne soient pas occluses et qu’aucun collier ne vienne serrer le cou, ce qui augmenterait la pression intracrânienne (PIC).
Oxygénothérapie et gestion de la ventilation
Les chats ayant subi un traumatisme crânien sévère nécessitent une ventilation mécanique pour maintenir les concentrations des gaz du sang artériel à leur niveau optimal. Les indications absolues de la ventilation mécanique incluent la perte de connaissance, l’augmentation de la PaCO2 au-dessus de 50 mmHg et la baisse de la saturation en oxygène périphérique (SpO2) malgré la mise en place d’un traitement adapté [1] [2] [3] [4] [8].
Traitement de niveau 2
Diurétiques
L’HTIC peut être traitée de manière agressive par l’administration de diurétiques osmotiques de type mannitol, mais ces diurétiques sont réservés aux individus dont on est sûr qu’ils ont retrouvé une normovolémie. Si ce n’est pas le cas, leur utilisation risque de précipiter le développement d’une insuffisance rénale aiguë, c’est pourquoi ils n’appartiennent qu’aux traitements de niveau 2. Après administration, le mannitol augmente le volume plasmatique et réduit la viscosité sanguine, ce qui améliore le débit sanguin cérébral ainsi que l’apport d’oxygène au cerveau, et réduit la PIC en diminuant l’œdème. Une vasoconstriction se produit suite à l’augmentation de la PaO2, ce qui aide également à diminuer la PIC. En outre, l’effet osmotique du mannitol réduit le volume de liquide extracellulaire dans le cerveau [1] [2] [3] [4] [8] et aide à neutraliser les radicaux libres, qui contribuent aux processus pathologiques secondaires [9].
Le mannitol doit être administré en bolus (0,5-2 g/kg) sur 15 minutes pour optimiser l’effet d’expansion plasmatique ; les perfusions continues (CRI) augmentent la perméabilité de la barrière hématoméningée, ce qui aggraverait l’œdème. Les faibles doses de mannitol sont aussi efficaces pour réduire la PIC que les doses plus élevées, mais peuvent ne pas durer aussi longtemps. Le mannitol réduit l’œdème cérébral en 15 à 30 minutes après administration et a une durée d’action d’environ 2 à 5 heures. Son administration répétée peut induire une diurèse entraînant une réduction du volume plasmatique, une augmentation de l’osmolarité, une déshydratation intracellulaire, une hypotension et une ischémie ; il est donc crucial d’administrer des cristalloïdes et colloïdes isotoniques en quantités suffisantes pour maintenir l’hydratation.
L’administration de furosémide (0,7 mg/kg) avant celle du mannitol a un effet synergique sur la réduction de la PIC. L’utilisation du mannitol doit être réservée aux animaux en état critique (coma de Glasgow < 8), à ceux qui se dégradent ou qui ne répondent pas à un autre traitement ; rien ne prouve aujourd’hui que le mannitol soit contre-indiqué en cas d’hémorragie intracrânienne.
Traitement des crises convulsives
Traitement de niveau 3
Hyperventilation
Hypothermie
Surgery
Traitement de soutien
Simon Platt
BVM&S, MRCVS, Dip. ACVIM (Neurologie), Dip. ECVN
Le Dr Platt obtient son diplôme vétérinaire en 1992 à l’Université d’Edimbourg (Ecosse). Après un internat en Médecine et Chirurgie des Petits Animaux au Collège Vétérinaire de l’Université de Guelph en Ontario (Canada), il exerce pendant 2 ans en clientèle privée en Angleterre. En 1998, le Dr Platt effectue un résidanat en neurologie et neurochirurgie à l’Université de Floride et il est actuellement Professeur au Département de Médecine et Chirurgie des Petits Animaux à l’Université de Géorgie.
Références bibliographiques
- Dewey CW. Emergency management of the head trauma patient. Principles and practice. Vet Clin North Am Small Anim Pract 2000;30(1):207-225.
- Hopkins AL. Head trauma. Vet Clin North Am Small Anim Pract 1996;26(4):875-891.
- Adamantos S, Garosi L. Head trauma in the cat: 1. assessment and management of craniofacial injury. J Feline Med Surg 2011;13(11):806-814.
- Adamantos S, Garosi L. Head trauma in the cat: 2. assessment and management of traumatic brain injury. J Feline Med Surg 2011;13(11):815- 822.
- Platt SR, Radaelli ST, McDonnell JJ. The prognostic value of the Modified Glasgow Coma Scale in head trauma in dogs. J Vet Intern Med 2001;15(6):581-594.
- Platt SR, Radaelli ST, McDonnell JJ. Computed tomography after mild head trauma in dogs. Vet Rec 2002;151(8):243.
- Beltran E, Platt SR, McConnell JF, et al. Prognostic value of early magnetic resonance imaging in dogs after traumatic brain injury: 50 cases. J Vet Intern Med 2014;28(4):1256-1262.
- Syring RS. Assessment and treatment of central nervous system abnormalities in the emergency patient. Vet Clin North Am Small Anim Pract 2005;35(2):343-358.
- Yilmaz N, Dulger H, Kiymaz N, et al. Activity of mannitol and hypertonic saline therapy on the oxidant and antioxidant system during the acute term after traumatic brain injury in the rats. Brain Res 2007;1164:132-135.
Autres articles de ce numéro
Partager sur les réseaux sociaux