Piodermite canina: il problema della resistenza alla meticillina
Scritto da Ana Oliveira
Questo articolo fornisce una panoramica sulle attuali conoscenze di Staphylococcus pseudointermedius meticillino-resistente (SPMR) come patogeno causale della piodermite canina e considera la diagnosi della malattia, le opzioni di trattamento, la prevenzione e gli aspetti zoonotici.
Article
Punti chiave
La piodermite batterica canina causata principalmente da Staphylococcus pseudointermedius.
S. pseudointermedius meticillino-resistente (SPMR) ha distribuzione mondiale. I batteri sono resistenti agli antibiotici beta-lattamici e spesso anche ad altri farmaci comunemente usati per trattare la piodermite canina.
In caso di sospetta infezione da SPMR, sono fortemente raccomandati la coltura batterica e lantibiogramma.
Le strutture veterinarie devono adottare protocolli igienici rigorosi per prevenire la diffusione di questo patogeno.
Introduzione
Prima della comparsa della resistenza alla meticillina, Staphylococcus pseudointermedius era sensibile alla maggior parte dei farmaci antibiotici disponibili per gli animali. Più di recente, il batterio ha acquisito materiale genetico e sviluppato resistenza alla meticillina. È così comparso un genotipo multi-farmacoresistente, che limita le opzioni di trattamento ed evidenzia la necessità di un uso responsabile degli antibiotici. Questo articolo fornisce una panoramica sulle attuali conoscenze di Staphylococcus pseudointermedius meticillino-resistente (SPMR) come patogeno causale della piodermite canina e considera la diagnosi della malattia, le opzioni di trattamento, la prevenzione e gli aspetti zoonotici.
S. pseudointermedius: un patogeno?
I batteri stafilococchi sono normali commensali della cute e delle mucose dei cani sani ma sono anche patogeni opportunisti. La presentazione clinica più frequente delle infezioni canine da stafilococco è la piodermite, seguita dall’otite esterna. Staphylococcus pseudointermedius (in precedenza identificato erroneamente come S. intermedius) è il patogeno più comune e sin dal 2007 è stato classificato nel gruppo S. intermedius insieme a S. Delphini e S. intermedius [1]. Altri stafilococchi coagulasi-positivi che sono considerati patogeni includono S. aureus, S. hyicus e S. schleiferi sottospecie coagulans. Anche le specie coagulasi-negative, cioè S. schleiferi sottospecie schleiferi, sono state riconosciute come una causa di piodermite [2].
Che cosa si intende per resistenza alla meticillina?
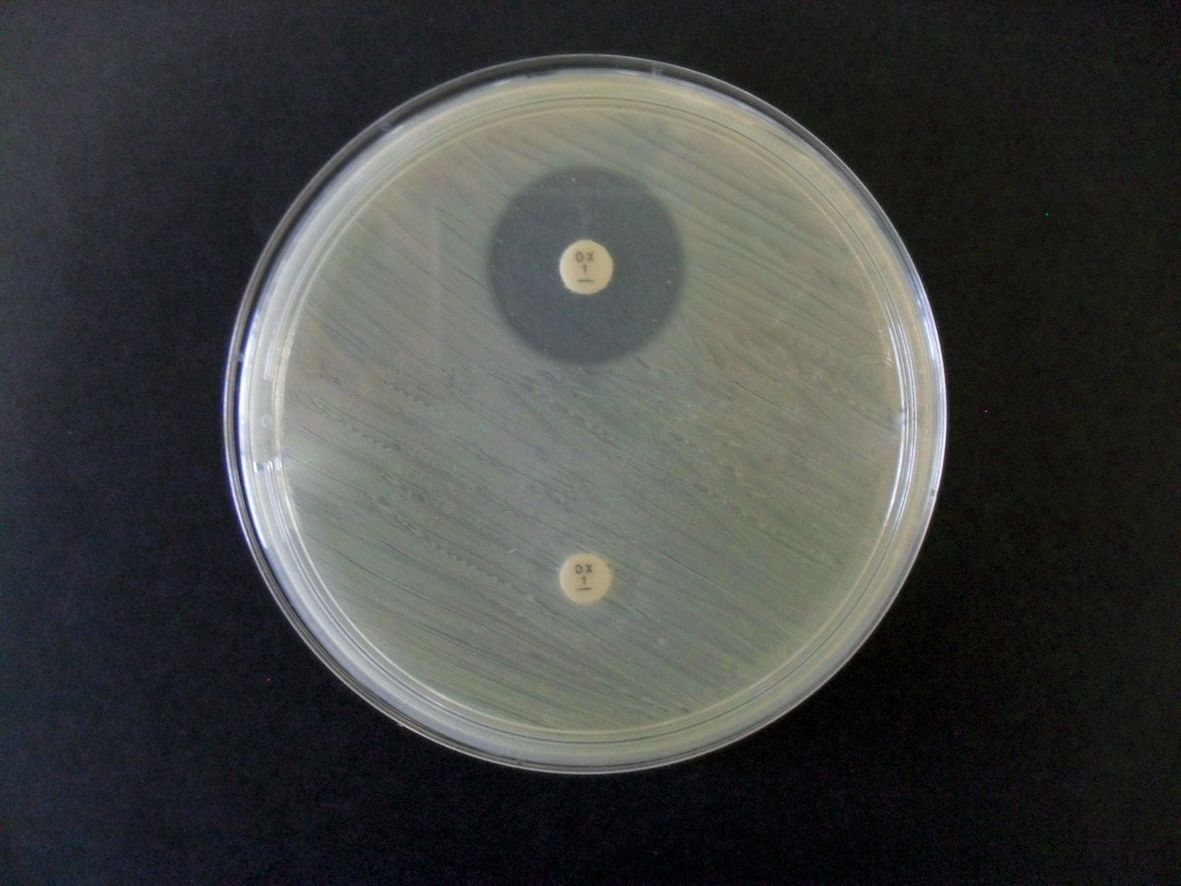
La meticillina (in precedenza nota come dimetossipenicillina) è stata introdotta nel 1959 ed è una penicillina penicillinasi-resistente semisintetica. L’antibiotico è stato sviluppato per superare la resistenza mediata dall’enzima beta-lattamasi, che distrugge l’anello β-lattamico delle penicilline. La resistenza alla meticillina è stata documentata in S. aureus la prima volta nel 1961 [3]. S. aureus meticillino-resistente (SAMR) si è evoluto fino a produrre un difetto nella proteina di legame per la penicillina mediato dall’acquisizione del gene mecA. Questo fa parte di un elemento genetico mobile più voluminoso noto come “cassetta cromosomica stafilococcica”, in grado di integrarsi nel cromosoma stafilococcico. Al giorno d’oggi, la meticillina non viene più utilizzata clinicamente e l’oxacillina è diventata il sostituto nei test in vitro per SAMR (Figura 1). La resistenza all’oxacillina rappresenta virtualmente la non sensibilità totale a tutti i β-lattamici, compresi farmaci che vengono spesso utilizzati per trattare la piodermite canina [4] come ad esempio :
- Cefalosporine (ad es. cefalexina, cefpodoxima proxetil, cefovecina).
- Amoxicilline potenziate (ad es. amoxicillina-clavulanato).
- Penicilline (ad es. ampicillina, amoxicillina).

La cefoxitina può essere utilizzata in medicina umana nello screening di SAMR ma non è appropriata per determinare la non sensibilità ai β-lattamici di S. pseudointermedius [5].
S. pseudointermedius meticillino-resistente (SPMR) è stato segnalato la prima volta nel 1999 in Nord America ed è attualmente riconosciuta la sua distribuzione mondiale [6],[7],[8]. Le strutture specializzate, che ricevono spesso casi di piodermite cronici o ricorrenti (e quindi hanno già ricevuto terapie antibiotiche) segnalano di frequente livelli elevati di SPMR [6]. Dato l’impatto zoonotico di SAMR, è stata dedicata minore attenzione a SPMR, nonché a S. schleiferi meticillino-resistente.
SPMR è una sfida?
Storicamente, la piodermite è stata trattata empiricamente con beta-lattamici, macrolidi o antibiotici sulfamidici potenziati. Il problema con SPMR non è solo la resistenza ai β-lattamici ma anche quella nei confronti di altri antibiotici, come ad esempio clindamicina, eritromicina, fluorochinoloni, gentamicina e tetraciclina [9]. Il fenotipo multi-resistente è associato ad alterazioni genetiche dovute a elementi mobili trasponibili che codificano per l’antibioticoresistenza [10]. Due linee cellulari clonali di SPMR sono state sviluppate contemporaneamente in Europa e negli Stati Uniti con modelli di resistenza diversi. Il clone del Nord America è ancora sensibile a cloramfenicolo, rifampicina e amikacina, mentre il clone europeo rivela sensibilità all’acido fusidico e alla doxiciclina/minociclina [9].
S. pseudointermedius, con la sua resistenza a tre o più classi di antibiotici, è classificato negli stafilococchi multi-farmacoresistenti ed è pertanto sconsigliabile passare empiricamente da una classe di antibiotici all’altra se fallisce il trattamento con l’antimicrobico di prima linea. Questi casi devono essere testati mediante coltura e antibiogramma prima di prescrivere un secondo antibiotico [11]. Il quadro clinico non consente la differenziazione dei ceppi di S. pseudintermedius sensibili rispetto a quelli resistenti, dato che SPMR non è più virulento rispetto a S. pseudintermedius (SPMS) meticillino-sensibile [6].
Come si diagnostica la piodermite?
È possibile diagnosticare una piodermite in base all’anamnesi e ai segni clinici. I test diagnostici minimi comprendono la citologia, la coltura batterica e l’antibiogramma. La diagnosi differenziale include la demodicosi e la dermatofitosi e, più raramente, le malattie pustolose sterili. Altre procedure diagnostiche, come ad esempio i raschiati cutanei, la coltura per i dermatofiti e l’istopatologia, vanno applicate caso per caso.
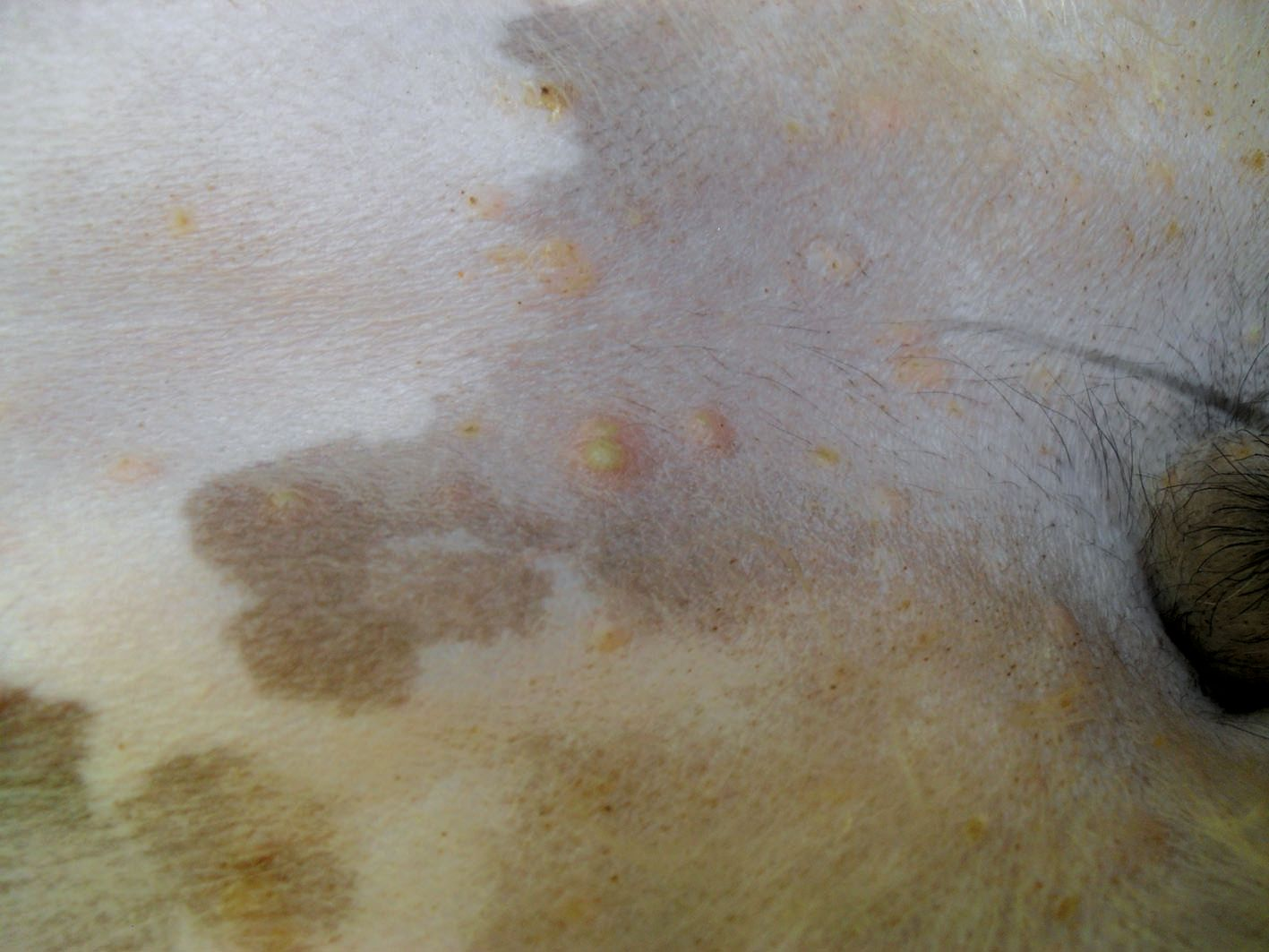
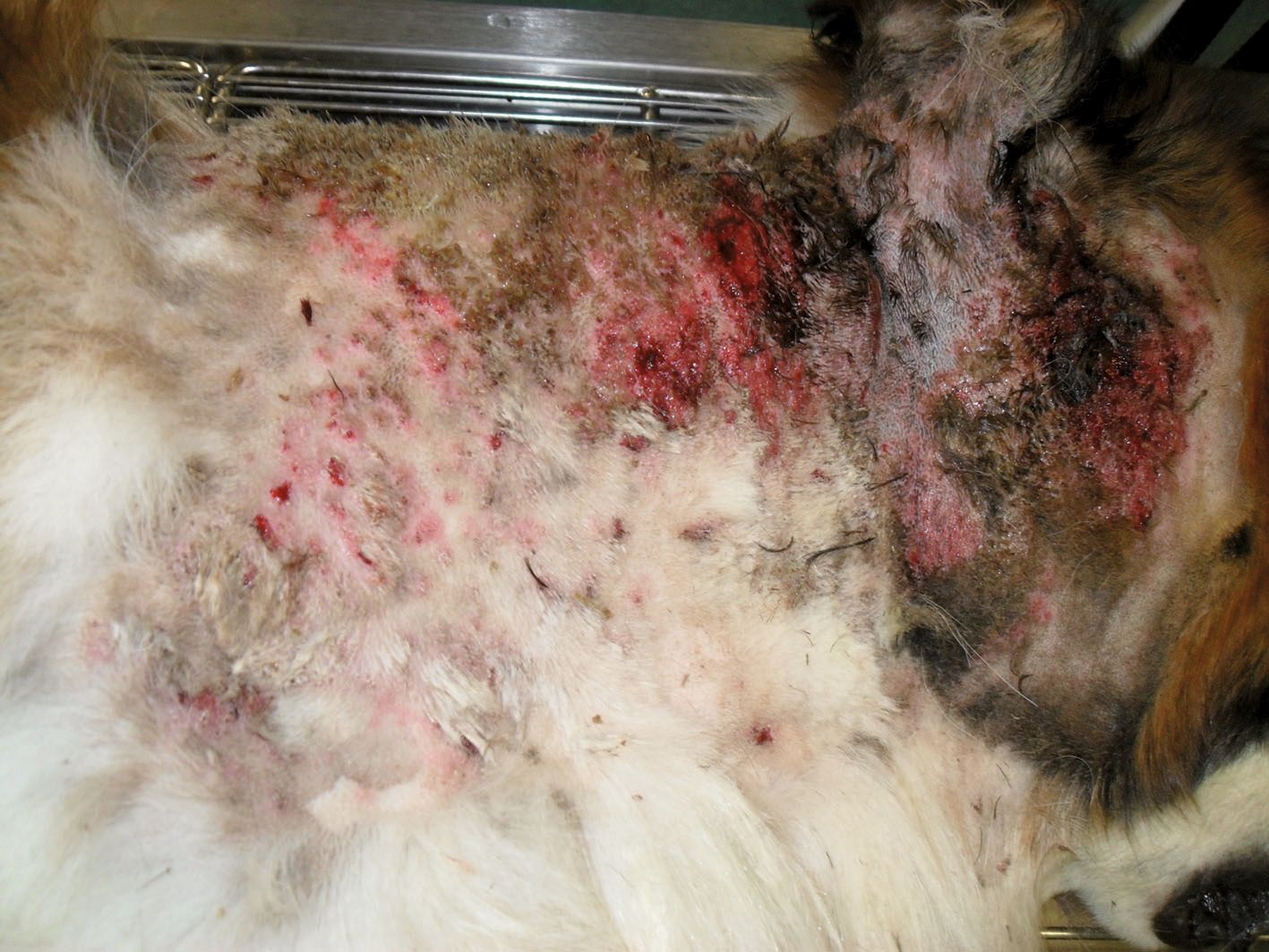
S. pseudointermedius colonizza la cute e le mucose (naso, bocca e mucosa anale) dei cani sani e circa l’80% delle infezioni proviene dalle sedi di trasmissione del paziente [12]. Le infezioni cutanee canine causate da S. pseudointermedius includono la piodermite superficiale e profonda. La forma più comune di piodermite superficiale canina è la follicolite batterica, le cui lesioni tipiche includono piccole pustole e papule eritematose associate ai follicoli piliferi (Figura 2). Inoltre, si osservano spesso collaretti epidermici e lesioni a bersaglio, mentre sono un possibile riscontro croste, alopecia, eritema e iperpigmentazione. Nelle razze a pelo corto, la presentazione clinica può essere caratterizzata da aree circolari multifocali di alopecia (che conferiscono un aspetto “tarlato”). I segni di piodermite profonda includono bolle emorragiche, seni drenanti, ulcere, edema e infiammazione grave (Figura 3). È possibile osservare uno scolo emorragico e/o purulento con dolore associato. È fondamentale distinguere tra follicolite batterica e piodermite profonda, perché la seconda è caratterizzata da maggiore penetrazione, rottura del follicolo pilifero e coinvolgimento del derma e del sottocute, per cui richiede un trattamento di maggiore durata [13].
La citologia è un test ambulatoriale affidabile, rapido e minimamente invasivo per confermare la presenza di un’infezione batterica. La presenza di neutrofili con cocchi fagocitati intracitoplasmatici conferma la piodermite (Figura 4). In caso di piodermite profonda, lo schema infiammatorio è caratterizzato dalla presenza di neutrofili degenerati, macrofagi e talvolta eosinofili. In rari casi, possono essere presenti anche bastoncelli. La mancanza di microrganismi alla citologia cutanea non esclude l’infezione e sebbene la citologia sia il primo test diagnostico da eseguire, non può sostituire la coltura batterica o l’istopatologia [14]. Coltura e antibiogramma possono essere eseguiti in ogni caso e sono fortemente raccomandati nelle seguenti situazioni:
- Se i segni clinici e i riscontri citologici non sono coerenti tra loro, ad es. quando non si vedono microrganismi alla citologia ma i segni clinici sono ancora indicativi di piodermite.
- Se la citologia mostra batteri a forma di bastoncello, essendo difficile prevedere la sensibilità dei bacilli agli antibiotici.
- In ogni caso di piodermite profonda, poiché richiede un trattamento di maggiore durata.
- Qualsiasi infezione pericolosa per la vita.
- Sospetta infezione da SPMR.

Quando sospettare un’infezione da SPMR?
L’infezione da SPMR va sospettata se vengono identificati uno o più fattori di rischio (Tabella 1) [4],[11],[14],[15],[16]. I veterinari devono essere consapevoli del fatto che le infezioni da SPMS, confermate dalla coltura, possono trasformarsi in infezioni da SPMR durante il trattamento antibiotico. Questo può essere dovuto alla trasmissione di fattori genetici o al fatto che pur essendo inizialmente presenti nel paziente cloni multipli di SPMS e di SPMR, al primo tentativo è stato coltivato solo SPMS [17].
Tabella 1. Fattori di rischio associati a SPMR.
|
Come prelevare il materiale per la coltura batterica?
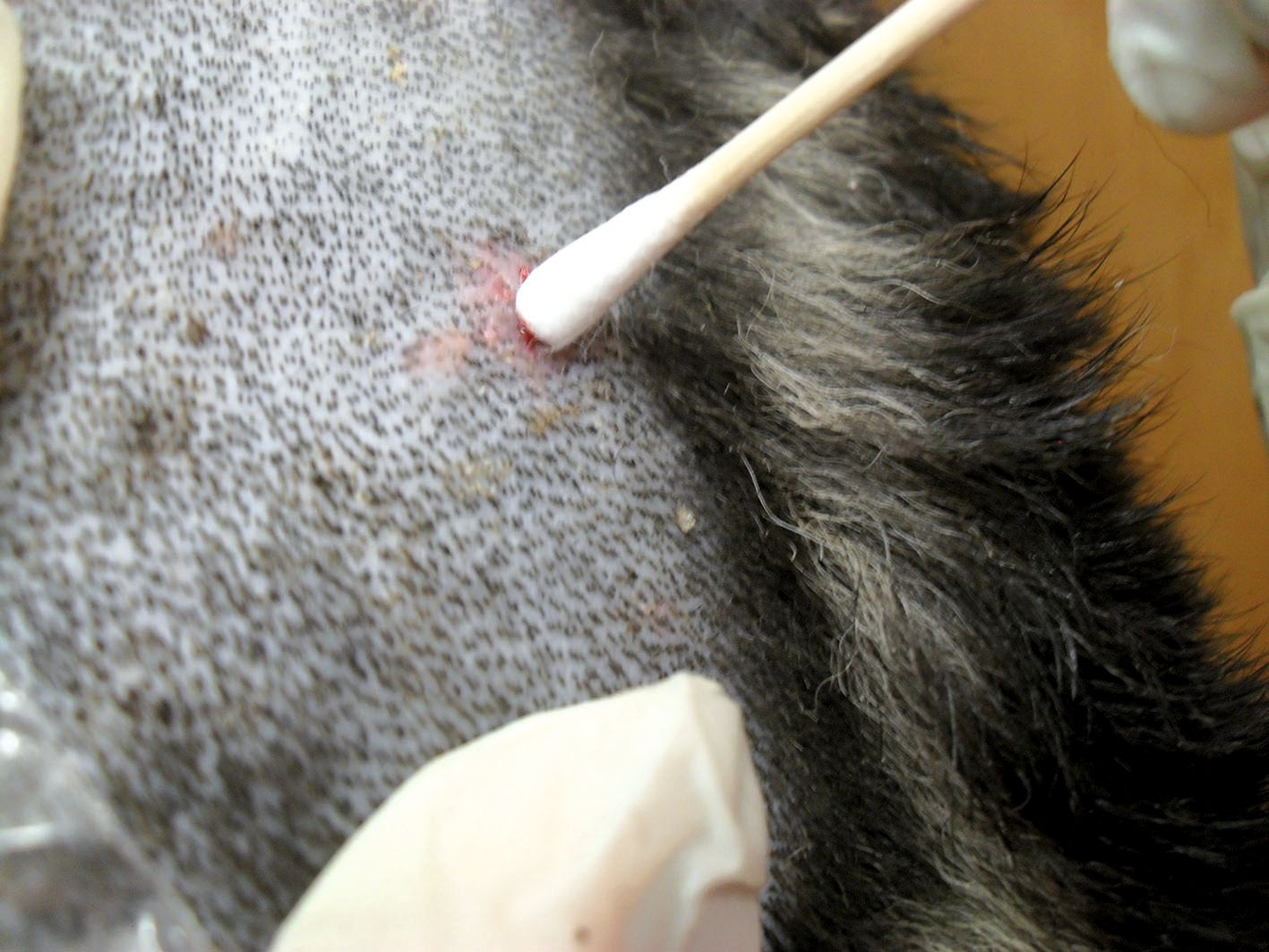
Possono essere coltivati i prelievi di numerosi tipi di lesioni e deve essere evitata la contaminazione dei campioni. La cute deve essere innanzitutto strofinata con alcol e lasciata asciugare all’aria. Pustole, papule e foruncoli intatti sono lesioni adatte che possono essere accuratamente aperte con un ago sterile prima di prelevare il contenuto con un tampone sterile (Figura 5). Se non sono presenti lesioni intatte, è ancora possibile prelevare il materiale tamponando un collaretto epidermico o l’area sottostante una crosta di recente formazione. Recentemente, è stato segnalato che tre tecniche di prelievo (tampone di cotone asciutto, tampone di cotone inumidito con soluzione salina e raschiato cutaneo superficiale) forniscono risultati simili quando utilizzate per la coltura batterica [18]. Nel caso di tratti drenanti, la lesione deve essere spremuta leggermente in modo da raccogliere materiale fresco. Per le lesioni nodulari, il materiale deve essere ottenuto perforando il nodulo con un ago e aspirando il contenuto con una siringa. La biopsia cutanea è utile per raccogliere materiale da tessuti più profondi e può essere eseguita utilizzando un bisturi circolare o una lama per bisturi al fine di ottenere una biopsia a cuneo a tutto spessore. Ciò permette l’esame dei tessuti sottocutanei o più profondi. Il materiale viene quindi inviato a un laboratorio di microbiologia in un contenitore sterile utilizzando terreni di trasporto appropriati.
Quando sospettare un’infezione da SPMR?
L’infezione da SPMR va sospettata se vengono identificati uno o più fattori di rischio (Tabella 1) [4],[11],[14],[15],[16]. I veterinari devono essere consapevoli del fatto che le infezioni da SPMS, confermate dalla coltura, possono trasformarsi in infezioni da SPMR durante il trattamento antibiotico. Questo può essere dovuto alla trasmissione di fattori genetici o al fatto che pur essendo inizialmente presenti nel paziente cloni multipli di SPMS e di SPMR, al primo tentativo è stato coltivato solo SPMS [17].
Tabella 1. Fattori di rischio associati a SPMR.
|
Come prelevare il materiale per la coltura batterica?
Possono essere coltivati i prelievi di numerosi tipi di lesioni e deve essere evitata la contaminazione dei campioni. La cute deve essere innanzitutto strofinata con alcol e lasciata asciugare all’aria. Pustole, papule e foruncoli intatti sono lesioni adatte che possono essere accuratamente aperte con un ago sterile prima di prelevare il contenuto con un tampone sterile (Figura 5). Se non sono presenti lesioni intatte, è ancora possibile prelevare il materiale tamponando un collaretto epidermico o l’area sottostante una crosta di recente formazione. Recentemente, è stato segnalato che tre tecniche di prelievo (tampone di cotone asciutto, tampone di cotone inumidito con soluzione salina e raschiato cutaneo superficiale) forniscono risultati simili quando utilizzate per la coltura batterica [18]. Nel caso di tratti drenanti, la lesione deve essere spremuta leggermente in modo da raccogliere materiale fresco. Per le lesioni nodulari, il materiale deve essere ottenuto perforando il nodulo con un ago e aspirando il contenuto con una siringa. La biopsia cutanea è utile per raccogliere materiale da tessuti più profondi e può essere eseguita utilizzando un bisturi circolare o una lama per bisturi al fine di ottenere una biopsia a cuneo a tutto spessore. Ciò permette l’esame dei tessuti sottocutanei o più profondi. Il materiale viene quindi inviato a un laboratorio di microbiologia in un contenitore sterile utilizzando terreni di trasporto appropriati.
Quali test deve eseguire il laboratorio di microbiologia?
Il laboratorio deve identificare il microrganismo e svolgere appropriati test di sensibilità agli antibiotici. Si consiglia di distinguere S. aureus dagli altri stafilococchi coagulasi-positivi per due motivi principali: i batteri del genere S. aureus hanno implicazioni zoonotiche e i breakpoint per l’antibiogramma di S. aureus e S. pseudointermedius sono diversi. Linee guida recentemente pubblicate [11] consigliano di includere nei test di sensibilità agli antibiotici iniziali eritromicina, clindamicina, amoxicillina-clavulanato, tetraciclina (per testare la sensibilità alla doxiciclina), trimetoprim-sulfametossazolo, gentamicina, cefalotina (o cefazolina, come cefalosporina di prima generazione), cefpodoxima proxetil (come cefalosporina di terza generazione) ed enrofloxacina. L’oxacillina viene inclusa per rilevare la resistenza alla meticillina in S. pseudointermedius. Se l’enrofloxacina non è il fluorochinolone di prima scelta, può essere considerata l’inclusione di altri fluorochinoloni (difloxacina, marbofloxacina e orbifloxacina). I risultati devono essere comparati con i breakpoint, come definito dal Clinical and Laboratory Standards Institute* (CLSI). Gli antibiotici con “sensibilità intermedia” devono essere segnalati come resistenti, essendo improbabile che possano raggiungere le concentrazioni terapeutiche nei siti interessati [11]. Infine, se i risultati in vitro rivelano resistenza all’eritromicina e sensibilità alla clindamicina, dato che per SPMR è stata segnalata una resistenza inducibile a clindamicina del 2%, si esegue il test del doppio disco per valutare tale parametro [9]. Se vengono identificati stafilococchi meticillino-resistenti, si possono fare eseguire in laboratorio ulteriori test per la sensibilità ad amikacina, cloramfenicolo, minociclina e rifampicina [11].
* Gli standard CLSI includono informazioni del Subcommittee on Veterinary Antimicrobial Susceptibility Testing e dell’European Committee on Antimicrobial Susceptibility Testing.
Come trattare la piodermite da S. pseudointermedius?
Nel trattamento della piodermite superficiale e profonda del cane s’impiega spesso la terapia sistemica. Prima di iniziare la terapia antibiotica, è importante determinare se la piodermite è profonda, grave e/o generalizzata abbastanza da richiedere l’uso di antibiotici sistemici [13]. Il trattamento di SPMR e SPMS segue gli stessi principi di base, con il riconoscimento del patogeno e dello schema di sensibilità [19]. I fattori relativi al paziente, come ad esempio causa sottostante, immunosoppressione ed eventuali malattie concomitanti, devono essere tutti affrontati. Inoltre, devono essere presi in considerazione il coinvolgimento nel trattamento da parte del proprietario, nonché la disponibilità, il costo e gli effetti indesiderati del farmaco. L’uso di alcuni farmaci negli animali potrebbe non essere autorizzato in alcuni paesi e se viene proposto l’uso off-label il veterinario deve prima discutere le implicazioni con il proprietario.
Una revisione sistematica recente ha identificato una solida evidenza di elevata efficacia per cefovecina sottocutanea nella piodermite superficiale e per amoxicillina-clavulanato orale nella piodermite profonda [20]. Un buon livello di evidenza di efficacia moderata-elevata è stato identificato per i farmaci orali amoxicillina-clavulanato, clindamicina, cefadroxil, trimetoprim-sulfametossazolo e sulfadimetossina-ormetoprim nella piodermite superficiale e per pradofloxacina orale, cefadroxil orale e cefovecina sottocutanea nella piodermite profonda [20]. Una pubblicazione recente fornisce linee guida cliniche per la diagnosi e il trattamento della follicolite batterica superficiale canina [11].
Come trattare il primo evento di piodermite superficiale/follicolite?
A first occurrence of superficial pyoderma/folliculitis can be treated empirically or after bacterial culture and sensitivity. The recommended antibiotics for empirical use are amoxicillin-clavulanate, cefadroxil/cefalexin, clindamycin, lincomycin, trimethoprim- or ormetoprim-sulfonamides, and these options are licensed for veterinary use in most countries [11]. If compliance is poor, cefovecin and cefpodoxime proxetil can also be considered for first occurrence pyoderma. It is important to keep in mind that these latter antibiotics have a broader spectrum of activity, including some gram-negative bacteria, and should only be used when appropriate and after culture and sensitivity tests [13].
Come trattare SPMR?
Le alternative negli antibiotici sistemici per SPMR o per gli stafilococchi multi-farmacoresistenti sono più limitate. Si raccomanda la selezione dei farmaci appropriati dopo la coltura e l’antibiogramma e quando non esistono alternative. Quando si sceglie un piano di trattamento, è importante considerare il rischio che si sviluppi un’ulteriore resistenza del ceppo infettivo [4]. Un’altra considerazione è che SPMR può essere trattato solo con una terapia topica diligente. I farmaci disponibili per SPMR sono le tetracicline (ad es. doxiciclina e minociclina), i fluorochinoloni (ad es. enrofloxacina, marbofloxacina, orbifloxacina, pradofloxacina e ciprofloxacina), il cloramfenicolo, la rifampicina e gli aminoglicosidi (ad es. gentamicina e amikacina). L’uso di farmaci come ad esempio linezolid, teicoplanina o vancomicina, è fortemente sconsigliato, a prescindere dalla sensibilità, poiché questi farmaci sono riservati al trattamento delle infezioni da SAMR gravi nell’uomo [11].
Alcuni dei farmaci utilizzati per SPMR hanno effetti indesiderati potenzialmente gravi. Il cloramfenicolo è un antibiotico batteriostatico che deve essere maneggiato con i guanti, dato il rischio di causare anemia aplastica irreversibile nell’uomo. Gli effetti indesiderati nel cane sono vomito, tossicità epatica e mielosoppressione (reversibile). Più di recente, è stata anche segnalata debolezza degli arti posteriori [21]. Gli aminoglicosidi possono causare nefrotossicità e ototossicità, per cui è meglio evitarli negli animali con insufficienza renale. Si raccomanda il monitoraggio della funzione renale per prevenire la lesione renale acuta indotta dagli aminoglicosidi**. La rifampicina può causare epatotossicità e richiede il monitoraggio della funzione epatica prima di iniziare la terapia, quindi ogni settimana durante il trattamento. Altri effetti indesiderati comprendono anemia, trombocitopenia, anoressia, vomito, diarrea e colore arancione dei fluidi corporei. È stato segnalato che per S. aureus la resistenza alla rifampicina può essere prevenuta con l’associazione a certi antibiotici, quali clindamicina e cefalexina. Non è noto se questo avvenga anche nel caso di SPMR, poiché lo sviluppo della resistenza è stato segnalato anche in associazione con un altro antibiotico [22].
** Secondo le linee guida dell’International Renal Interest Society (IRIS) (www.iris-kidney.com).
I farmaci e i dosaggi raccomandati per il trattamento della follicolite superficiale sono riportati nella Tabella 2. La piodermite profonda con cicatrizzazione e necrosi estese può limitare la penetrazione del farmaco nei tessuti. In questi casi è quindi possibile usare antibiotici che penetrano nelle sedi di infiammazione, come ad esempio clindamicina, cefovecina e fluorochinoloni [13]. In generale, nella piodermite superficiale non complicata, la terapia viene somministrata per 3-4 settimane, più una settimana dopo la risoluzione clinica. Nei casi ricorrenti, nella piodermite profonda o con immunosoppressione concomitante, il trattamento deve essere somministrato per 6-8 settimane, più di 10-14 giorni dopo la risoluzione clinica. L’incapacità di emettere una diagnosi e il mancato controllo della causa sottostante possono anche impedire la risoluzione completa dell’infezione e predisporre alle reinfezioni. In molti casi, SPMR potrebbe richiedere regimi di trattamento di maggiore durata [23]. Le visite di controllo vengono solitamente programmate ogni 2-4 settimane fino a ottenere la remissione clinica.
Tabella 2. Antibiotici e dosaggi raccomandati nella follicolite batterica superficiale del cane [11].
| Categoria | Commenti | Farmaco | Dose suggerita |
|---|---|---|---|
| Prima linea | Scelta primaria per la terapia empirica in base alla sospetta sensibilità o se la sensibilità è stata provata mediante coltura e antibiogramma | Clindamicina | 5,5-10 mg/kg PO ogni 12 ore |
| Lincomicina | 15-25 mg/kg PO ogni 12 ore | ||
| Amoxicillina-clavulanato | 12,5-25 mg/kg PO ogni 12 ore | ||
| Cefadroxil/cefalexina | 15-30 mg/kg PO ogni 12 ore | ||
| Sulfamidico-trimetoprim | 15-30 mg/kg PO ogni 12 ore | ||
| Prima o seconda linea | Cefalosporine di terza generazione | Cefovecina | 8 mg/kg SC ogni 2 settimane |
| Cefpodoxima proxetil | 5-10 mg/kg PO ogni 24 ore | ||
| Seconda linea | Riserva da usare dopo aver dimostrato la sensibilità e se i farmaci di prima linea non sono un’opzione | Doxiciclina | 5 mg/kg PO ogni 12 ore oppure 10 mg/kg PO ogni 24 ore |
| Minociclina | 10 mg/kg PO ogni 12 ore | ||
| Enrofloxacina | 5-20 mg/kg PO ogni 24 ore | ||
| Marbofloxacina | 2,75-5,5 mg/kg PO ogni 24 ore | ||
| Pradofloxacina | 3 mg/kg PO ogni 24 ore | ||
| Terza linea | Usare dopo aver dimostrato la sensibilità e con cautela a causa dei possibili effetti indesiderati gravi | Cloramfenicolo | 40-50 mg/kg PO ogni 8 ore |
| Amikacina | 15-30 mg/kg EV/IM/SC ogni 24 ore | ||
| Rifampicina | 5-10 mg/kg PO ogni 12 ore |
La terapia topica: serve?
Il trattamento topico della piodermite accelera il recupero e/o riduce la necessità della terapia sistemica. Gli agenti topici possono essere l’unico trattamento necessario in alcuni casi o essere adiuvanti per gli antibiotici sistemici. I prodotti topici possono essere suddivisi in prodotti antibatterici e antibiotici topici. Entrambi possono essere utilizzati per le lesioni generalizzate o per quelle localizzate.
Gli antibatterici topici comprendono clorexidina, perossido di benzoile, lattato di etile e prodotti a base di ipoclorito di sodio. È stato segnalato che una concentrazione di clorexidina al 2-4% è efficace come monoterapia, mentre lo shampoo alla clorexidina si è rivelato più efficace quando confrontato allo shampoo con perossido di benzoile [24]. Questi prodotti possono essere utilizzati in forma di shampoo, balsami, spray, salviette o diluiti nell’acqua del bagno. Non sono stati segnalati fenomeni di resistenza biocida alla clorexidina nei casi di SPMR [25]. Per le lesioni localizzate, altre opzioni antibatteriche topiche comprendono gli unguenti a base di miele, che hanno un effetto antibatterico contro SPMS e SPMR [26]. La nisina è un peptide antibatterico, disponibile in forma di salviette, per trattare la piodermite localizzata e la colonizzazione superficiale batterica [27].
Quando necessario, gli antibiotici topici possono essere utilizzati per le lesioni focali. Essi comprendono acido fusidico, argento sulfadiazina, gentamicina, fluorochinoloni e mupirocina, che possono essere utili anche quando il laboratorio segnala una resistenza. L’acido fusidico è un antibiotico concentrazione-dipendente che fornisce localmente concentrazioni elevate e può essere un’alternativa efficace per SPMR anche quando i test in vitro rivelano una non sensibilità. La mupirocina viene impiegata per l’infezione nasale topica e la decolonizzazione di SAMR nell’uomo ma alcuni paesi limitano il suo uso negli animali.
Quali sono le implicazioni zoonotiche di SPMR?
Con l’emergere di SPMR c’è stato un rinnovato interesse per le implicazioni zoonotiche di S. pseudointermedius. Si è visto che nell’uomo la colonizzazione nasale è una possibile evenienza e i proprietari con cani affetti da piodermite profonda possono trasportare lo stesso ceppo genetico di SPMR presente nei propri animali da compagnia, il che conferma la trasmissione inter-specie [28]. Anche i veterinari che vengono a contatto con gli animali infetti sembrano avere un rischio maggiore di coltura nasale positiva per SPMR quando condividono lo stesso ambiente [29]. L’uomo non è ospite naturale di S. pseudointermedius, il che spiega la minore incidenza di SPMR rispetto a SAMR ma non è noto se i ceppi di S. pseudointermedius contenenti elementi genetici mobili possano costituire un serbatoio per la diffusione dei geni di resistenza alla flora commensale della cute umana [4].
Come prevenire in pratica la diffusione di SPMR?
Sono disponibili linee guida sulle modalità per mantenere standard elevati di pratica clinica e igiene al fine di ridurre i rischi di SAMR e SPMR e trattare i pazienti infetti [30]. La prevenzione di SPMR è basata su: uso responsabile degli antibiotici, igiene rigorosa delle mani e misure di disinfezione ambientale. Tutte le superfici e le attrezzature devono essere efficacemente pulite e disinfettate dopo la visita di un paziente e prima di quella successiva. Se le superfici sono sporche, si devono usare innanzitutto detergenti e acqua perché la sporcizia può compromettere l’efficacia dei disinfettanti. Tutte le superfici devono essere facilmente lavabili (ad es. utilizzando tastiere per computer lavabili) ed è fondamentale coinvolgere tutto il personale, esponendo nei luoghi appropriati indicazioni sulle procedure di pulizia e disinfezione e inserendo in un registro i compiti relativi al protocollo. È stato segnalato un focolaio nosocomiale di SPMR con pazienti canini e felini colonizzati e infetti [31]. La segnalazione suggerisce la necessità di misure di controllo rigorose per arginare il focolaio e raccomanda l’adozione di una politica del tipo “cerca e isola” e di precauzioni standard come ad esempio disinfezione delle mani, isolamento dei pazienti, igiene ambientale e del vestiario, al fine di prevenire la trasmissione di SPMR tra i pazienti.
Conclusione
I veterinari specializzati in piccoli animali visitano spesso cani con piodermite batterica e la maggior parte dei casi al primo evento può essere trattata empiricamente. Si deve tuttavia sospettare l’infezione da SPMR se la risposta alla precedente terapia antibiotica è stata limitata o in presenza di altri fattori di rischio. In questi casi, occorre eseguire la coltura e l’antibiogramma perché SPMR offre opzioni antibiotiche sistemiche limitate. Il trattamento topico è consigliato come monoterapia o come terapia adiuvante all’antibiosi sistemica per accelerare il recupero. SPMR ha implicazioni zoonotiche e le strutture sono tenute ad attuare protocolli per evitare la diffusione di questo patogeno.
Ana Oliveira
DVM, MSc, Dip. ECVD, Faculdade Medicina Veterinária, Universidade Lusófona de Humanidades e Tecnologias (ULHT), Lisbona, Portogallo
Portogallo
La Dr.ssa Oliveira si è laureata come medico veterinario presso la Facoltà di Medicina Veterinaria di Lisbona nel 1998 e ha ottenuto il diploma dell’European College of Veterinary Dermatology nel 2009, dopo aver completato una residenza alla Royal (Dick) School of Veterinary Medicine, University of Edinburgh. La Dr.ssa Oliveira è attualmente responsabile del reparto di dermatologia presso la Facoltà di Medicina Veterinaria ULHT.
Riferimenti
- Bannoehr J, Ben Zakour NL, Waller AS, et al. Population genetic structure of the Staphylococcus intermedius group: insights into agr diversification and the emergence of methicillin-resistant strains. J. Bacteriol. 2007;189(23):8685-8692.
- Frank LA, Kania SA, Hnilica KA, et al. Isolation of Staphylococcus schleiferi from dogs with pyoderma. J. Am. Vet. Med. Assoc. 2003;222(4):451-454.
- Barber M. Methicillin-resistant staphylococci. J. Clin. Pathol. 1961;14:385-393.
- Van Duijkeren E, Catry B, Greko C, et al. Review on methicillin-resistant Staphylococcus pseudintermedius. J. Antimicrob. Chemother. 2011;66:2705-2714.
- Schissler JR, Hillier A, Daniels JB, et al. Evaluation of clinical laboratory standards institute interpretive criteria for Methicillin-Resistant Staphylococcus pseudintermedius isolated from dogs. J. Vet. Diagn. Invest. 2009;21:684-688.
- Loeffler A, Linek M, Moodley A, et al. First report of multiresistant, mecA-positive Staphylococcus intermedius in Europe: 12 cases from a veterinary dermatology referral clinic in Germany. Vet. Dermatol. 2007;18: 412-421.
- Onuma K, Tanabe T, Sato H. Antimicrobial resistance of Staphylococcus pseudintermedius isolates from healthy dogs and dogs affected with pyoderma in Japan. Vet. Dermatol. 2012;23:17-22.
- Gortel K, Campbell KL, Kakoma I, et al. Methicillin resistance among staphylococci isolated from dogs. Am. J. Vet. Res. 1999;60:1526-1530.
- Perreten V, Kadlec K, Schwarz S, et al. Clonal spread of methicillin-resistant Staphylococcus pseudintermedius in Europe and North America: an international multicentre study. J. Antimicrob. Chemother. 2010;65:1145-1154.
- Loeffler A, McCarthy A, Harrison E, et al. Genetic insights into the emergence of multidrug-resistance in meticillin-resistant Staphylococcus pseudintermedius, In Proceedings. 27th Congress ESVD-ECVD 2013:200.
- Hillier A, Lloyd DH, Weese JS, et al. Guidelines for the diagnosis and antimicrobial therapy of canine superficial bacterial folliculitis (Antimicrobial Guidelines Working Group of the International Society for Companion Animal Infectious Diseases). Vet. Dermatol. 2014;25:163-e43.
- Pinchbeck LR, Cole LK, Hillier A, et al. Genotypic relatedness of staphylococcal strains isolated from pustules and carriage sites in dogs with superficial bacterial folliculitis. Am. J. Vet. Res. 2006;67:1337-1346.
- Beco L, Guagure E, Lorente Mndez C, et al. Suggested guidelines for using systemic antimicrobials in bacterial skin infections: part 2 antimicrobial choice, treatment regimens and compliance. Vet. Rec. 2013;172:156-160.
- Beco L, Guagure E, Lorente Mndez C, et al. Suggested guidelines for using systemic antimicrobials in bacterial skin infections; part 1 diagnosis based on clinical presentation, cytology and culture. Vet. Rec. 2013;172:72.
- Sasaki T, Kikuchi K, Tanaka Y, et al. Methicillin-resistant Staphylococcus pseudintermedius in a veterinary teaching hospital. J. Clin. Microbiol. 2007;45:1118-1125.
- Nienhoff U, Kadlec K, Chaberny IF, et al. Methicillin-resistant Staphylococcus pseudintermedius among dogs admitted to a small animal hospital. Vet. Microbiol. 2011;150:191-197.
- Linek M. Update on MRSP, In Proceedings. 27th Ann Cong ESVD-ECVD 2014:114-117.
- Ravens PA, Vogelnest LJ, Ewen E, et al. Canine superficial bacterial pyoderma: evaluation of skin surface sampling methods and antimicrobial susceptibility of causal Staphylococcus isolates. Aust. Vet. J. 2014;92:149-155.
- Frank LA, Loeffler A. Meticillin-resistant Staphylococcus pseudintermedius: clinical challenge and treatment options. Vet. Dermatol. 2012;23:283-291.
- Summers JF, Brodbelt DC, Forsythe PJ, et al. The effectiveness of systemic antimicrobial treatment in canine superficial and deep pyoderma: a systematic review. Vet. Dermatol. 2012;23:305-329.
- Short J, Zabel S, Cook C, et al. Adverse events associated with chloramphenicol use in dogs: a retrospective study (2007-2013). Vet. Rec. 2014;175:537.
- Kadlec K, van Duijkeren E, Wagenaar JA, et al. Molecular basis of rifampicin resistance in methicillin-resistant Staphylococcus pseudintermedius isolates from dogs. J. Antimicrob. Chemother. 2011;66:1236-1242.
- Bryan J, Frank LA, Rohrbach BW, et al. Treatment outcome of dogs with meticillin-resistant and meticillin-susceptible Staphylococcus pseudintermedius pyoderma. Vet. Dermatol. 2012;23:361-368.
- Loeffler A, Cobb MA, Bond R. Comparison of a chlorhexidine and a benzoyl peroxide shampoo as sole treatment in canine superficial pyoderma. Vet. Rec. 2011;169:249.
- Couto N, Belas A, Couto I, et al. Genetic relatedness, antimicrobial and biocide susceptibility comparative analysis of methicillin-resistant and susceptible Staphylococcus pseudintermedius from Portugal. Microb. Drug Resist. 2014;20:364-371.
- Oliveira A, Mar B, Sola M, et al. In vitro determination of the minimum bactericidal concentration of a honey-based ointment against Staphylococcus pseudintermedius isolated from canine bacterial pyoderma, In Proceedings. 27th Ann Cong ESVD-ECVD 2014:200.
- Frank LA. Nisin-impregnated wipes for the treatment of canine pyoderma and surface bacterial colonization. Vet. Dermatol. 2009;20:219.
- Guardabassi L, Loeber M, Jacobson A. Transmission of multiple antimicrobial-resistant Staphylococcus intermedius between dogs affected by deep pyoderma and their owners. Vet. Microbiol. 2004;98:23-27.
- Morris DO, Boston RC, OShea K, et al. The prevalence of carriage of meticillin-resistant staphylococci by veterinary dermatology practice staff and their respective pets. Vet. Dermatol. 2010;21:400-407.
- British Small Animal Veterinary Association. Meticillin-resistant staphylococci in companion animals. Available at: www.bsava.com/Resources/MRSA.aspx. Accessed November 2014
- Grnthal T, Moodley A, Nyksenoja S, et al. Large outbreak caused by methicillin resistant Staphylococcus pseudintermedius ST71 in a Finnish veterinary teaching hospital from outbreak control to outbreak prevention. PLoS One 2014; DOI: 10.1371/journal.pone.0110084.
Altri articoli di questo numero
Condividi sui social media