Diagnosi e trattamento dell'epatite cronica canina
L'epatite cronica è una malattia comune nel cane, ma passa spesso inosservata, soprattutto nelle fasi iniziali; Cynthia Webster presenta una panoramica della malattia, con particolare attenzione alle opzioni diagnostiche e terapeutiche.
Article
Punti Chiave
Una diagnosi accurata di epatite cronica (EC) richiede la valutazione istopatologica di multiple biopsie epatiche, preferibilmente ottenute mediante laparoscopia, da diversi lobi epatici.
Per tutti i campioni bioptici epatici, deve essere valutata la concentrazione di rame in modo quantitativo, poiché l'eccesso di rame è una causa importante e trattabile di EC.
I cani possono avere un'infiammazione epatica significativa anche in assenza di segni clinici o una diagnostica per immagini compatibile con epatopatia.
Nei cani in cui si arrivati ad una diagnosi di EC idiopatica dopo esclusione meticolosa di tutte le altre cause, indicata la somministrazione ex juvantibus di farmaci immunosoppressori per determinare l'eventuale presenza di un'epatite immunomediata.
Introduzione
L'epatite cronica (EC) può colpire cani di qualsiasi razza e l'esordio può essere insidioso. Progredisce ad uno stadio definito cirrosi terminale quando si sviluppano fibrosi e rigenerazione nodulare significative; nel (Riquadro 1) sono indicati i criteri istopatologici che definiscono l’epatite cronica [1]. È fondamentale differenziare istologicamente l’EC da un’epatite reattiva aspecifica, dove sono presenti infiltrati infiammatori da lievi a moderati nelle regioni portali, lobulari e centrolobulari, senza alcuna evidenza di morte o degenerazione cellulare. Questi infiltrati sono dovuti alla diffusione di citochine infiammatorie ed endotossine da aree danneggiate in altre parti del letto splancnico [2].
|
Riquadro 1. Criteri istopatologici che definiscono l'epatite cronica.
Eziologia
Nella maggior parte dei cani con EC non è possibile determinarne l'eziologia, e si parla dunque di processi idiopatici [3] [4], ma esistono varie cause reali o potenziali che è importante sottolineare.
Numerosi studi hanno fallito nell’identificare virus epatotropici in cani con EC, ma in modelli sperimentali in cani da laboratorio sono emerse evidenze istopatologiche e/o sierologiche di batteri del genere Leptospira; inoltre, le moderne tecniche di biologia molecolare hanno permesso di identificare la presenza di Leptospire in cani con epatite granulomatosa [5]. Non è noto se l'EC sia causata dal microrganismo o da una reazione immunitaria nei confronti di quest'ultimo. La leishmaniosi è associata ad epatiti croniche granulomatose, ed anche infezioni batteriche (Bartonella), da rickettsie (Ehrlichia, Anaplasma), e protozoarie (Neospora, Toxoplasma, Sarcocystis) possono esserne causa.
Queste infezioni, tuttavia, sono più spesso acute o subacute e possono far parte di un processo patologico sistemico.
Diversi medicinali ed integratori hanno il potenziale di causare EC nel cane ed è importante raccogliere un'anamnesi farmacologica completa [6]. La maggior parte dei medicinali potrebbe causare lesioni epatiche acute, ma alcuni, tra cui anticonvulsivanti (fenobarbitale, primidone e fenitoina), ossibendazolo, lomustina, amiodarone, mitotano e FANS, possono portare ad infiammazione epatica cronica.
Un’altra possibile eziologia di cui tener conto è la tossicità da rame. Può accadere infatti che i cani assumano rame (Cu) in eccesso con la dieta. Il rame a livello epatico si lega a specifiche proteine o viene escreto nella bile, dal momento che il rame libero causa stress ossidativo che porta a morte epatocellulare. Nel cane, le concentrazioni normali di rame a livello epatico sono pari a 120-400 µg/g sul peso a secco (DW, Dry Weight) [7]. Il danno epatico (evidenziato dall’aumento dei livelli ematici di alanina aminotransferasi [ALT] in presenza di alterazioni morfologiche) inizia quando i livelli superano i 1000 µg/g su DW, e il danno è sempre presente con valori da 1500 µg/g su DW in su [7] [8] [9]. Esiste, tuttavia, una notevole variabilità fenotipica nella risposta del singolo cane all'eccesso di rame. Alcuni cani sopportano livelli di rame considerati tossici senza evidenza di alcun danno epatico, mentre altri presentano danni gravi con lievi aumenti di rame [9] [10] [11]. Sebbene in qualsiasi razza canina ci possa essere accumulo di rame, diverse razze mostrano una predisposizione (Tabella 1) [7]. In alcuni cani, ad esempio il Bedlington terrier, l'accumulo di rame è dovuto a modificazioni genetiche nelle proteine leganti il rame. Le ricerche suggeriscono tuttavia che un eccesso di rame nella dieta contribuisca alla crescente incidenza dell'epatite cronica da accumulo di rame (Cu-EC) segnalata negli ultimi due decenni [10] [11]. Circa 20 anni fa, diverse aziende di petfood passarono da un’integrazione nutrizionale di rame a base di ossido di rame (che ha una biodisponibilità molto scarsa) al rame chelato, maggiormente biodisponibile. Questo cambiamento, insieme al fatto che il National Research Council americano non ha stabilito un limite massimo per il rame introdotto con l’alimento, ha portato alla commercializzazione di alcuni alimenti commerciali contenenti quantità eccessive di rame altamente biodisponibile [12] [13]. In Europa, la FEDIAF1 ha stabilito un valore massimo per le concentrazioni di rame negli alimenti commerciali per cani, sebbene alcuni studi suggeriscano che nel cane, in particolare per alcune razze, si possa accumulare rame a livello epatico se alimentati con alimenti aventi concentrazioni di rame anche inferiori a tale livello [14] [15]. Negli ultimi due decenni, numerosi studi hanno riscontrato nel cane (con o senza EC) concentrazioni epatiche di rame superiori rispetto a popolazioni canine simili analizzate prima del 1998 [10] [11]. La diagnosi di epatopatia da accumulo di rame richiede la valutazione di un campione bioptico epatico che mostri la presenza sia di epatite cronica sia di un accumulo di rame (rodamina-positivo), principalmente negli epatociti centrolobulari, e livelli elevati di rame epatico (>400 µg/g DW, tipicamente superiore a 1000 µg/g su DW). Tuttavia, arrivare a questa diagnosi è sfidante. Infatti, bisogna tener conto della variabilità tra lobi epatici nella concentrazione di rame, della presenza di fibrosi, che se significativa può ridurre i livelli di rame, del fatto che i noduli rigenerativi non presentano accumulo di rame, e che le alterazioni infiammatorie/fibrotiche degli stadi terminali complicano la determinazione della distribuzione lobulare.
| Razza | Eziologia | Base genetica |
|---|---|---|
| Bedlington terrier | Rame |
Sì, COMMD1 (maggioranza) o ABCB12 |
| Dalmata | Rame | Sì, ma nessun gene identificato |
| Labrador retriever |
Rame (1/3 dei casi) Idiopatica/autoimmune |
Sì; ATP7B in circa 1/3 dei cani |
| Dobermann pinscher |
Rame Autoimmune |
Sconosciuta |
| English e American Cocker spaniel | Idiopatica/autoimmune | Sconosciuta |
| Springer Spaniel inglese | Idiopatica/autoimmune | Sconosciuta |
| West Highland white terrier | Rame Idiopatica |
Sì, ma nessun gene identificato |
Tabella 1. Predisposizioni di razza per l'epatite cronica.
1 Fédération européenne de l'industrie des aliments pour animaux familiers
Quando non viene identificata nessuna altra eziologia, si formula spesso una diagnosi di EC immunomediata. Sebbene non siano presenti criteri specifici per questa diagnosi, nei cani con EC idiopatica si suggerisce una base immunomediata in presenza di infiltrato linfocitario da moderato a marcato all'istopatologia, positività per autoanticorpi sierici, anamnesi familiare di EC, associazione con altre malattie autoimmuni (ad es., ipotiroidismo, atopia, IBD), sesso (tipicamente più frequente nelle femmine), e risposta positiva alla terapia immunosoppressiva [13]. Per arrivare ad una diagnosi presuntiva di epatopatia immunomediata bisogna eliminare scrupolosamente tutte le altre potenziali eziologie (infettiva, tossica (tossine ambientali o di origine alimentare), legata a medicinali).
Segnalamento e segni clinici

L'epatite cronica può presentarsi in qualsiasi cane, compresi i meticci, ma ci sono diverse razze predisposte (Tabella 1) [16]. L'epatite cronica si sviluppa generalmente in cani di mezza età, sebbene siano segnalati casi dai 5 mesi fino ai 17 anni. Esiste una predisposizione per le femmine nelle razze Labrador, Dobermann, Dalmata e Springer spaniel inglese, e una predisposizione per i maschi di Cocker spaniel (Figura 1).
I segni clinici più comuni sono aspecifici e possono includere letargia/depressione e anoressia. Poliuria e polidipsia (PU/PD) sono considerate segni precoci. Segni più specifici di epatopatia, come ittero, encefalopatia epatica e ascite, sono meno comuni e indicano generalmente una fase più avanzata della malattia (Figura 2a) (Figura 2b) (Figura 2c).
Data la capacità di riserva del fegato, molti cani con EC rimangono subclinici e la patologia viene identificata durante screening ematici di routine dall’aumento degli enzimi epatici all’esame biochimico. È in questa fase che si deve arrivare alla diagnosi, poiché l'intervento terapeutico nella malattia avanzata ha spesso meno successo.
Patologia clinica
L'alanina aminotransferasi sierica (ALT) sierica è il miglior test di screening per l'EC, sebbene la sua sensibilità sia solo intorno al 70-80%. Lesioni istologiche significative possono essere presenti anche in assenza di aumento dell'ALT. Normalmente, l’ALT aumenta di più rispetto alla fosfatasi alcalina (ALP), il cui livello tende ad elevarsi più tardi nel decorso della malattia. Nella cirrosi terminale, i livelli sierici degli enzimi epatici possono calare in modo marcato, man mano che gli epatociti sono sostituiti da tessuto fibroso. La Tabella 2 riassume la frequenza delle restanti alterazioni della biochimica clinica.
| Parametro | % di cani con alterazione | N. di studi (n. di cani) |
|---|---|---|
| Aumento ALT | 85 ±15 |
10 (250) |
| Aumento ALP | 82 ±18 | 10 (250) |
| Aumento AST | 78 ±10 | 3 (56) |
| Aumento GGT | 61 ±12 | 5 (121) |
| Diminuzione BUN | 40 ±29 | 5 (65) |
| Ipoalbuminemia | 49 ±19 | 15 (323) |
| Ipocolesterolemia | 40 ±12 | 4 (118) |
Tabella 2. Alterazioni biochimiche comuni nei cani con EC.
Gli acidi biliari sierici totali (TSBA) non sono considerati un test di screening per l'EC. Usando un cut-off di 20-25 mmol/L, la sensibilità degli acidi biliari pre- e post-prandiali nell’identificare l'EC è solo intorno al 50%. Gli acidi biliari sono molto sensibili in caso di shunt, e nei casi di cirrosi con ipertensione portale e sviluppo di shunt portosistemici acquisiti multipli (MAPSS) la sensibilità sale a quasi il 100%. Si sconsiglia di attenderne un aumento dei TSBA prima di procedere alla biopsia epatica, poiché si sarebbero già verificate alterazioni epatiche significative e forse irreversibili.
Dato che la PU/PD è un segno clinico comune nell'EC, l’esame delle urine mostra spesso isostenuria. All’EC da accumulo di rame si può associare la sindrome di Fanconi (glicosuria con normoglicemia), di natura transitoria [7].
Diagnostica per immagini
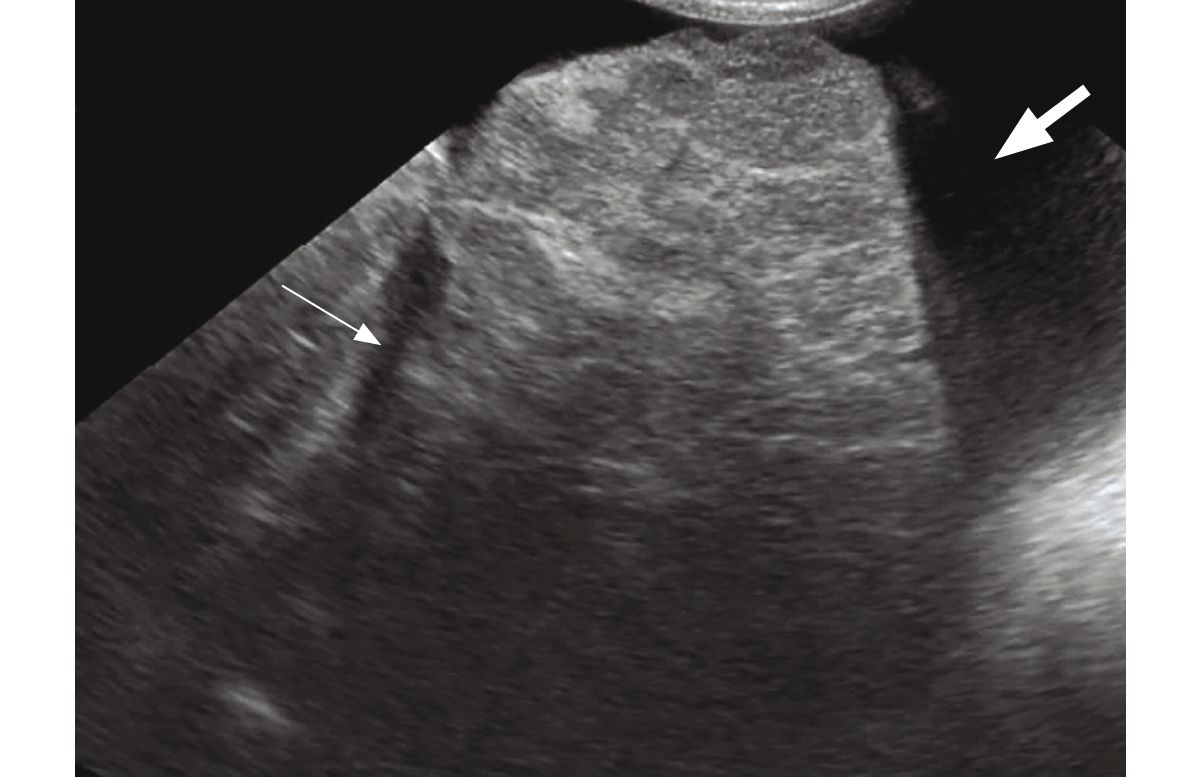
La radiologia del fegato è solitamente normale nei cani malati, quindi l'ecografia è una parte indispensabile degli accertamenti diagnostici di routine in tutti i cani con sospetta epatopatia cronica. La Tabella 3 mostra un riassunto delle alterazioni ecografiche più comuni descritte in letteratura. È importante notare che diversi studi hanno dimostrato che non esistono criteri ecografici tali da predire la presenza di EC; infatti, il fegato può apparire normale alla scansione anche in presenza di malattia significativa [17] [18] [19].
| Anomalia | % di cani che la mostrano |
|---|---|
| Microepatia | 39 |
| Ascite | 29 |
| Eterogenea/non omogenea/maculata | 23 |
| Iperecogena | 18 |
| Nodulare | 17 |
| Margini irregolari | 17 |
| Normale | 14 |
| Epatomegalia | 7,8 |
| MAPSS (shunt portosistemici acquisiti multipli) | 4,3 |
| Linfonodi epatici aumentati | 2,8 |
| Ipoecogena | 2 |
Tabella 3. Alterazioni ecografiche osservate nell'epatite cronica.
Nell'EC avanzata, il fegato può apparire ecograficamente piccolo e a margini irregolari (Figura 3), con segni di ipertensione portale. Questi includono ascite, edema (particolarmente a livello della cistifellea e del pancreas), ridotta velocità del flusso portale (velocità media <10 cm/s, rispetto all'intervallo normale di 10.5-25.7 cm/s), o flussi anomali e visualizzazione di MAPSS, che appaiono solitamente come un plesso intricato di piccoli vasi tortuosi, caudalmente al rene sinistro [20].
Esecuzione della biopsia
La diagnosi di EC richiede il campionamento del tessuto epatico. Gli agoaspirati non sono adeguati per emettere una diagnosi e comportano spesso una classificazione errata del processo patologico. La biopsia ecoguidata con aghi di grosso calibro (14 o 16 G) può fornire campioni adeguati per la diagnosi se il prelievo viene eseguito in più di una zona [21]. Tuttavia, l'accuratezza diagnostica delle biopsie con ago da 18 G è discutibile, poiché i campioni prelevati sono di dimensione relativamente piccola, soggetti a frammentazione in presenza di fibrosi, e, qualora ci fossero alterazioni in lobi diversi da quelli mediali o laterali di sinistra, che sono facilmente accessibili, il prelievo potrebbero non essere eseguibile. Questo può rappresentare un problema, data la frequente eterogeneità tra i diversi lobi epatici in termini di severità istologica e deposito di rame. In genere, per una diagnosi accurata di EC si richiede al patologo di valutare 10-12 regioni portali, difficili da ottenere a meno che non vengano effettuate biopsie multiple. Tuttavia, queste possono aumentare il rischio di sanguinamento.
La laparoscopia è la tecnica di riferimento per l’ottenimento di biopsie epatiche. Consente una valutazione macroscopica dell'intero fegato, del sistema biliare extraepatico e delle strutture circostanti, permettendo al contempo l'acquisizione di multipli campioni di maggiori dimensioni, con una media di 16-18 triadi portali per campione bioptico. Per la diagnosi di EC, servono cinque campioni da almeno due lobi diversi; tre per la valutazione istopatologica e uno ciascuno per la coltura aerobi/anaerobi e la quantificazione dei metalli pesanti.
| Parametro | Criteri per alto rischio |
|---|---|
| HCT | <30% |
| Conta piastrinica | <80.000 |
| PT/aPTT |
>1.5 x limite superiore |
| vWF (nelle razze sensibili) | <50% |
| Tempo di sanguinamento della mucosa buccale (BMBT) | >5 minuti |
| Fibrinogeno | <100 mg/dL |
Riquadro 2. Valutazione del rischio di sanguinamento per biopsia epatica.
I rischi della biopsia comprendono: complicanze anestesiologiche (specialmente in pazienti con epatopatia avanzata), emorragie, embolie gassose (in laparoscopia), infezioni, pneumotorace e shock vagotonico. La preoccupazione principale è l'emorragia [22]. È difficile valutare il rischio di sanguinamento nei cani con epatopatia che presentano carenze sia nei procoagulanti che negli anticoagulanti e nei regolatori della fibrinolisi. In circa il 40% dei cani epatopatici si rileva prolungamento di PT e aPTT. In molti si riducono fibrinogeno, antitrombina e proteina C, con presenza occasionale di lievi anemia e trombocitopenia. Le linee guida per la valutazione del rischio di sanguinamento sono delineate nel (Riquadro 2), in base a lavori di letteratura umana e a pochi studi effettuati finora sul cane. [13] [21] [22].
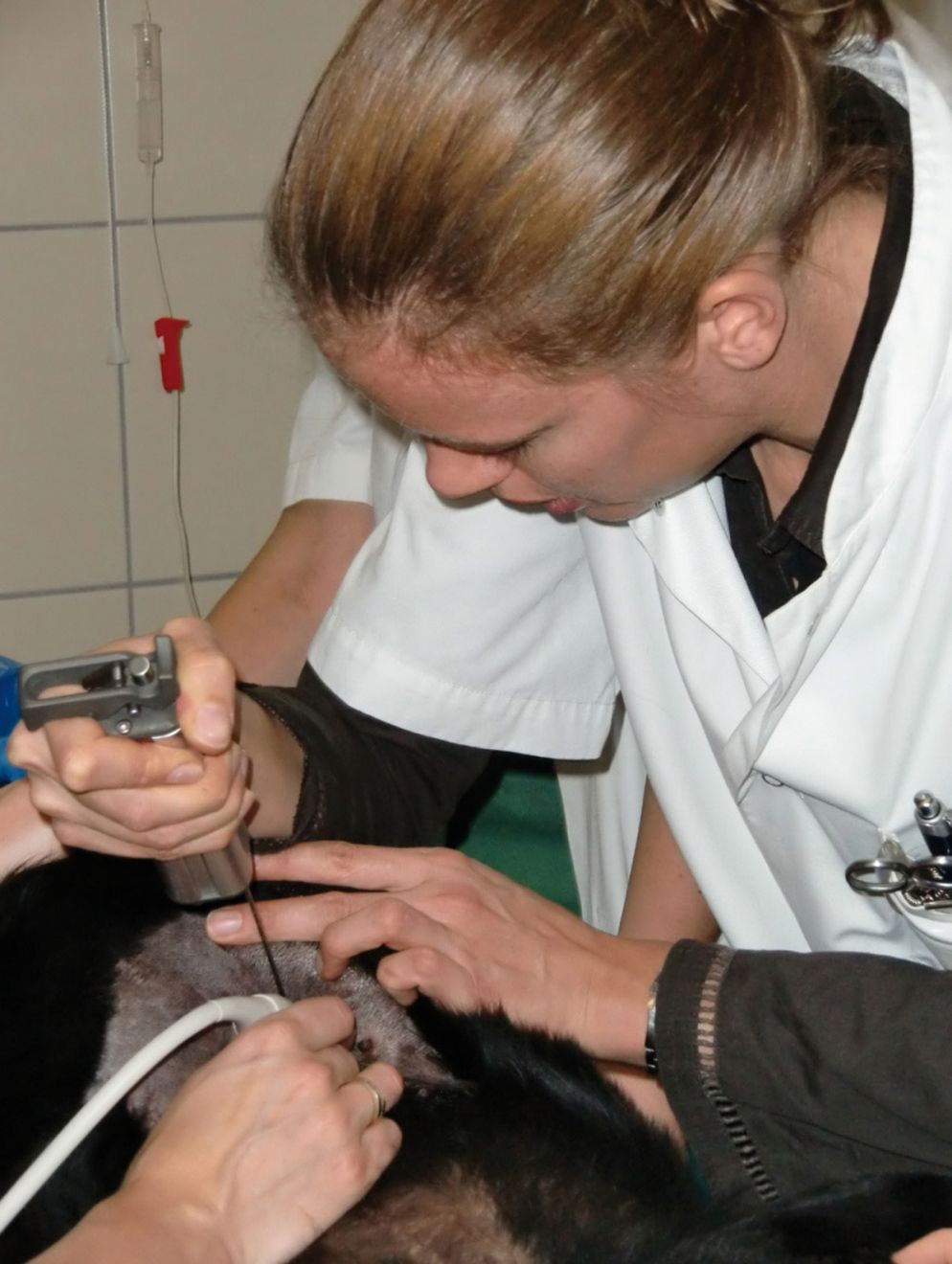
La biopsia epatica ecoguidata (Figura 4) comporta un rischio di sanguinamento maggiore rispetto alle tecniche in cui l'emostasi può essere controllata localmente (ad es. laparoscopia), sebbene il rischio di complicanze (definito come necessità di trasfusione o di rianimazione con fluidi) sia basso per entrambi i metodi, intorno all'1-5% [13] [22].
Nei pazienti ad alto rischio, non è noto se gli interventi preventivi, come la somministrazione di emoderivati o di vitamina K, riduca il rischio di emorragia dopo il prelievo epatico, ad eccezione dei cani con bassa attività del fattore di von Willebrand, che dovrebbero ricevere un prodotto crioprecipitato associato a desmopressina. Pertanto, nei cani ad alto rischio, si raccomanda di prestare la massima attenzione alla tecnica, di monitorare attentamente i soggetti ricoverati per 12 ore dopo la biopsia e di essere pronti all’utilizzo di emoderivati [13].
Interpretazione della biopsia
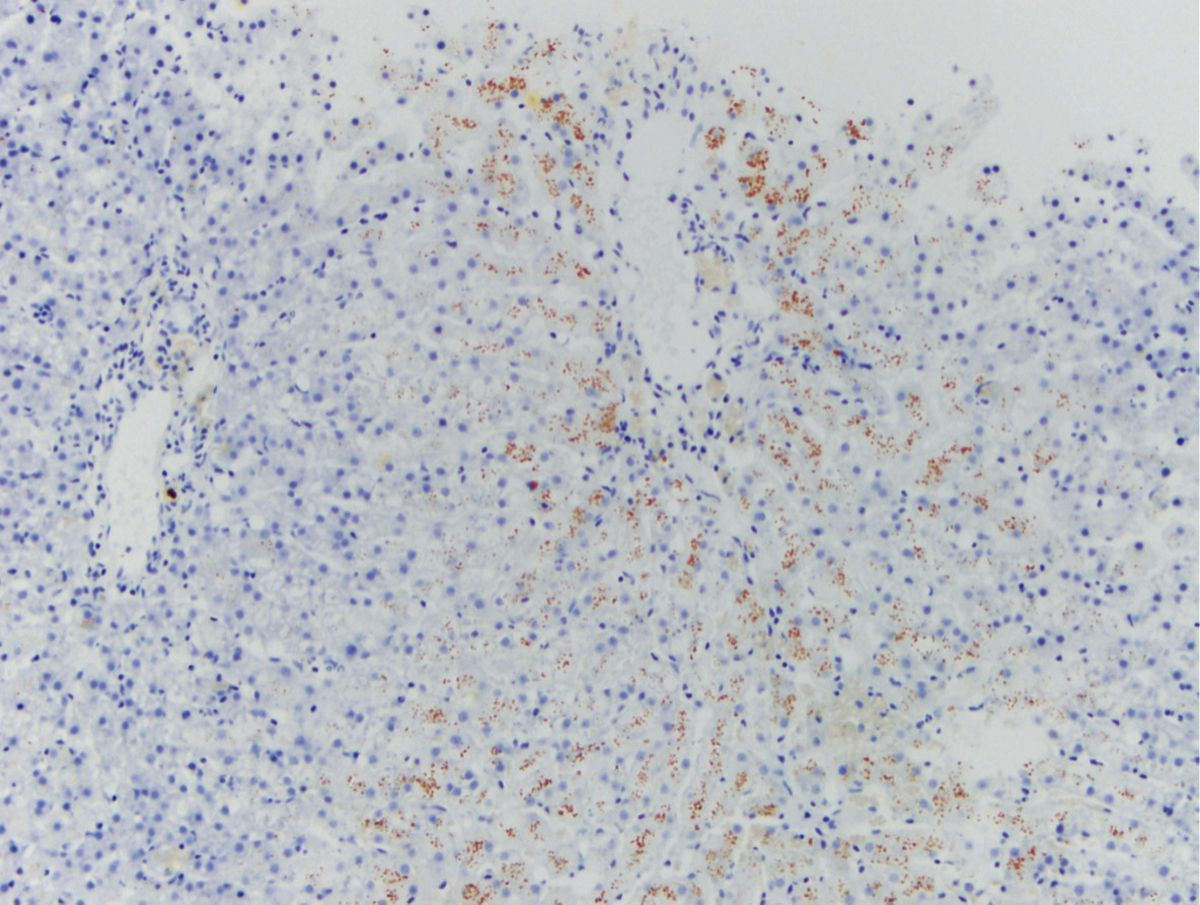
La valutazione dei campioni bioptici epatici richiede colorazioni con ematossilina ed eosina, rosso Sirio o tricromica di Masson (per la fibrosi) e rodanina (per il rame) [21]. È consigliabile che il patologo indichi il tipo, la sede e l'entità dell'infiammazione, della fibrosi e delle alterazioni degenerative (lipidosi, alterazione vacuolare, lipogranulomi), come pure la presenza, sede ed estensione della necrosi e della reazione dei dotti biliari, nonché la distribuzione lobulare e la quantità di rame determinato dalla colorazione (Figura 5). In alcuni casi è indicata l’esecuzione di colorazioni speciali per microrganismi infettivi, in particolare nell'epatite piogranulomatosa. Per massimizzare il valore intrinseco delle biopsie è necessario uno scambio consistente di informazioni tra veterinario clinico e patologo. In alcuni casi, si dovrebbe considerare la valutazione dei campioni da parte di un patologo (e internista) con esperienza in istopatologia e medicina del fegato.
Terapia
La terapia deve essere mirata all'eziologia sottostante. Se si sospetta un agente infettivo, si deve eseguire un'adeguata terapia antimicrobica, e i tossici o i medicinali vanno eliminati dall'ambiente del cane. Qualsiasi aumento del rame a livello epatico in un cane con EC deve essere trattato. Il trattamento dell’epatopatia da accumulo di rame è sintetizzato nella Tabella 4 e comprende restrizione dietetica del rame e metodi per chelarlo o prevenirne l'assorbimento intestinale (penicillamina e zinco) [7]. È indicata la somministrazione concomitante di epatoprotettori e antiossidanti (S-adenosilmetionina, vitamina E e/o acido ursodesossicolico). Alcuni cani con epatopatia da accumulo di rame presentano infiammazione intensa e possono trarre beneficio da un breve ciclo di corticosteroidi a dosaggio antinfiammatorio.
| Trattamento e dosaggio | Meccanismo d'azione e note |
|---|---|
| Nutrizione con ridotto tenore di rame Fornire una dieta commerciale o casalinga adeguata con <5 mg/kg sul peso secco (0,1-0,12 mg/100 kcal) <0,1 µg/g di rame nell’acqua; utilizzare acqua distillata o acqua testata per il rame |
Limita l'assorbimento intestinale di rame Le diete a contenuto limitato di rame disponibili hanno spesso una restrizione proteica non necessaria; considerare l'aggiunta di proteine La maggior parte dei cani richiede una dieta a basso contenuto di rame per tutta la vita In presenza di tubi in rame, far scorrere l'acqua per alcuni minuti per eliminare quello in sospensione |
| D-penicillamina 10-15 mg/kg q12 PO a stomaco vuoto |
Chelante del rame Gli effetti collaterali comuni includono nausea e vomito. Gli effetti più rari includono deficit di rame, Ferro o Zinco, di vitamina B12, eruzioni cutanee, proteinuria e discrasie ematica. Può causare lieve aumento dell'ALP ed epatopatia vacuolare. Non somministrare assieme allo zinco |
| Zinco (zinco gluconato) 50 mg q12 a stomaco vuoto |
Induce la sintesi della metallotioneina citoplasmatica nell'intestino e nel fegato, diminuendo l'assorbimento di rame e proteggendo il fegato. Rimuove lentamente il rame, quindi appropriata solo per il mantenimento Spesso causa nausea e vomito; raramente si osserva anemia emolitica. È indispensabile monitorare i livelli sierici che devono essere >200 mg/dL, ma inferiori a 1000 mg/dL |
| S-adenosilmetionina (SAMe) 20 mg/kg PO q24 a stomaco vuoto |
Aumenta i livelli di glutatione (GSH), promuove le poliammine antinfiammatorie e la metilazione del DNA e delle membrane per favorire la stabilità cellulare Causa occasionalmente vomito. Dato che il composto è instabile, nel cane vanno utilizzati prodotti con farmacodinamica comprovata |
| Vitamina E 10 UI/kg PO q24, senza superare 400 UI/cane/die |
Antiossidante: previene la perossidazione lipidica delle membrane Fornire assieme al cibo. A dosi elevate, può essere pro-ossidante e interferire con la coagulazione |
| Ursodiol 10-15 mg/kg PO q24 somministrato con il cibo |
Coleretico, antiossidante e anti-apoptosico. Indicato in caso di iperbilirubinemia o evidenza di alterazioni ecografiche dell'albero biliare. Provoca talvolta vomito. Le formulazioni generiche hanno solitamente un'ottima biodisponibilità |
Tabella 4. Terapia dell’epatopatia cronica da accumulo di rame.

Bedlington terrier, Dalmata e cani giovani con marcato aumento del rame epatico (>3000 µg/g su DW) avranno probabilmente bisogno di una nutrizione specifica a vita, combinata ai chelanti del rame. In tutti gli altri casi, il tempo necessario per raggiungere l'equilibrio del rame tramite la penicillamina e una dieta a basso contenuto di rame non è noto. Alcuni paper sui Labrador retriever suggeriscono che la durata della chelazione venga correlata alla concentrazione epatica iniziale di rame, con 6, 9 e >12 mesi richiesti in presenza di 1000, 1500 e 2000 µg/g su DW rispettivamente (Figura 6). Non è noto se questo sia applicabile ad altre razze. L'opinione degli esperti è che alcuni cani eliminino il rame più facilmente di altri, e che spesso questo avvenga a prescindere dalla sua concentrazione epatica [13].
Idealmente, la ripetizione della biopsia, assieme alla determinazione qualitativa e quantitativa dei livelli di rame, dovrebbe definire quando è possibile interrompere la terapia chelante. Se ciò non fosse possibile, si può utilizzare il livello ematico dell’ALT come marcatore surrogato, pur riconoscendo che i suoi livelli possono rimanere normali nonostante l'infiammazione in corso; è quindi consigliabile proseguire la terapia chelante per 2-3 mesi dopo la normalizzazione dei livelli di ALT. Sebbene qualche lavoro suggerisca che gli agoaspirati colorati con rodamina possano essere utili nel monitoraggio dei livelli di rame, questa procedura non sarà raccomandata fino alla pubblicazione di ulteriori studi.
In alcuni cani, nonostante il ripristino del normale livello del rame, persistono infiammazione, evidenziata dall'istologia ed aumento dell’ALT. Questi cani non erano affetti da epatopatia da accumulo di rame, oppure il danno aveva esposto i neoepitopi e scatenato una reazione immunitaria che si perpetua.
Generalmente, tutti i cani affetti vengono alimentati con basso contenuto di rame, e sebbene questo spesso non sia sufficiente per mantenerne un livello epatico normale, è difficile prevedere quali cani richiedano una terapia aggiuntiva. In generale, i cani con livelli iniziali elevati (>2000 µg/g), quelli con anamnesi familiare di epatopatia da accumulo di rame ed i cani in cui l'ALT non si normalizza entro un periodo di 6-8 mesi dall’inizio della terapia chelante, continuano con la nutrizione specifica associata a una terapia di mantenimento con penicillamina o zinco.
Dato che il miglioramento istologico avviene in ritardo rispetto al miglioramento clinico e di laboratorio, la terapia deve proseguire oltre la normalizzazione degli esami di laboratorio.
Studi limitati suggeriscono che alcuni cani con epatopatia da accumulo di rame idiopatica abbiano realmente una malattia autoimmune e possano andare in remissione con la terapia appropriata; mancano tuttavia studi clinici prospettici sull’uso di immunosoppressori nell'EC a sospetta base autoimmune. Corticosteroidi, azatioprina, micofenolato e ciclosporina vengono suggeriti per il trattamento dell'epatite autoimmune nel cane (Tabella 5), sebbene nessuno di questi farmaci sia supportato da studi clinici prospettici. Spesso, i cani in cui si sospetta una patologia su base autoimmune ricevono anche epatoprotettori in concomitanza.
| Medicinale e dosaggio | Commenti e possibili effetti indesiderati |
|---|---|
| Azatioprina 1 mg/kg PO q24 per 7 giorni, quindi 1 mg/kg q48 |
Aumento degli enzimi epatici (generalmente reversibile con l'interruzione) Mielosoppressione reversibile |
| Prednisolone 2 mg/kg PO q24 (non oltre 40 mg/die) ridotti gradualmente a 0,5 mg/kg q48 |
PU/PD/polifagia Disturbi GI Ipercoagulabilità Aumento di ALP e GGT Sviluppo di epatopatia da steroidi Predisposizione alle infezioni (ad es. UTI) Catabolismo Ritenzione di sodio Utilizzare desametasone nei pazienti con ascite |
| Ciclosporina 5 mg/kg PO q12 |
[Nausea/vomito Iperplasia gengivale Predisposizione alle infezioni (ad es. UTI e infezioni da funghi opportunisti) Utilizzare solo preparati emulsionati Si raccomanda di non utilizzare prodotti generici nella terapia iniziale |
| Micofenolato 10 mg/kg PO q12 |
Diarrea |
Tabella 5. Terapia immunosoppressiva per presunta EC immunomediata.
Ancora una volta, l'endpoint terapeutico ottimale per giudicare la risposta al trattamento è la normalizzazione dell'istologia epatica, ma questa spesso non è ripetibile, per cui il livello dell'ALT può essere utilizzato come marker surrogato. Non è nota la tempistica di remissione nei cani con EC autoimmune. La normalizzazione degli enzimi epatici può richiedere 2-3 anni nell'uomo, anche se si osserva un outcome a lungo termine migliore quando il livello torna sotto controllo già entro 3 mesi. Dato che il miglioramento istologico avviene in ritardo rispetto al miglioramento clinico e di laboratorio (entro 3-8 mesi nell'uomo), la terapia deve proseguire oltre la normalizzazione degli esami di laboratorio per alcuni mesi, prima di tentare l'interruzione del trattamento. Parametri di laboratorio negli intervalli di riferimento per oltre 12-18 mesi possono essere un adeguato marker per considerare di interrompere la terapia medica. Il tasso di recidiva nei cani non è noto, ma nell'uomo arriva fino al 50%. Spesso, ricominciare la terapia prontamente porta al controllo della patologia.
Prognosi e complicanze
L’epatite cronica è una patologia generalmente a carattere ingravescente. Vari studi hanno quindi valutato i tempi di sopravvivenza [13]; tutti gli studi erano retrospettivi e i cani sono stati trattati con una ampia gamma di farmaci e sottoposti a vari regimi nutrizionali. In 10 studi con dati di sopravvivenza (n=364 cani), la sopravvivenza media era di 561 giorni ± 268 giorni. Nei cani con cirrosi comprovata dalla biopsia, la sopravvivenza era notevolmente inferiore, pari a 23 ± 23 giorni (n=39). I fattori clinicopatologici associati a una prognosi sfavorevole sono iperbilirubinemia, aumento di PT e aPTT, e ipoalbuminemia. La presenza di ascite e il grado di fibrosi riscontrato alla biopsia sono fattori prognostici negativi; l'unica eccezione potrebbe essere nei Cocker spaniel con EC, dove i cani con ascite possono avere una sopravvivenza maggiore.
Le complicanze dell'EC nel cane comprendono: ipertensione portale, ascite, encefalopatia epatica, ulcere gastrointestinali e coagulopatie (sanguinamento e trombosi) [20] [23] [24]. Il sanguinamento è più comune con la malattia in stadio terminale, la trombosi si verifica più spesso quando sono coinvolti altri fattori pro-trombotici, quali infiammazione sistemica, chirurgia o terapia corticosteroidea [20]. L'incidenza delle infezioni batteriche secondarie è scarsamente documentata nei cani con EC, ma sembra essere appena del 5% circa [24].
L'epatite cronica può colpire qualsiasi razza canina e l'esordio può essere insidioso; lesioni istologiche significative possono essere presenti anche in assenza di aumento degli enzimi epatici. Per una diagnosi definitiva, sono necessari campioni bioptici multipli, sebbene la biopsia possa comportare alcuni rischi per il paziente. Una terapia mirata è preferibile, ove possibile, sebbene in molti casi l'agente causale non venga identificato; inoltre, è consigliabile proseguire la terapia per alcuni mesi dopo la risoluzione dei segni clinici.
Cynthia RL Webster
DVM, Dipl. ACVIM (SAIM)
Stati Uniti d'America
La Dr.ssa Webster si è laureata alla Cornell University nel 1985 e, dopo aver lavorato in una clinica privata, è tornata alla Cummings School of Veterinary Medicine per il suo percorso di residency. Nel 1993 si è diplomata in Medicina interna dei piccoli animali, quindi ha completato una borsa di studio post dottorato in Biologia del trasporto epatocitario. Attualmente Professore associato al dipartimento di Scienze cliniche della Tufts Veterinary School, è autrice di oltre 100 articoli e numerosi capitoli di libri. Recentemente, ha presieduto il panel di consensus ACVIM sulla diagnosi e il trattamento dell'epatite cronica nel cane.
Riferimenti
- Van den Ingh TSGAM, Van Winkle TJ, Cullen JM, et al. Morphological classification of parenchymal disorders of the canine and feline liver: Hepatocellular death, hepatitis, and cirrhosis-2 (updated version) In: WSAVA Standards for Clinical and Histological Diagnosis of Canine and Feline Liver Diseases. Society of Comparative Hepatology. Available at; http://www.vetvisuals.com/lms/moodle/mod/book/view.php?id=1001&chapterid=52859
- Twedt DC. Reactive hepatopathies and chronic hepatitis in the dog. Vet Q 1998;2:S46-47.
- Bexfield N. Canine idiopathic chronic hepatitis. Vet Clin North Am Small Anim Pract 2017;47:645-663.
- Poldervaart JH, Favier RP, Penning LC, et al. Primary hepatitis in dogs: a retrospective review (2002-2006). J Vet Intern Med 2009;23:72-80.
- Kearns S. Infectious hepatopathies in dogs and cats. Top Companion Anim Med 2009;24:189-198.
- Bunch SE. Hepatotoxicity associated with pharmacologic agents in dogs and cats. Vet Clin North Am Small Anim Pract 1993;23(3):659-670.
- Dirksen K, Fieten H. Canine copper-associated hepatitis. Vet Clin North Am Small Anim Pract 2017;47:631-644.
- Thornburg LP, Rottinghaus G, McGowan M, et al. Hepatic copper concentrations in purebred and mixed-breed dogs. Vet Pathol 1990;27:81-88.
- Thornburg LP, Rottinghaus G, Dennis G, et al. The relationship between hepatic copper content and morphologic changes in the liver of West Highland White Terriers. Vet Pathol 1996;33:656-661.
- Johnston AN, Center SA, McDonough SP, et al. Hepatic copper concentrations in Labrador Retrievers with and without chronic hepatitis: 72 cases (1980-2010). J Am Vet Med Assoc 2013;242:372-380.
- Strickland JM, Buchweitz JP, Smedley RC, et al. Hepatic copper concentrations in 546 dogs (1982-2015). J Vet Intern Med 2018;32(6):1943-1950.
- Subcommittee on Dog and Cat Nutrition, Committee on Animal Nutrition, National Research Council. Nutrient Requirements of Dogs and Cats. Washington, DC: The National Academy Press; 2006.
- Webster CRL, Center SA, Cullen JM, et al. ACVIM consensus statement on the diagnosis and treatment of chronic hepatitis in dogs. J Vet Intern Med 2019;33(3):1173-1200.
- Fieten H, Hooijer-Nouwens BD, Biourge VC, et al. Association of dietary copper and zinc levels with hepatic copper and zinc concentration in Labrador Retrievers. J Vet Intern Med 2012;26(6):1274-1278.
- http://www.fediaf.org/images/FEDIAF_Nutritional_Guidelines_2019_Update_030519.pdf
- Watson P. Canine breed-specific hepatopathies. Vet Clin North Am Small Anim Pract 2017;47:665-682.
- Kemp SD, Panciera DL, Larson MM, et al. A comparison of hepatic sonographic features and histopathologic diagnosis in canine liver disease: 138 cases. J Vet Intern Med 2013;27:806-813.
- Feeney DA, Anderson KL, Ziegler LE, et al. Statistical relevance of ultrasonographic criteria in the assessment of diffuse liver disease in dogs and cats. Am J Vet Res 2008;69:212-221.
- Warren-Smith CM, Andrew S, Mantis P, et al. Lack of associations between ultrasonographic appearance of parenchymal lesions of the canine liver and histological diagnosis. J Small Anim Pract 2012;53:168-173.
- Buob S, Johnston AN, Webster CR. Portal hypertension: pathophysiology, diagnosis, and treatment. J Vet Intern Med 2011;25:169-186.
- Lidbury JA. Getting the most out of liver biopsy. Vet Clin North Am Small Anim Pract 2017;47:569-583.
- Webster CR. Hemostatic disorders associated with hepatobiliary disease. Vet Clin North Am Small Anim Pract 2017;47:601-615.
- Rothuizen J. Important clinical syndromes associated with liver disease. Vet Clin North Am Small Anim Pract 2009;39:419-437.
- Wagner KA, Hartmann FA, Trepanier LA. Bacterial culture results from liver, gallbladder, or bile in 248 dogs and cats evaluated for hepatobiliary disease: 1998-2003. J Vet Intern Med 2007;21:417-424.
Altri articoli di questo numero
Condividi sui social media