Gestione delle ferite con plasma freddo
Scritto da Christoph J. Klinger
La terapia con CAPP (Cold Atmospheric Pressure Plasma, plasma freddo a pressione atmosferica) è una tecnologia emergente nel campo veterinario; questo articolo offre un'introduzione a questa procedura innovativa e ai suoi vantaggi per il cane.
Punti chiave
La terapia al plasma freddo un metodo semplice e indolore, che elimina efficacemente gli agenti infettivi e accelera il processo di guarigione della ferita.
Sebbene la CAPP possa essere molto efficace contro i batteri multiresistenti, non elimina la causa sottostante e non deve sostituire la diagnosi clinica.
Introduzione
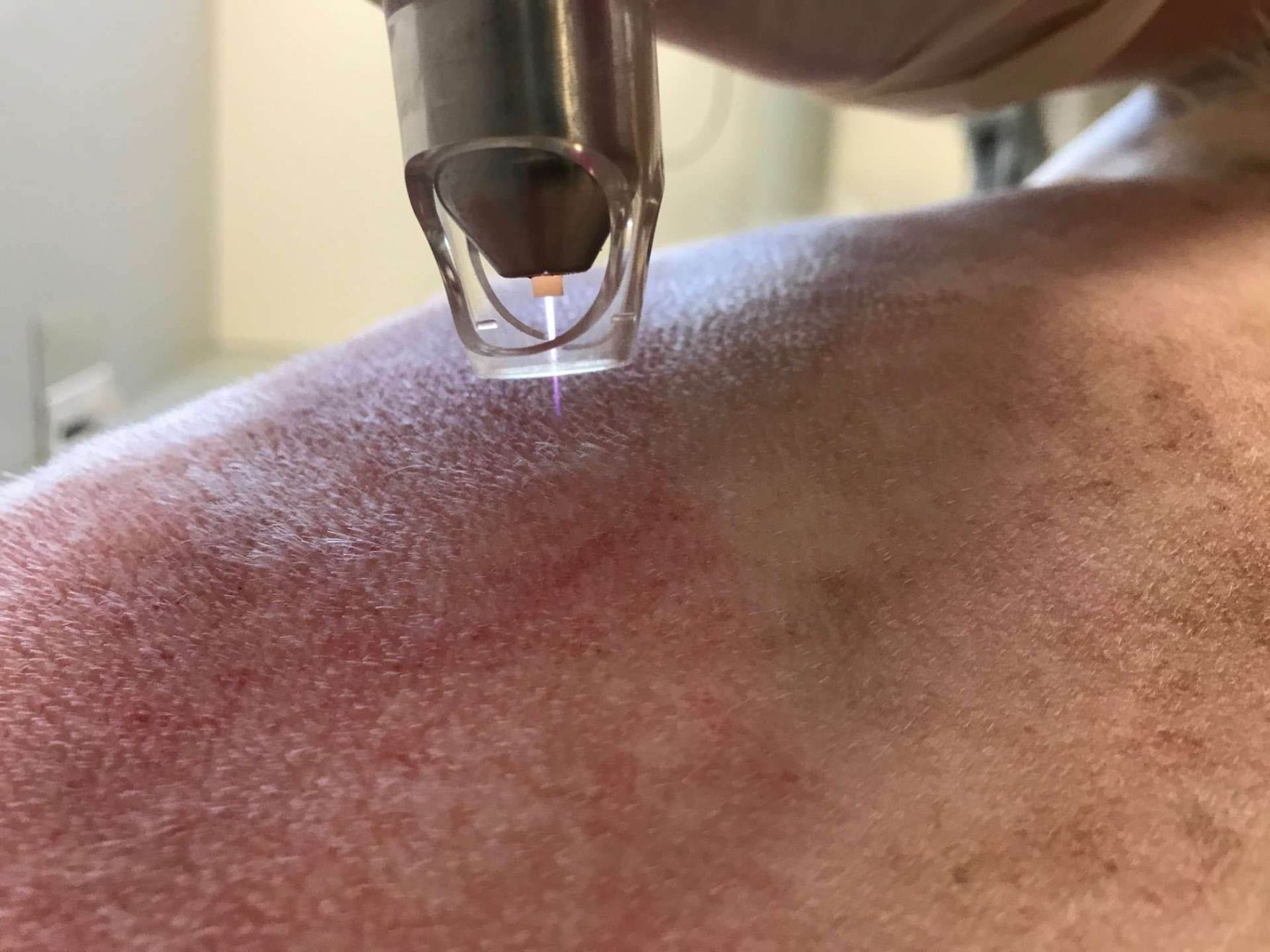
Dato il numero crescente in tutto il mondo di infezioni batteriche e fungine farmaco-resistenti, sta diventando sempre più importante sviluppare alternative terapeutiche per tali patogeni infettivi. Il progresso verso metodi sostenibili, fisici o di altro tipo, in grado di eliminare tali agenti problematici appare sempre più essenziale, e la terapia con plasma freddo a pressione atmosferica (CAPP) appartiene a questo tipo di procedure, offrendo un'efficacia comprovata nel trattamento di batteri, virus e funghi resistenti [1][2][3][4][5]. Inoltre, la tecnica modifica e sovraregola numerosi fattori che promuovono e accelerano la guarigione, particolarmente vantaggioso in pazienti con disturbi della guarigione delle ferite [6][7]. Originariamente utilizzata in medicina umana, la CAPP sta diventando più ampiamente accettata anche in medicina veterinaria, in parte perché è una procedura indolore che può essere applicata senza sedazione [8]; l'attuale mancanza di studi sugli animali rende la tecnica ancora relativamente sconosciuta. Questo articolo offre un'analisi approfondita della terapia, e alcuni esempi pratici del possibile uso effettivo su piccoli animali (Figura 1).
Principi fisici di base e modalità d’azione
Il plasma è talvolta chiamato il "quarto stato della materia" (dopo gli stati solido, liquido e gassoso) ed è essenzialmente una miscela gassosa di ioni o elettroni liberi in uno spazio confinato [9]. Esempi naturali del fenomeno includono i fulmini e le eruzioni solari, ma il plasma può anche essere prodotto artificialmente a temperatura ambiente e pressione atmosferica normale, ad esempio accelerando particelle gassose cariche lungo un campo elettromagnetico. È stato dimostrato che la terapia con CAPP influenza positivamente la guarigione tissutale accelerando il processo di guarigione e riducendo la formazione di cicatrici. Il modo in cui produce i suoi effetti non è ancora del tutto chiaro, sebbene sia noto che la CAPP influenzi fortemente alcuni fattori di crescita (es. FGF-7 per la migrazione del cheratinocita), alcune molecole segnale antinfiammatorie (come TGF-β) e varie vie infiammatorie [6][7][8][9][10][11].
La CAPP era inizialmente utilizzata solo per la disinfezione della ferita e per promuovere la guarigione di soggetti ustionati, ma oggi è indicata in molte altre situazioni. È efficace nel trattamento delle infezioni cutanee, sia semplici che complicate (soprattutto in presenza di patogeni multiresistenti) e per vari altri disturbi della guarigione della ferita, come ad esempio quelli che possono svilupparsi secondariamente al diabete [1][3][6]. La terapia è ampiamente segnalata come estremamente efficace nel combattere i patogeni batterici, virali e fungini, anche quando c'è formazione di biofilm [2][3][5][9], e la sua modalità d’azione fisica rende irrilevante qualsiasi resistenza ad antibiotici, antimicotici o antivirali. Gli studi hanno dimostrato che la CAPP ha un effetto batteriostatico eccellente su Staphylococcus aureus spp. meticillino-resistente (MRSA), S. pseudintermedius (MRSP) e su Pseudomonas aeruginosa multi-resistente (MRPA), cioè alcuni dei patogeni cutanei batterici più comuni in medicina veterinaria [1][2][3][4].
Progettazione e applicazione del dispositivo
Attualmente sono disponibili tre tipi di dispositivi base, ognuno dei quali con vantaggi e svantaggi. Tutti prevedono la creazione di plasma freddo mediante ionizzazione di un gas in stato di plasma, solitamente aria atmosferica (cioè ossigeno e azoto) o un gas inerte, come ad esempio l'argon.
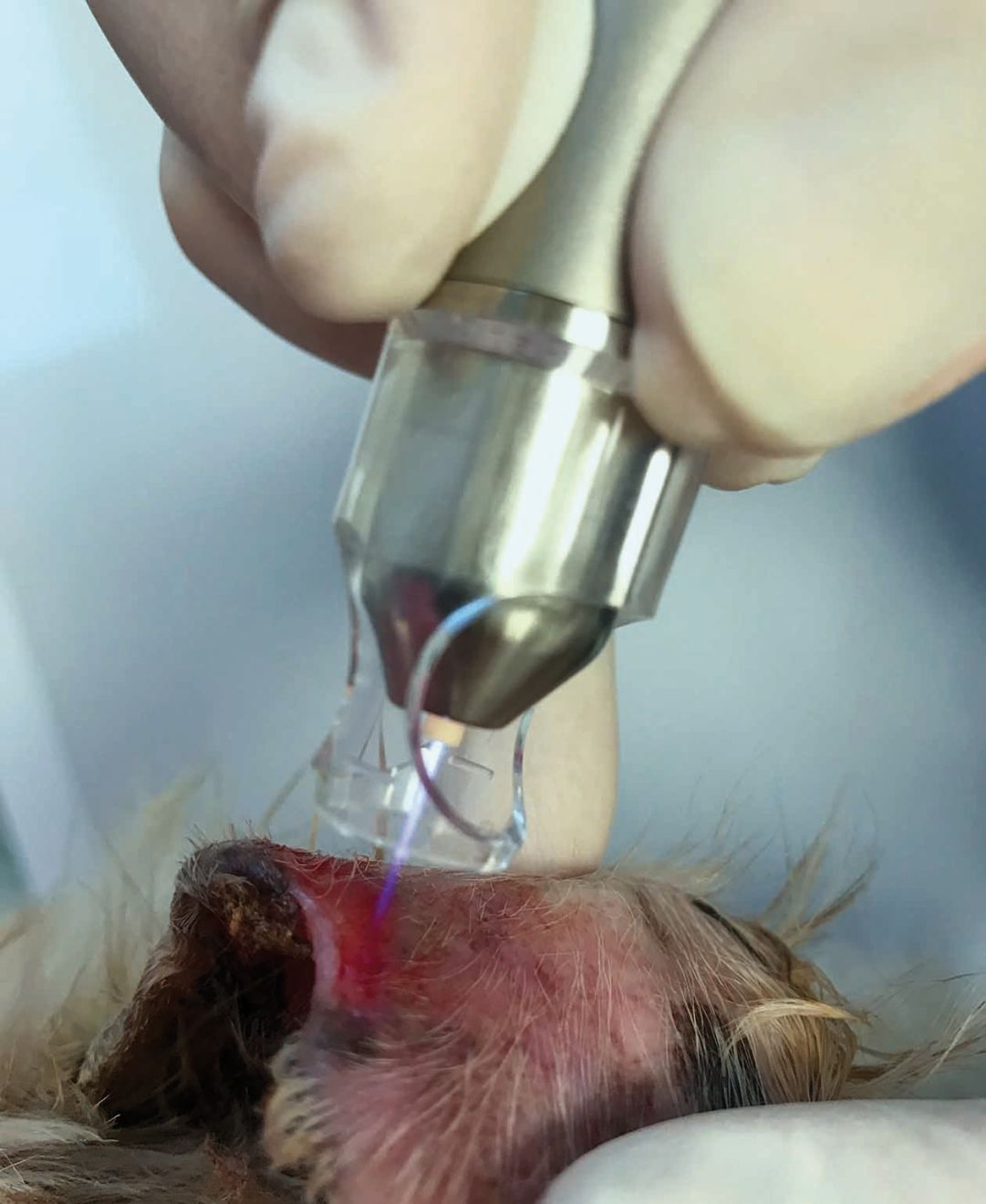
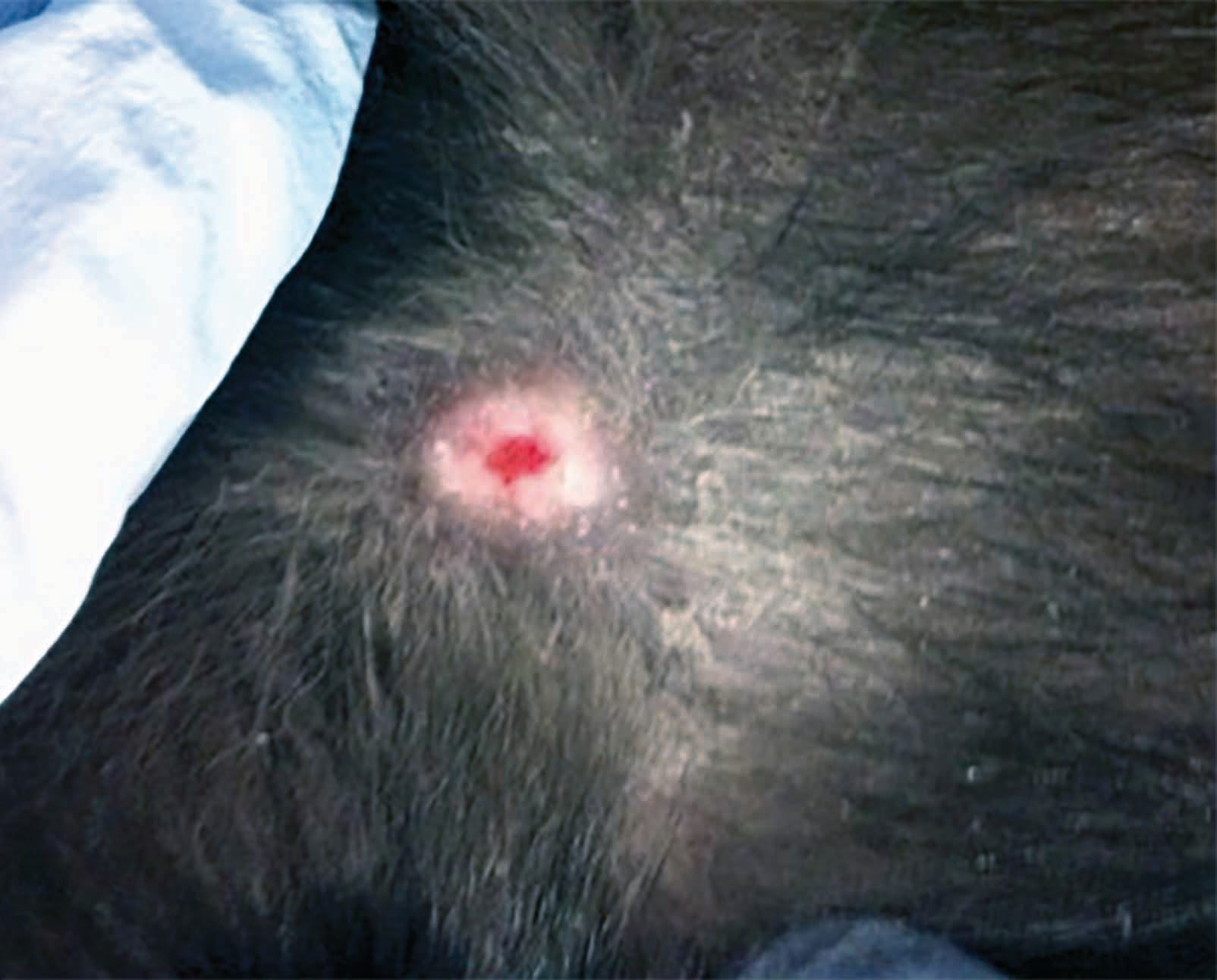
- Il dispositivo più semplice ed economico (a partire da € 2.000) crea una carica elettrica sul catodo e utilizza la cute come anodo, con il plasma che viene generato nello spazio ristretto tra i due (Figura 2). I principali vantaggi, oltre al costo, sono la semplicità d'uso e una progettazione relativamente semplice, che consente di poter alimentare il dispositivo a batteria. Alcuni pazienti trovano sgradevole il rumore o la sensazione di "formicolio", che dipende dall'intensità della corrente applicata.
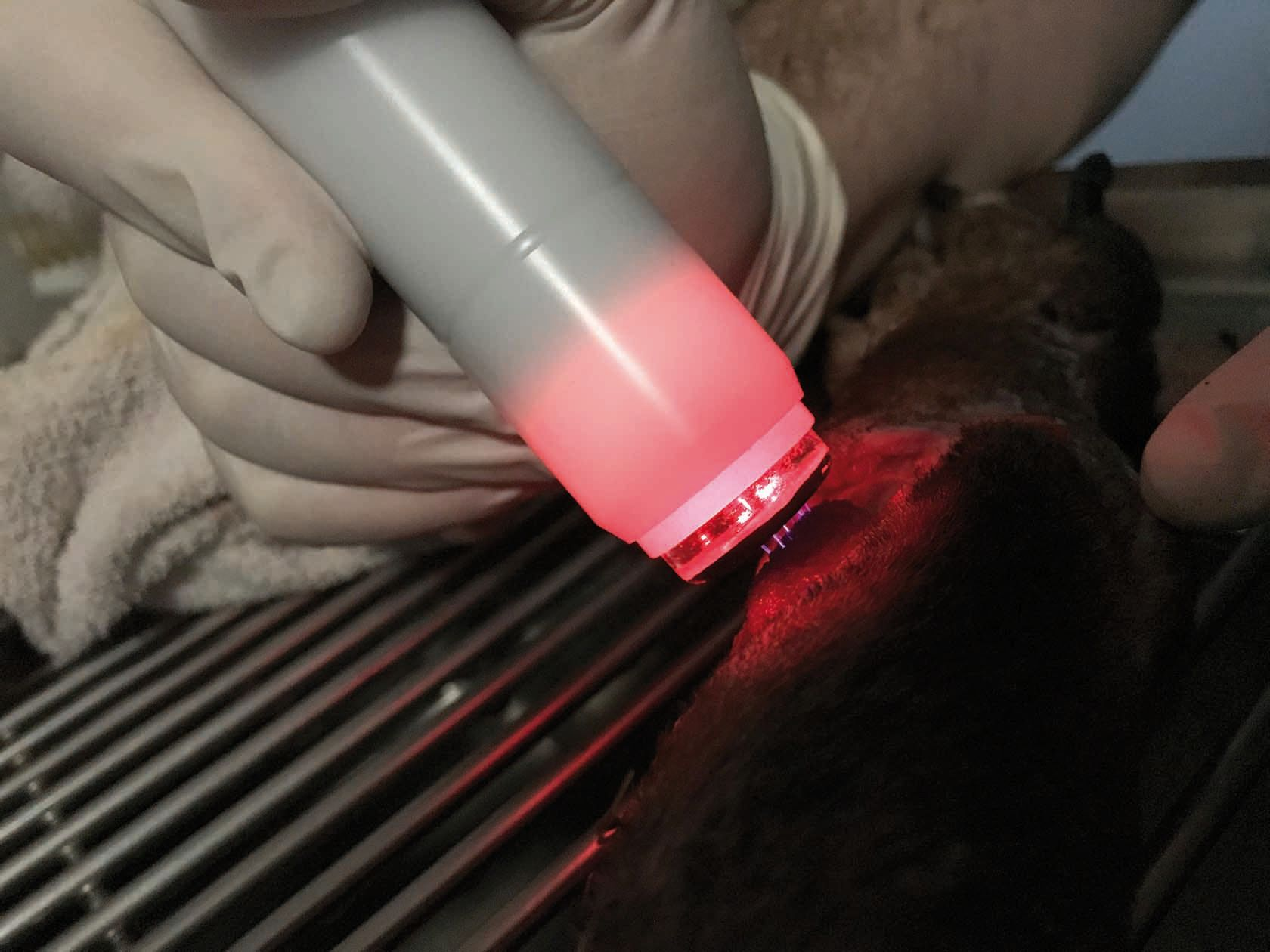
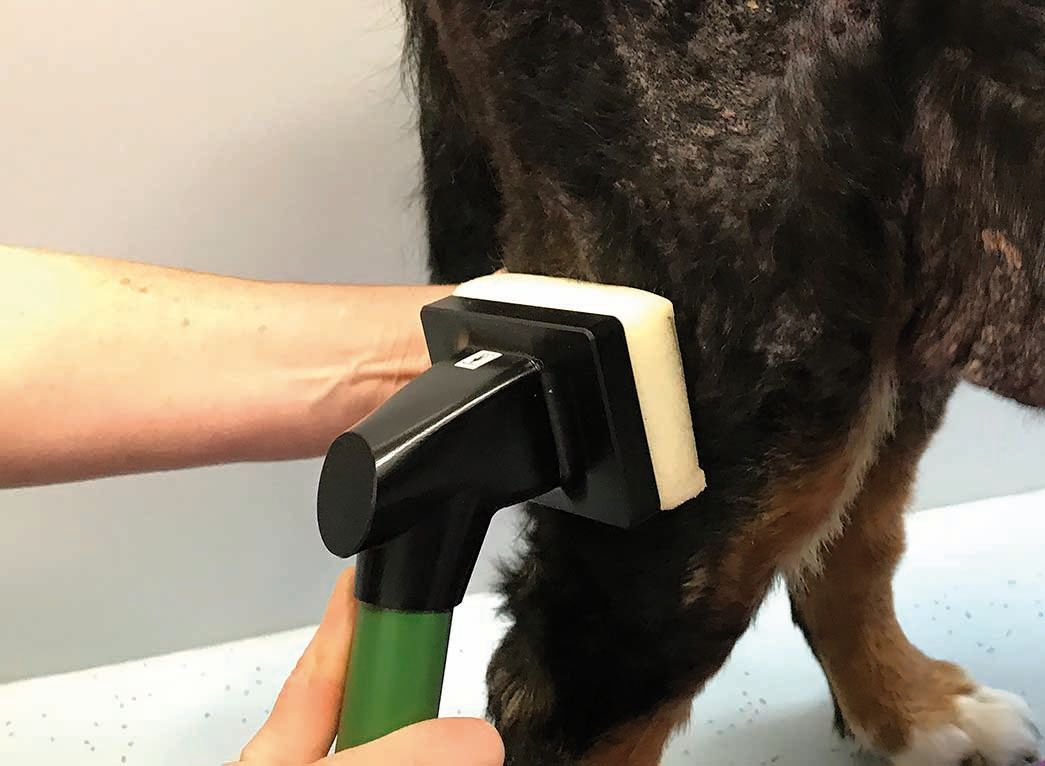
- Un secondo tipo di dispositivo utilizza un mezzo intermedio (ad es. un tampone di poliuretano) collocato come conduttore elettrico tra il catodo e la cute. Questo riduce o elimina la sensazione di formicolio (Figura 3), anche se può ancora capitare che il contatto diretto con la ferita risulti sgradevole. Questo metodo consente di trattare una superficie relativamente ampia e risparmiare tempo se si trattano ferite più grandi o cani di grossa taglia. Tuttavia, per i pazienti di piccola taglia, le ferite più piccole, o le lesioni delle pliche cutanee, il collocamento corretto del tampone di poliuretano può complicare il procedimento. Inoltre, per ogni paziente è necessario un tampone nuovo, e sebbene i dispositivi siano portatili, richiedono comunque la rete elettrica per funzionare.
- Un terzo tipo di dispositivo genera plasma partendo da un gas inerte, come ad esempio l'argon, che viene quindi rilasciato sulla punta della penna di trattamento sotto forma di una piccola fiamma o "getto" (Figura 1). Il getto viene trasmesso alla superficie cutanea con movimenti circolari, vicino alla ferita stessa ma senza toccarla. Questo modello consente trattamenti "spot" selettivi, anche nelle pliche cutanee più profonde o in ferite cavitarie, e può consentire la rapida essiccazione delle ferite essudative e purulente, minimizzando al tempo stesso l'irritazione o il rumore. Lo svantaggio risiede nel costo d'acquisto elevato (fino a € 15.000), nel consumo di gas, e nella portabilità molto limitata del dispositivo.
Ci sono numerose segnalazioni che la terapia con CAPP sia estremamente efficace nella lotta contro batteri, virus e funghi, anche in presenza di biofilm; inoltre, il suo meccanismo d’azione rende irrilevante qualsiasi resistenza ad antibiotici, antimicotici o antivirali.
Tutti e tre i dispositivi sono facili da usare e possono essere azionate da assistenti dopo un breve periodo di formazione; questo consente alla terapia con CAPP di essere convenientemente integrata nella pratica quotidiana, sia in assenza di sterilità come nella sala visite che in una sala operatoria asettica. Essendo indolore, il paziente richiede raramente sedazione o anestesia; il successo dipende dall'identificazione della causa principale del problema [6][7]. La durata e la frequenza di applicazione dipendono in parte dalle specifiche del dispositivo (la profondità di penetrazione varia da alcuni nanometri a pochi millimetri), e in parte dal tipo, dalla profondità e dalla natura della lesione. Generalmente, il trattamento dell'area interessata ogni 2 o 3 giorni per due settimane, ridotto poi a una volta alla settimana, è un regime iniziale solitamente efficace.
Ad oggi, gli effetti indesiderati della CAPP sembrano bassissimi, a parte minima irritazione cutanea in caso di contatto prolungato [8]. Sebbene siano stati effettuati pochi studi comparativi per valutare l'efficacia dei vari dispositivi [12], l'autore ritiene che la tolleranza del paziente e la velocità di guarigione appaiano migliori con il terzo tipo di dispositivo. I proprietari sono generalmente molto soddisfatti dai risultati di qualsiasi dispositivo CAPP e sono disposti a pagare costi aggiuntivi per questa terapia.
Possibili applicazioni in Medicina Veterinaria
Attualmente, tutti i dispositivi sono progettati principalmente per l'uso topico e l'aspetto più significativo e innovativo della terapia con CAPP è che consente di ottenere la disinfezione fisica di quasi tutte le sedi che hanno un coinvolgimento batterico, virale o fungino [1][4][5]; inoltre, è fortemente efficace contro vari ceppi batterici, sia non resistenti che resistenti [1][12]. Data la sua penetrazione tissutale limitata, le ferite aperte e poco profonde sembrano essere l'applicazione ideale per la tecnica; i suoi effetti positivi nelle aree difficili da raggiungere (pieghe interdigitali, cavità corporee, canali uditivi e ferite profonde) sono invece più discutibili. Per ora, molto dipende dal modello del dispositivo e dal tipo di lesione trattata; alcuni dispositivi per CAPP possono essere adatti per il trattamento della pododermatite o dell'otite esterna, mentre altri sono più idonei per l'uso su superfici ampie.
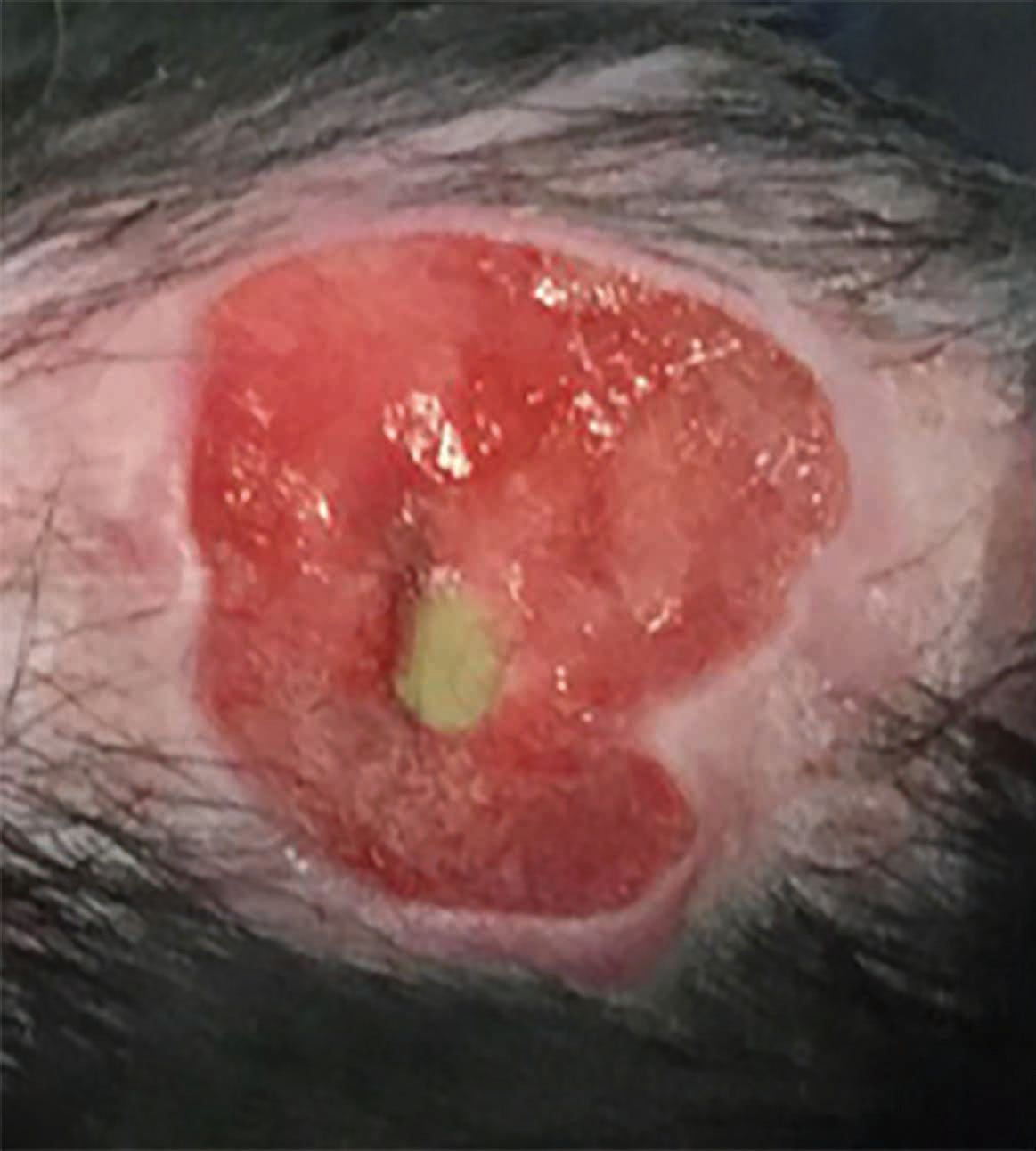
Oltre all'aspetto della disinfezione, si stanno presentando altri vantaggi di questa terapia. Ad esempio, si utilizza nelle lesioni correlate a vasculite come, ad esempio, quelle osservate nella leishmaniosi. La Figura 4 mostra un Labrador affetto da leishmaniosi trattato precedentemente per quattro settimane con antimoniato di meglumina, miltefosina e allopurinolo. Sebbene i parametri clinici e i titoli anticorpali fossero migliorati con il trattamento, la vasculite associata aveva determinato il graduale peggioramento dell'ulcerazione sulla faccia interna delle pinne auricolari, con esposizione della cartilagine sottostante. Questa condizione è andata in remissione quasi completa entro 28 giorni grazie alla terapia con CAPP, sebbene i segni siano poi riapparsi sei mesi dopo a causa della leishmaniosi.
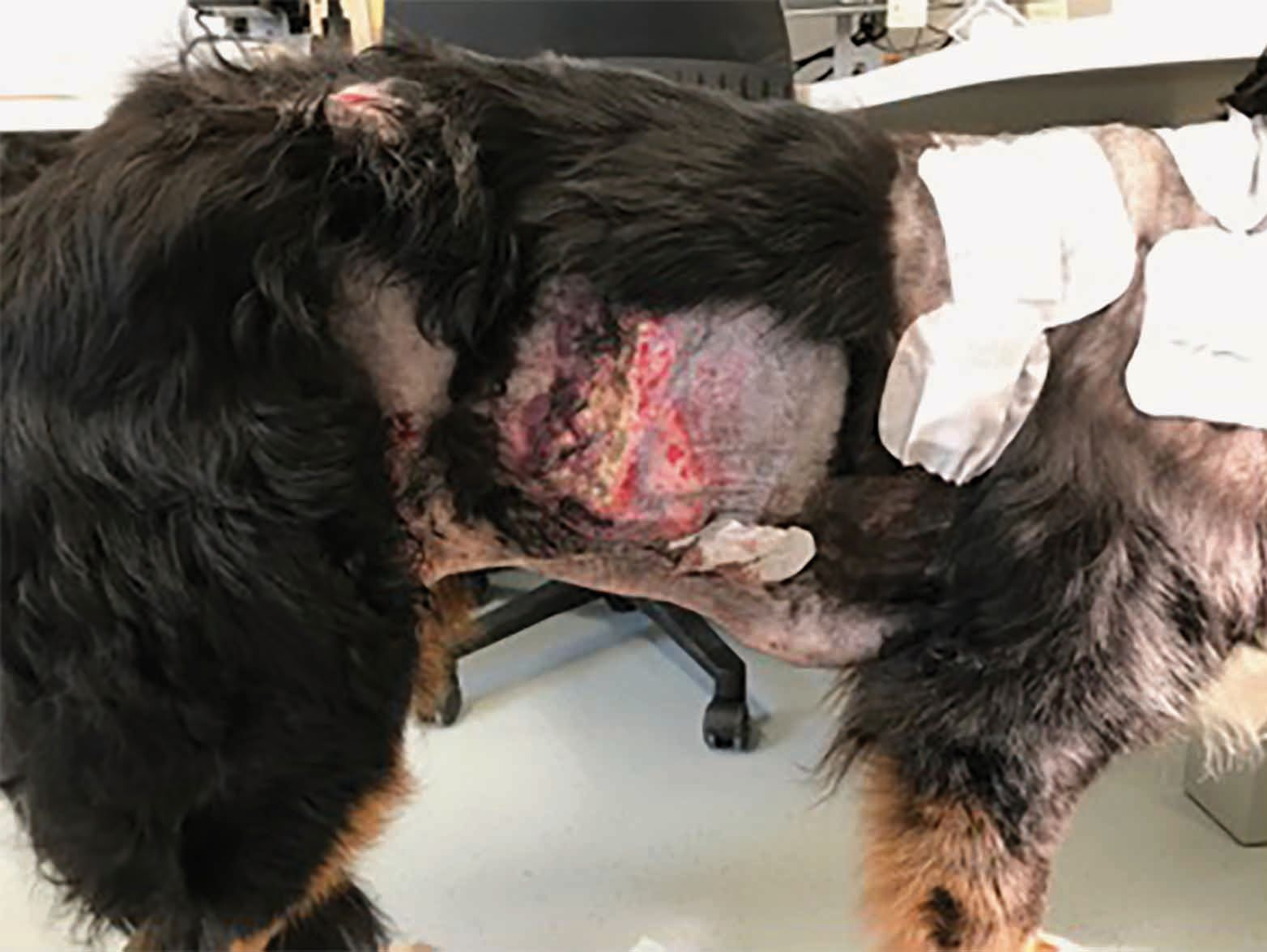
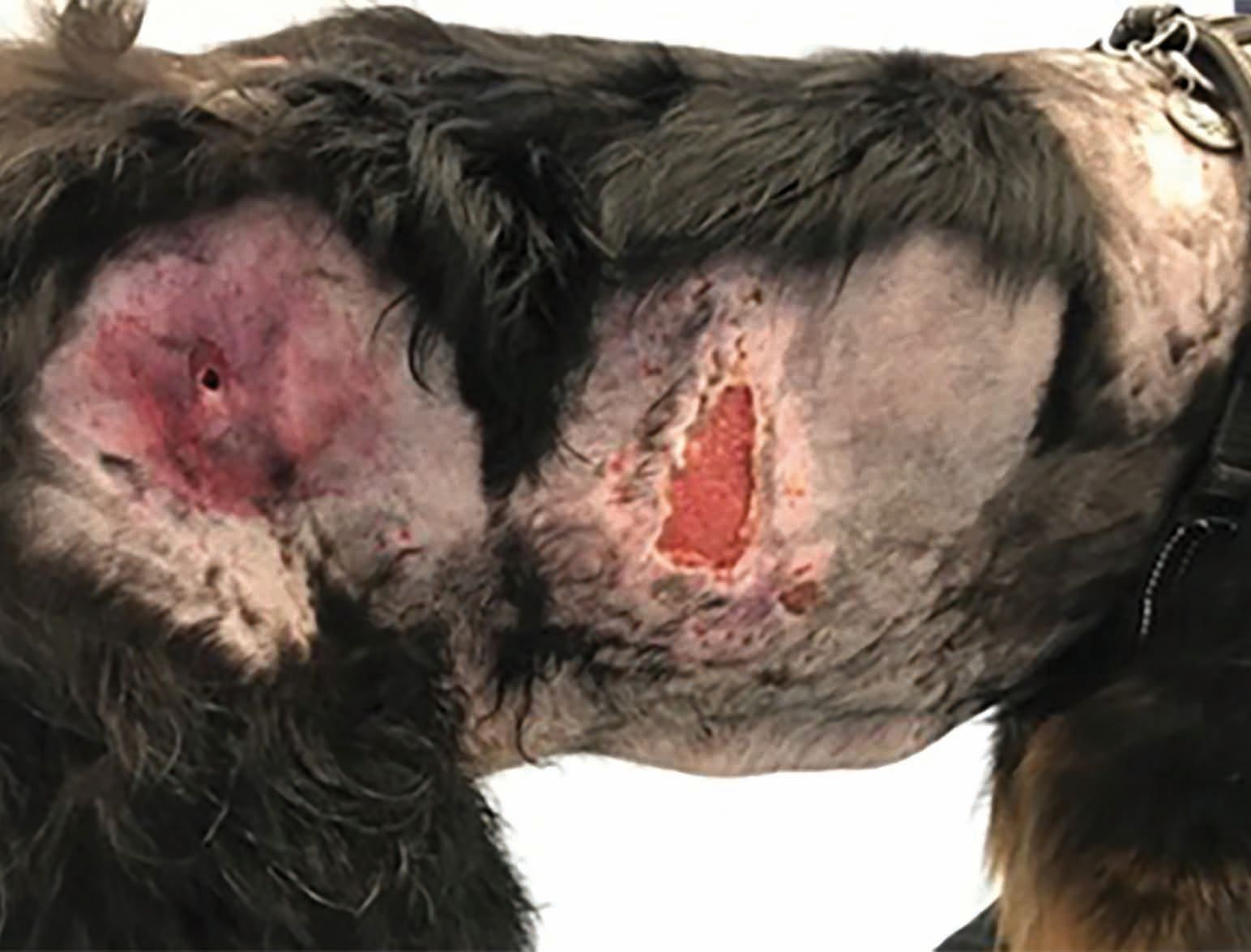
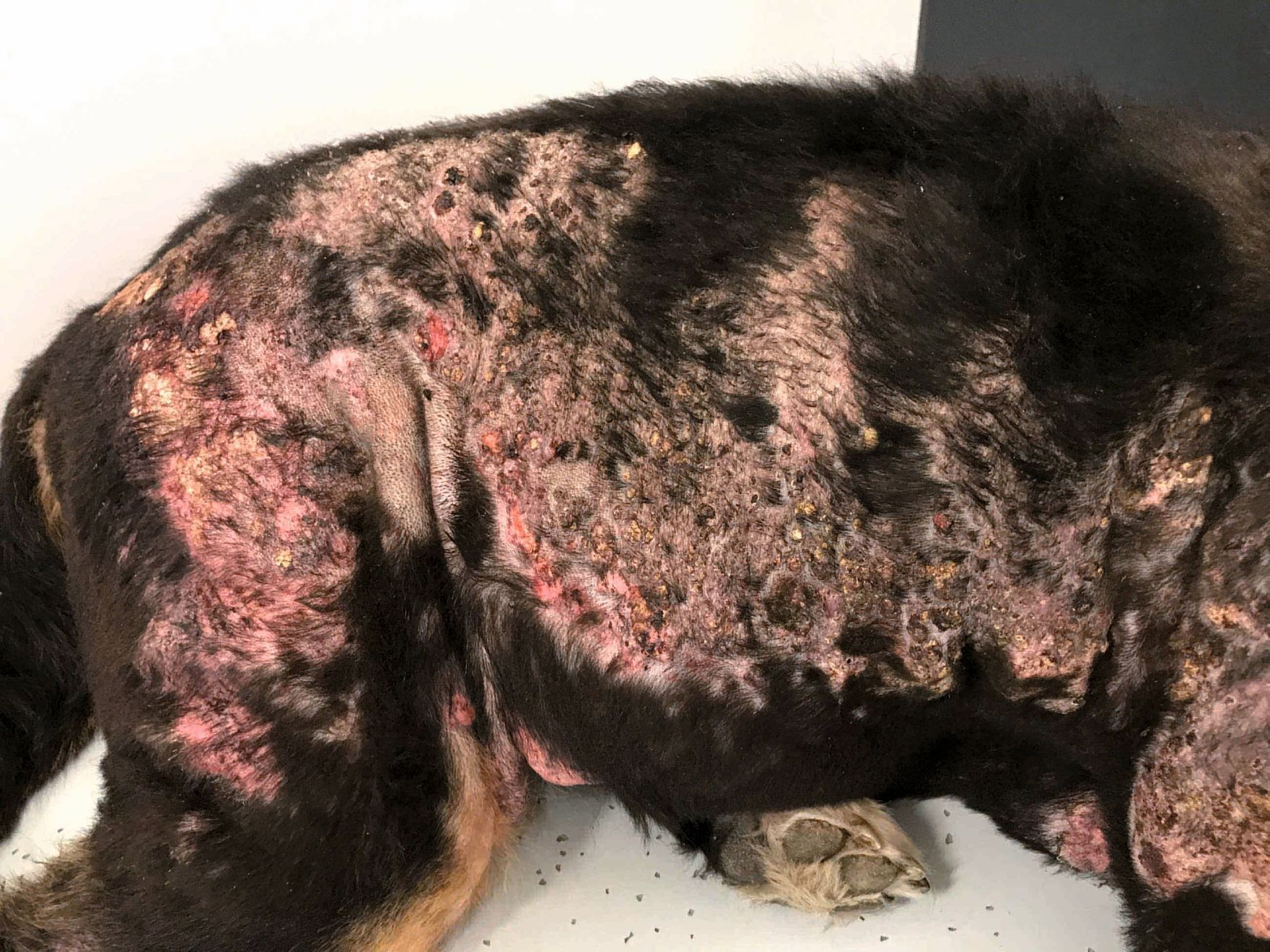
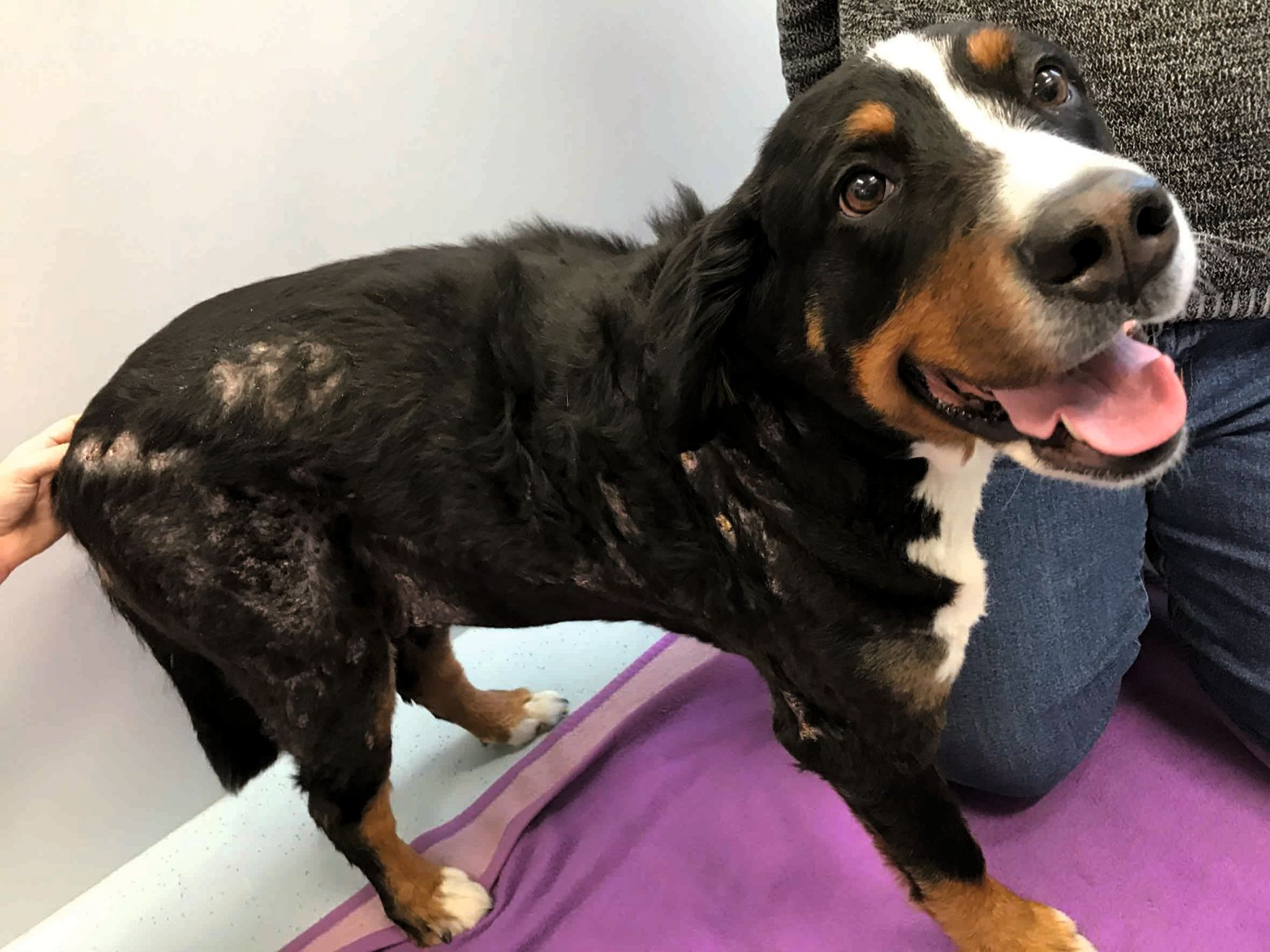
È importante sottolineare che, sebbene la CAPP promuova la guarigione della ferita, è probabile che si abbia una recidiva entro un breve lasso di tempo se non viene trattata la patologia sottostante, come accade ad esempio nei pazienti immunodepressi [13]. La Figura 5 mostra un Bovaro del Bernese di otto anni che ha sviluppato una setticemia secondaria a corpo estraneo necrotizzante ileale. Il cane aveva ricevuto una diagnosi di ipoadrenocorticismo ed era stato trattato con desossicorticosterone per diversi anni. Come risultato della setticemia, il paziente aveva sviluppato una fascite necrotizzante multipla sui fianchi, che aveva mostrato una risposta limitata al trattamento antibiotico triplo, facilmente a causa della terapia corticosteroidea. Tuttavia, l'applicazione della CAPP ha prodotto un rapido miglioramento nel giro di tre settimane; inoltre, anche se il cane durante il trattamento aveva sviluppato ulteriori zone di fascite, anche queste sono state trattate con successo e si sono risolte dopo 24 giorni di trattamento, senza ulteriore recidiva.
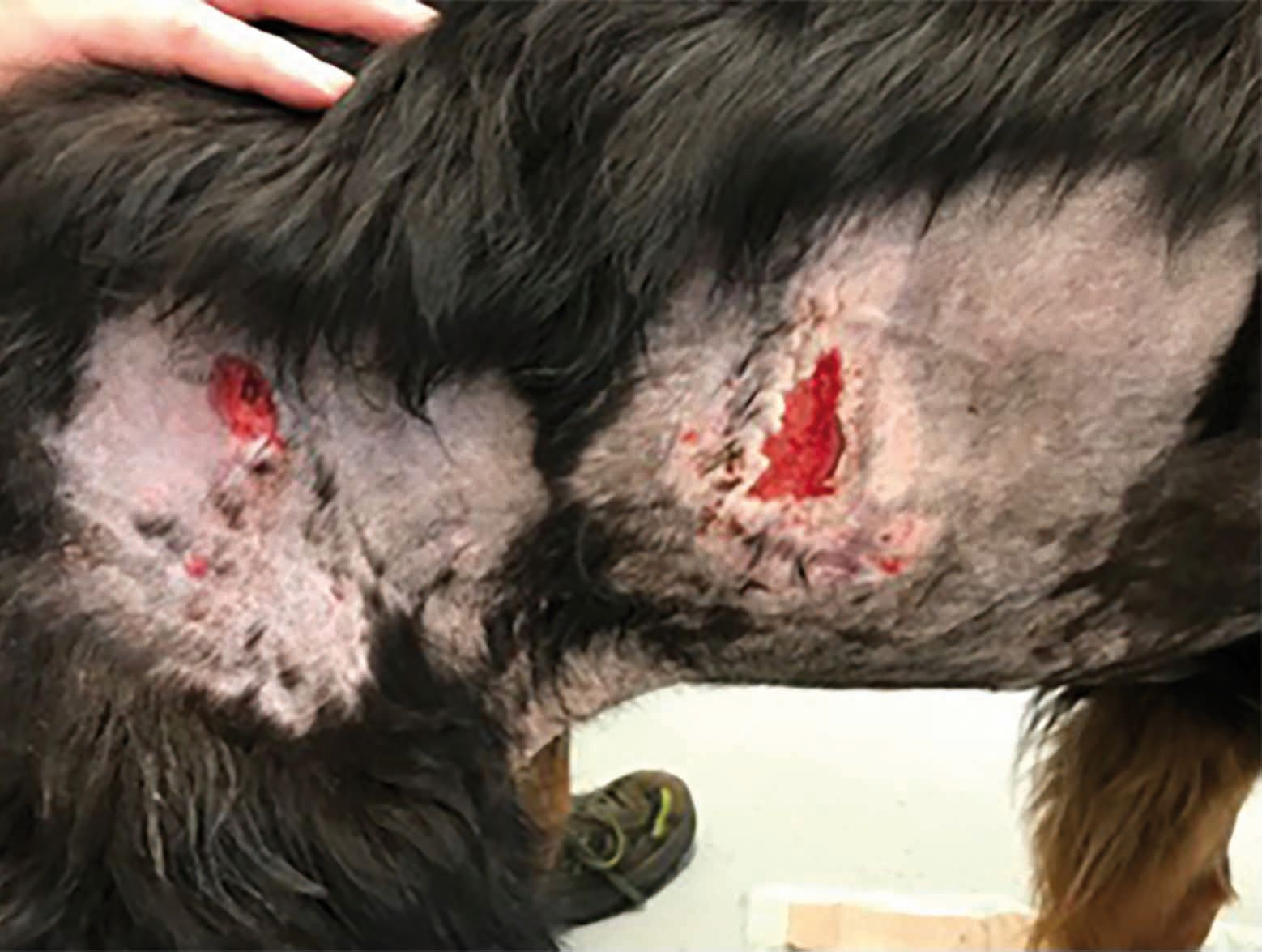
La CAPP ha dimostrato la sua utilità anche in pazienti con patologie immunomediate. La Figura 6 mostra un Pastore tedesco di tre anni con fistole perianali. Il cane è stato trattato con una combinazione di CAPP, ciclosporina e tacrolimus topico, ma per fini di confronto è stata trattata con la CAPP solo la metà sinistra dell'ano, mentre il lato destro era coperto da un foglio di carta durante le sessioni con il plasma freddo. Dopo 18 giorni era evidente che, sebbene i farmaci fossero efficaci, il lato sinistro aveva mostrato una chiusura della ferita significativamente più rapida e una formazione di cicatrici inferiore rispetto all'altro lato.
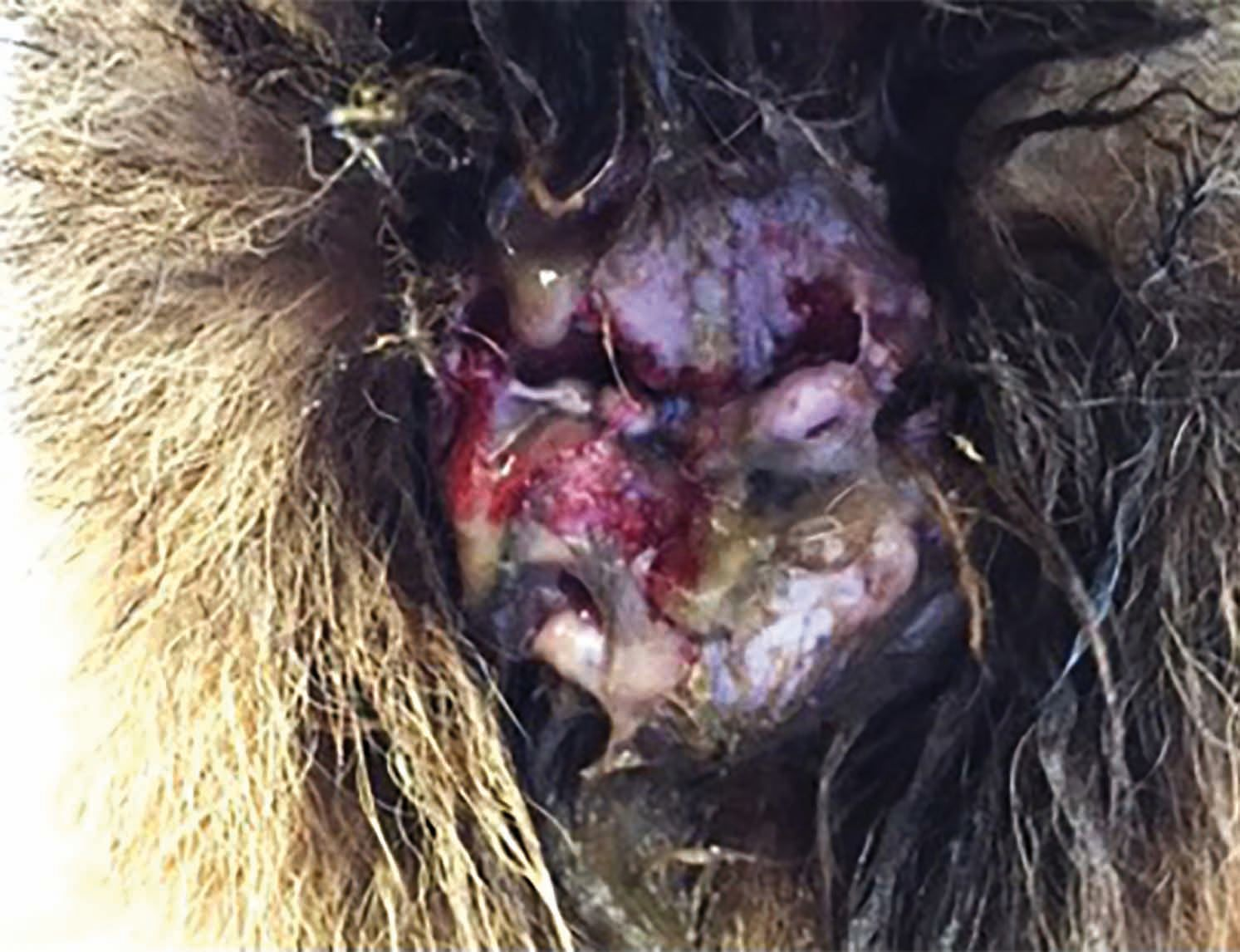
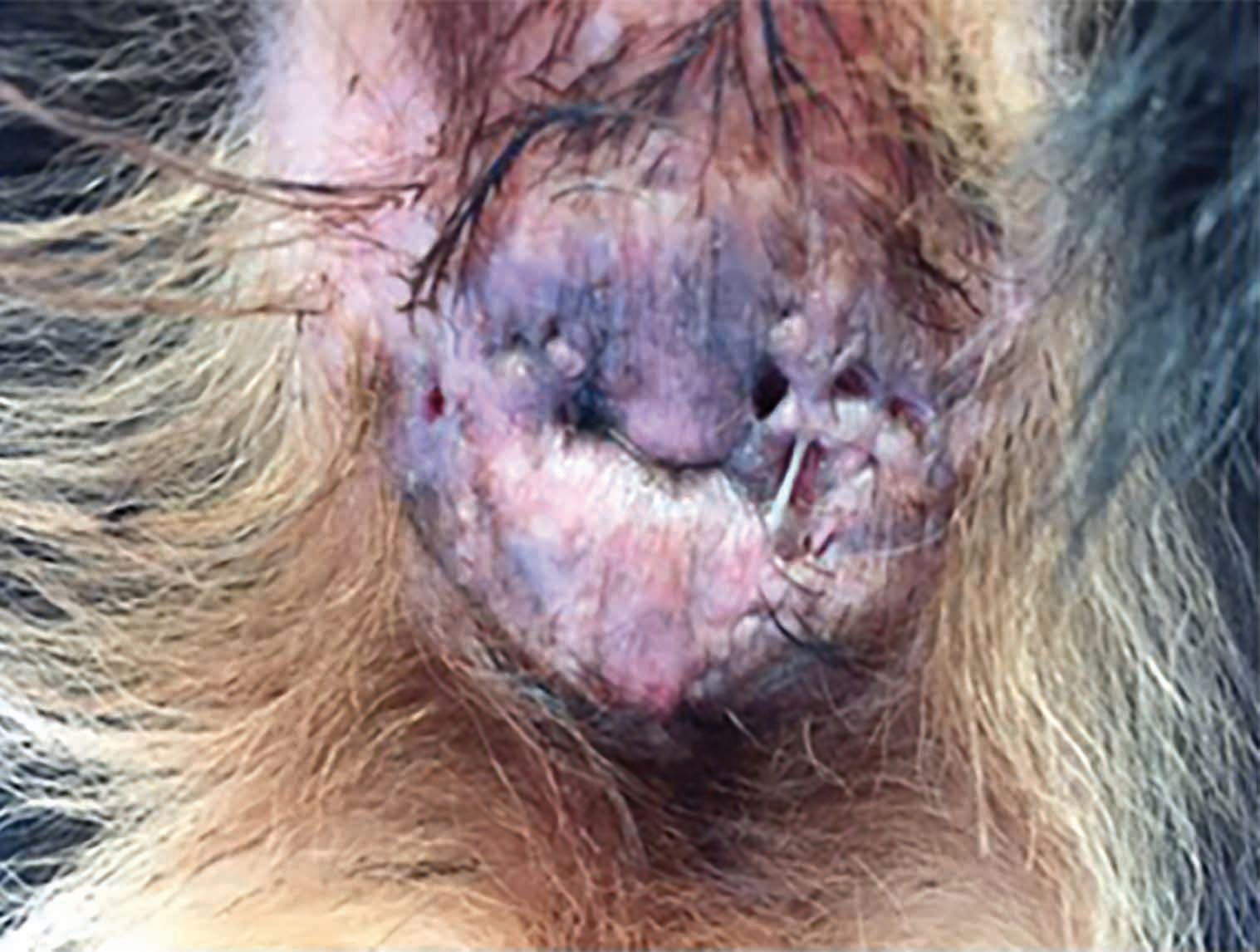
Un altro focus è l'effetto positivo della terapia al plasma freddo sulla fibrosi [11]. La Figura 7 mostra un Bovaro del Bernese di quattro anni con calcinosi cutanea grave secondaria a iperadrenocorticismo iatrogeno, risultato del trattamento per il pemfigo foliaceo. A parte la terapia antinfiammatoria locale (dimetilsulfossido) e il passaggio dai glucocorticoidi ad altri farmaci, come la ciclosporina, per controllare il pemfigo, le alternative terapeutiche in questi casi sono molto limitate. La calcinosi cutanea può esitare spesso in cicatrici significative, ma qui il trattamento con la CAPP ha prodotto una risposta molto rapida: il 90% della cute risultava completamente guarita e priva di cicatrici entro quattro settimane, con successiva ricrescita completa del pelo.
Infine, la CAPP potrebbe essere applicabile in altre aree. È già in corso la ricerca sulle alternative che consentiranno di applicarla internamente tramite interventi mininvasivi (ad es. per via endoscopica) [14]. Il suo uso nei casi chirurgici è ancora controverso; può essere utile per la disinfezione della ferita postoperatoria e la prevenzione delle cicatrici, ma sul suo impiego intraoperatorio regna incertezza; sebbene possa ridurre la carica batterica dovuta alla chirurgia, un tempo operativo prolungato può consentire perdita di fluidi dai tessuti, compromettendo la guarigione [11][15].
Conclusione
La terapia con plasma freddo a pressione atmosferica (CAPP) è un trattamento fisico semplice che può accelerare in modo significativo la guarigione di molte ferite cutanee. Elimina efficacemente gli agenti infettivi a prescindere dalla farmaco resistenza, e accelera il recupero del paziente, soprattutto in presenza di fattori che potrebbero rallentare il processo di guarigione. Dato che l'applicazione è rapida, indolore e poco complicata, è adatta anche per l'uso quotidiano nella pratica clinica, sebbene manchino studi a supporto della sua efficacia sui piccoli animali. È importante sottolineare che la CAPP non deve sostituire la diagnosi accurata del Medico Veterinario, poiché non può curare la patologia sottostante.
Christoph J. Klinger
Dr. med. vet.
Germania
Il Dr. Klinger si è laureato a Monaco nel 2011 e ha lavorato in una struttura per piccoli animali prima di intraprendere un internato di un anno presso la Ludwig Maximilian University. Ha quindi completato una residenza con certificazione ECVD e ACVD a Monaco e nel 2016 ha discusso qui la tesi di dottorato.
Riferimenti
- Daeschlein G, Napp M, von Podewils S, et al. In vitro susceptibility of multidrug resistant skin and wound pathogens against low temperature atmospheric pressure plasma jet (APPJ) and dielectric barrier discharge plasma (DBD). Plasma Process Polym 2014;11(2):175-183.
- Daeschlein G, Scholz S, Ahmed R, et al. Cold plasma is well-tolerated and does not disturb skin barrier or reduce skin moisture. J Dtsch Dermatol Ges 2012;10(7):509-515.
- Filipić A, Gutierrez-Aguirre I, Primc G, et al. Cold plasma, a new hope in the field of virus inactivation. Trends Biotechnol 2020;38(11):1278-1291.
- Haertel B, Eiden K, Deuter A, et al. Differential effect of non-thermal atmospheric-pressure plasma on angiogenesis. Lett Appl NanoBioScience 2014;3(2):159-166.
- Metelmann HR, Vu TT, Do HT, et al. Scar formation of laser skin lesions after cold atmospheric pressure plasma (CAP) treatment: a clinical long-term observation. Clin Plasma Med 2013;1(1):30-35.
- Arndt S, Schmidt A, Karrer S, et al. Comparing two different plasma devices kINPen and Adtec SteriPlas regarding their molecular and cellular effects on wound healing. Clin Plasma Med 2018;9(10):1016.
- Classen J, Dengler B, Klinger CJ, et al. Cutaneous alternariosis in an immunocompromised dog successfully treated with cold plasma and cessation of immunosuppressive medication. Tierrztl Prax K 2017;45(05):337-343.
- Winter J, Nishime TM, Bansemer R, et al. Enhanced atmospheric pressure plasma jet setup for endoscopic applications. J Phys Appl Phys 2018;52(2):024005.
- Nolff MC, Winter S, Reese S, et al. Comparison of polyhexanide, cold atmospheric plasma and saline in the treatment of canine bite wounds. J Small Anim Pract 2019;60(6):348-355.
- Hfner A, Steffen H, Holtfreter B, et al. Effects of non-thermal atmospheric pressure plasma and sodium hypochlorite solution on Enterococcus faecalis biofilm: an investigation in extracted teeth. Plasma Process Polym 2017;14(3):1600064.
- Koban I, Matthes R, Hbner N-O, et al. Treatment of Candida albicans biofilms with low-temperature plasma induced by dielectric barrier discharge and atmospheric pressure plasma jet. NJP 2010;12(7):073039.
- Kondeti VSK, Phan CQ, Wende K, et al. Long-lived and short-lived reactive species produced by a cold atmospheric pressure plasma jet for the inactivation of Pseudomonas aeruginosa and Staphylococcus aureus. Free Radic Biol Med 2018;124:275-287.
- Sun P, Sun Y, Wu H, et al. Atmospheric pressure cold plasma as an antifungal therapy. Appl Phys Lett 2011;98(2):021501.
- Hasse S, Duong Tran T, Hahn O, et al. Induction of proliferation of basal epidermal keratinocytes by cold atmospheric pressure plasma. Clin Exp Dermatol 2016;41(2):202-209.
- Schmidt A, Bekeschus S, Wende K, et al. A cold plasma jet accelerates wound healing in a murine model of full-thickness skin wounds. Exp Dermatol 2017;26(2):156-162.
Altri articoli di questo numero
Condividi sui social media