Вісь «кишечник - нирки» в котів: пожива для роздумів
Наразі є переконливі докази того, що між кишечником і нирками є важливі зв’язки, та що здоров’я шлунково-кишкового тракту може бути ключовим чинником під час лікування ниркових захворювань, про що і йдеться в цій статті.
Ключові моменти
Зв’язок між кишечником і нирками має значний вплив на обидві системи органів, і відповідні клінічні наслідки
Коти з хронічною хворобою нирок (ХХН) мають дисбактеріоз та порушений склад кишкової мікробіоти
Уремічні токсини накопичуються навіть на ранніх стадіях хронічної хвороби нирок (ХХН); це має численні шкідливі наслідки та пов'язане з прогресуванням захворювання.
Лікування дисбактеріозу та накопичення уремічних токсинів може бути важливим елементом у терапії хронічної хвороби нирок у котів
Вступ
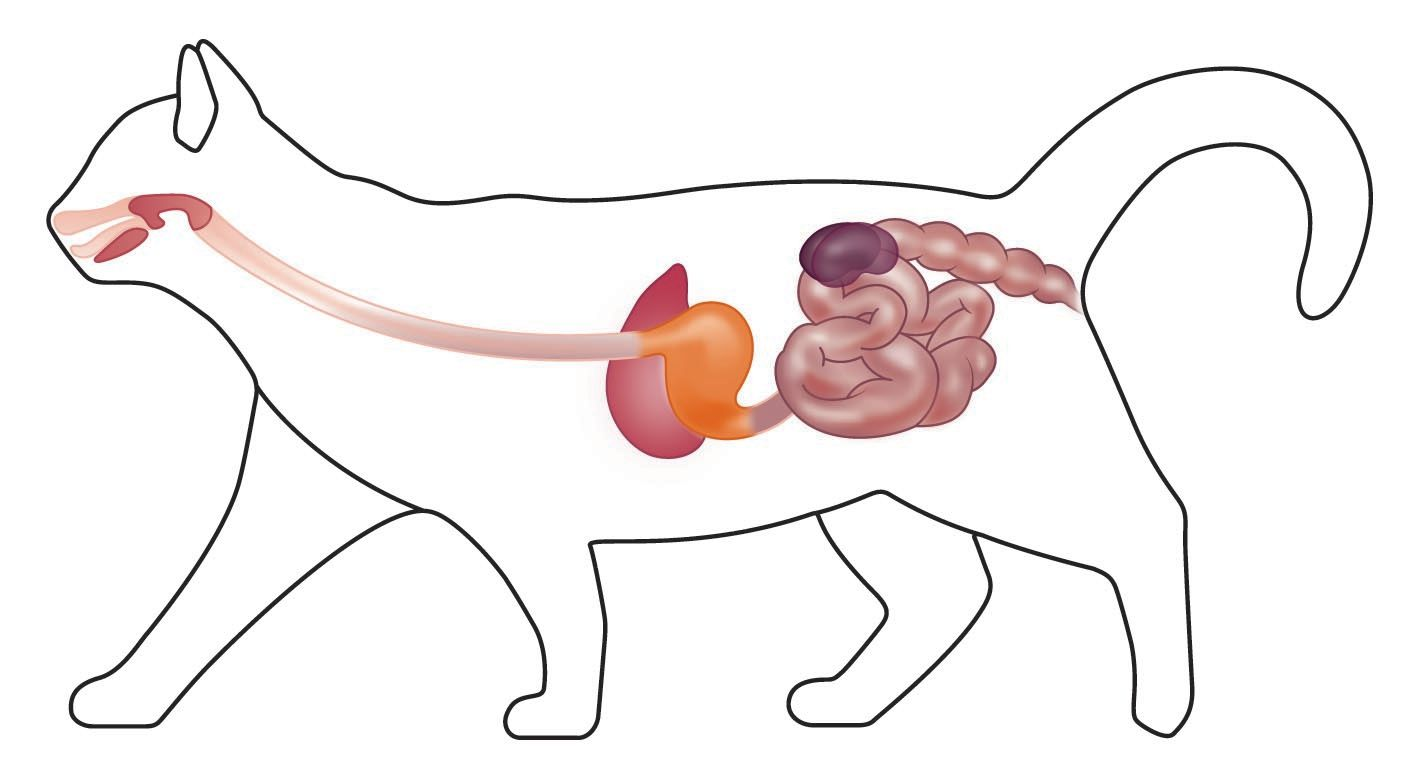
Дедалі більше досліджень підтверджують, що в багатьох видів тварин спостерігається значний зв’язок між кишечником і нирками (також відомий як «вісь кишечник — нирки») (рис. 1), і що обидві системи суттєво впливають одна на одну, а це має потенційно серйозні клінічні наслідки. У котів із хронічною хворобою нирок (ХХН) спостерігається дисбактеріоз, що: кишечник є терапевтичною мішенню для потенційного збільшення тривалості життя й лікування супутніх захворювань. У цій статті ми розглядаємо сучасні уявлення про взаємозв’язок між кишечником і нирками та стратегії, доступні ветеринарним лікарям для потенційного покращення мікробіому кишечника й відповідного зменшення накопичення шкідливих уремічних токсинів, що утворюються в ньому.

Мікробіом і дисбактеріоз
Кишковий мікробіом визначають як сукупність мікроорганізмів, переважно бактерій, що населяють шлунково-кишковий тракт та утворюють екосистему, яка характеризується складними взаємодіями як із хазяїном, так і між собою. Існують тисячі філотипів кишкових бактерій котів, що налічують трильйони клітин із широким спектром функціональних можливостей. Цей різноманітний набір мікроорганізмів має важливе значення для підтримки здоров’я організму хазяїна завдяки продуктам бактеріального метаболізму та впливу на експресію генів у кишечнику. Здорова бактеріальна мікробіота та взаємодія між метаболітами хазяїна й бактерій є життєво важливими для розвитку та підтримки належного функціонування імунної системи, засвоєння поживних речовин із раціону, збереження цілісності кишкового бар’єра, синтезу поживних речовин (наприклад, коротколанцюгових жирних кислот, вітаміну B12) і захисту від інвазії кишкових патогенів [1].
Дисбактеріоз визначають як дизбаланс співіснування мікроорганізмів кишечника зі зміною складу мікробіоти та її метаболічної активності. При багатьох станах дисбактеріоз не лише є маркером захворювання, але й активно сприяє розвитку патології [2]. Дисбактеріоз кишечника був широко задокументований у людей із ХХН та під час моделювання в лабораторних умовах; було показано, що уремія негативно впливає на мікробіом, змінюючи склад мікробіоти кишечника з більш рівномірно розподіленої та складної на простішу, у якій домінують певні бактеріальні родини [2]. Окрім безпосереднього впливу сечовини та подальшого підвищеного вироблення аміаку кишковими бактеріями, серед причин дисбактеріозу кишечника у хворих на ХХН, є часте вживання антибіотиків і фосфатозвʼязувальних сполук, а також зміни в раціоні, як-от зменшення споживання клітковини [2].
Креатинін і азот сечовини крові (АСК) є найвідомішими з клінічного погляду уремічними токсинами, але насправді це
лише дві з приблизно 146 органічних розчинених речовин, які є ймовірними уремічними токсинами
Уремічні токсини
Під терміном «уремія» розуміють як накопичення речовин у крові внаслідок зниження швидкості клубочкової фільтрації (ШКФ), так і клінічні прояви, що виникають як його наслідок. Зазвичай це стосується порушення балансу електролітів, органічних розчинених речовин і гормонів, але також — уремічних токсинів. Креатинін і азот сечовини крові (АСК) є найвідомішими з клінічного погляду уремічними токсинами, але насправді це лише дві з приблизно 146 органічних розчинених речовин, які є ймовірними уремічними токсинами [3]. Важливо зазначити, що багато з цих речовин не регулюються активно організмом, тому їхня кількість поступово зростає зі зниженням ШКФ. Навіть для пацієнтів-людей це становить особливу проблему, оскільки деякі токсини не піддаються виведенню шляхом гемодіалізу [3]. Особливий інтерес становлять уремічні токсини, які є відходами катаболізму білків мікробіоти товстої кишки (наприклад, індоксилсульфат (IS), п-крезолсульфат (pCS)), оскільки вважається, що вони не тільки чинять негативні патофізіологічні ефекти, а й сприяють розвитку клінічного синдрому уремії.
Індол і п-крезол, які є попередниками уремічного токсину, є продуктами катаболізму білків, що утворюються в товстій кишці внаслідок ферментування білків мікробіотою [4],[5]. Індоли утворюються внаслідок метаболізму харчового триптофану за участі триптофанази такої кишкової мікробіоти, як Escherichia coli (E. coli), Proteus vulgaris та Bacteroides spp. (рис. 2). П-крезол утворюється шляхом часткового розщеплення тирозину й фенілаланіну багатьма кишковими облігатними або факультативними анаеробами, зокрема такими, як Bacteroides, Lactobacillus, Enterobacter, Bifidobacterium і Clostridium. Індол і п-крезол всмоктуються, а потім сульфуються в печінці у зв’язані білком уремічні токсини IS і pCS відповідно. Ці токсини зазвичай виводяться нирками й, відповідно, накопичуються в системному кровообігу пацієнтів із нирковою недостатністю. Дисбактеріоз також сприяє виробленню уремічних токсинів у товстій кишці, створюючи порочне коло [4],[5]. Через порушення засвоєння білка в тонкому кишечнику, що спостерігається у хворих на ХХН, збільшується кількість білкового субстрату в просвіті кишечника. Це сприяє розмноженню протеолітичних бактерій, які виробляють попередники уремічних токсинів. Закрепи також можуть відігравати свою роль у цьому через тривалу затримку калових мас у товстому кишечнику. Пацієнти з ХХН, які страждають на закрепи, мають вищі рівні уремічних токсинів, ніж пацієнти з нормальними показниками калу [6].

Шкідливий вплив уремічних токсинів
Хоча підвищена концентрація речовини не свідчить про патологію, відомо, що накопичення численних уремічних токсинів при ХХН є шкідливим. Наприклад, накопичення IS і pCS при ХХН пов’язане з індукуванням утворення вільних радикалів, активацією ренін-ангіотензин-альдостеронової системи (РААС), що сприяє розвитку фіброзу нирок, індукуючи запалення й пошкоджуючи клітини ниркових канальців, а також стимулює прогресування гломерулярного склерозу[7]. Інші небажані ефекти уремічних токсинів також сприяють підвищенню показників захворюваності й смертності. Серед таких ефектів — порушення в роботі неврологічної системи, зниження вироблення еритропоетину й оновлення кісткової тканини, прискорення атрофії м’язів і підвищений ризик серцево-судинних захворювань [7] (рис. 3).

Жирні кислоти в калі при ХНН
Додатковими метаболітами мікробіоти товстої кишки, порушення в яких можуть відбуватися за кишкового дисбактеріозу, є жирні кислоти. До коротколанцюгових жирних кислот (КЛЖК), які виробляє мікробіота товстої кишки, належать прямоланцюгова оцтова, пропіонова, масляна й валеріанова кислота, а також ізовалеріанова й ізомасляна кислота з розгалуженим ланцюгом (рис. 4). Прямоланцюгові КЛЖК є основними кінцевими продуктами сахаролітичної ферментації складних полісахаридів (зокрема неперетравлюваних харчових волокон) й епітеліального слизу та є важливими поживними речовинами, критично необхідними для здоров’я як кишечника, так і організму загалом [8]. Вони мають кілька корисних місцевих і системних ефектів, зокрема сприяють моториці товстої кишки, метаболізму ліпідів і глюкози, регулюють артеріальний тиск і мають протизапальні властивості. На відміну від кислот із прямим ланцюгом, жирні кислоти з розгалуженим ланцюгом становлять лише невелику частину усіх синтезованих коротколанцюгових жирних кислот та утворюються, коли білок проходить через тонкий кишечник, не всмоктуючись, а амінокислоти з розгалуженим ланцюгом, отримані з білка, ферментуються мікробіотою в товстому кишечнику [8]. Жирні кислоти з розгалуженим ланцюгом та інші продукти ферментації білків у товстому кишечнику вважаються шкідливими для кишечника й можуть провокувати запалення й негативно впливати на моторику кишечника [8]. У людей дисбактеріоз на тлі ХХН пов’язаний зі зменшенням мікробіоти, яка продукує коротколанцюгові жирні кислоти, але, наскільки відомо авторам, жирні кислоти з розгалуженим ланцюгом не досліджували.

Що ми знаємо про котів?
У ветеринарній медицині інформація про мікробіом, уремічні токсини та їхній зв’язок із захворюваннями нирок є відносно обмеженими, але наші знання є дещо глибшими, якщо говорити про котів. Порівняно зі здоровими котами (віком від 8 років), у котів із ХХН було зафіксовано випадки дисбактеріозу, що характеризується зниженим різноманіттям і багатством фекальних мікроорганізмів, що підтверджується секвенуванням гена 16S рРНК [9]. Крім того, у котів із ХХН уремічні токсини, що утворюються в кишечнику, накопичуються в системному кровообігу. Доведено, що в котів із ХХН спостерігаються значно підвищені рівні IS (рис. 5), що пов’язано з прогресуванням захворювання [10],[11],[12]. Хоча в одному дослідженні концентрації pCS суттєво не відрізнялися в групах здорових і хворих на ХХН котів, найвищі концентрації виявили в котів із ХХН [9]. Цікаво, що навіть у котів із ХХН 2 стадії за шкалою IRIS концентрація уремічних токсинів значно вища, ніж у котів із контрольної групи, що свідчить про те, що цей дисбаланс виникає на порівняно ранній стадії розвитку захворювання.
Коли оцінювали концентрацію прямо- й коротколанцюгових жирних кислот (оцтової, пропіонової, масляної, валеріанової кислот) і жирних кислот із розгалуженим ланцюгом (ізобутилової, ізовалеріанової) у фекаліях котів із ХХН та здорових котів із контрольної групи, у першій групі виявили підвищений вміст ізовалеріанової кислоти у фекаліях, зокрема в котів із ХХН 3 та 4 стадії за шкалою IRIS [9]. У котів із м’язовою атрофією концентрації жирних кислот із розгалуженим ланцюгом у фекаліях були вищими порівняно з котами без м’язової атрофії. Додаткові дослідження показали, що коти з ХХН мають порушений профіль жовчних кислот у калі [13], й дефіцит кількох незамінних амінокислот у сироватці крові [14]. Разом ці дані підтверджують порушення засвоєння білка в котів із ХХН, але необхідні додаткові дослідження, щоб краще зрозуміти взаємодію між кишечником і нирками в цього виду тварин. Однак ці дослідження підтверджують ідею про те, що мікробіом кишечника є терапевтичною мішенню в котів, хворих на ХХН, задля зменшення вироблення шкідливих уремічних токсинів у кишечнику й відновлення здоровішої спільноти мікроорганізмів кишечника.

Кишечник як потенційна терапевтична мішень
Уремічні токсини
Через потенційний негативний вплив уремічних токсинів, що утворюються в кишечнику, і погану здатність до їх виведення шляхом гемодіалізу через зв’язування з білками медицина спрямувала свої зусилля на стратегії зменшення вироблення IS та pCS, зокрема на модуляцію росту мікроорганізмів у товстій кишці за допомогою дієти, застосування пребіотиків, пробіотиків і цільової адсорбції уремічних токсинів за допомогою адсорбентів [4],[5]. Вироблення IS і pCS можна модулювати шляхом вибіркового збільшення кількості сахаролітичних і зменшення кількості протеолітичних бактерій у товстому кишечнику, а також оптимізації часу кишкового транзиту (а отже, важливим аспектом є боротьба із закрепами). Доведено, що пребіотики й пробіотики впливають на склад мікробіоти товстої кишки й успішно застосовуються для зниження концентрації IS і pCS у пацієнтів із ХХН. Окрім того, було доведено, що внаслідок збільшення в раціоні рівня вуглеводів і клітковини та зменшення споживання білків знижується концентрація IS і pCS. Такі адсорбенти, як-от севеламеру гідрохлорид і AST-120, також використовують для обмеження абсорбції цих токсинів у кишечнику [15],[16]. Однак публікацій про стратегії зниження концентрації уремічних токсинів у кишечнику у ветеринарних пацієнтів із ХХН було мало, і подальші дослідження його як потенційної терапевтичної мішені видаються обґрунтованими.
Концепція зниження концентрації уремічних токсинів і зменшення клінічних симптомів уремії шляхом зменшення навантаження білком у раціоні є центральним принципом в основі історичної модифікації білків у ветеринарних раціонах для лікування тварин із нирковою недостатністю. Однак через брак досліджень наразі немає переконливих доказів того, що обмеження споживання білка призводить до зменшення концентрації уремічних токсинів чи клінічних симптомів уремії, що зумовило розвиток нещодавніх суперечок (особливо стосовно котів) щодо ідеального вмісту білка в раціонах для тварин із нирковою недостатністю [17],[18]. Доступні обмежені дані про вплив різного вмісту білка на концентрацію уремічних токсинів у котів. В одному дослідженні здорових котів підвищений вміст білка в раціоні (10,98 г/100 ккал МЕ проти 7,44 г/100 ккал МЕ) супроводжувався підвищеними концентраціями IS і порівняно вищими концентраціями pCS [19]. Аналогічно, дослідження на котах із ХХН 1 стадії за шкалою IRIS, яких годували трьома раціонами з різним рівнем білка, показало, що в них були значно вищі концентрації IS і pCS на раціоні з найвищим вмістом білка (8,01 г/100 ккал ME порівняно з 6,95 г/100 ккал ME і 5,65 г/100 ккал ME) [20].
У котів із хронічною нирковою недостатністю спостерігається дисбактеріоз, що підтверджує думку про те, що кишечник є терапевтичною мішенню для потенційного покращення тривалості життя й лікування супутніх захворювань.
Досі точаться дискусії щодо ідеального вмісту білка в раціоні котів із нирковою недостатністю, оскільки їх вважають облігатними м’ясоїдними, а отже, вони мають підвищену потребу в білку порівняно з собаками й людьми. Дослідження показують, що котам похилого віку може знадобитися більше білка, ніж молодим котам. Крім того, в багатьох котів із ХХН із часом спостерігається зниження маси тіла, оцінка кондиції тіла (вгодованості) та/або м’язової маси. Беручи до уваги відому сьогодні інформацію, рекомендації щодо харчового білка для котів із ХХН, імовірно, полягають у делікатному балансуванні вмісту білка, щоб обмежити вироблення уремічних токсинів, водночас підтримуючи безжирову масу тіла. Ключова концепція успіху під час годування модифікованим білковим раціоном полягає в забезпеченні достатнього споживання калорій.
Пребіотики й пробіотики застосовують для лікування котів із ХХН з ціллю покращити стан їхнього мікробіому і знизити концентрацію в крові уремічних токсинів, що утворилися в кишечнику. Застосування комерційної добавки пробіотиків (Enterococcus faecium SF68) було досліджено в котів із ХХН. Дослідження показало, що добавка не мала помітного впливу на мікробіом кишечника й концентрацію в сироватці крові основних уремічних токсинів, що утворюються в кишечнику [21]. В іншому дослідженні оцінювали вплив ферментованої клітковини (пребіотика) в експериментальних раціонах на фекальну мікробіоту котів із ХХН і виявили, що їхній мікробіом був стійким до змін порівняно з мікробіомом здорових котів [22]. Клітковина дійсно знижувала відповідні концентрації уремічних токсинів у плазмі крові котів із ХХН порівняно зі здоровими котами, що підтверджує припущення про те, що зміна мікробіому кишечника може призвести до зменшення вироблення уремічних токсинів, але для цього потрібні стратегії, що ґрунтуються на доказовій медицині й ураховують особливості конкретного виду тварин.
Деякі комерційні продукти зараз доступні в багатьох країнах, серед них — пробіотик / пребіотик, призначений для сприятливого впливу на мікробіом за рахунок створення середовища з нижчим виробленням уремічних токсинів та адсорбент на основі вуглецю, призначений для зв’язування індолу в травному тракті, щоб запобігти його потраплянню в організм. Останній продукт знижує рівень індоксилсульфату в котів похилого віку після восьми тижнів застосування [23], але дані щодо ефективності будь-якого з цих продуктів для зниження концентрації IS у котів із ХХН досі не отримано.
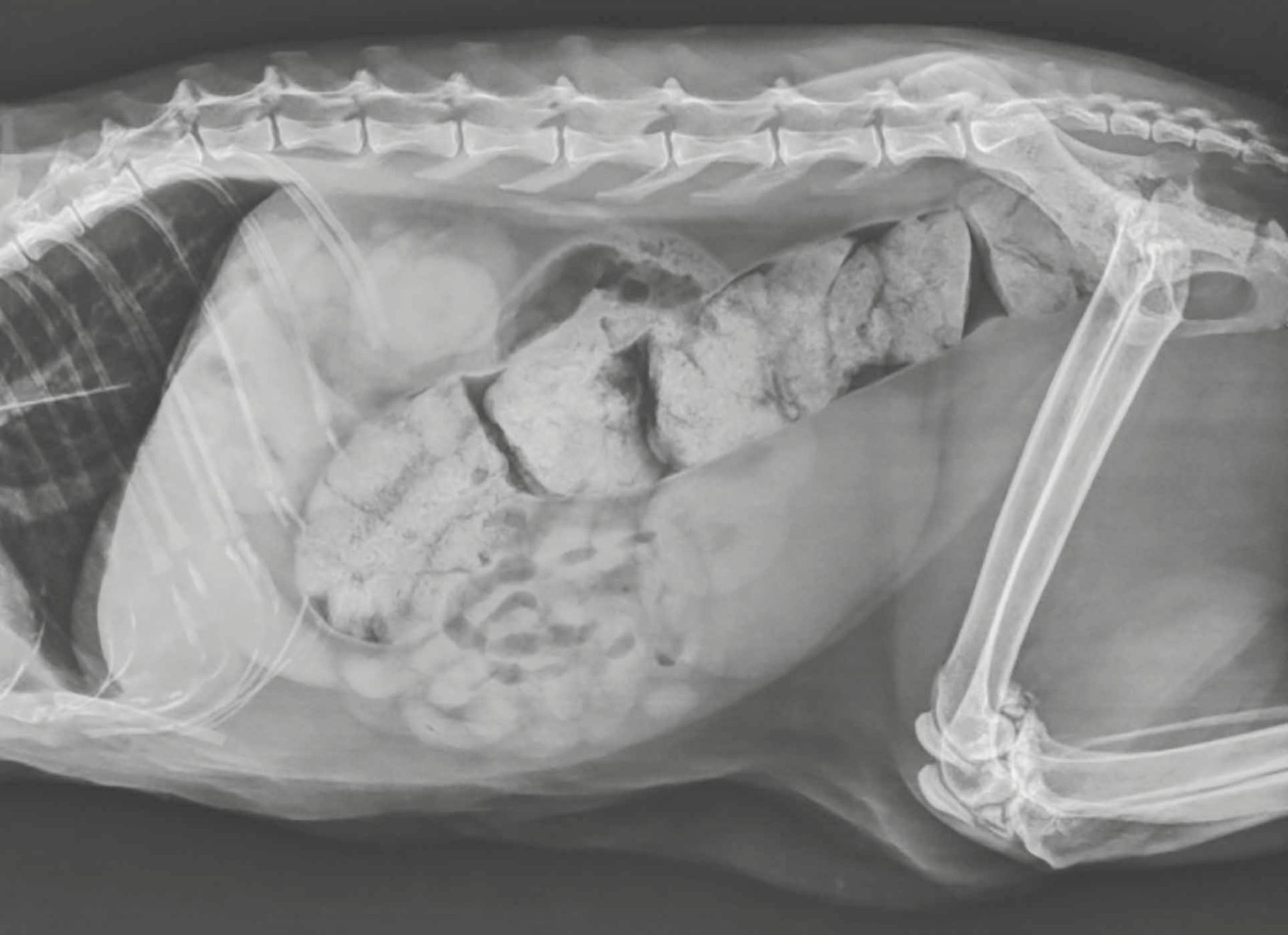
Закреп
Про поширеність закрепів, пов’язаних із ХХН у котів, не повідомлялося, але, за деякими даними, вони є поширеною медичною проблемою (рис. 6). Попередні результати дослідження звичок випорожнення в котів свідчать про те, що в котів із ХХН дефекація є менш регулярною, а причиною закрепів у них є порушення функції водного балансу (можливо, у поєднанні з порушенням моторики ШКТ). Оскільки нирки не можуть у належний спосіб концентрувати сечу, а пацієнт страждає від хронічного субклінічного зневоднення, вода реабсорбується з товстої кишки для компенсації. Гіпокаліємія та вживання фосфатозв’язувальних препаратів також можуть сприяти виникненню закрепів [24],[25]. Лікування закрепів може полягати в коригуванні зневоднення й електролітного дисбалансу, застосуванні дієти, клітковини, осмотичних пом’якшувачів випорожнень чи засобів, які стимулюють моторику шлунково-кишкового тракту, як-от лактулоза. Окрім клінічних ефектів, закреп може мати й інші негативні наслідки, а також він є класичним прикладом порушення у вісі «кишечник-нирки». Як уже згадувалося раніше, у пацієнтів із ХХН, які страждають на закрепи, концентрація уремічних токсинів є вищою, ніж у пацієнтів із нормальними показниками калу й навпаки — такі токсини можуть негативно впливати на моторику шлунково-кишкового тракту [8]. Лабораторне моделювання ХХН продемонструвало значне зменшення рівня уремічних токсинів, креатиніну й навіть покращення гістопатології нирок після прийому лактулози [26].
Висновок
Хоча ще багато роботи попереду, з'являються докази того, що шлунково-кишковий тракт і нирки взаємодіють і впливають одне на одного як у здорових осіб, так і у хворих. Враховуючи, що багато котів із хронічною хворобою нирок (ХХН) мають порушення мікробіому, ймовірно, що кишечник стане основним об'єктом для активного лікування за допомогою специфічних терапевтичних засобів з метою покращення тривалості та якості життя хворих котів.
Стейсі К. Саммерс
Лікар ветеринарної медицини, доктор філософії (Ph.D), дипломант Американського коледжу ветеринарної внутрішньої медицини, Університет штату Орегон, Корвалліс, штат Орегон, США
США
Доктор Саммерс є сертифікованим лікарем в галузі внутрішньої медицини дрібних тварин і доцентомкою Університету штату Орегон. Вона здобула спеціальність лікаря ветеринарної медицини в Університеті штату Вашингтон і пройшла ротаційну інтернатуру у ветеринарній клініці Wheat Ridge в Колорадо як ветеринарний лікар. Потім продовжила свою освіту в Університеті штату Колорадо (CSU) за стипендіальною програмою з досліджень інфекційних хвороб котів у Центрі досліджень тварин-компаньйонів. Її докторська робота була присвячена новим етіологіям і ролі мікробіому кишечника котів із хронічною хворобою нирок (ХХН), а її поточні дослідження зосереджені на медицині котячих, урології й мікробіомі.
Джессіка М. Квімбі
Лікар ветеринарної медицини, доктор філософії (Ph.D) , дипломант Американського коледжу ветеринарної внутрішньої медицини, Університет штату Огайо, Колумбус, штат Огайо, США
США
Доктор Квімбі отримала кваліфікацію в Університеті Вісконсін-Медісон у 2003 році, а потім захистила докторську дисертацію з хронічної хвороби нирок (ХХН) котів в Університеті штату Колорадо (CSU) й обіймала посаду викладач до 2017 року. Вона є сертифікованим лікарем в галузі внутрішньої медицини дрібних тварин і доцентом Університету штату Огайо. Її поточні наукові дослідження охоплюють питання патофізіології нирок, нові стратегії лікування й клінічну фармакологію котів з акцентом на покращенні підтримувальної терапії та якості життя котів, хворих на ХХН. За свій внесок у нефрологію й медицину котячих доктор Квімбі отримала нагороду Міжнародного товариства вивчення захворювань нирок (IRIS) і нагороду AVMF / Winn Feline Foundation Research Award. У 2021 році її обрали до складу правління IRIS. потенційного покращення мікробіому кишечника й відповідного зменшення накопичення шкідливих уремічних токсинів, що утворюються в ньому.
Джерела
- Sharon G, Garg N, Debelius J, et al. Specialized metabolites from the microbiome in health and disease. Cell. Metab. 2014;20:719-730.
- Cheng FP, Hsieh MJ, Chou CC, et al. Detection of indoxyl sulfate levels in dogs and cats suffering from naturally occurring kidney diseases. Vet. J. 2015;205:399-403.
- Chen CN, Chou CC, Tsai PSJ, et al. Plasma indoxyl sulfate concentration predicts progression of chronic kidney disease in dogs and cats. Vet J. 2018;232:33-39.
- Liao YL, Chou CC, Lee YJ. The association of indoxyl sulfate with fibroblast growth factor-23 in cats with chronic kidney disease. J. Vet. Intern. Med. 2019;33:686-693.
- Summers S, Quimby J, Winston J. Fecal primary and secondary bile acids in cats with chronic kidney disease. J. Vet. Int. Med. 2020;34:29-34.
- Summers SC, Quimby J, Blake A, et al. Serum and fecal amino acid profiles in cats with chronic kidney disease. Vet. Sci. 2022;9(2):84.
- Lin CJ, Pan CF, Chuang CK, et al. Effects of sevelamer hydrochloride on uremic toxins serum indoxyl sulfate and p-cresyl sulfate in hemodialysis patients. J. Clin. Med. Res. 2017;9:765-770.
- Yamamoto S, Kazama JJ, Omori K, et al. Continuous reduction of protein-bound uraemic toxins with improved oxidative stress by using the oral charcoal adsorbent AST-120 in haemodialysis patients. Sci. Rep. 2015;5:14381.
- Polzin DJ, Churchill JA. Controversies in Veterinary Nephrology: renal diets are indicated for cats with International Renal Interest Society Chronic Kidney Disease Stages 2 to 4: The Pro View. Vet. Clin. North Am. Small Anim. Pract. 2016;46:1049-1065.
- Scherk MA, Laflamme DP. Controversies in Veterinary Nephrology: renal diets are indicated for cats with International Renal Interest Society Chronic Kidney Disease Stages 2 to 4: The Con View. Vet. Clin. North Am. Small Anim. Pract. 2016;46:1067-1094.
- Summers S, Quimby J, Gagne J, et al. Effect of dietary protein on serum concentrations of gut-derived uremic toxins in healthy cats. J. Vet. Intern. Med. 2021;35:3069.
- Vaziri ND, Wong J, Pahl M, et al. Chronic kidney disease alters intestinal microbial flora. Kidney Int. 2013;83:308-315.
- Ephraim E, Jewell DE. High protein consumption with controlled phosphorus level increases plasma concentration of uremic toxins in cats with early chronic kidney disease. J. Food Sci. Nutr. 2021;DOI:10.24966/FSN-1076/100096.
- Summers S. Assessment of novel causes and investigation into the gut microbiome in cats with chronic kidney disease (Publication No. 27837106) [Doctoral dissertation 2020, Colorado State University). ProQuest Dissertations Theses Global.
- Hall JA, Jackson MI, Jewell DE, et al. Chronic kidney disease in cats alters response of the plasma metabolome and fecal microbiome to dietary fiber. PLoS One 2020;15:e0235480.
- Mottet J, Kowollik N. Renaltec attenuates serum levels of indoxyl sulfate in geriatic cats. In: Proceedings, BSAVA Congress, Birmingham, UK, 2019.
- Benjamin SE, Drobatz KJ. Retrospective evaluation of risk factors and treatment outcome predictors in cats presenting to the emergency room for constipation. J. Feline Med. Surg. 2019:1098612X19832663.
- Quimby J, Lappin M. Evaluating sucralfate as a phosphate binder in normal cats and cats with chronic kidney disease. J. Am. Anim. Hosp. Assoc. 2016;52:8-12.
- Sueyoshi M, Fukunaga M, Mei M, et al. Effects of lactulose on renal function and gut microbiota in adenine-induced chronic kidney disease rats. Clin. Exp. Nephrol. 2019;23:908-919.
- Rosner M, Reis T, Husain-Syed F, et al. Classification of uremic toxins and their role in kidney failure. Clin. J. Am. Soc. Nephrol. 2021;16(12):1918-1928.
- Evenepoel P, Meijers BK, Bammens BR, et al. Uremic toxins originating from colonic microbial metabolism. Kidney Int. Suppl. 2009:S12-19.
- Nallu A, Sharma S, Ramezani A, et al. Gut microbiome in chronic kidney disease: challenges and opportunities. Transl. Res. 2017;179:24-37.
- Ramos CI, Armani RG, Canziani ME, et al. Bowel habits and the association with uremic toxins in non-dialysis-dependent chronic kidney disease patients. J. Ren. Nutr. 2020;30(1):31-35.
- Lau WL, Savoj J, Nakata MB, et al. Altered microbiome in chronic kidney disease: systemic effects of gut-derived uremic toxins. Clin. Sci. (Lond) 2018;132:509-522.
- Summers S, Quimby JM, Phillips RK, et al. Preliminary evaluation of fecal fatty acid concentrations in cats with chronic kidney disease and correlation with indoxyl sulfate and p-cresol sulfate. J. Vet. Intern. Med. 2020;34:206-215.
- Summers SC, Quimby JM, Isaiah A, et al. The fecal microbiome and serum concentrations of indoxyl sulfate and p-cresol sulfate in cats with chronic kidney disease. J. Vet. Intern. Med. 2019;33:662-669.
Інші статті в цьому випуску
Поділіться в соціальних мережах