คำถามที่พบบ่อยเกี่ยวกับโลหิตวิทยาของสุนัข
Written by Josep Pastor
การเก็บตัวอย่างเลือด (blood samples) เพื่อการวิเคราะห์ทางโลหิตวิทยา (hematological analysis) มักเกิดขึ้นหลายครั้งต่อวันในคลินิกรักษาสัตว์ขนาดเล็ก (small animal clinic) ทุกแห่ง ทั้งนี้สัตวแพทย์ควรตระหนักถึงปัจจัยต่างๆที่อาจมีผลต่อผลลัพธ์ที่ได้

ประเด็นสำคัญ
ปัจจัยต่าง ๆ เช่น การอดอาหารก่อนเก็บตัวอย่าง (pre-sample fasting) สายพันธุ์ของสุนัข และการจัดการกับตัวอย่าง (sample handling) สามารถส่งผลต่อผลการตรวจโลหิตวิทยาของสัตว์ป่วยได้
เครื่องวิเคราะห์ทางโลหิตวิทยา (hematology analyzers) ในคลินิกนั้นมีข้อดีหลายประการ แต่การควบคุมคุณภาพ (quality control) ที่ดีเยี่ยมนั้นถือเป็นสิ่งสำคัญอย่างยิ่ง และการแปลผลค่าจากกราฟไซโตแกรม (cytograms) และฮิสโตแกรม (histograms) อย่างถูกต้องก็มีความสำคัญเช่นเดียวกัน
การเกิดการเกาะกลุ่มของเซลล์เม็ดเลือดแดง (autoagglutination) ควรได้รับการยืนยันโดยการล้างเซลล์เม็ดเลือดแดง (washing erythrocytes) ด้วยสารละลายทางสรีรวิทยา (physiological solution) เสมอ
การตรวจสเมียร์เลือด (blood smears) จะให้ข้อมูลที่มีคุณค่ามาก และช่วยยืนยันผลจากเครื่องวิเคราะห์ทางโลหิตวิทยา
บทนำ
เพื่อให้การแปลผลข้อมูลทางโลหิตวิทยาในคลินิกรักษาสัตว์นั้นถูกต้อง ผลลัพธ์ที่ได้จะต้องสะท้อนถึงสภาพที่แท้จริงของสัตว์ป่วยเพื่อช่วยให้เกิดการวินิจฉัยที่แม่นยำและการรักษาที่เหมาะสม ทั้งนี้สัตวแพทย์จำเป็นต้องพิจารณาปัจจัยสำคัญหลายประการเพื่อให้มั่นใจในคุณภาพและความน่าเชื่อถือ (quality and reliability) ของผลการวิเคราะห์ทางโลหิตวิทยา โดยสัตวแพทย์ควรตระหนักถึงสิ่งต่างๆเหล่านี้ ได้แก่ ระดับของการควบคุมคุณภาพ (degree of quality controls) ที่ใช้กับเครื่องวิเคราะห์ทางโลหิตวิทยา ความจำเป็นในการระบุแหล่งที่มาของข้อผิดพลาดที่อาจเกิดขึ้น (ก่อนการวิเคราะห์ ระหว่างการวิเคราะห์ และหลังการวิเคราะห์) และความสำคัญของการตรวจสเมียร์เลือด บทความนี้มีวัตถุประสงค์เพื่ออธิบายข้อผิดพลาดทั่วไปที่มักเกิดขึ้นในการตรวจทางโลหิตวิทยาและการแปลผลจากสุนัขป่วยในรูปแบบคำถามและคำตอบ
ผลของภาวะไขมันในเลือดสูง (lipemia) หรือการแตกทำลายของเม็ดเลือดแดง (hemolysis) ต่อผลการตรวจทางโลหิตวิทยาคืออะไร? ภาวะไขมันในเลือดสูง (lipemia) (รูปภาพที่ 1) จะทำให้ตัวอย่างเลือดมีความขุ่น (turbidity) เพิ่มขึ้นและรบกวนการวัดระดับความเข้มข้นของฮีโมโกลบิน (hemoglobin concentration) นอกจากนี้ยังขึ้นอยู่กับระบบการทำงานของเครื่องวิเคราะห์ (ระบบ impedance หรือระบบ laser beam) การมีอนุภาคไขมันขนาดเล็ก (lipid microdroplets) อาจทำให้เกิดการนับจำนวนเกล็ดเลือด (platelet count) ความเข้มข้นเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (mean corpuscular hemoglobin concentration; MCHC) และจำนวนเม็ดเลือดขาวทั้งหมด (total leukocyte count) เพิ่มสูงขึ้นอย่างผิดปกติ 1,2 สาเหตุทั่วไปอย่างหนึ่งของภาวะไขมันในเลือดสูงที่พบได้บ่อยที่สุดคือการไม่อดอาหารก่อนเก็บตัวอย่าง เพราะฉะนั้นเพื่อหลีกเลี่ยงหรือกำจัดการรบกวนนี้ ตัวอย่างเลือดควรเก็บหลังจากสัตว์ป่วยอดอาหารเป็นเวลา 12 ชั่วโมง
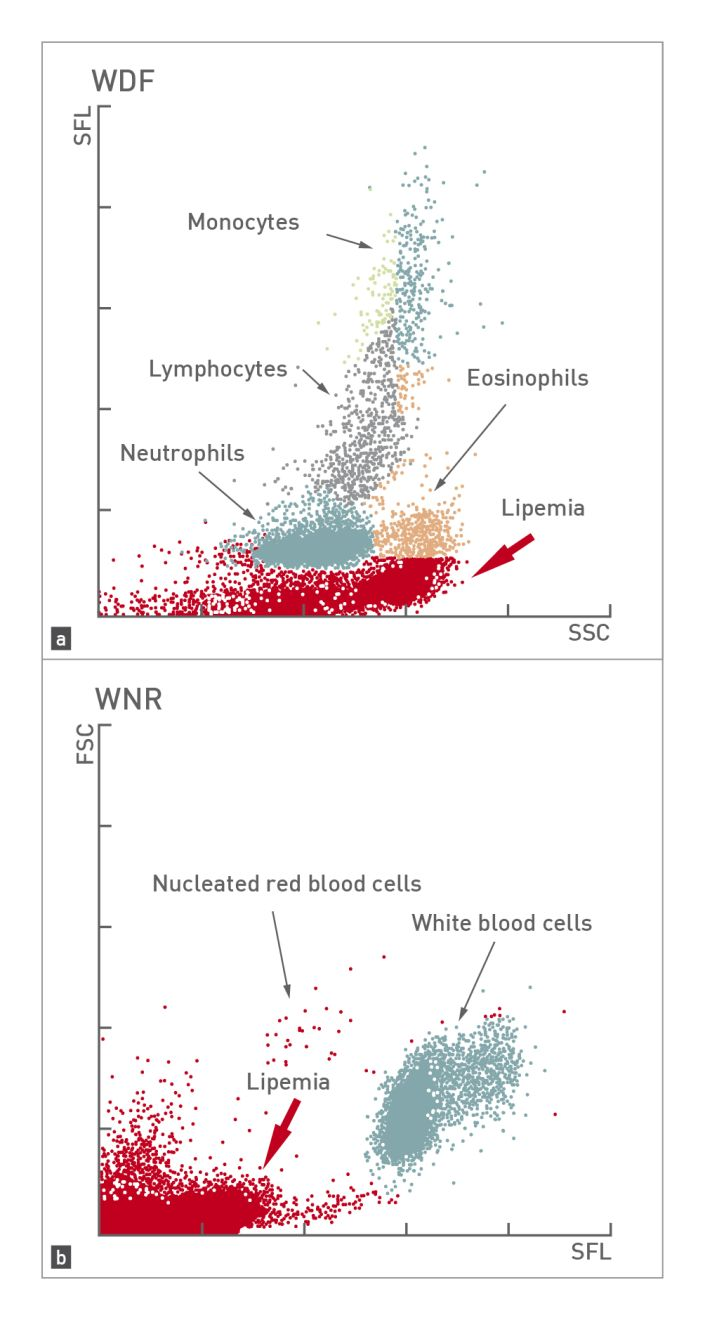
เครื่องวิเคราะห์ระบบ laser beam บางเครื่องสามารถคำนวณค่าความเข้มข้นเฉลี่ยของฮีโมโกลบินในเซลล์ (cellular hemoglobin concentration mean; CHCM) ซึ่งคำนวณได้โดยตรงจากเซลล์เม็ดเลือดแดง ไม่ใช่จากการนับจำนวนเม็ดเลือดแดงและระดับความเข้มข้นของฮีโมโกลบินเหมือนกับ MCHC ความแตกต่างระหว่างค่า CHCM และ MCHC จะบ่งชี้ถึงการรบกวนในพารามิเตอร์เหล่านี้ โดยสาเหตุที่พบได้บ่อยที่สุดคือการมีฮีโมโกลบินที่ละลายในพลาสม่า (free hemoglobin) จากการแตกทำลายของเม็ดเลือดแดงในหลอดเลือด (intravascular hemolysis) และ/หรือการแตกทำลายหลังการเก็บตัวอย่าง (post-extraction) 4,5
สัตวแพทย์ควรพิจารณาสายพันธุ์ของสุนัขเมื่อแปลผลค่าทางโลหิตวิทยาหรือไม่?
ควรพิจารณา เพราะการไม่ทราบลักษณะเฉพาะของสายพันธุ์อาจก่อให้เกิดปัญหาได้ ยกตัวอย่างเช่น มีการพบภาวะเกล็ดเลือดใหญ่กว่าปกติ (macrothrombocytopenia) โดยธรรมชาติ ซึ่งเกิดจากการกลายพันธุ์ของยีนเบต้า-1 ทูบูลิน (beta-1 tubulin gene) ในสุนัขพันธุ์ Cavalier King Charles Spaniel 6. เครื่องวิเคราะห์จะตรวจจับเกล็ดเลือดขนาดใหญ่ (macroplatelets) เหล่านี้เมื่อคำนวณอัตราส่วนร้อยละของเกร็ดเลือดต่อปริมาตรเลือดทั้งหมด (plateletcrit) ซึ่งถือว่ามีความสำคัญเพราะเป็นตัวบ่งชี้จำนวนเกล็ดเลือดที่เพียงพอได้ดีกว่าการนับจำนวนเกล็ดเลือดจริง (actual platelet count) 7. ทั้งนี้หากสัตวแพทย์สงสัยว่ามีการกลายพันธุ์ การยืนยันที่ชัดเจนจะต้องทำการตรวจทางโมเลกุล (molecular testing)
นอกจากนี้ยังมีตัวอย่างอื่นๆอีกมากมาย เช่น สุนัขสายพันธุ์ตะวันออก (oriental breeds) บางสายพันธุ์ (เช่น Akita Inu, Shar-pei และ Shiba Inu) อาจแสดงภาวะเม็ดเลือดแดงเล็กกว่าปกติ (microcytosis) โดยธรรมชาติ และค่าฮีโมโกลบินของ reticulocyte (reticulocyte hemoglobin value) จะต่ำกว่าช่วงอ้างอิงของสุนัขสายพันธุ์อื่นๆ 8. ส่วนสุนัขพันธุ์ Poodles โดยปกติแล้วจะมีปริมาตรเฉลี่ยของเม็ดเลือดแดงที่สูงกว่าสายพันธุ์อื่นๆ ขณะที่สุนัขพันธุ์ Greyhounds เช่นเดียวกับสุนัขล่าสัตว์โดยใช้สายตา (sighth hounds) อื่นๆ มักมีปริมาตรเม็ดเลือดแดงอัดแน่นโดยธรรมชาติ จำนวนเม็ดเลือดแดงและระดับความเข้มข้นของฮีโมโกลบินสูงกว่าสายพันธุ์อื่นๆ แต่มีจำนวนเกล็ดเลือดที่ต่ำกว่าและมีภาวะเม็ดเลือดขาวต่ำเล็กน้อย (mild leukopenia) เมื่อเทียบกับสายพันธุ์อื่นๆ 9.
ดังนั้น เมื่อต้องการแปลผลการตรวจของสัตว์โดยเปรียบเทียบกับช่วงอ้างอิงปกติ สัตวแพทย์ควรคำนึงถึงชนิดของสัตว์ (species) อายุ และสายพันธุ์ของสัตว์เสมอ การทราบถึงความแปรปรวนของค่าทางโลหิตวิทยาที่อธิบายไว้ในสุนัขสายพันธุ์ต่างๆซึ่งมักพบในคลินิกจึงเป็นสิ่งสำคัญ
ฉันสามารถใช้หลอดที่มีสาร heparin หรือ citrate สำหรับการตรวจทางโลหิตวิทยาได้หรือไม่?
การตรวจทางโลหิตวิทยาในสุนัขต้องใช้เลือดครบส่วน (whole blood) ที่มีการป้องกันการแข็งตัวของเลือดด้วยสาร EDTA แต่ทั้งนี้สารป้องกันการแข็งตัวอื่นๆ เช่น heparin หรือ citrate ก็มีการใช้ในทางสัตวแพทย์เช่นกัน การใช้สารป้องกันการแข็งตัวของเลือดที่ไม่ถูกต้องอาจทำให้ได้ผลลัพธ์ที่ไม่แม่นยำ ตัวอย่างเลือดครบส่วนที่ใช้สาร heparin นั้นไม่ควรใช้ในการนับเซลล์ เพราะในตัวอย่างเลือดนี้เกล็ดเลือดและเม็ดเลือดขาวมักจะเกาะกลุ่มกัน สาร heparin ถูกใช้เพื่อเก็บพลาสม่าสำหรับการตรวจทางชีวเคมี (biochemical tests) ส่วนเลือดครบส่วนที่ใช้สาร citrate จะถูกใช้ในการตรวจการแข็งตัวของเลือด (coagulation assays) และการเก็บพลาสม่าหรือการตรวจประสิทธิภาพการแข็งตัวของเลือดด้วยวิธี viscoelastic tests
อย่างไรก็ตามมีการกล่าวถึงการใช้ตัวอย่างเลือดที่ใช้สาร citrate สำหรับการนับเซลล์ในกรณีที่ตัวอย่างเลือดที่ใช้สาร EDTA มีการเกาะกลุ่มกันของเกล็ดเลือดและ/หรือเม็ดเลือดขาว โดยเมื่อใช้หลอดที่มีสาร citrate (ซึ่งมีโซเดียมซิเตรต (sodium citrate) ที่อยู่ในรูปของเหลว 3.2%) ในสถานการณ์นี้ อัตราส่วนของสาร citrate ต่อเลือดต้องเป็น 1:9 อย่างแม่นยำ เนื่องจากในกรณีนี้ตัวอย่างเลือดที่ใช้สาร citrate จะมีการเจือจางของเลือดเล็กน้อย (hemodilution) ซึ่งต้องนำข้อมูลมาพิจารณาในการประเมินค่าที่ได้จากเครื่องวิเคราะห์ทางโลหิตวิทยา 10.
EDTA เป็นสารป้องกันการแข็งตัวของเลือดที่เหมาะสมที่สุด (anticoagulant of choice) สำหรับการตรวจทางโลหิตวิทยา ในทางการแพทย์มนุษย์ (human medicine) มีคำแนะนำว่าปริมาณตัวอย่างเลือดที่ใส่ในหลอดควรอยู่ในช่วงร้อยละ 10 ของปริมาณที่ผู้ผลิตแนะนำ การใส่เลือดปริมาณน้อยหรือมากเกินไปจะส่งผลต่อความแม่นยำของผลการตรวจทางโลหิตวิทยา นอกจากนี้การมีสาร EDTA มากเกินไปจะทำให้เม็ดเลือดแดงเหี่ยว (crenation) และมีขนาดเล็กลง ซึ่งส่งผลให้ค่าปริมาตรเม็ดเลือดแดงอัดแน่นโดยวิธีปั่นด้วยหลอดแก้วขนาดเล็ก (microhematocrit) และปริมาตรเฉลี่ยของเม็ดเลือดแดง (MCV) ลดลงอย่างผิดปกติ (false reduction) 10.
เพื่อให้การแปลผลข้อมูลทางโลหิตวิทยาในคลินิกรักษาสัตว์นั้นถูกต้อง ผลลัพธ์ที่ได้จะต้องสะท้อนถึงสภาพที่แท้จริงของสัตว์ป่วยเพื่อช่วยให้เกิดการวินิจฉัยที่แม่นยำและการรักษาที่เหมาะสม
การควบคุมคุณภาพที่ดีสำหรับเครื่องวิเคราะห์ทางโลหิตวิทยาในคลินิกมีความสำคัญมากเพียงใด?
การมีโปรแกรมควบคุมคุณภาพ (quality control programs) ถือเป็นสิ่งสำคัญและควรมีการเข้าร่วมโปรแกรมเหล่านี้เมื่อใช้เครื่องวิเคราะห์ทางโลหิตวิทยาในคลินิก โดย The American Society of Veterinary Clinical Pathology (ASVCP) ได้เผยแพร่แนวทางต่างๆเพื่อปรับปรุงการควบคุมคุณภาพในโลหิตวิทยาทางสัตวแพทย์ 11,12,13,14. และเพื่อดำเนินการป้องกันข้อผิดพลาดในขั้นตอนก่อนการวิเคราะห์, ระหว่างการวิเคราะห์และหลังการวิเคราะห์ โปรแกรมควบคุมคุณภาพภายใน (Internal quality control programs) จะต้องมีการตรวจสอบโดยใช้ตัวอย่างควบคุม (control samples) นอกจากนี้การเข้าร่วมโปรแกรมควบคุมคุณภาพจากภายนอก (ภายใน (External quality control programs) ทั้งในระดับภูมิภาคหรือระดับนานาชาติก็ถือเป็นสิ่งที่จำเป็นเช่นกัน
ค่าปริมาตรเม็ดเลือดแดงอัดแน่นที่คำนวณด้วยมือ (manual hematocrit)เปรียบเทียบกับเครื่องวิเคราะห์อัตโนมัติ (analyzer) อย่างไร?
เครื่องวิเคราะห์ทางโลหิตวิทยาอัตโนมัติ (Automated hematology analyzers) จะคำนวณค่าปริมาตรเม็ดเลือดแดงอักแน่นจากการนับจำนวนเม็ดเลือดแดง (red blood cell count) และปริมาตรเฉลี่ยของเม็ดเลือดแดง (MCV) อย่างไรก็ตามการวัดค่าปริมาตรเม็ดเลือดแดงอัดแน่นโดยวิธีปั่นด้วยหลอดแก้วขนาดเล็กด้วยมือ (manual microhematocrit) นั้นถือว่าเป็นวิธีที่แม่นยำและสามารถทำซ้ำได้มากที่สุด โดยใช้การหมุนเหวี่ยง (centrifuging) ตัวอย่างที่ความเร็วสูงและอ่านค่าจากหลอดคาปิลลารี่ (capillary tube) เทียบกับมาตรวัด ทั้งนี้แม้จะเป็นวิธีที่ค่อนข้างแม่นยำ แต่ผลการศึกษาเมื่อไม่นานมานี้ที่ทำร่วมกับนักศึกษาสัตวแพทย์และสัตวแพทย์พบว่าร้อยละ 25 ของนักศึกษามีข้อผิดพลาดจากการผสมเลือดไม่เพียงพอ (inadequate mixing of blood) ก่อนเติมลงในหลอด ร้อยละ 23 อ่านผลไม่ถูกต้อง และร้อยละ 91 ไม่ได้เติมเลือดลงในหลอดแก้วขนาดเล็กหรือ microhematocrit tubes ตามคำแนะนำขององค์การอนามัยโลก (WHO) 15,16.
เพื่อที่จะลดจำนวนตัวอย่างที่ต้องตรวจวัดปริมาตรเม็ดเลือดแดงอัดแน่นโดยวิธีปั่นด้วยหลอดแก้วขนาดเล็กด้วยมือ สัตวแพทย์ควรศึกษาเกี่ยวกับความสัมพันธ์ระหว่างระดับความเข้มข้นของฮีโมโกลบิน (hemoglobin concentration) และปริมาตรเม็ดเลือดแดงอัดแน่น (hematocrit) ซึ่งโดยทั่วไปมีการใช้กฎเลข 3 (rule of 3) คือ ปริมาตรเม็ดเลือดแดงอัดแน่นควรอยู่ที่ประมาณ 3 เท่าของระดับความเข้มข้นของฮีโมโกลบิน หากค่าฮีมาโตคริตอยู่นอกช่วงนี้แนะนำให้ทำการตรวจปริมาตรเม็ดเลือดแดงอัดแน่นโดยวิธีปั่นด้วยหลอดแก้วขนาดเล็กด้วยมือและนำผลที่ได้มาประกอบกันกับค่าที่ได้จากเครื่องวิเคราะห์ ซึ่งก็คือปริมาตรเฉลี่ยของเม็ดเลือดแดง (MCV) และความเข้มข้นเฉลี่ยของฮีโมโกลบินในเม็ดเลือดแดง (MCHC) ในการวิเคราะห์ทางโลหิตวิทยา 10.
นอกจากนี้ยังควรกล่าวถึงภาวะโซเดียมในเลือดสูง (hypernatremia) ซึ่งสามารถเปลี่ยนแปลงปริมาตรเม็ดเลือดแดงอัดแน่นที่ได้จากเครื่องวิเคราะห์อัตโนมัติได้ โดยเม็ดเลือดแดงของสัตว์ที่มีภาวะโซเดียมในเลือดสูงจะบวมเมื่อผสมกับตัวทำละลายในเครื่องวิเคราะห์ (analyzer diluent) ซึ่งทำให้ค่าปริมาตรเฉลี่ยของเม็ดเลือดแดงหรือ MCV เพิ่มขึ้นอย่างผิดปกติและส่งผลให้ค่าปริมาตรเม็ดเลือดแดงอัดแน่นสูงขึ้นตามไปด้วย 17.

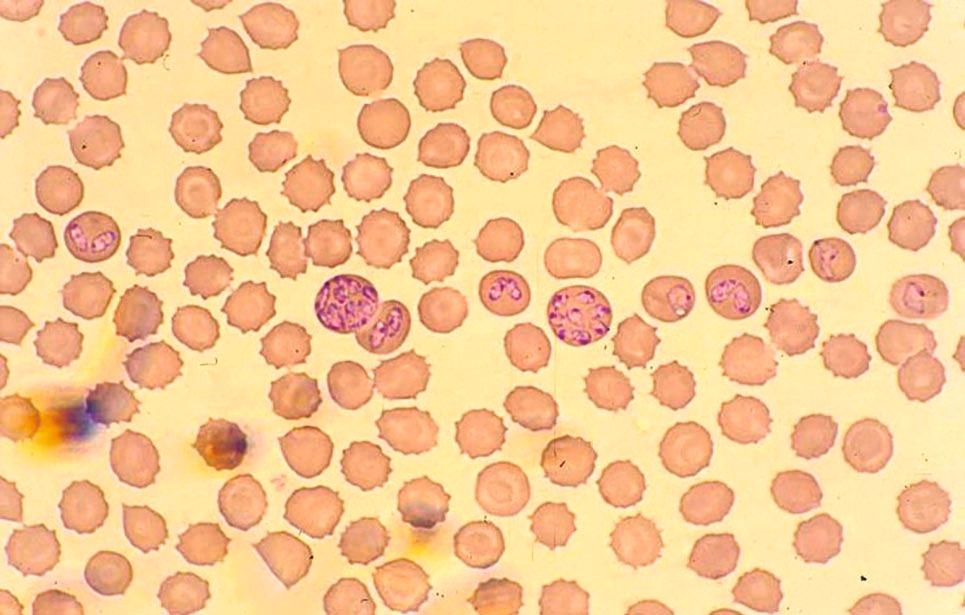
เครื่องวิเคราะห์ทางโลหิตวิทยาสามารถระบุภาวะไม่มีเม็ดเลือดขาวตัวอ่อนนอกไขกระดูก (left shift) หรือความผิดปกติของรูปร่างเซลล์เม็ดเลือดขาว (toxic changes) ได้อย่างน่าเชื่อถือได้หรือไม่?
ASVCP ได้กำหนดคำแนะนำสำหรับการตรวจสเมียร์เลือดภายใต้กล้องจุลทรรศน์ (microscopic review of blood smears) และการยืนยันผลการตรวจนับแยกจำนวนของเม็ดเลือดขาวแต่ละชนิดด้วยเครื่องอัตโนมัติ (automated differential leukocyte counts) 14. โดยความคิดเห็นของผู้เชี่ยวชาญทางสัตวแพทย์เกี่ยวกับการประเมินด้วยการตรวจสเมียร์เลือดนั้นมีความแตกต่างกัน: ผู้เชี่ยวชาญบางคนแนะนำว่าทุกตัวอย่างเลือดควรได้รับการตรวจสเมียร์เลือด ขณะที่บางคนแนะนำว่าควรตรวจสเมียร์เลือดและ/หรือทำการตรวจนับแยกจำนวนของเม็ดเลือดขาวแต่ละชนิดด้วยมือ (manual differentiation of leukocytes) ในกรณีที่ตรงกับเกณฑ์เฉพาะบางประการ ทั้งนี้แนวทางที่เหมาะสมนั้นขึ้นอยู่กับกลุ่มสัตว์ป่วยและบริบท (เช่น สัตว์ที่ป่วย การตรวจสุขภาพก่อนการวางยาสลบหรือการตรวจสุขภาพสุนัขสูงอายุ) เครื่องวิเคราะห์ทางโลหิตวิทยาที่มีอยู่ในปัจจุบันและความรู้ของเจ้าหน้าที่ในห้องปฏิบัติการ
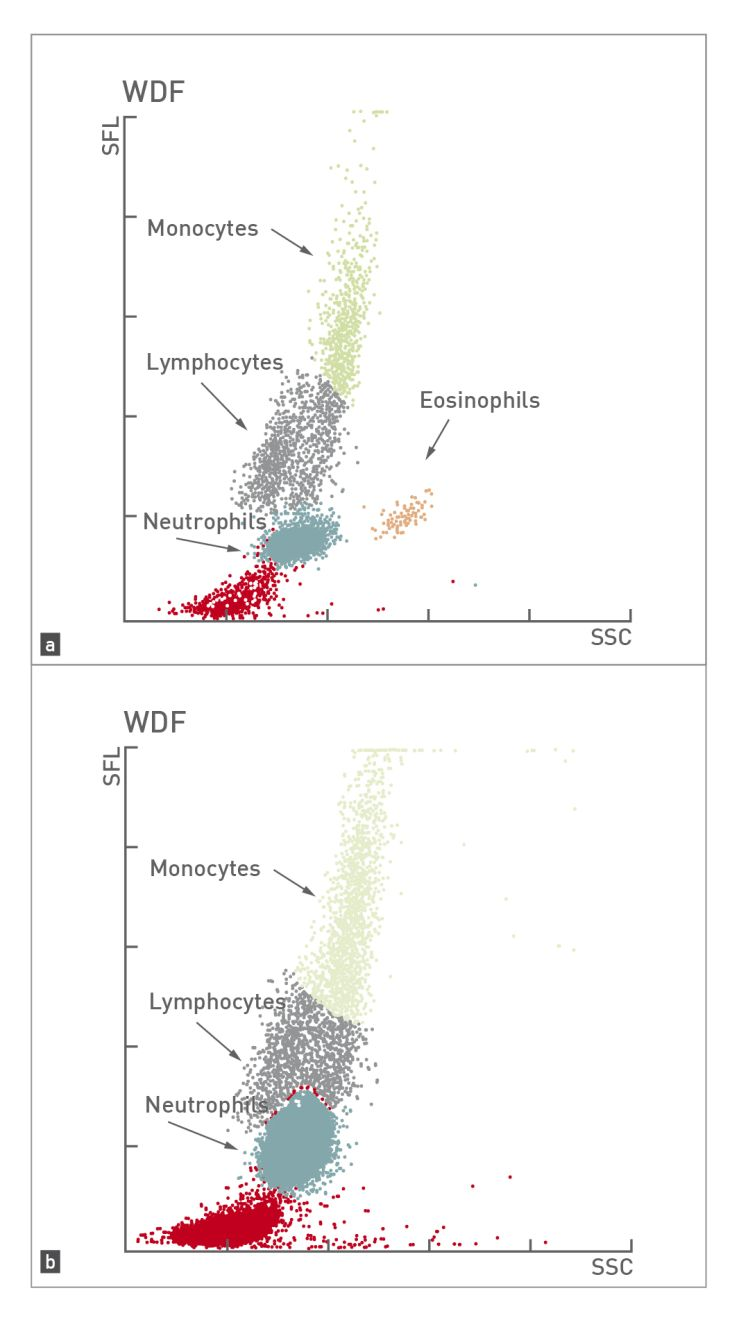
เครื่องวิเคราะห์ทางโลหิตวิทยาระบบ laser beam นอกจากจะให้ผลลัพธ์เชิงตัวเลขแล้วยังสามารถนำเสนอผลในรูปแบบกราฟไซโตแกรม (cytogram) ได้อีกด้วย การศึกษาต่างๆในด้านสัตวแพทย์ได้แสดงให้เห็นว่ากราฟไซโตแกรมนั้นมีความสำคัญอย่างมากในการตัดสินใจในการตรวจสเมียร์เลือด 18,19. ด้วยเหตุนี้การศึกษาเกี่ยวกับสเมียร์เลือดจึงเป็นสิ่งที่แนะนำเมื่อกราฟไซโตแกรมผิดปกติ เครื่องวิเคราะห์ได้แสดงสัญลักษณ์เตือนเกี่ยวกับความล้มเหลวหรือข้อผิดพลาดในการจำแนกชนิดของเซลล์เม็ดเลือดขาวหรือเมื่อจำนวนเม็ดเลือดขาวอยู่นอกช่วงอ้างอิง โดยเครื่องวิเคราะห์อัตโนมัติระบบ laser beam สามารถแสดงให้เห็นถึงความผิดปกติของรูปร่างเซลล์เม็ดเลือดขาว (toxic changes) หรือภาวะภาวะไม่มีเม็ดเลือดขาวตัวอ่อนนอกไขกระดูก (left shift) ได้ (รูปภาพที่ 4) อย่างไรก็ตามข้อมูลเกี่ยวกับความไว (sensitivity) และความจำเพาะ (specificity) ของการค้นพบเหล่านี้มีน้อยมาก เพราะฉะนั้นจึงสำคัญที่สัตวแพทย์จะต้องตัดสินใจตรวจสเมียร์เลือดเสมอในกรณีที่สัตว์ป่วยหรือมีภาวะเม็ดเลือดขาวสูง (leukocytosis) หรือเมื่อเครื่องวิเคราะห์แสดงการแจ้งเตือน (รูปภาพที่ 5)

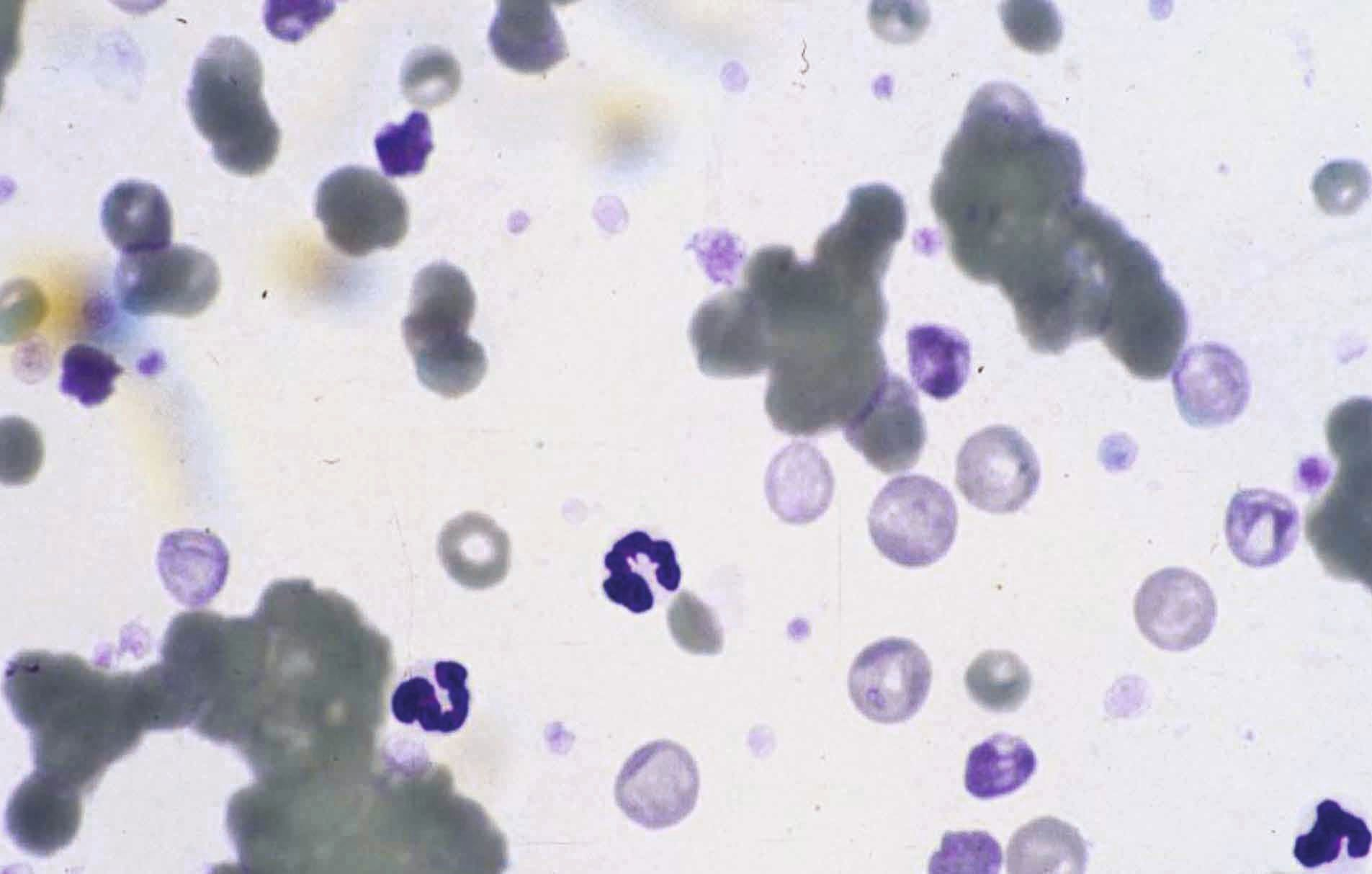
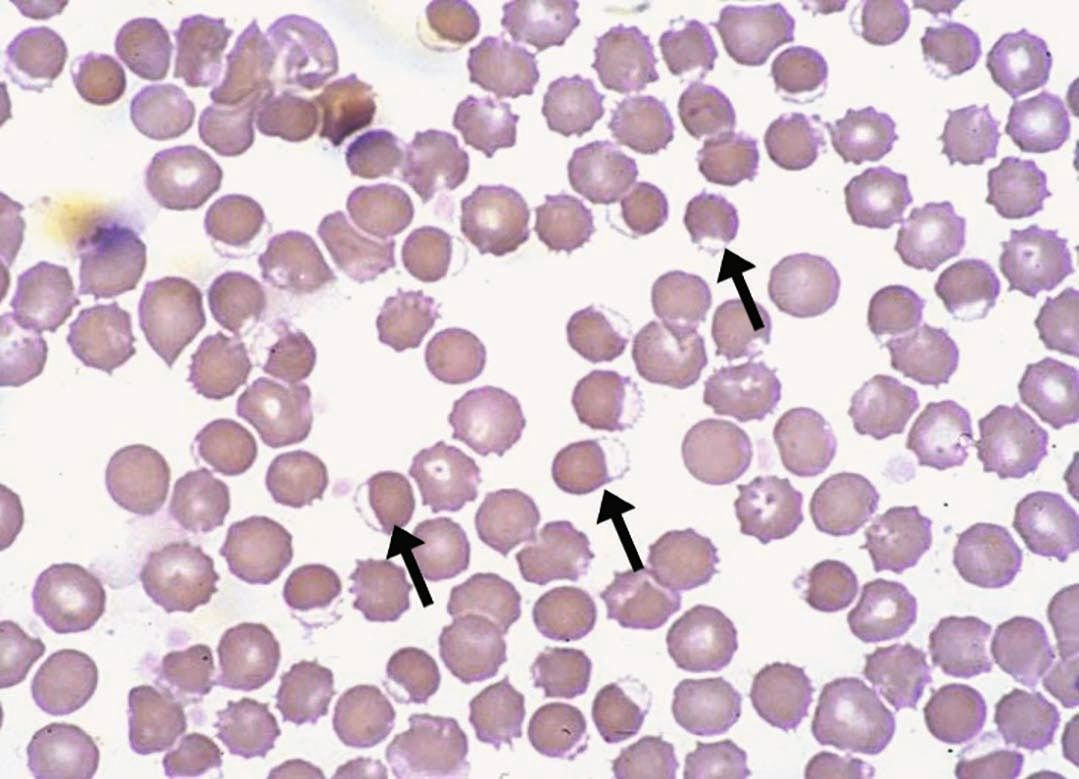
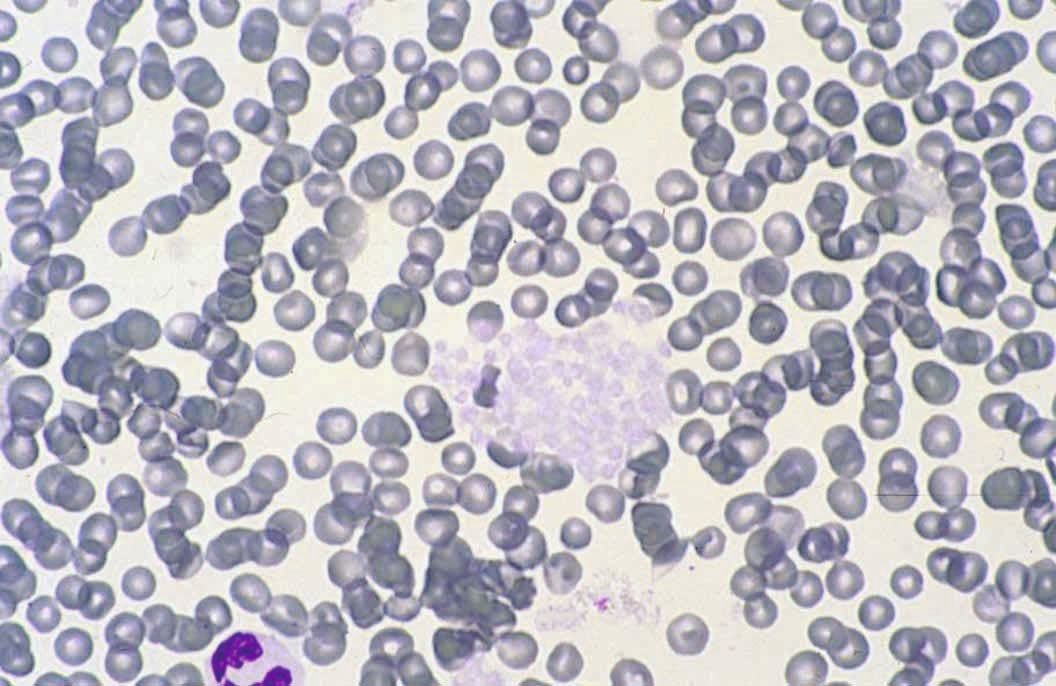
ทุกครั้งที่สัตวแพทย์พบจำนวนเกล็ดเลือดลดลง (decreased platelet count) การตรวจเมียร์เลือดนั้นถือเป็นสิ่งที่จำเป็น โดยส่วนหนึ่งอาจเกิดจากข้อผิดพลาดจากการขนส่งตัวอย่างเลือดหรือปัญหาที่เกิดขึ้นในระหว่างการเก็บตัวอย่างเลือดซึ่งพบได้บ่อยในทางสัตวแพทย์ การประเมินจำนวนเกล็ดเลือดด้วยการตรวจสเมียร์เลือดนั้นสามารถทำได้โดยการคูณจำนวนเกล็ดเลือดเฉลี่ย (average number of platelets) ต่อช่องมอง (field) ที่กำลังขยาย 1000 เท่า (ใช้เลนส์อิมเมอร์ชั่น ออย (oil immersion)) กับ 15000/µL อย่างไรก็ตามมีการศึกษาหนึ่งพบว่าความแปรปรวนของการประเมินจำนวนเกล็ดเลือดในสุนัขโดยใช้วิธีนี้ค่อนข้างสูงและขึ้นอยู่กับผู้ปฏิบัติงานและพื้นที่ที่ใช้ในการประเมินสเมียร์ 25.
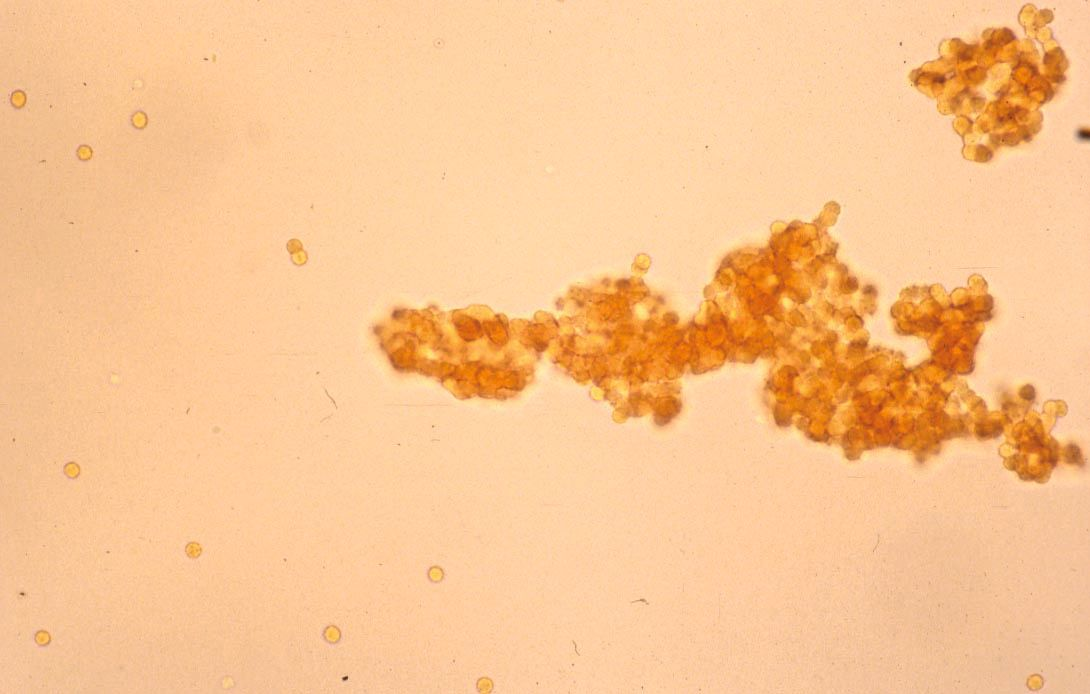
การนับจำนวนเกล็ดเลือดในทุกตัวอย่างเลือดที่มีการเกาะกลุ่มของเกล็ดเลือด (platelet aggregates) เป็นเรื่องที่น่าผิดหวังและอาจไม่จำเป็นสำหรับตัวอย่างเลือดส่วนใหญ่ เนื่องจากคำแนะนำทางคลินิกได้ระบุว่าหากจำนวนเกล็ดเลือดอยู่ในช่วงอ้างอิง การเกาะกลุ่มของเกล็ดเลือดก็จะไม่มีความสำคัญทางคลินิก อย่างไรก็ตามทุกครั้งที่เครื่องวิเคราะห์อัตโนมัติแสดงให้เห็นภาวะเกล็ดเลือดต่ำ (thrombocytopenia) สัตวแพทย์ก็ควรตรวจสเมียร์เลือดเพื่อตรวจหาการเกาะกลุ่มของเกล็ดเลือด (รูปภาพที่ 8) 26. เครื่องวิเคราะห์ทางโลหิตวิทยาระบบ laser ที่ใหม่กว่าจะมีตัวบ่งชี้สำหรับการเกาะกลุ่มของเกล็ดเลือด โดยขึ้นอยู่กับจำนวนและขนาดของการเกาะกลุ่ม นอกจากนี้สัตวแพทย์อาจสามารถตรวจพบการเกาะกลุ่มได้จากกราฟไซโตแกรมและและฮิสโตแกรมที่เครื่องวิเคราะห์ให้มาซึ่งจะช่วยลดความจำเป็นในการตรวจสเมียร์เลือดในกรณีที่สามารถระบุได้อย่างชัดเจน
เป็นที่น่าสังเกตว่ามีบทความล่าสุดได้ทำการประเมินการกำหนดอัตราส่วนของเกล็ดเลือดตัวอ่อนต่อจำนวนเกล็ดเลือดทั้งหมด (immature platelet fraction (IPF)) ในสุนัขโดยใช้เครื่องวิเคราะห์เชิงพาณิชย์ (commercial analyzer) เซลล์อ่อน (immature cells) เหล่านี้ถือเป็นตัวบ่งชี้การฟื้นฟูของไขกระดูกในการผลิตเกล็ดเลือด (bone marrow regeneration) เมื่อร่างกายมีความต้องการสูง การศึกษาดังกล่าวรายงานว่าค่าที่เครื่องวิเคราะห์ให้มานั้นมีค่าประเมินสูงกว่าค่าจริงเล็กน้อย (slightly overestimated) ในกรณีที่มีการเกาะกลุ่มของเกล็ดเลือด 27.
โลหิตวิทยาทางสัตวแพทย์ (veterinary hematology) ได้ก้าวหน้าไปอย่างมากในช่วงปีที่ผ่านมาโดยเฉพาะอย่างยิ่งจากการนำเครื่องวิเคราะห์ที่มีเทคโนโลยีที่ทันสมัยเข้ามาใช้ อย่างไรก็ตามผู้เชี่ยวชาญทางสัตวแพทย์จำเป็นต้องตระหนักว่ายังมีปัจจัยหลายอย่างที่อาจทำให้ผลลัพธ์ผิดพลาดหรือทำให้เกิดการแปลผลที่ผิดพลาด เทคนิคการเก็บตัวอย่างเลือดที่ดีและการประมวลผลอย่างรอบคอบจึงเป็นสิ่งที่จำเป็นสำหรับการวินิจฉัยที่เชื่อถือได้ พร้อมทั้งต้องมีการควบคุมคุณภาพเครื่องวิเคราะห์ในคลินิกที่เหมาะสมอย่างสม่ำเสมอ นอกจากนี้การตรวจสเมียร์เลือดยังคงจำเป็นในหลายๆโอกาสเพื่อการวินิจฉัยที่ดียิ่งขึ้นสำหรับสัตว์เลี้ยงของเรา!
Josep Pastor
DVM, PhD, Dip. ECVCP, Faculty of Veterinary Medicine, Barcelona Autonomous University, Barcelona, SpainSpain
Josep Pastor obtained both his bachelor’s degree and doctorate in veterinary medicine from the Barcelona Autonomous University (UAB) and has been a professor of Medical Pathology at the UAB Faculty of Veterinary Medicine since 1991. He is also currently co-director of the Hematology Unit in the University’s Department of Animal Medicine and Surgery. He attained diplomate status from the European College of Veterinary Clinical Pathology in 2002 and has authored several veterinary textbooks, as well as numerous articles for both national and international journals. His main areas of interest are hematology, clinical pathology and small animal oncology.
References
- Zandecki M, Genevieve F, Gerard J, et al. Spurious counts and spurious results on haematology analysers: a review. Part I: platelets. Int. J. Lab. Hematol. 2007;29(1):4-20.
- Zandecki M, Genevieve F, Gerard J, et al. Spurious counts and spurious results on haematology analysers: a review. Part II: white blood cells, red blood cells, haemoglobin, red cell indices and reticulocytes. Int. J. Lab. Hematol. 2007;29(1):21-41.
- Berda-Haddad Y, Faure C, Boubaya M, et al. Increased mean corpuscular haemoglobin concentration: artefact or pathological condition? Int. J. Lab. Hematol. 2017;39(1):32-41.
- Stockham SL, Scott MA. Fundamentals of Veterinary Clinical Pathology, 2nd ed. Ames, Iowa: Blackwell, 2008. p120-122
- Stokol T, Erb HN. A comparison of platelet parameters in EDTA‐ and citrate‐anticoagulated blood in dogs. Vet. Clin. Pathol. 2007;36:148-154.
- Davis B, Toivio-Kinnucan M, Schuller S, et al. Mutation in beta1-tubulin correlates with macrothrombocytopenia in Cavalier King Charles Spaniels. J. Vet. Intern. Med. 2008;22(3):540-545.
- Tvedten HW, Lilliehöök IE, Oberg J, et al. Validation of Advia plateletcrit for assessing platelet mass in dogs, including Cavalier King Charles spaniels. Vet. Clin. Pathol. 2012;41(3):336-343.
- Schaefer DM, Stokol T. The utility of reticulocyte indices in distinguishing iron deficiency anemia from anemia of inflammatory disease, portosystemic shunting, and breed-associated microcytosis in dogs. Vet. Clin. Pathol. 2015;44(1):109-119.
- Zaldívar-López S, Marín LM, Iazbik MC, et al. Clinical pathology of Greyhounds and other sighthounds. Vet. Clin. Pathol. 2011;40(4):414-425.
- Harvey JW. Veterinary Hematology: A Diagnostic Guide and Color Atlas. St. Louis, MO: Elsevier/Saunders, 2012. p17-19
- Arnold JE, Camus MS, Freeman KP, et al. ASVCP Guidelines: Principles of Quality Assurance and Standards for Veterinary Clinical Pathology (version 3.0). Vet. Clin. Pathol. 2019;48(4):542-618.
- Flatland B, Freeman KP, Friedrichs KR, et al. ASVCP quality assurance guidelines: control of general analytical factors in veterinary laboratories. Vet. Clin. Pathol. 2010;39(3):264-277.
- Camus MS, Flatland B, Freeman KP, et al. ASVCP quality assurance guidelines: external quality assessment and comparative testing for reference and in-clinic laboratories. Vet. Clin. Pathol. 2015;44(4):477-492.
- Vap LM, Harr KE, Arnold JE, et al; ASVCP quality assurance guidelines: control of preanalytical and analytical factors for hematology for mammalian and nonmammalian species, hemostasis, and crossmatching in veterinary laboratories. Vet. Clin. Pathol. 2012;41(1):8-17.
- Breheny CR, Brown A, Handel I, et al. Inter- and intra-operator variability in the analysis of packed cell volume. J. Small Anim. Pract. 2017;58(1):29-34.
- World Health Organization Diagnostic Imaging and Laboratory Technology. Recommended method for the determination of packed cell volume by centrifugation. World Health Organization, Geneva, 2000
- Boisvert AM, Tvedten HW, Scott MA. Artifactual effects of hypernatremia and hyponatremia on red cell analytes measured by the Bayer H*1 analyzer. Vet. Clin. Pathol. 1999;28(3):91-96.
- Lilliehook I, Tvedten H. Validation of the Sysmex XT‐2000iV hematology system for dogs, cats, and horses. II. Differential leukocyte counts. Vet. Clin. Pathol. 2009;38:175-182.
- Stirn M, Moritz A, Bauer N. Rate of manual leukocyte differentials in dog, cat and horse blood samples using ADVIA 120 cytograms. BMC Vet. Res. 2014;10:125.
- Garden OA, Kidd L, Mexas AM, et al. ACVIM consensus statement on the diagnosis of immune-mediated hemolytic anemia in dogs and cats. J. Vet. Intern. Med. 2019;33(2):313-334.
- Piane L, Théron ML, Aumann M, et al. Spurious reticulocyte profiles in a dog with babesiosis. Vet. Clin. Pathol. 2016;45(4):594-597. Doi: 10.1111/vcp.12395.
- Piane L, Young KM, Giraud L, et al. Spurious reticulocyte profiles in dogs with large form babesiosis: a retrospective study. Vet. Clin. Pathol. 2016;45(4):598-603. Doi: 10.1111/vcp.12396.
- Bauer N, Nakagawa J, Dunker C, et al. Evaluation of the automated hematology analyzer Sysmex XT-2000iV™ compared to the ADVIA® 2120 for its use in dogs, cats, and horses: Part I – Precision, linearity, and accuracy of complete blood cell count. J. Vet. Diagn. Invest. 2011;23(6):1168-1180.
- Bauer N, Nakagawa J, Dunker C, et al. Evaluation of the automated hematology analyzer Sysmex XT-2000iV™ compared to the ADVIA® 2120 for its use in dogs, cats, and horses. Part II – Accuracy of leukocyte differential and reticulocyte count, impact of anticoagulant and sample aging. J. Vet. Diagn. Invest. 2012;24(1):74-89.
- Paltrinieri S, Paciletti V, Zambarbieri J. Analytical variability of estimated platelet counts on canine blood smears. Vet. Clin. Pathol. 2018;47:197-204.
- Tvedten HW, Backlund K, Lilliehook IE. Reducing error in feline platelet enumeration by addition of Iloprost to blood specimens: comparison to prostaglandin E1 and EDTA. Vet. Clin. Pathol. 2015;44:179-187.
- Jornet-Rius O, Mesalles-Naranjo M, Pastor J. Performance of the Sysmex XN-V hematology analyzer in determining the immature platelet fraction in dogs: A preliminary study and reference values. Vet. Clin. Pathol. 2023;52(3):433-442.
Other articles in this issue
แบ่งปันบนโซเชียลมีเดีย