เซลล์วิทยาเพื่อการวินิจฉัยเชิงปฏิบัติสำหรับสัตวแพทย์
Written by Peter J. O’Brien and Maria Balan
เซลล์วิทยาเป็นวิธีที่มีประสิทธิภาพสูงสำหรับการวินิจฉัยและประเมินพยาธิสภาพต่าง ๆ บทความนี้จะนำเสนอภาพรวมของเทคนิคดังกล่าวและทบทวนถึงเนื้องอกที่พบได้บ่อยที่สุดจากการวิเคราะห์ทางเซลล์วิทยา
Article
ประเด็นสำคัญ
เซลล์วิทยาเป็นวิธีที่รวดเร็ว ราคาไม่แพง และมีประสิทธิภาพ โดยสามารถนำมาใช้ประเมินพยาธิสภาพต่างๆ ได้แก่ การอักเสบ (inflammation) การบาดเจ็บ (injury) การติดเชื้อ (infection) ภาวะเซลล์เพิ่มจำนวนผิดปกติ (hyperplasia) และเนื้องอก (neoplasia)
ผลการตรวจทางเซลล์วิทยามักจะมีความสัมพันธ์ที่ดีกับผลการตรวจทางจุลพยาธิวิทยาของชิ้นเนื้อ (tissue biopsy)
เทคนิคการเก็บตัวอย่างที่ดี พร้อมกับการให้ข้อมูลสัตว์ป่วยอย่างเพียงพอ จะช่วยให้นักพยาธิวิทยา (pathologist) สามารถแปลผลตัวอย่างที่ส่งมาได้อย่างถูกต้องและเพิ่มความสำเร็จในการวินิจฉัย
เนื้องอกร้าย (malignancies) ส่วนใหญ่สามารถถูกวินิจฉัยได้อย่างมีประสิทธิภาพด้วยการตรวจทางเซลล์วิทยา โดยการระบุเกณฑ์สำคัญอย่างน้อยสามข้อในเซลล์ตัวอย่างที่มีจำนวนมากพอ
บทนำ
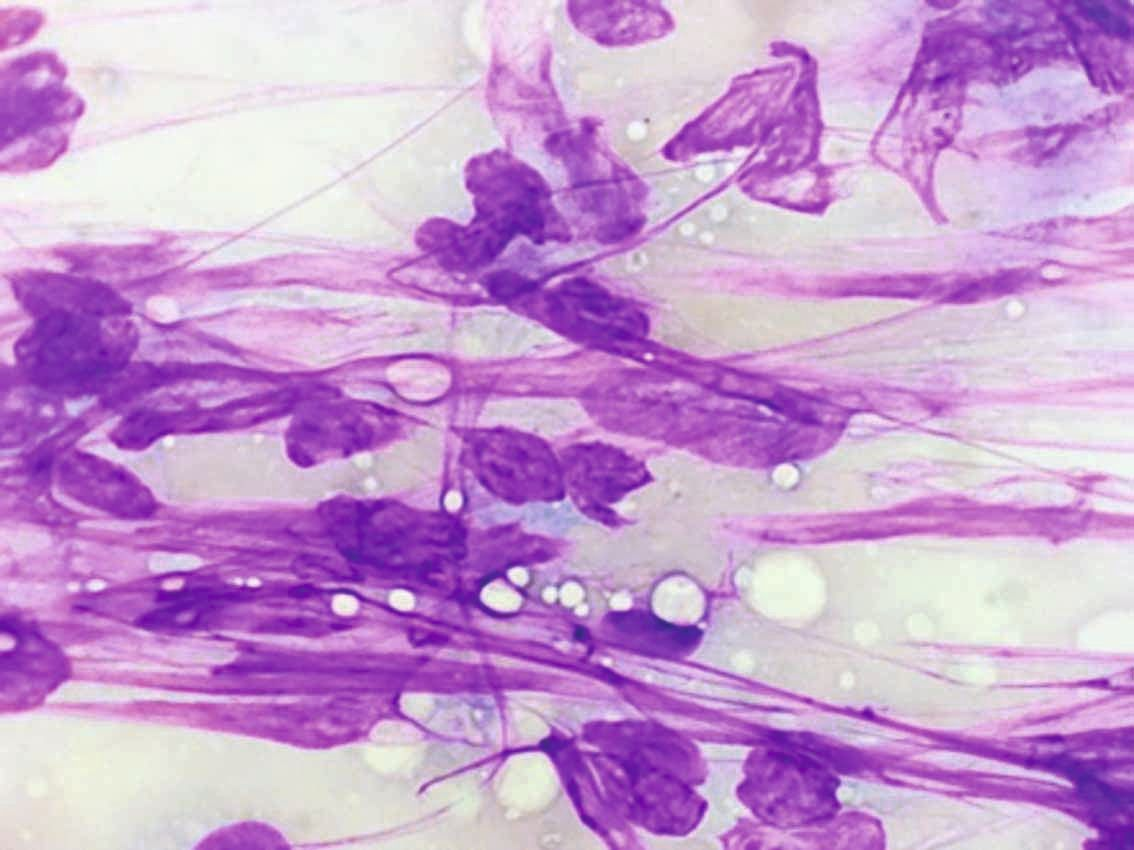
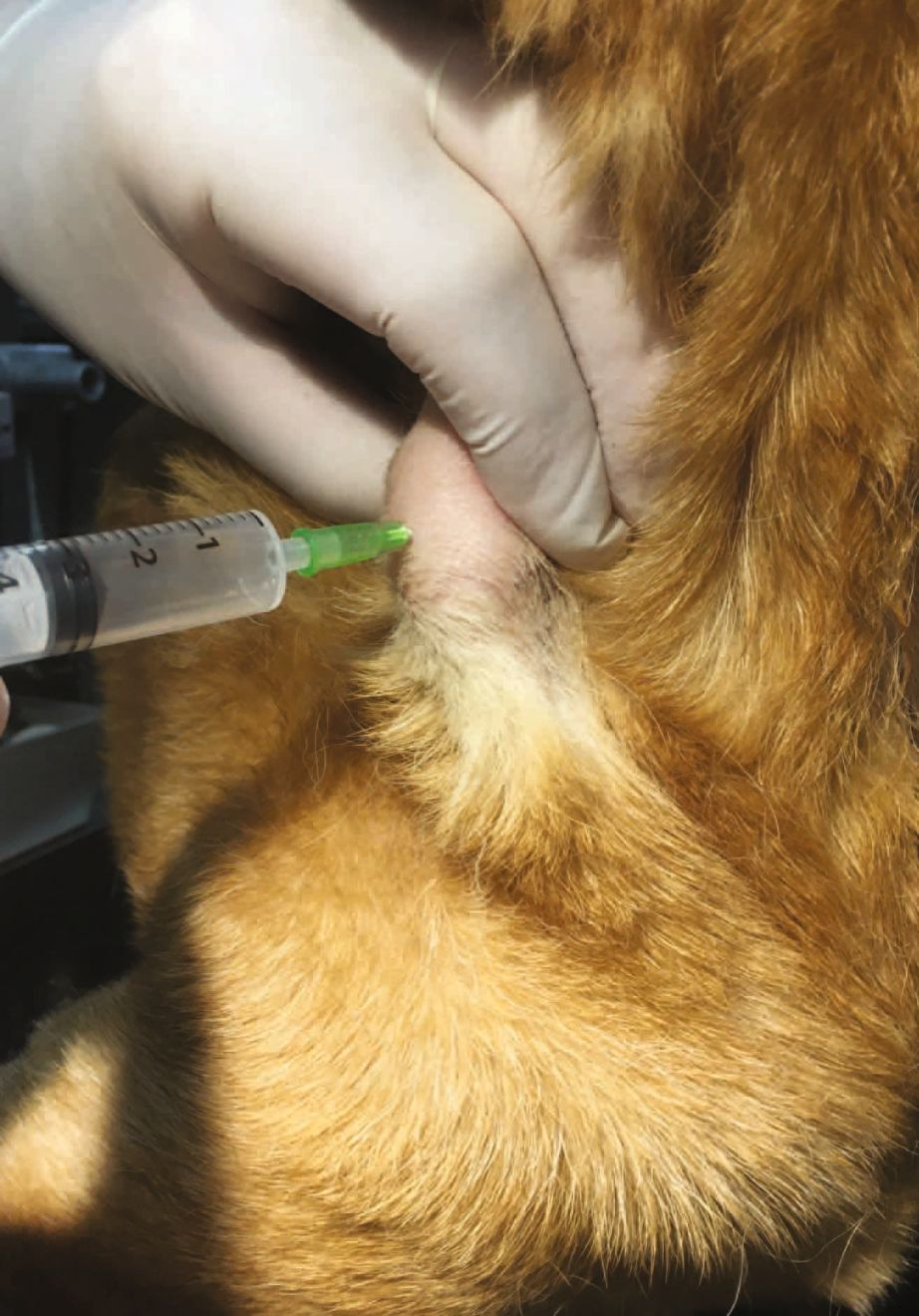
เซลล์วิทยา (คือ การศึกษาพยาธิสภาพในระดับเซลล์) เป็นวิธีที่มีประสิทธิภาพสูงและเป็นที่นิยมใช้ในสัตวแพทย์เพื่อวินิจฉัยและประเมินพยาธิสภาพต่างๆ เช่น การอักเสบ การบาดเจ็บ การติดเชื้อ ภาวะเซลล์เพิ่มจำนวนผิดปกติ (hyperplasia) และเนื้องอก (neoplasia) วิธีนี้เป็นวิธีที่ทำได้ง่าย ประหยัด น่าเชื่อถือ รุกล้ำร่างกายน้อย (minimally invasive) และรวดเร็ว (กล่องข้อความที่ 1) เทคนิคนี้มักนำมาใช้กับการเจาะดูดเก็บตัวอย่างด้วยเข็มขนาดเล็ก (fine-needle aspirates) จากก้อน (lumps) การบวม (swellings) หรือรอยโรคที่ไม่ทราบสาเหตุบริเวณภายนอกร่างกาย (รูปภาพที่ 1) นอกจากนี้ ยังสามารถใช้ประเมินเซลล์ที่ได้จากการขูด (scraping) จากรอยโรคที่ผิวหนัง, การป้ายจากเยื่อบุผิว (swabs of mucosal surfaces), และการแปะรอยโรค, ชิ้นเนื้อหรือพื้นผิวเนื้อเยื่อโดยตรงบนสไลด์แก้ว (direct imprints) ยิ่งไปกว่านั้น ยังมีการนำมาใช้กับสารน้ำที่ได้จากการล้างโพรงจมูก (nasal) หลอดลม (tracheal) หลอดลมฝอย (bronchial) และถุงลม (alveolar spaces), จากการสวนปัสสาวะในกระเพาะปัสสาวะและต่อมลูกหมากและจากการดูดเก็บสารน้ำในช่องว่างร่างกายและข้อต่อ โดยปัจจุบันมีการใช้วิธีเจาะดูดเก็บตัวอย่างด้วยเข็มขนาดเล็กโดยอาศัยการอัลตราซาวด์นำ (ultrasound-guided fine-needle aspiration) จากก้อนหรืออวัยวะภายใน เช่น ตับ ม้าม และไต เพื่อประเมินรอยโรคภายในมากขึ้นเรื่อยๆ
กล่องข้อความที่ 1 ข้อดีของการตรวจวินิจฉัยทางเซลล์วิทยา
|
ข้อดีและข้อเสียของการตรวจเซลล์วิทยา
ผลการตรวจทางเซลล์วิทยามีความสัมพันธ์อย่างมากกับผลที่ได้จากการตัดชิ้นเนื้อเพื่อตรวจทางจุลพยาธิวิทยา อย่างไรก็ตามข้อจำกัดของเทคนิคเซลล์วิทยาเมื่อเทียบกับจุลพยาธิวิทยาคือเซลล์วิทยาให้ปริมาณเซลล์ที่น้อยกว่ามากและให้ข้อมูลเกี่ยวกับโครงสร้างของเนื้อเยื่อ (architectural information) รวมถึงข้อมูลการปฏิสัมพันธ์ระหว่างเซลล์ (cross-cell interaction information) ได้น้อยกว่า ลักษณะโครงสร้างที่สำคัญบางอย่างอาจพบเห็นได้ด้วยเซลล์วิทยา เช่น การเรียงตัวเป็นแถวของเซลล์ใน basal cell tumors, การเกี่ยวข้องกับเส้นเลือดฝอย (capillaries) ใน lipomas และ hemangiopericytomas, การก่อตัวเป็นถุงและท่อ (acinar and tubular formations) และสารนอกเซลล์ในเนื้อเยื่อที่หลั่งสาร (extracellular matrix in secretory tissue) และการก่อตัวเป็นติ่ง (papillary formations) ในเนื้อเยื่อบุผิว (epithelial tissues) อย่างไรก็ตามข้อมูลระดับเซลล์ (cell-level) และระดับใต้เซลล์ (subcellular) ที่ได้จากการตรวจเซลล์วิทยาอาจจำเป็นสำหรับการวินิจฉัยบางภาวะ เช่น hemangiopericytoma และตัวอย่างเซลล์วิทยา (cytological specimens) ที่ถูกเตรียมอย่างดีจะปราศจากการหดตัว (shrinkage) และสิ่งแปลกปลอมอื่นๆ (artefacts) จากการตรึงด้วยฟอร์มาลดีไฮด์ (formaldehyde fixation) ที่พบในการตรวจทางจุลพยาธิวิทยา สิ่งนี้อาจมีความเกี่ยวข้องในการวินิจฉัยที่อาศัยการประเมินขนาดเซลล์ (cell-size evaluation) เป็นหลัก เช่น มะเร็งต่อมน้ำเหลือง (lymphoma)
สำหรับผลการตรวจทางเซลล์วิทยาส่วนใหญ่ ทักษะและความรู้ที่จำเป็นสำหรับการเก็บและเตรียมตัวอย่าง ตลอดจนการประเมินด้วยกล้องจุลทรรศน์นั้นถือเป็นพื้นฐานสำหรับสัตวแพทย์ ถึงแม้ว่าการดำเนินการอย่างไม่รอบคอบอาจทำให้ตัวอย่างใช้ไม่ได้ก็ตาม (กล่องข้อความที่ 2) รอยโรคอักเสบ (Inflammatory lesions) อาจเป็นสิ่งที่ระบุได้ง่ายที่สุด (กล่องข้อความที่ 3) เนื่องจากส่วนใหญ่พิจารณาจากการจำแนกชนิดของเซลล์เม็ดเลือด (blood cells) ที่เข้ามาและเซลล์มาโครฟาจ (macrophages) ที่เกิดขึ้น ตลอดจนการประเมินความรุนแรง (severity) เซลล์จากเนื้อเยื่อบางชนิดสามารถจดจำได้ง่ายจากลักษณะทางสัณฐานวิทยา (morphological features) ที่แตกต่างกันเพียงไม่กี่ประการ เช่น เนื้องอกผิวหนัง (skin tumors) ประมาณร้อยละ 80 เป็นเนื้องอกเพียง 10 ชนิดเท่านั้น ซึ่งสัตวแพทย์สามารถเรียนรู้การวินิจฉัยผลการตรวจทางเซลล์วิทยาที่พบบ่อยที่สุดได้อย่างรวดเร็วและส่งต่อกรณีที่มีความซับซ้อนกว่าให้ผู้เชี่ยวชาญดำเนินการต่อไป นอกจากนี้หนังสือเรียน คู่มือ แผนภาพและวรรณกรรมที่เกี่ยวข้องซึ่งเน้นสำหรับสัตวแพทย์ได้กลายเป็นที่แพร่หลายอย่างกว้างขวางในช่วงสองทศวรรษที่ผ่านมา ทั้งในรูปแบบสิ่งพิมพ์และดิจิทัลบนอินเทอร์เน็ต
กล่องข้อความที่ 2: 5 สาเหตุของตัวอย่างเซลล์วิทยาที่วินิจฉัยไม่ได้
|

กล่องข้อความที่ 3: แนวทางอัลกอริทึม (algorithmic approach) ในการตรวจเซลล์วิทยาของซีสต์ (cyst), ก้อนเนื้อ (lump) หรือตุ่มนูน (bump)
|
ประการแรก: ตัวอย่างเพียงพอสำหรับการประเมินหรือไม่?
|
||
| ประการที่สอง: เป็นเนื้อเยื่อหรือสารน้ำ? | ||
|
ถ้าเป็นเนื้อเยื่อ ↙
|
ถ้าเป็นสารน้ำ ↘
|
|
เทคโนโลยีและความรู้ได้พัฒนาไปอย่างมากในช่วงเวลาที่ผ่านมานี้ โดยเฉพาะอย่างยิ่งในด้านการได้มาซึ่งภาพจากจุลทรรศน์คุณภาพสูง การวิเคราะห์และการจัดเก็บข้อมูล สิ่งที่จำเป็นในการตรวจวิเคราะห์ตัวอย่างเมื่อเก็บ ป้ายและย้อมสีแล้ว มีเพียงแค่กล้องจุลทรรศน์, โทรศัพท์มือถือ, คอมพิวเตอร์, หนังสือคู่มือภาพสี (color atlas) และเครื่องปั่นเหวี่ยงทางคลินิก (clinical centrifuge) เท่านั้น นอกจากนี้ในแง่มุมทางธุรกิจและการเงิน ยังเป็นที่น่าสังเกตว่าเซลล์วิทยาได้กลายเป็นองค์ประกอบสำคัญของพยาธิวิทยาคลินิก (clinical pathology) ในการดำเนินงานของคลินิกสัตวแพทย์ ที่น่าสนใจคือ ผู้ดูแลและผู้ตรวจในการสอบสาขาพยาธิวิทยาคลินิก (supervisors and examiners in the specialty of clinical pathology) มักจะพบว่าสัตวแพทย์ประจำบ้านใช้เวลาส่วนใหญ่ ให้ความสนใจและทำคะแนนได้ดีที่สุดในสาขาย่อยของเซลล์วิทยา (subspeciality of cytology) เมื่อเทียบกับสาขาอื่นๆ ในพยาธิวิทยาคลินิก เช่น ชีวเคมี (biochemistry), พยาธิวิทยาทั่วไป (general pathology), โลหิตวิทยา (hematology) และการจัดการห้องปฏิบัติการ
การเก็บตัวอย่างและการสร้างภาพอย่างมีประสิทธิภาพ
โดยทั่วไปแล้ว สำหรับรอยโรคเพียงรอยเดียว สัตวแพทย์จะส่งสเมียร์ 1-4 สไลด์ ซึ่งจะถูกประเมินเพื่อดูความหนาแน่นของเซลล์ (cellularity) การคงสภาพของเซลล์ (cell preservation) และการมีอยู่ของการอักเสบ (กล่องข้อความที่ 4) และลักษณะของเซลล์มะเร็ง (malignant features) (กล่องข้อความที่ 5) ตัวอย่างที่มีคุณภาพสำหรับการวินิจฉัยจะต้องมีจำนวนเซลล์เพียงพอและได้รับการตรึงอย่างถูกต้อง โดยเซลล์จะมีการกระจายตัวดีและมีการปนเปื้อนเลือดน้อยที่สุด การเก็บตัวอย่างมักทำโดยการดูด (aspiration) แต่บางครั้งก็ทำได้โดยการสอดเข็มเข้าไปเฉยๆในกรณีที่เซลล์แยกตัวจากกัน เช่น ในมะเร็งต่อมน้ำเหลือง การดูดโดยใช้เข็มขนาด 22-23G และกระบอกฉีดยาขนาด 20 มล. ทำได้โดยการเคลื่อนเข็มไปมาสองสามครั้งเพื่อเก็บเซลล์จากบริเวณที่กว้างขึ้นและเป็นตัวแทนของรอยโรค สารที่ถูกดูดออกมาจะถูกหยดลงบนสไลด์โดยถือเข็มทำมุม 45 องศา การป้ายสไลด์ที่ดีที่สุดทำได้โดยใช้สไลด์ที่สองวางทับสไลด์แรก แล้วดึงออกช้าๆ ในแนวนอน โดยใช้แรงกดในแนวตั้งน้อยที่สุด จากนั้นจึงทำให้แห้งอย่างรวดเร็วโดยการโบกสไลด์ไปมาในอากาศประมาณ 30 วินาที หรือวางไว้หน้าพัดลมที่เป่าแรงๆหรือเครื่องเป่าผม วิธีนี้จะช่วยป้องกันไม่ให้เซลล์หดตัวและสลายตัว
กล่องข้อความที่ 4: การประเมินการอักเสบทางเซลล์วิทยา
|
กล่องข้อความที่ 5: เกณฑ์การวินิจฉัยมะเร็ง (ต้องมีมากกว่า 3 ข้อ)
| คำนำหน้า (prefix) | ส่วนของคำ (word stem) | คำอธิบายลักษณะของเซลล์ (cell feature) |
|---|---|---|
| Aniso | -cytosis/-karyosis/-nucleoliosis | ขนาดแตกต่างกันมากกว่า 2 เท่า |
| Hyper | -chromasia | มีภาวะไซโตพลาสซึมติดสีน้ำเงินหรือม่วง (↑ cytoplasmic basophilia) |
| -mitotic | เพิ่มการแบ่งเซลล์ (↑ mitoses); มีการเปลี่ยนแปลงรูปร่างนิวเคลียส (↑ nuclear molding); อัตราส่วนนิวเคลียสต่อไซโตพลาสซึมสูงขึ้น (↑ Nucleus: cytoplasm ratio, N/C) > 50%; การก่อตัวของกลุ่มเซลล์ขนาดใหญ่ (large cell aggregates) หรือการก่อตัวแบบอวัยวะ (organoid formation) | |
| Micro | -nuclei | ความผิดพลาดในการแบ่งเซลล์ ทำให้เกิดโครโมโซมหรือชิ้นส่วน fragment ที่มีขนาด <2 ไมโครเมตรในเซลล์ลูก (daughter cell); ย้อมสีเหมือนนิวเคลียส |
| Macro | -cytosis/karyosis/nucleoliosis | เช่น นิวเคลียส >10 ไมโครเมตร หรือนิวคลีโอลี (nucleoli) ≥ 2/3 ของเส้นผ่านศูนย์กลางเม็ดเลือดแดง หรือ >5 ไมโครเมตร |
| Multi | -nucleation | มี 2, 3 นิวเคลียส (bi-, tri-nucleated) หรือ >3 นิวเคลียส |
| -nucleoliosis | มีนิวคลีโอลี >5 อันในหนึ่งนิวเคลียส | |
| Megalo | -cytosis/-karyosis/-nucleoliosis | ขนาดใหญ่ผิดปกติ; มีพื้นที่ > 5 เท่าของขนาดปกติ |
| Pleo | -morphism | มีหลายรูปร่าง: นิวเคลียสเว้าแหว่ง, ขดงอ หรือยืดออก (indented, convoluted or elongated nuclei); N/C แปรผันได้ > 2 |
| Xeno | -cytosis/karyosis/nucleoliosis | นิวคลีโอลีมีลักษณะแปลก, ไม่ปกติ (เช่น เป็นเหลี่ยมหรือเป็นรูปกระสวย (angular or fusiform nucleoli)); การแบ่งเซลล์ผิดรูป (asymmetric mitotic figures) |
การตรวจด้วยกล้องจุลทรรศน์แบบใช้แสง (light microscopy examination) ควรทำโดยใช้กล้องจุลทรรศน์ชนิดสามตา (trinocular microscope) ที่ติดตั้งกล้องดิจิทัลเชื่อมต่อกับคอมพิวเตอร์เพื่อจับภาพให้ได้หลายภาพ อีกทางเลือกหนึ่งคือสามารถใช้กล้องโทรศัพท์มือถือร่วมกับฟังก์ชันซูมเพื่อถ่ายภาพเซลล์ระยะใกล้ได้ (รูปภาพที่ 3) ภาพถ่ายจากกล้องจุลทรรศน์ (photomicrographs) ควรได้รับการปรับแต่งดิจิทัลโดยการปรับความสว่าง คอนทราสต์ และสมดุลสีขาวของพื้นหลัง ซึ่งจะช่วยกำจัดพื้นหลังสีเหลืองที่บิดเบือนภาพออกไป ภาพควรถูกครอบตัดเพื่อเน้นลักษณะการวินิจฉัยที่เกี่ยวข้อง ทั้งนี้มีซอฟต์แวร์ประมวลผลภาพฟรีหลายชนิดที่ช่วยให้สามารถสร้างภาพปะติด (collages) โดยอัตโนมัติจากภาพที่ปรับแต่งแล้ว 4-16 ภาพที่มีลักษณะการวินิจฉัยที่แตกต่างกัน เพื่อให้ได้ภาพที่เป็นตัวแทนของสเมียร์ที่ครอบคลุมและแม่นยำยิ่งขึ้น และช่วยอำนวยความสะดวกในการวินิจฉัย (รูปภาพที่ 4) ภาพปะติดเพื่อการวินิจฉัยสามารถถ่ายโอนแบบดิจิทัลไปยังรายงานในรูปแบบไฟล์ jpeg แชร์แบบสดในโปรแกรมการประชุมแบบเรียลไทม์ หรือจัดเก็บไว้เพื่อการเปรียบเทียบหรือการศึกษาในอนาคต
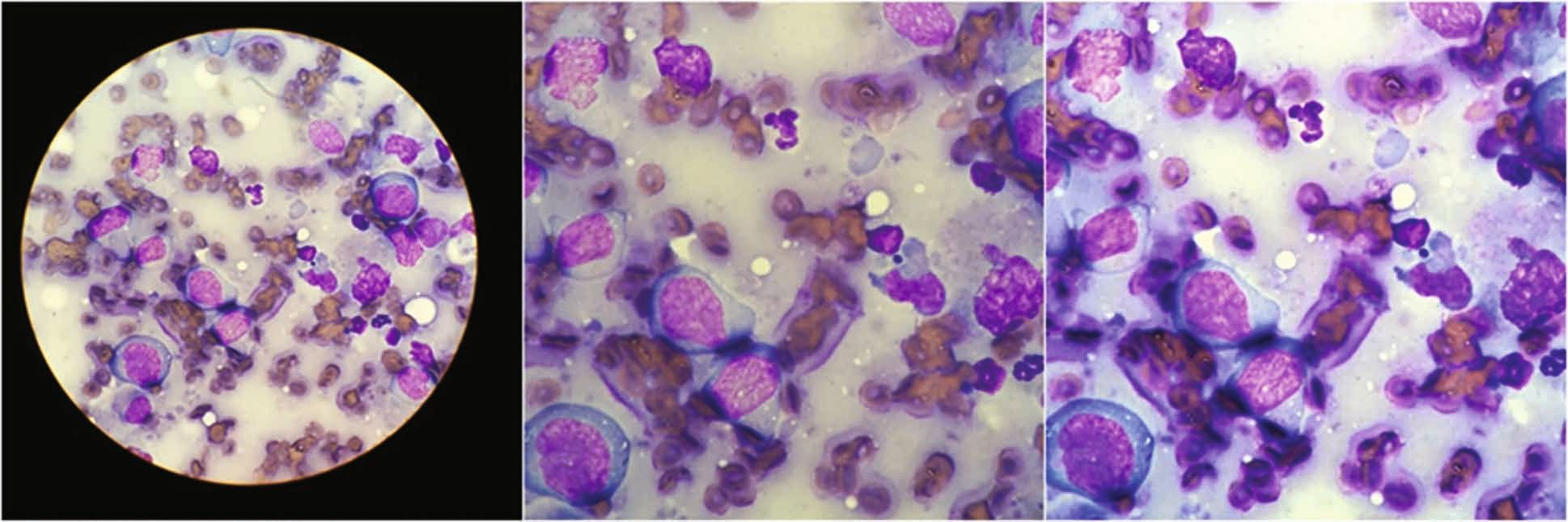
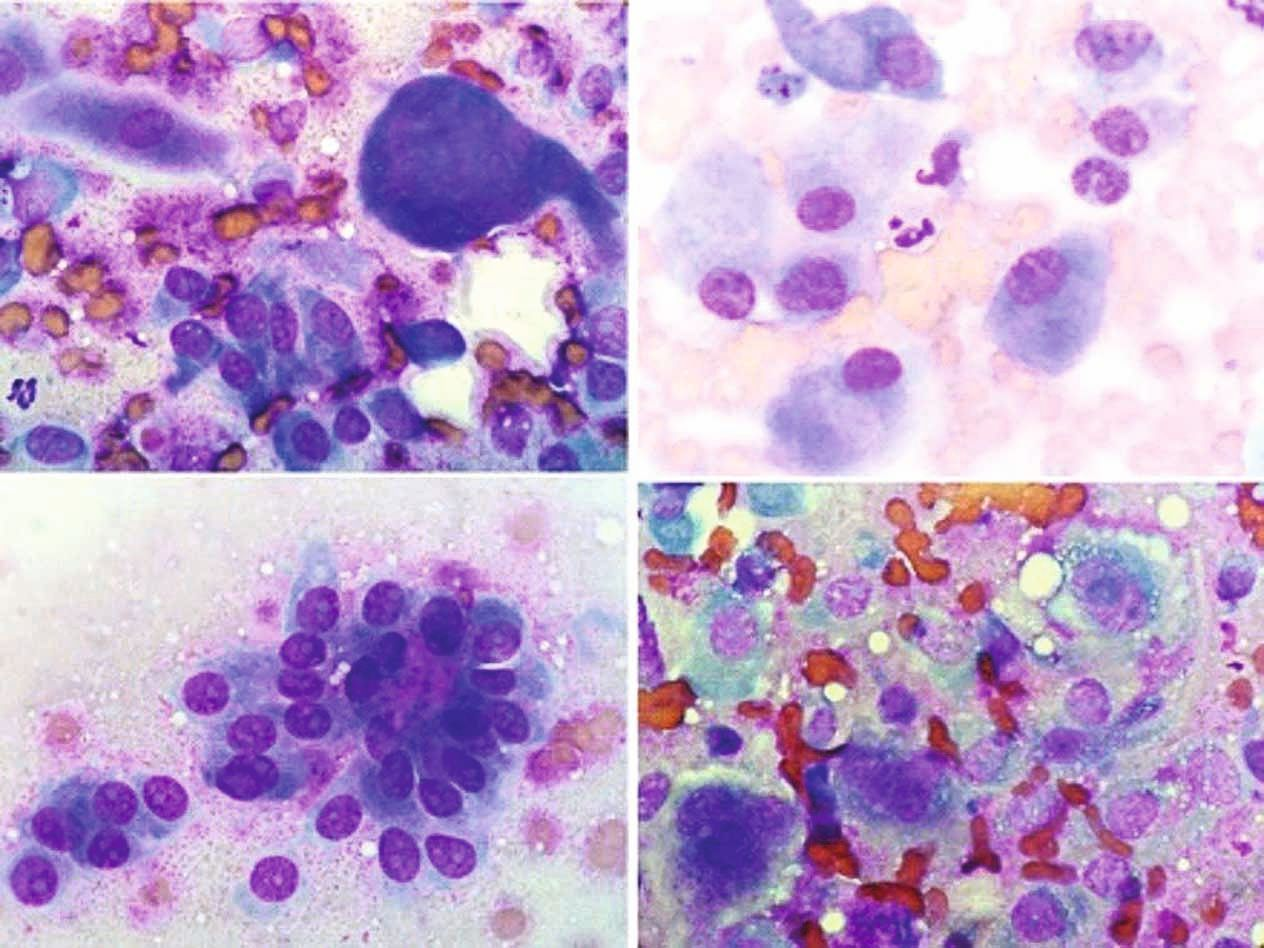
การตรวจเซลล์วิทยาเริ่มต้นด้วยการตรวจด้วยตาเปล่า (gross examination) เพื่อประเมินเบื้องต้นว่ามีจำนวนเซลล์เพียงพอหรือมากเกินไปหรือไม่ มีการปนเปื้อนเลือด/ไขมันหรือไม่ มีโครงสร้างที่มองเห็นได้ด้วยตาเปล่า (เช่น กลุ่มเซลล์ (cell clumps) หรือตัวอ่อน (larvae)) หรือไม่ และมีสิ่งแปลกปลอมจากการป้าย/การทำให้แห้งที่ชัดเจนหรือไม่ จากนั้นจึงทำการตรวจด้วยกล้องจุลทรรศน์โดยตรง (direct microscopy) ในระดับกำลังขยาย 3 ระดับในกระบวนการที่เป็นขั้นเป็นตอนและทำซ้ำไปมา:
I) กำลังขยายประมาณ 10-20 เท่า เพื่อสแกนหาโครงสร้างขนาดใหญ่ได้อย่างครอบคลุม รวบรวมข้อมูลการจัดเรียงตัวของเซลล์ (architectural information) และระบุบริเวณที่มีความสำคัญต่อการวินิจฉัยมากที่สุด
II) กำลังขยายประมาณ 40-60 เท่า เพื่อปรับปรุงและแก้ไขรายละเอียดให้ชัดเจนยิ่งขึ้น
III) กำลังขยาย 100 เท่า โดยใช้น้ำมัน (oil immersion) สำหรับรายละเอียดระดับเซลล์/ใต้เซลล์เชิงลึก (in-depth cellular/sub-cellular detail)
เซลล์วิทยาและเนื้องอก (Cytology and Neoplasia)
การทบทวนตัวอย่างที่ส่งมายังห้องปฏิบัติการของมหาวิทยาลัยของผู้เขียนได้ให้สถิติที่น่าสนใจและแสดงให้เห็นถึงประโยชน์ของเซลล์วิทยาในการตรวจสอบเนื้องอกที่อาจเป็นไปได้ ประมาณร้อยละ 95 ของ 7,560 กรณี (ซึ่งร้อยละ 62 เป็นการส่งภายในและร้อยละ 38 มาจากคลินิกภายนอก) มาจากสุนัข โดยรวมแล้วร้อยละ 14 ของตัวอย่างไม่สามารถวินิจฉัยได้เนื่องจากมีการเก็บเซลล์ที่สมบูรณ์ได้ไม่เพียงพอ (กล่องข้อความที่ 2) และร้อยละ 19 ของกรณีที่มีสไลด์ที่สามารถอ่านได้เป็นเนื้องอก (ร้อยละ 64 เป็นชนิดร้ายแรง) ที่เหลือส่วนใหญ่เป็นการอักเสบ
ในการจัดหมวดหมู่เนื้องอกทางเซลล์วิทยา 3 ประเภท พบว่า เนื้องอกเมเซนไคม์ (mesenchymal tumors) มีอุบัติการณ์โดยรวมสูงสุด (ร้อยละ 42) โดยในจำนวนนี้ร้อยละ 98 เป็นของสุนัข และร้อยละ 2 เป็นของแมว ตามมาด้วยเนื้องอกเซลล์กลม (round cell tumors) (ร้อยละ 32) เป็นของสุนัขร้อยละ 88 และของแมวร้อยละ 12 และสุดท้ายคือเนื้องอกเยื่อบุผิว (epithelial tumors) (ร้อยละ 26) โดยเป็นของสุนัขร้อยละ 93 และของแมวร้อยละ 7 สำหรับมะเร็งในสุนัข พบว่าเป็นมะเร็งต่อมน้ำเหลือง (lymphomas) ร้อยละ 30 มะเร็งคาร์ซิโนมา (carcinomas) ร้อยละ 27 มะเร็งซาร์โคมา (sarcomas) ร้อยละ 26 เนื้องอกมาสต์เซลล์ (mast cell tumors) ร้อยละ 13 และเนื้องอกนิวโรเอนโดครีน (neuroendocrine tumors) ร้อยละ 4 ส่วนเนื้องอกชนิดไม่รุนแรง (benign tumors) ในสุนัข พบว่าเป็นเนื้องอกไขมัน (lipoma) ร้อยละ 65 อะดีโนมา (adenomas) ร้อยละ 16 ฮิสติโอไซโตมา (histiocytomas) ร้อยละ 7 และฮีแมงจิโอเพอริไซโตมา (hemangiopericytomas) ร้อยละ 5 ในทางกลับกันพบเนื้องอกชนิดไม่รุนแรงในแมวจำนวนน้อยเกินไปที่จะนำมาประเมินได้ แต่มีมะเร็งในแมวรวมทั้งสิ้น 75 ราย โดยเป็นมะเร็งต่อมน้ำเหลือง ร้อยละ 52 มะเร็งคาร์ซิโนมา ร้อยละ 30 มะเร็งซาร์โคมา ร้อยละ 9 เนื้องอกมาสต์เซลล์ ร้อยละ 4 และเนื้องอกพลาสมาเซลล์ (plasma cell tumors) ร้อยละ 3
เนื้องอกห้าอันดับแรกคิดเป็นร้อยละ 84 ของเนื้องอกทั้งหมดที่วินิจฉัยได้ในประชากรสุนัข และร้อยละ 98 ในแมว โดยเนื้องอกไขมันหรือ lipoma เป็นเนื้องอกที่ถูกวินิจฉัยทางเซลล์วิทยาบ่อยที่สุดในสุนัข โดยถูกวินิจฉัยได้บ่อยกว่าในคลินิกภายนอกถึงสองเท่า แต่พบน้อยมากในแมว (n=1) เนื้องอกมาสต์เซลล์พบในสุนัขบ่อยกว่าในแมวสองเท่า (ร้อยละ 8 เทียบกับร้อยละ 4) ส่วนมะเร็งต่อมน้ำเหลืองนั้นเป็นเนื้องอกที่พบบ่อยที่สุดในแมว วินิจฉัยในแมวได้บ่อยกว่าในสุนัขถึงสองเท่า เนื้องอกมากกว่าหนึ่งในสามเป็นซาร์โคมา (sarcomas) และคาร์ซิโนมา (carcinomas) และถูกวินิจฉัยได้บ่อยกว่าในตัวอย่างจากคลินิกเฉพาะทางของเราถึงสามเท่า โดยสามารถดูคำอธิบายของเนื้องอกที่พบบ่อยที่สุดได้โดยคลิกที่ลิงก์นี้
สำหรับผลการตรวจทางเซลล์วิทยาส่วนใหญ่ ทักษะและความรู้ที่จำเป็นสำหรับการเก็บและเตรียมตัวอย่าง ตลอดจนการประเมินด้วยกล้องจุลทรรศน์นั้นถือเป็นพื้นฐานสำหรับสัตวแพทย์
เกณฑ์การวินิจฉัยเนื้องอกร้าย
การวินิจฉัยเนื้องอกร้าย (มะเร็ง) มีความสำคัญอย่างยิ่งในทางเซลล์วิทยา เนื้องอกร้ายส่วนใหญ่สามารถวินิจฉัยได้อย่างมีประสิทธิภาพโดยการพบเกณฑ์ที่ระบุไว้อย่างน้อย 3 ข้อในเซลล์ที่มีจำนวนมากพอ (กล่องข้อความที่ 5) เนื้องอกที่ไม่ร้ายแรงมีลักษณะเด่นคือเซลล์จะมีรูปร่างคล้ายคลึงกัน แต่ในทางตรงกันข้าม เซลล์มะเร็งจะมีลักษณะเฉพาะคือมีความหลากหลายอย่างมากทั้งในรูปร่างและขนาดของเซลล์ นิวเคลียส และนิวคลีโอลี ลักษณะเหล่านี้มักถูกอธิบายด้วยคำที่ใช้คำนำหน้าภาษากรีก (Greek prefixes) เช่น pleo, aniso, macro, xeno, hyper) และการจดจำเกณฑ์เหล่านี้จะเป็นประโยชน์อย่างมาก
สัตวแพทย์สามารถเรียนรู้การวินิจฉัยผลการตรวจทางเซลล์วิทยาที่พบบ่อยที่สุดได้อย่างรวดเร็วและส่งต่อกรณีที่มีความซับซ้อนกว่าให้ผู้เชี่ยวชาญดำเนินการต่อไป
การจำแนกประเภทเนื้องอก
เนื้องอกร้ายในทางเซลล์วิทยาแบ่งออกเป็นสามกลุ่มตามต้นกำเนิด (origin) และสัณฐานวิทยา (morphology) ได้แก่:
- เนื้องอกเมเซนไคม์ (Mesenchymal tumor) (หากเป็นชนิดร้ายจะเรียกว่า sarcomas) ตัวอย่างมักมีจำนวนเซลล์น้อยถึงปานกลาง โดยพบเซลล์เดี่ยวๆ หรือรวมกลุ่มกันหลวมๆ มีขอบเซลล์ที่ไม่ชัดเจน และบางครั้งอาจเกี่ยวข้องกับเมทริกซ์นอกเซลล์สีชมพู (pink, extracellular matrix) เซลล์แต่ละเซลล์มีลักษณะเป็นรูปกระสวย มีนิวเคลียสรูปไข่ที่ยืดออกเล็กน้อย และมีไซโตพลาสซึมติดสีน้ำเงินม่วงอ่อนๆ (pale-basophilic cytoplasm) จำนวนมาก โดยมักปรากฏเป็นการขยายแบบขั้วเดียว/สองขั้ว (uni-/bipolar extension) บางครั้งอาจพบลักษณะเม็ดละเอียดสีแดงในไซโตพลาสซึมคล้ายจุดเล็กๆ (cytoplasmic granulation)
- เนื้องอกเยื่อบุผิว (Epithelial tumors) (หากเป็นชนิดร้ายจะเรียกว่า carcinomas) มักมีเซลล์รูปกลมถึงเหลี่ยม (round to polygonal cells) มีนิวเคลียสกลม และมีไซโตพลาสซึมติดสีน้ำเงินม่วง (basophilic cytoplasm) จำนวนมาก เซลล์มักจะหลุดลอกออกมาเป็นกลุ่ม ขอบเซลล์จะเห็นได้ชัดเจนกว่าในซาร์โคมาแต่ชัดเจนน้อยกว่าในเนื้องอกเซลล์กลม
- เนื้องอกเซลล์กลมชนิดแยกตัว (Discrete round cell tumors) มีการหลุดลอกของเซลล์สูง ดังนั้นการเก็บตัวอย่างมักจะได้เซลล์เดี่ยวๆ จำนวนมาก บางครั้งเซลล์เหล่านี้อาจรวมตัวกันเป็นกลุ่มขนาดใหญ่หลายชั้น (multi-layered clusters) โดยมีรายละเอียดของเซลล์น้อยหรือไม่ปรากฏเลย เซลล์กลมส่วนใหญ่มีแนวโน้มที่จะแตกได้ง่าย ดังนั้นจึงต้องระมัดระวังเป็นพิเศษในระหว่างการเตรียมตัวอย่าง
สรุป
การเก็บและเตรียมตัวอย่าง ตลอดจนการประเมินด้วยกล้องจุลทรรศน์ ล้วนแต่เป็นทักษะพื้นฐานที่สามารถนำมาประยุกต์ใช้ในคลินิกได้อย่างง่ายดาย ปัจจุบันเซลล์วิทยากำลังมีบทบาทสำคัญมากขึ้นเรื่อยๆในการวินิจฉัยโรคในสัตว์เล็ก และรอยโรคอักเสบเป็นสิ่งที่ระบุได้ง่ายที่สุดเนื่องจากส่วนใหญ่พิจารณาจากการจำแนกชนิดของเซลล์เม็ดเลือด แต่เนื้องอกก็มักมีลักษณะเฉพาะที่สามารถช่วยในการวินิจฉัยได้ในหลายกรณี ทั้งนี้สัตวแพทย์สามารถเรียนรู้การวินิจฉัยผลการตรวจทางเซลล์วิทยาที่พบบ่อยที่สุดได้อย่างรวดเร็วและส่งต่อกรณีที่มีความซับซ้อนกว่าให้ผู้เชี่ยวชาญดำเนินการต่อไปได้
เอกสารอ่านเพิ่มเติม
- O’Brien PJ, Lumsden JH. The cytological examination of body cavity fluids. Sem. Vet. Med. Surg. Small Anim. 1988;3:140-156.
- Metcalfe LVA, O’Brien PJ, Papakonstantinou S, et al. Malignant melanoma in a grey horse: case presentation and review of equine melanoma treatment options. Ir. Vet. J. 2013;66:22-26.
- Papakonstantinou S, O’Brien PJ. High content imaging for the morphometric diagnosis and immunophenotypic prognosis of canine lymphomas. Cytometry: Part B – Clinical Cytometry Doi: 10.1002/cytob.21170; 2014.
- Domingos M, Davies AM, O’Brien PJ. Application of high content analysis in clinical cytology for translational safety biomarkers of drug-induced toxicity for lymphoma chemotherapy. Basic Clin. Pharmacol. Toxicol. 2014;115:145-153.
- Balan M, O’Brien PJ, McCullough M. Marked paraneoplastic basophilia accompanying eosinophilia in a cat with alimentary T-cell lymphoma. J. Feline Med. Surg. Open Reports 2017;3(2):1-6.
- Balda IO, O’Brien PJ, Mullins RA, et al. Intraoperative impression smear cytology to guide successful treatment of a large renal cyst in a dog: a case report. J. Vet. Sci. 2022;23(2):e34.
- Martínez-Caro J, O’Brien PJ. Novel, diagnostic, cytomorphometric profile of canine, classical haemangiopericytoma: including nuclear criteria of malignancy. Comp. Clin. Pathol. 2023;32(2):299-310.
Peter J. O’Brien
BSc, DVM, MS, PhD, DVSc, Dip. ACVP (ClinPath), Dip. ECVCP, FRCPath. Pathobiology Department, School of Veterinary Medicine, University College Dublin, Ireland
Dr. O’Brien gained his DVM from Saskatoon, Canada before studying for his MS and PhD in Minnesota, USA. He then had seven years at Guelph Veterinary College in the Department of Veterinary Clinical Pathology before moving into the pharmaceutical sector. He returned to academia in 2006, working as the staff clinical pathologist at the Veterinary Teaching Hospital in Dublin. Author of more than 150 scientific papers, he has served as President for the European Society of Veterinary Clinical Pathology, the European College of Veterinary Clinical Pathology, and the European Board of Veterinary Specialisation.
Maria Balan
DVM, MVB, MSc, PgDip, Pathobiology Department, School of Veterinary Medicine, University College
Dr. Balan is currently a resident in Veterinary Clinical Pathology at University College Dublin, having worked as a veterinary clinical pathologist with over five years’ experience in both diagnostic and research laboratories. Part of a multi-disciplinary team, she is primarily involved in assessing, monitoring, and evaluating information from clinical and laboratory data, literature review and competent authorities, but also has extensive under- and post-graduate teaching experience.
Other articles in this issue
แบ่งปันบนโซเชียลมีเดีย