การประเมินการทำงานของตับทางห้องปฏิบัติการ
Written by Erica Behling-Kelly
ตับเป็นอวัยวะที่ซับซ้อน และตัวบ่งชี้ทางชีวภาพ (biomarkers) ที่เราใช้ในการประเมินการทำงานของตับนั้นก็มีความซ้อนทับกันในแง่ของคุณค่าการทำนาย (predictive value) และประโยชน์ทางคลินิก
Article
ประเด็นสำคัญ
อาการแสดงทางคลินิกที่เห็นได้ชัดของโรคตับ (hepatic disease) ที่อาจเกิดขึ้นได้คือภาวะดีซ่าน (icterus) แต่อย่างไรก็ตามสัตวแพทย์ควรตระหนักว่าโรคตับที่รุนแรงอาจเกิดขึ้นได้โดยที่สัตว์ไม่แสดงภาวะดีซ่าน
อัลบูมิน กลูโคส คอเลสเตอรอล และยูเรีย สามารถใช้ร่วมกันเพื่อบ่งชี้ความสามารถของตับในการมีส่วนร่วมในกระบวนการเมตาบอลิซึมระดับกลาง (intermediary metabolism)
การวัดระดับความเข้มข้นของแอมโมเนียในเลือด (serum ammonia concentration) เป็นการทดสอบที่มีความไวและจำเพาะสูงในการประเมินมวลเซลล์ตับ (hepatocellular mass) และการไหลเวียนของเลือดไปยังตับ
การตรวจปัสสาวะ (urinalysis) ควรเป็นส่วนหนึ่งที่สำคัญของการตรวจทางห้องปฏิบัติการเมื่อสงสัยโรคตับ
บทนำ
การประเมินตับในห้องปฏิบัติการต้องมีข้อมูลพื้นฐานอย่างน้อยที่สุด ได้แก่ การตรวจนับเม็ดเลือดครบส่วน (complete blood count; CBC), ค่าทางชีวเคมี (biochemical profile), และการตรวจปัสสาวะ (urinalysis) โดยค่าชีวเคมีส่วนใหญ่จะใช้ในการตรวจสุขภาพและหน้าที่ของตับโดยตรง แต่ไม่สามารถแยกพยาธิสภาพของตับที่เป็นปฐมภูมิออกจากทุติยภูมิได้โดยลำพัง การแยกความแตกต่างนี้ต้องอาศัยการวิเคราะห์ข้อมูลทั้งหมดที่มีและในบางกรณีก็อาจยังไม่สามารถระบุได้ชัดเจน เช่น สุนัขที่เป็นภาวะเม็ดเลือดแดงแตกจากภูมิคุ้มกัน (immune-mediated hemolytic anemia; IMHA) ซึ่งมักจะแสดงค่าทางชีวเคมีที่บ่งชี้ถึงการบาดเจ็บของเซลล์ตับ (hepatocellular injury) และภาวะท่อน้ำดีอุดตัน (cholestasis) ซึ่งเป็นผลมาจากภาวะขาดออกซิเจน (hypoxia) และไซโตไคน์ที่ก่อให้เกิดการอักเสบ (inflammatory cytokines) ส่งผลต่อการทำงานของตับ 1,2,3,4 การตรวจ CBC จึงมีจำเป็นอย่างยิ่งในการช่วยบ่งชี้โรคทางโลหิตวิทยาปฐมภูมิ (primary hematological disease) และสนับสนุนข้อสรุปว่าพยาธิสภาพของตับเป็นกระบวนการทุติยภูมิ (secondary process)
ตัวบ่งชี้ทางชีวภาพในซีรั่ม (serum biomarkers) ที่ใช้ในการประเมินตับทางคลินิกนั้นสะท้อนถึงหน้าที่หลักของตับ โดยระดับความเข้มข้นของอัลบูมิน (albumin concentration) จะใช้ในการประเมินการสังเคราะห์โปรตีน (protein synthesis) ในขณะที่ระดับกลูโคสและคอเลสเตอรอลจะบ่งชี้บทบาทของตับในกระบวนการเมตาบอลิซึมระดับกลาง นอกจากนี้กรดน้ำดี (bile acids) และคอเลสเตอรอลยังเป็นดัชนีที่บ่งชี้ถึงความโล่งของทางเดินน้ำดี (biliary tract patency) และการไหลเวียนของสารในลำไส้และตับ (enterohepatic recirculation) ส่วนการที่ตับดูดซึม (uptakes) เปลี่ยนแปลงคุณสมบัติทางเคมี (conjugates) และขับบิลิรูบินออก (excretes) นั้นล้วนเป็นผลมาจากการสลายฮีโมโกลบิน (hemoglobin) โดยเซลล์ฟาโกไซต์ (phagocytes) ท้ายที่สุดคือการล้างพิษ (detoxification) ของสารพิษและยาโดยตับนั้นอาจไม่ปรากฏการเปลี่ยนแปลงของค่าชีวเคมีหรืออาจสะท้อนให้เห็นผ่านการเปลี่ยนแปลงของเอนไซม์ในซีรั่มบางชนิดโดยเฉพาะ
ข้อมูลทางห้องปฏิบัติการจากฐานข้อมูลจะถูกรวบรวมและวิเคราะห์เพื่อช่วยในการตรวจจับกระบวนการทางพยาธิวิทยาหลักทั้งสี่ประการในตับ ได้แก่ การบาดเจ็บของเซลล์ตับ (hepatocellular injury), ภาวะท่อน้ำดีอุดตัน (cholestasis), การทำงานที่ผิดปกติของเซลล์ตับ/ภาวะตับวาย (hepatocellular dysfunction/insufficiency) และการเปลี่ยนแปลงในการไหลเวียนเลือดของระบบเลือดพอร์ทัลของตับ (hepatic portal circulation) กระบวนการเหล่านี้มักเกิดขึ้นพร้อมกันหรือเป็นผลสืบเนื่องกัน อย่างไรก็ตามมีความเป็นไปได้ที่พยาธิสภาพหลายอย่างจะมีผลตรงกันข้ามกับสารวิเคราะห์เฉพาะ (specific analytes) บางชนิด ซึ่งจะลดความไวในการวินิจฉัยพยาธิสภาพของตับได้ เช่น ระดับคอเลสเตอรอลอาจอยู่ในช่วงปกติในสุนัขที่มีภาวะตับแข็งรุนแรง (severely cirrhotic liver) เนื่องจากภาวะท่อน้ำดีอุดตันจากโครงสร้างไปหักล้างกับการสังเคราะห์คอเลสเตอรอลที่ลดลงอันเป็นผลมาจากมวลตับที่ลดลง (กล่าวคือเซลล์ตับไม่เพียงพอที่จะกำจัดกรดน้ำดี) การเข้าถึงปัญหาโดยเน้นที่กระบวนการ (process-centric approach) จะช่วยให้สามารถเลือกการทดสอบวินิจฉัย (diagnostic tests) ได้อย่างตรงจุดและสร้างรายการการวินิจฉัยแยกโรคที่ชัดเจนได้มากยิ่งขึ้น
ผลตรวจทางชีวเคมีแต่ละชุดเป็นเพียงภาพสะท้อนในช่วงเวลาหนึ่งเท่านั้น สัตวแพทย์จะต้องพิจารณาถึงค่าครึ่งชีวิต (half-lives) ของเอนไซม์เมื่อประเมินนัยสำคัญทางคลินิกของการเปลี่ยนแปลงเมื่อเวลาผ่านไป
การตรวจหาการบาดเจ็บของตับ
การบาดเจ็บ (injury) เป็นคำที่ค่อนข้างคลุมเครือแต่ใช้กันทั่วไปเพื่อสะท้อนถึงอันตรายที่ส่งผลให้เกิดความเสียหายต่อเยื่อหุ้มเซลล์ตับ (hepatocellular membrane) และสันนิษฐานว่ามีการสลายตัว (cellular lysis) และการตายของเซลล์ในระดับหนึ่ง ตับอาจได้รับบาดเจ็บโดยตรงจากภาวะอักเสบของเนื้อเยื่อ (parenchymal inflammation) (ตับอักเสบปฐมภูมิหรือ primary hepatitis), สารพิษ (ยาและพืช), เนื้องอก (ปฐมภูมิหรือการแพร่กระจาย) หรือเป็นผลสืบเนื่องมาจากโรคทางระบบร่างกาย (systemic disease) ที่มีผลต่อการไหลเวียนของเลือด, การขนส่งออกซิเจน หรือภาวะต่อมไร้ท่อผิดปกติ (endocrinopathy) โดยไม่ว่าสาเหตุจะเป็นอะไร ก็มีเพียงตัวบ่งชี้ทางชีวเคมีไม่กี่ตัวที่เราสามารถใช้ระบุการบาดเจ็บชนิดนี้ได้
เอนไซม์ "รั่วไหล" จากตับ
เอนไซม์ในซีรั่ม (serum enzymes) ที่ใช้ในการประเมินตับจะถูกแบ่งออกเป็นสองประเภทหลัก กลุ่มแรกคือเอนไซม์ที่อยู่ในไซโตซอลของเซลล์ตับ (cytosol of the hepatocytes) และเรียกกันทั่วไปว่า เอนไซม์รั่วไหล (leakage enzymes) ซึ่งในสุนัขและแมว เอนไซม์เหล่านี้ได้แก่ อะลานีนอะมิโนทรานสเฟอเรส (alanine aminotransferase; ALT) และ แอสพาร์เทตอะมิโนทรานสเฟอเรส (aspartate aminotransferase; AST) การเพิ่มขึ้นของระดับเอนไซม์เหล่านี้ในซีรั่มมีความจำเพาะต่อการบาดเจ็บของเซลล์ตับ แต่จะใช่ก็ต่อเมื่อตัดสาเหตุอื่นๆออกไปแล้ว เช่น ภาวะเม็ดเลือดแดงแตก (hemolysis) และการบาดเจ็บของกล้ามเนื้ออย่างรุนแรง (severe muscle injury) (เนื่องจาก AST มีอยู่ในเนื้อเยื่อกล้ามเนื้อมากกว่าตับ) 5,6 เนื่องจากตับมีเซลล์สำรอง (cellular reserve) จำนวนมากและมีความสามารถในการฟื้นตัว (regeneration) ปริมาณของการเพิ่มขึ้นของเอนไซม์เหล่านี้จึงเป็นสัดส่วนกับจำนวนเซลล์ตับที่เสียหายแต่ไม่ได้สะท้อนถึงการกลับคืนสู่สภาพปกติของการบาดเจ็บหรือบ่งบอกถึงการทำงานในการสังเคราะห์ของตับแต่อย่างใด 5,7 เพราะฉะนั้นการติดตามค่าเหล่านี้อย่างต่อเนื่องจึงมีความสำคัญอย่างยิ่ง: ALT มีค่าครึ่งชีวิต 2-3 วันในสุนัข และเพียง 3-4 ชั่วโมงในแมว ในขณะที่ค่าครึ่งชีวิตของ AST น้อยกว่าหนึ่งวันในสุนัข 5,8 ผลตรวจค่าทางชีวเคมีแต่ละชุดเป็นเพียงภาพสะท้อนในช่วงเวลาหนึ่ง ดังนั้นจึงต้องพิจารณาค่าครึ่งชีวิตของเอนไซม์เมื่อประเมินนัยสำคัญทางคลินิกของการเปลี่ยนแปลงเมื่อเวลาผ่านไป สิ่งสำคัญที่ควรจำคือตับที่เป็นพังผืดขนาดเล็ก (small fibrotic liver) ซึ่งได้รับผลกระทบจากโรคเรื้อรังเป็นเวลานาน (long-term disease) อาจเหลือเซลล์ตับที่ยังมีชีวิตรอดอยู่ไม่กี่เซลล์ที่จะปล่อยเอนไซม์ออกมา ดังนั้นระดับ ALT และ AST ในซีรั่มจึงอาจเพิ่มขึ้นเพียงเล็กน้อยหรืออยู่ในช่วงปกติได้แม้จะมีพยาธิสภาพขั้นรุนแรงก็ตาม โดยทั่วไปแล้วความผิดปกติที่เกิดจากการอักเสบหรือการตายของเซลล์ (necrotizing disorders) มักเกี่ยวข้องกับการเพิ่มขึ้นของเอนไซม์รั่วไหลในปริมาณมากที่สุด
การอักเสบของตับสามารถเกิดขึ้นได้อย่างเงียบๆและไม่แสดงอาการชัดเจน โดยจากการศึกษาในสุนัขพันธุ์ Labrador Retrievers ซึ่งเป็นพันธุ์ลำดับแรกๆของสุนัขที่มีภาวะตับวายที่เกี่ยวข้องกับทองแดง (copper-associated hepatopathy) พบว่าร้อยละ 64 (122 ใน 191 ตัว) ของสุนัขที่ดูแข็งแรงทางคลินิกมีหลักฐานทางจุลพยาธิวิทยาของการแทรกของเซลล์อักเสบ (inflammatory infiltrates) ในเนื้อเยื่อตับ กิจกรรมของเอนไซม์ในซีรั่มกลับมีความไวค่อนข้างต่ำในการตรวจพบทั้งภาวะตับอักเสบเฉียบพลันและเรื้อรัง (acute and chronic hepatitis) ในประชากรสุนัขกลุ่มนี้ 9 ในการศึกษาแยกต่างหาก การประเมินชิ้นเนื้อตับ (hepatic biopsies) 4,559 ตัวอย่างจากสุนัข แสดงให้เห็นว่าร้อยละ 50 ของชิ้นเนื้อมีระดับทองแดงสูงกว่า 400 ppm dry weight (ค่าอ้างอิง 120-400 ppm) และ 19% มีระดับทองแดงสูงกว่า 1000 ppm อีกทั้งในการศึกษาเดียวกันนั้นยังพบว่าภาวะ necroinflammation (คือการตอบสนองทางภูมิคุ้มกันของตับต่อภาวะเซลล์ตาย) สามารถทำนายระดับทองแดงในตับได้ 10 สำหรับการสะสมทองแดงในตับในแมวนั้นยังไม่ได้รับการศึกษาอย่างละเอียดเท่าในสุนัข แต่กำลังปรากฏว่าเป็นสาเหตุหนึ่งของภาวะตับอักเสบในแมว 11 ทั้งนี้ภาวะต่อมไทรอยด์ทำงานเกินในแมว (feline hyperthyroidism) เป็นสาเหตุที่ทราบกันดีว่าทำให้เอนไซม์ ALT เพิ่มขึ้นเล็กน้อยแต่กลไกที่แท้จริงยังไม่เป็นที่แน่ชัด 12 แม้ว่าเอนไซม์ glutamate dehydrogenase (GLDH) และ sorbitol dehydrogenase (SDH) จะเป็นเอนไซม์ที่บ่งชี้ภาวะเซลล์ตับรั่วไหลที่มีประโยชน์ในสัตว์ชนิดอื่น แต่ก็ยังมีงานวิจัยน้อยมากที่ประเมินประโยชน์ในการวินิจฉัยของเอนไซม์เหล่านี้ในแมวเมื่อเทียบกับสุนัข
เอนไซม์ชนิดที่ถูกกระตุ้น
เอนไซม์ชุดที่สองที่ใช้ในการประเมินตับเรียกว่า เอนไซม์ชนิดที่ถูกกระตุ้น (inducible enzymes) ซึ่งรวมถึง อัลคาไลน์ฟอสฟาเตส (alkaline phosphatase; ALP) และ แกมมากลูตามิลทรานสเฟอเรส (gamma glutamyl transferase; GGT) เซลล์ตับจะเพิ่มวิถีการสังเคราะห์โปรตีน (protein synthetic pathways) ที่สร้างเอนไซม์เหล่านี้ตามหลังเหตุการณ์ที่เรียกว่าการกระตุ้น (inductive event) ซึ่งโดยทั่วไปแล้วคือการได้รับยาหรือฮอร์โมน 13 กรดน้ำดี (bile acid) ก็สามารถกระตุ้นเอนไซม์เหล่านี้ได้เช่นกันและยังสามารถละลายเยื่อหุ้มเซลล์ (solubilize cell membranes) ได้ด้วย จึงเป็นเหตุผลที่การเพิ่มขึ้นของ ALP และ GGT มีความสัมพันธ์อย่างมากกับภาวะท่อน้ำดีอุดตัน 14 เซลล์ของท่อระบายน้ำดี (biliary canalicular cells) จะตอบสนองต่อแรงดันที่เพิ่มขึ้นโดยการเพิ่มจำนวน (hyperplasia) ซึ่งทำให้จำนวนเซลล์ที่ผลิต GGT ได้นั้นเพิ่มขึ้น 15 สิ่งนี้มักสะท้อนให้เห็นในการเพิ่มขึ้นของ GGT ที่สูงขึ้นตามสัดส่วนเมื่อมีกระบวนการอุดตันของท่อน้ำดี การเพิ่มขึ้นอย่างต่อเนื่องของ GGT และ ALP สามารถบ่งบอกถึงการฟื้นตัวและการเพิ่มจำนวนของเซลล์ในทางเดินน้ำดี และเช่นเดียวกับการประเมินเอนไซม์รั่วไหล การติดตามผลอย่างต่อเนื่องนั้นถือเป็นสิ่งจำเป็น กระดูกสามารถเป็นแหล่งที่มาของ ALP เพิ่มเติม (additional source) ได้ทั้งในสุนัขและแมว และคอร์ติโคสเตียรอยด์ (corticosteroids) ยังกระตุ้นเอนไซม์นี้ในสุนัข ดังนั้นโรคที่เกี่ยวข้องกับการเพิ่มขึ้นของการสร้างกระดูก (และอายุของสัตว์) รวมถึงการได้รับคอร์ติโคสเตียรอยด์ทั้งจากภายในหรือภายนอกร่างกาย (ในสุนัขเท่านั้น) จะต้องนำมาพิจารณาในการประเมินตับทางห้องปฏิบัติการ 16 นอกจากนี้ ยังพบการเพิ่มขึ้นของ ALP ในภาวะไทรอยด์ทำงานเกินในแมว (feline hyperthyroidism) 17 ในขณะที่การรักษาด้วยฟีโนบาร์บิทัล (phenobarbital) ก็สามารถทำให้ ALT, ALP และ GGT เพิ่มสูงขึ้นในสุนัขได้ 18 หากผลทางห้องปฏิบัติการดูมีความสับสน Levamisole สามารถใช้เพื่อยับยั้งไอโซเอนไซม์ที่ถูกกระตุ้นโดยคอร์ติโคสเตียรอยด์เพื่อช่วยในการวินิจฉัยเพิ่มเติมได้แต่มักไม่ค่อยมีความจำเป็นต้องใช้
เอนไซม์ชนิดที่ถูกกระตุ้นสามารถถูกปล่อยออกมาจากเซลล์ตับที่ยังคงสภาพสมบูรณ์ได้ แต่การสลายตัวของเซลล์ตับก็จะปล่อยเอนไซม์เหล่านี้ออกมาเช่นกัน ในกรณีเช่นนี้ โดยทั่วไปแล้วจะคาดการณ์ได้ว่าจะมีการเพิ่มขึ้นของเอนไซม์รั่วไหลมากกว่า แต่อย่างไรก็ตามเหตุการณ์การกระตุ้นที่เกิดขึ้นก่อนเหตุการณ์การสลายตัวของเซลล์ตับอาจทำให้ภาพรวมของเอนไซม์ในซีรั่มมีความซับซ้อนและเข้าใจได้ยาก
เนื่องจากตับมีเซลล์สำรองจำนวนมากและมีความสามารถในการฟื้นตัว ปริมาณของการเพิ่มขึ้นของเอนไซม์เหล่านี้จึงเป็นสัดส่วนกับจำนวนเซลล์ตับที่เสียหายแต่ไม่ได้สะท้อนถึงการกลับคืนสู่สภาพปกติของการบาดเจ็บหรือบ่งบอกถึงการทำงานในการสังเคราะห์ของตับแต่อย่างใด
ภาวะท่อน้ำดีอุดตัน
ภาวะท่อน้ำดีอุดตัน (Cholestasis) คือการหยุดชะงักหรือการยับยั้งการไหลของน้ำดีซึ่งอาจเกิดขึ้นได้จากการลดลงของการหลั่งน้ำดีจากเซลล์ตับหรือจากการบีบรัดทางโครงสร้างในบริเวณใดก็ได้ตลอดทางเดินน้ำดีตั้งแต่ท่อระบายน้ำดีขนาดเล็กไปจนถึงถุงน้ำดี การขับน้ำดีออกจากเซลล์ตับ ผ่านเซลล์เยื่อบุผิวทางเดินน้ำดีและเข้าสู่ทางเดินอาหารในที่สุดนั้นเป็นกระบวนการที่จำเป็นต้องใช้พลังงานสูง ต้องอาศัยโปรตีนขนส่งแบบแอคทีฟ (active transporters) หลายชนิด และขึ้นอยู่กับความต่างศักย์ออสโมซิส (osmotic gradient) ดังนั้นจึงมีจุดที่อาจเกิดความผิดพลาดได้หลายจุดในกระบวนการนี้ซึ่งส่งผลให้เกิดภาวะท่อน้ำดีอุดตันได้ 14 พยาธิสภาพที่พบได้บ่อยที่สามารถทำให้เกิดภาวะท่อน้ำดีอุดตัน ได้แก่ เซลล์ตับบวม (เช่น ภาวะไขมันสะสมในตับ (hepatic lipidosis)), กระบวนการเนื้องอก, การอักเสบเรื้อรัง (พังผืด (fibrosis)), นิ่วในถุงน้ำดี (choleliths), ปรสิต, ตับอ่อนอักเสบ, ถุงน้ำดีมีเมือกสะสม (gallbladder mucoceles) และสาเหตุของภาวะท่อน้ำดีอุดตันจากการทำงาน (functional cholestasis) เช่น ภาวะขาดออกซิเจนและการยับยั้งการขับน้ำดีที่เกิดจากไซโตไคน์ (cytokine-mediated suppression of excretion) รอยโรคจากการกดทับ (compressive lesions) สามารถเกิดขึ้นได้ทั่วทั้งตับ (เช่น ภาวะไขมันสะสมในตับในแมวที่ทำให้เซลล์บวมและกดทับท่อระบายน้ำดี) หรือเป็นรอยโรคที่มีลักษณะคล้ายก้อน (mass-like lesion) ที่เกี่ยวข้องกับถุงน้ำดีหรือท่อน้ำดีขนาดใหญ่ รอยโรคจากการกดทับมักทำให้เกิดการสะสมของสารอื่นๆที่ต้องอาศัยระบบทางเดินน้ำดีที่เปิดโล่งในการขับออก ดังนั้นรอยโรคท่อน้ำดีอุดตันจากโครงสร้าง (structural cholestatic lesions) จำนวนมากจึงมักแสดงออกด้วยภาวะคอเลสเตอรอลในเลือดสูง (hypercholesterolemia) และภาวะบิลิรูบินในเลือดสูง (hyperbilirubinemia)
ภาวะบิลิรูบินในเลือดสูงและภาวะดีซ่าน
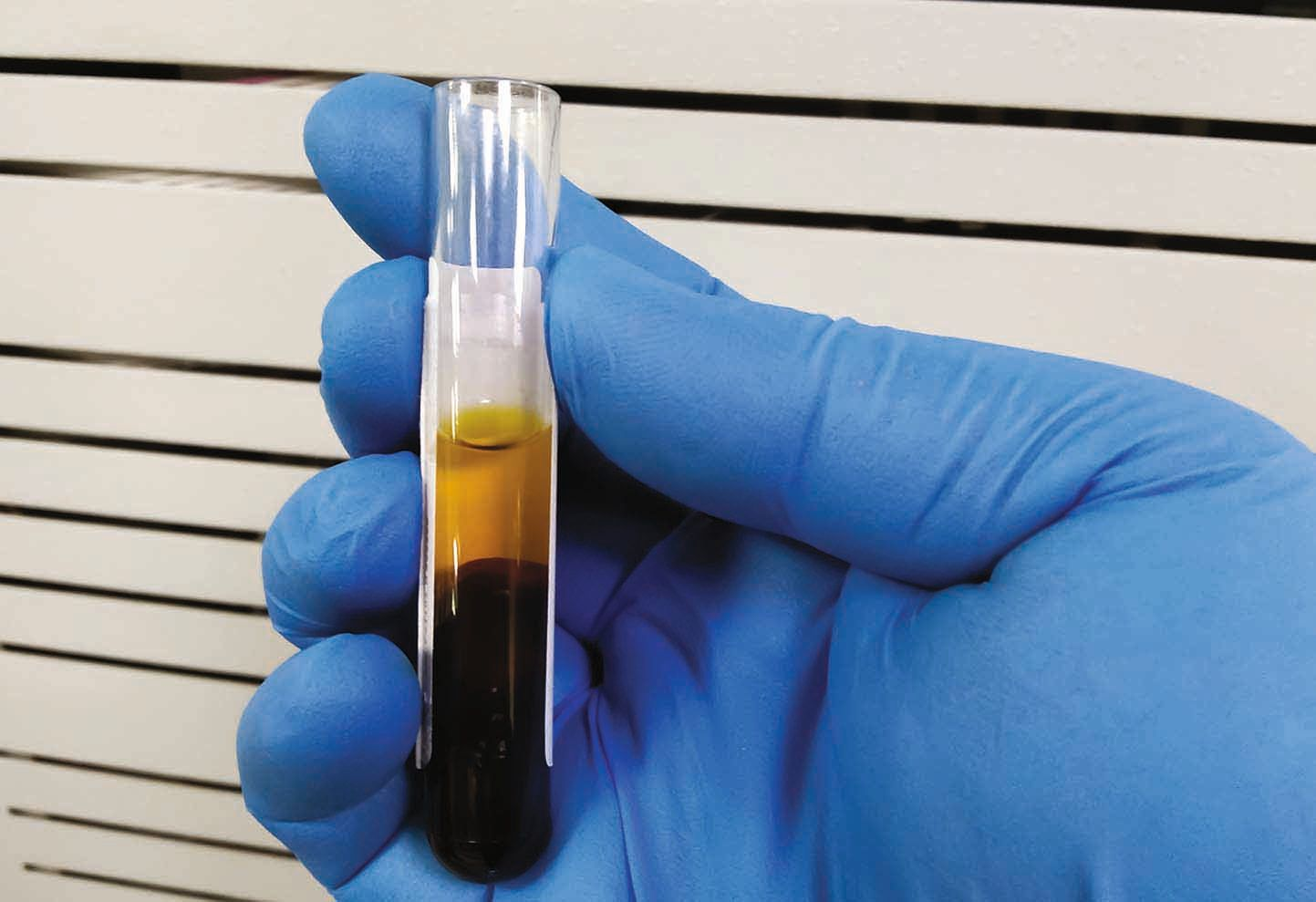
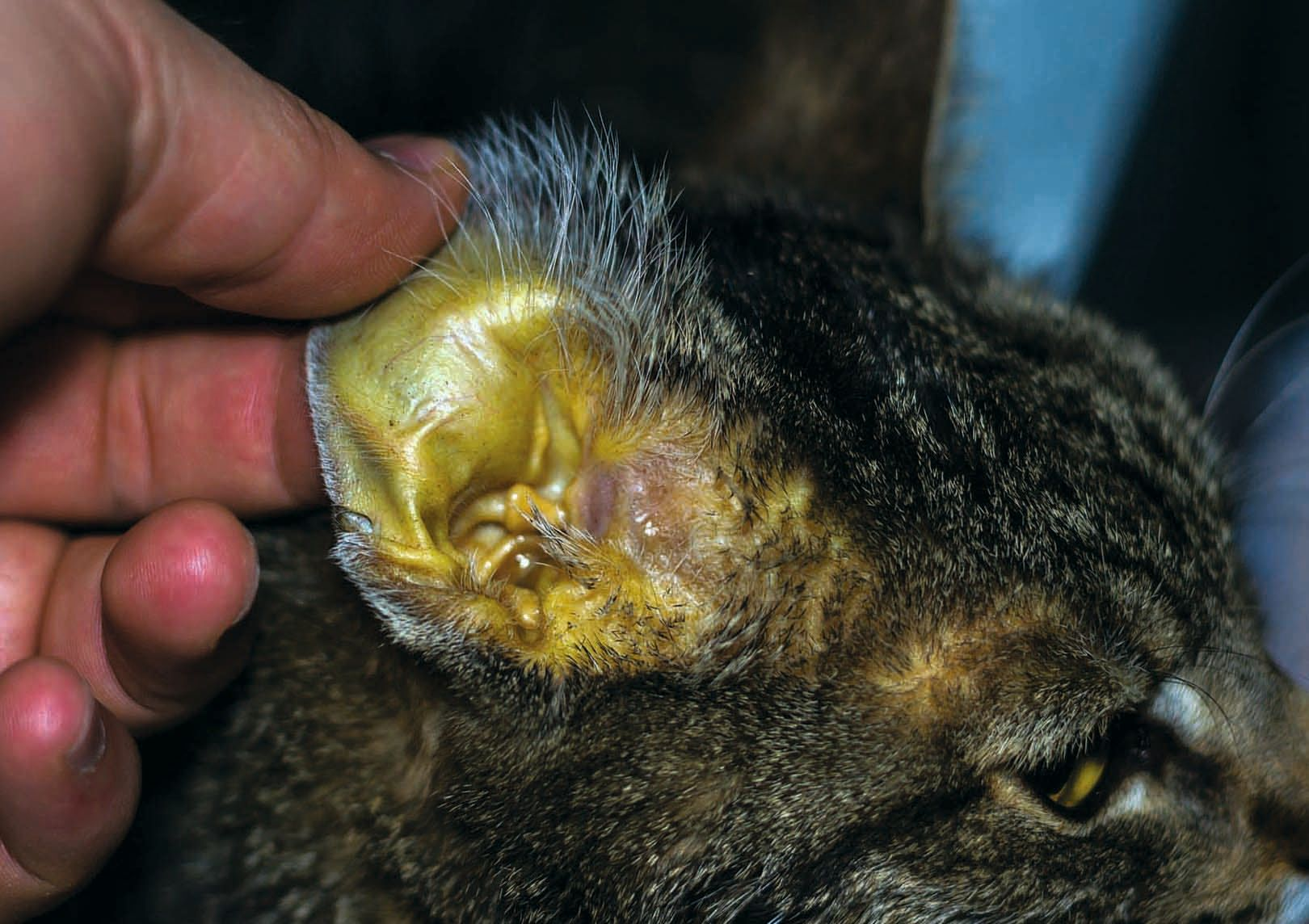
อาการแสดงทางคลินิกที่ชัดเจนของโรคตับที่อาจเกิดขึ้นคือ ภาวะดีซ่าน (icterus) ซึ่งเป็นการที่ผิวหนัง, เยื่อเมือกและตาขาวมีสีเหลืองปรากฏให้เห็นเนื่องจากการสะสมของบิลิรูบิน (รูปภาพที่ 1) ซึ่งเกิดจากภาวะบิลิรูบินในเลือดสูง (hyperbilirubinemia) (รูปภาพที่ 2) โดยทั่วไปแล้วจะมีระดับบิลิรูบินสูงกว่า 2-3 มิลลิกรัม/เดซิลิตร (34-51 ไมโครโมล/ลิตร) สิ่งสำคัญคือต้องตระหนักว่าสัตว์ที่ไม่มีภาวะดีซ่านก็สามารถมีพยาธิสภาพของตับที่รุนแรงได้ บิลิรูบินเกิดขึ้นจากการสลายและนำส่วนประกอบของเม็ดเลือดแดงที่เสื่อมสภาพกลับมาใช้ใหม่ ซึ่งประกอบด้วยสองขั้นตอนหลัก: ขั้นแรก เม็ดเลือดแดงจะถูกกลืนกินโดยมาโครฟาจและถูกย่อยสลาย และโมเลกุลของฮีโมโกลบินจะถูกเปลี่ยนเป็นบิลิรูบินด้วยเอนไซม์ ขั้นตอนนี้มักเกิดขึ้นในมาโครฟาจในม้าม และเกิดขึ้นในเซลล์คุปเฟอร์ (Kupffer cells) (มาโครฟาจที่อยู่ในตับ) ในระดับที่น้อยกว่า ขั้นที่สอง บิลิรูบินที่ไม่ได้ผ่านการเปลี่ยนแปลงคุณสมบัติทางเคมี (unconjugated bilirubin) ซึ่งผลิตโดยมาโครฟาจจะจับกับอัลบูมินแบบไม่ใช้พันธะโควาเลนต์ (non-covalently bound) และถูกส่งไปยังตับซึ่งต่อมาก็จะถูกดูดซึมโดยเซลล์ตับและถูกเปลี่ยนแปลงคุณสมบัติทางเคมีด้วยเอนไซม์เพื่ออำนวยความสะดวกในการขับออกทางน้ำดี ภาวะบิลิรูบินในเลือดสูงสามารถเกิดขึ้นได้เมื่อมีกระบวนการเม็ดเลือดแดงแตก (hemolytic process) หรือ "ภาวะดีซ่านก่อนถึงตับ" (pre-hepatic icterus) การสลายเม็ดเลือดแดงจะเร่งการหมุนเวียนของเม็ดเลือดแดงและการสลายฮีโมโกลบิน ในกรณีเหล่านี้ตับจะทำงานหนักเกินไปและบิลิรูบินที่ไม่ได้ผ่านการเปลี่ยนแปลงคุณสมบัติทางเคมีจะสะสมในเลือด 19ภาวะขาดออกซิเจนในตับซึ่งเป็นผลตามมาจากภาวะโลหิตจางเฉียบพลัน (acute anemia) จะลดพลังงานของเซลล์ตับ (cellular energy) และชะลอการขับบิลิรูบินออก รวมถึงไซโตไคน์ที่ก่อให้เกิดการอักเสบ (inflammatory cytokines) ยังยับยั้งการขับบิลิรูบินออกด้วย ดังนั้นในสัตว์ที่มีภาวะโลหิตจางจากเม็ดเลือดแดงแตก (hemolytic anemia) (ภาวะดีซ่านก่อนถึงตับ) จะมีองค์ประกอบของตับที่ได้รับผลกระทบในภายหลังซึ่งเกิดจากความผิดปกติทางชีวเคมี (biochemical lesions)
ภาวะดีซ่านชนิด "ในตับ" หรือ "หลังตับ" ( “hepatic” or “post hepatic” cases of icterus) นั้นเกิดขึ้นได้จากทั้งรอยโรคทางชีวเคมีภายในเซลล์ (intracellular biochemical lesions) หรือรอยโรคทางโครงสร้าง (structural lesions) ที่ขัดขวางการขับบิลิรูบินเข้าสู่น้ำดีโดยตรง (เช่น ภาวะท่อน้ำดีอุดตัน (cholestasis)) สาเหตุของภาวะดีซ่านในตับและหลังตับมักจะทับซ้อนกัน ในแง่ของการสร้างรายการการวินิจฉัยแยกโรค (differential diagnosis) เมื่อตัดภาวะดีซ่านชนิดก่อนถึงตับออกไปได้แล้ว การดำเนินการต่อไปคือการพิจารณาว่ามีรอยโรคทางชีวเคมีในเซลล์ตับและ/หรือเซลล์เยื่อบุผิวทางเดินน้ำดี (biliary epithelial cells) หรือไม่ หรือมีการบีบรัดทางโครงสร้าง (ซึ่งโดยทั่วไปแล้วจะอาศัยการวินิจฉัยด้วยภาพถ่ายทางการแพทย์ (imaging) มากกว่าข้อมูลทางห้องปฏิบัติการ)

หน้าที่การสังเคราะห์ของตับและเลือดที่หล่อเลี้ยงตับจากระบบพอร์ทัล
ตับมีคุณสมบัติในการสร้างโปรตีนจำนวนมาก โดยโปรตีนที่พบมากที่สุดคืออัลบูมิน นอกจากนี้ยังมีโปรตีนระยะเฉียบพลัน (acute phase proteins) และปัจจัยการแข็งตัวของเลือด (coagulation factors) หลายชนิด ยิ่งไปกว่านั้นตับยังเป็นแหล่งหลักของการสร้างกลูโคส (gluconeogenesis) การสังเคราะห์คอเลสเตอรอล (cholesterol synthesis) และเป็นที่อยู่ของเอนไซม์ในวงจรยูเรีย (urea cycle) ดังนั้นอัลบูมิน, กลูโคส, คอเลสเตอรอลและยูเรีย จึงถูกใช้ร่วมกันเพื่อบ่งชี้ความสามารถของตับในการมีส่วนร่วมในการเมตาบอลิซึมระดับกลางได้อย่างมีประสิทธิภาพ หากสุนัขหรือแมวมีเซลล์ตับที่ทำงานได้ไม่เพียงพอเนื่องจากการบาดเจ็บหรือการฝ่อลีบ (atrophy) สารวิเคราะห์ทั้งสี่ชนิดนี้อาจลดลงทั้งหมด อย่างไรก็ตามสารวิเคราะห์เหล่านี้ก็ได้รับผลกระทบจากกระบวนการอื่นๆ ได้เช่นกัน อัลบูมินเป็นโปรตีนระยะเฉียบพลันเชิงลบ (negative acute phase protein) และสามารถสูญเสียออกจากร่างกายได้หลายทาง รวมถึงทางปัสสาวะหรือทางเดินอาหารหรือจากภาวะเลือดออกหรือแม้แต่การมีสารคัดหลั่ง (exudation) ไหลออกจากร่างกาย การตรวจ CBC และการตรวจปัสสาวะ (urinalysis) จะสามารถช่วยแยกแยะสาเหตุอื่นๆเหล่านี้ได้ การสังเคราะห์
คอเลสเตอรอล (cholesterol synthesis) จะลดลงในโรคที่มีการดูดซึมสารอาหารบกพร่อง (malabsorptive diseases), ภาวะต่อมหมวกไตทำงานบกพร่อง (hypoadrenocorticism) และมะเร็งบางชนิด ดังนั้นกระบวนการต่างๆเหล่านี้จะต้องถูกแยกออกไปหากต้องการพิจารณาว่าภาวะตับวาย (synthetic liver failure) เป็นสาเหตุหลัก 20,21,22 การทำภาพวินิจฉัย (imaging) ก็สามารถช่วยในการประเมินขนาดโดยรวมของตับและมองหาสัญญาณของภาวะพังผืดที่อาจเกิดขึ้นได้
หากสงสัยว่ามีการเปลี่ยนแปลงของการไหลเวียนเลือดและการลดลงของการทำงานของตับในการกำจัดสารต่างๆ (decreased clearance functioning) สัตวแพทย์สามารถตรวจวัดระดับกรดน้ำดีในซีรั่ม (serum bile acids) เพื่อตรวจหาความผิดปกตินี้ได้ การเพิ่มขึ้นของกรดน้ำดีในซีรั่มสามารถบ่งชี้ถึงปริมาณเซลล์ตับที่ลดลงและ/หรือโรคเส้นเลือดลัดข้ามตับ (portosystemic shunting) (โดยที่กรดน้ำดียังคงอยู่ในระบบไหลเวียนเลือดเนื่องจากเลือดไม่ได้ไหลผ่านเข้าไปในตับ (blood by-passing the liver) กรดน้ำดีมีแนวโน้มที่จะเพิ่มขึ้นหากมีหลักฐานทางชีวเคมีของภาวะท่อน้ำดีอุดตัน ทั้งนี้การทดสอบนี้จะใช้ได้ยากขึ้นในการประเมินปริมาณเซลล์ตับและการไหลเวียนของเลือด โดยหากมีโรคที่เกี่ยวกับลำไส้เล็กส่วนปลายผิดปกติ (ileal disease) ร่วมด้วย การดูดซึมของกรดน้ำดีที่หลั่งเข้าสู่ทางเดินอาหารจะบกพร่อง ดังนั้นในสัตว์ที่เป็นโรคตับรุนแรงและมีภาวะการดูดซึมที่ลำไส้เล็กส่วนปลายบกพร่อง (ileal malabsorption) ระดับกรดน้ำดีอาจอยู่ในเกณฑ์ปกติได้ การทดสอบแบบพลวัต (dynamic test) (การวัดก่อนและหลังกินอาหาร) จะเพิ่มความไวของกรดน้ำดี แม้ว่าร้อยละ 15-20 ของสุนัขจะมีระดับที่สูงขึ้นในตัวอย่างขณะอดอาหาร ซึ่งอาจเป็นผลมาจากการที่กระเพาะอาหารว่างช้าหรือการหดตัวของถุงน้ำดีโดยไม่ตั้งใจ ในกรณีเหล่านี้ ควรใช้ค่าที่สูงกว่าของทั้งสองค่าในการตีความ 23
|
การตรวจปัสสาวะร่วมกับการประเมินตับ
ไตของสุนัขมีความสามารถในการขับคอนจูเกตบิลิรูบิน (conjugated bilirubin) ออกทางปัสสาวะได้สูงแม้จะมีปริมาณเพียงเล็กน้อยในเลือด (มี renal threshold ต่ำ) ด้วยเหตุนี้ ในสัตว์ที่มีภาวะท่อน้ำดีอุดตันหรือน้ำดีคั่ง (cholestatic animals) จึงมักพบภาวะบิลิรูบินในปัสสาวะสูง (bilirubinuria) ก่อนที่จะพบภาวะบิลิรูบินในเลือดสูง (hyperbilirubinemia) อย่างไรก็ตามในภาวะท่อน้ำดีอุดตันเรื้อรัง คอนจูเกตบิลิรูบินอาจจับกับอัลบูมินอย่างถาวร ก่อตัวเป็นเดลต้า-บิลิรูบิน (delta-bilirubin) ซึ่งจะคงอยู่ในกระแสเลือด ดังนั้นการไม่พบบิภาวะบิลิรูบินในปัสสาวะสูงในสัตว์ที่มีหลักฐานอื่นๆ ของภาวะท่อน้ำดีอุดตันจึงไม่ควรนำมาใช้เพื่อตัดประเด็นการเกิดภาวะท่อน้ำดีอุดตันออกไป นอกจากนี้ในสุนัขเพศผู้ยังสามารถเปลี่ยนแปลงคุณสมบัติทางเคมี (conjugate) บิลิรูบินบางส่วนได้ในท่อไต (renal tubules) ดังนั้นการพบบิลิรูบินในปัสสาวะปริมาณเล็กน้อยในสุนัขเพศผู้อาจไม่มีนัยสำคัญทางคลินิก หากการสังเคราะห์ยูเรียที่ตับลดลง อาจส่งผลกระทบต่อไตในลำดับถัดไป เนื่องจากยูเรียมีความจำเป็นต่อความสามารถของไตในการทำให้ปัสสาวะเข้มข้น สัตว์หลายตัวที่มีปัญหาโรคตับจึงมักจะมีปัสสาวะที่ไม่เข้มข้นและอาจมีภาวะปัสสาวะมาก (polyuria) (แสดงในรูปภาพที่ 3) สำหรับแมว การพบบิลิรูบินในปัสสาวะนั้นจำเป็นต้องได้รับการตรวจเพิ่มเติมเสมอ เนื่องจากการปนเปื้อนของแอมโมเนียลงในปัสสาวะอาจทำให้เกิดการก่อตัวของผลึกแอมโมเนียมไบยูเรต (ammonium biurate crystals) ได้
สิ่งที่ตรวจพบเพิ่มเติมจากผลการตรวจทางห้องปฏิบัติการ
สัณฐานวิทยาของเม็ดเลือดแดง
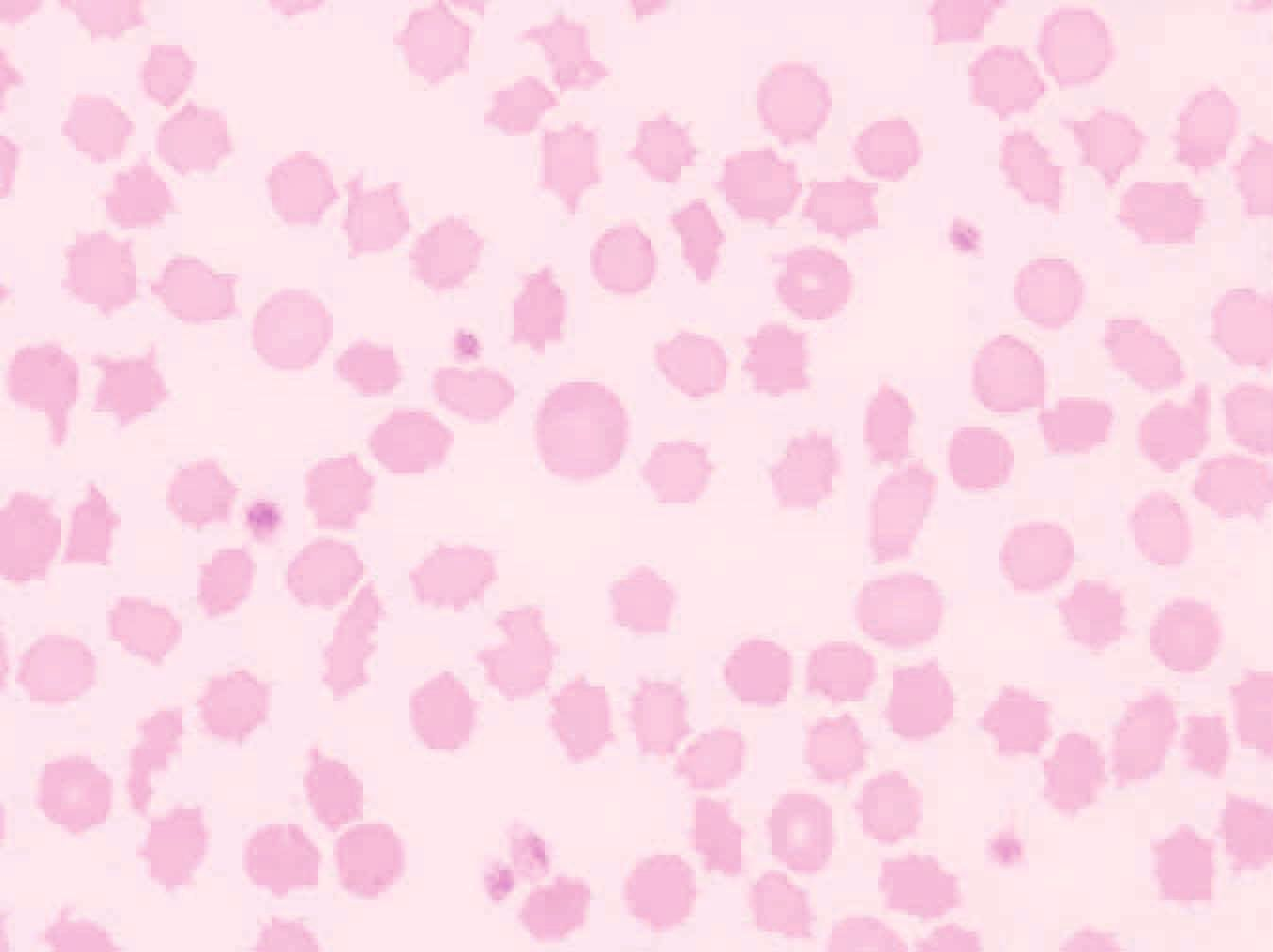
สัณฐานวิทยาของเม็ดเลือดแดงอาจได้รับผลกระทบจากการเปลี่ยนแปลงของไลโปโปรตีน (lipoprotein) ในซีรั่มที่เกิดขึ้นในโรคตับ สิ่งนี้สะท้อนให้เห็นภาวะเม็ดเลือดแดงรูปทรงผิดปกติ (poikilocytosis) ที่มักพบในแมวที่เป็นโรคไขมันสะสมในตับ (hepatic lipidosis) (รูปภาพที่ 4) สัตว์ที่เป็นโรคเส้นเลือดลัดข้ามตับ (portosystemic shunt) อาจแสดงอาการเม็ดเลือดแดงขนาดเล็ก (microcytosis) โดยมีหรือไม่มีภาวะโลหิตจางก็ได้ ส่วนอะแคนโทไซต์ (Acanthocytes) มีความสัมพันธ์กับพยาธิสภาพของตับเพียงเล็กน้อย
ภาวะเลือดออกผิดปกติจากตับ
ตับไม่เพียงแต่สร้างปัจจัยการแข็งตัวของเลือด (coagulation factors) เท่านั้น แต่ยังสร้างโปรตีนหลายชนิดที่ยับยั้งการแข็งตัวของเลือดด้วย ซึ่งรวมไปถึงโปรตีนซี (protein C) และโปรตีนเอส (protein S) สัตว์ที่มีการทำงานของตับในการสังเคราะห์ (synthetic liver function) ลดลงอาจแสดงอาการได้ทั้งภาวะเลือดออกง่ายหรือภาวะลิ่มเลือดอุดตัน โรคทางเดินอาหารที่ทำให้การดูดซึมวิตามินเคลดลงจะขัดขวางไม่ให้เซลล์ตับสามารถทำปฏิกิริยาคาร์บอกซิเลชัน (carboxylating) กับปัจจัยการแข็งตัวของเลือดบางชนิดได้อย่างมีประสิทธิภาพซึ่งส่งผลให้การแข็งตัวของเลือดบกพร่อง ในบรรดาปัจจัยที่ต้องพึ่งพาวิตามินเคเหล่านั้น ปัจจัยที่ VII (Factor VII) มีค่าครึ่งชีวิตสั้นที่สุด ด้วยเหตุนี้การที่ ค่า Prothrombin Time (PT) ยาวนานออกไปจึงอาจเกิดขึ้นก่อนที่ค่า Activated Partial Thromboplastin Time (aPTT) จะยาวนานตามมาในกรณีดังกล่าว
โปรตีนซีและ CRP
โปรตีนซี (Protein C) และ C-reactive protein (CRP) ล้วนถูกสร้างขึ้นที่ตับ โดยทั้งคู่สามารถวัดได้อย่างแม่นยำในสัตว์เลี้ยง อย่างไรก็ตามความคล้ายคลึงกันในชื่อเรียกที่โชคร้ายนี้อาจนำไปสู่ข้อผิดพลาดในการเลือกการทดสอบได้เป็นครั้งคราว โปรตีนซีเป็นตัวบ่งชี้ (biomarker) ที่ได้รับการพิสูจน์แล้วสำหรับการทำงานด้านการสังเคราะห์ของตับและการไหลเวียนของเลือดผ่านระบบพอร์ทัลของตับ (hepatoportal perfusion) ในฐานะที่เป็นส่วนประกอบหนึ่งของกลไกสำคัญในการต้านการแข็งตัวของเลือด (anti-coagulative pathway) เราพบว่าความเข้มข้นของโปรตีนซีในซีรั่มมีประโยชน์ในการ แยกความแตกต่างระหว่างโรคเส้นเลือดลัดข้ามตับ (portosystemic shunts) กับภาวะหลอดเลือดผิดปกติขนาดเล็กในตับ (microvascular dysplasia) เนื่องจากระดับโปรตีนซีจะลดลงอย่างต่อเนื่องในสุนัขที่เป็นโรคเส้นเลือดลัดข้ามตับ นอกจากนี้การเพิ่มขึ้นของความเข้มข้นของโปรตีนซียังสามารถใช้เพื่อติดตามผลการผูกเส้นเลือดลัดข้ามตับ (portosystemic shunt ligation) ได้อีกด้วย การตรวจวัดโปรตีนซีทำได้โดยใช้วิธี activity assay โดยใช้ตัวอย่างพลาสม่าที่ใส่สารกันเลือดแข็งชนิดซิเตรต (citrate) ส่วนโปรตีนระยะเฉียบพลัน CRP (C-reactive protein) สามารถตรวจวัดได้จากซีรั่มหรือพลาสม่าขึ้นอยู่กับวิธีทดสอบที่ใช้ 25
สารน้ำในช่องท้อง
ภาวะอัลบูมินในเลือดต่ำ (hypoalbuminemia) สามารถมีส่วนทำให้ความดันออนโคติก (oncotic pressure) ลดลงได้ ในขณะที่การเปลี่ยนแปลงเป็นพังผืด (fibrotic changes) ในตับสามารถเพิ่มความดันภายในหลอดเลือดและไซนูซอยด์ (sinusoids) ของตับได้ ดังนั้นสัตว์ที่มีพยาธิสภาพของตับอย่างมีนัยสำคัญจึงอาจมีสารน้ำในช่องท้อง (peritoneal effusion) (รูปภาพที่ 5) ซึ่งส่วนใหญ่เป็นสารน้ำชนิดทรานซูเดต (transudative effusion)

สรุป
ในการพิจารณาโรคตับที่อาจเกิดขึ้นในสัตว์เลี้ยง สิ่งสำคัญคือต้องจำไว้ว่ากระบวนการทางระบบ (systemic processes) สามารถก่อให้เกิดพยาธิสภาพของตับชนิดทุติยภูมิ (secondary hepatic pathology) ได้ ดังนั้นสัตวแพทย์ควรพิจารณาหลักฐานการบาดเจ็บหรือภาวะท่อน้ำดีอุดตันแยกออกจากกันและระบุรูปแบบที่เด่นชัด (predominant pattern) ให้ได้ การมองหาหลักฐานการทำงานสังเคราะห์ (synthetic function) ที่เปลี่ยนแปลงไปโดยใช้ระดับกลูโคส ยูเรีย คอเลสเตอรอลและอัลบูมินเป็น
Erica Behling-Kelly
DVM, PhD, Dip. ACVP, Ellie Diagnostics, Richardson, TX, USA
United States
Dr. Behling-Kelly received her DVM from the University of Georgia in 2002 and went on to gain her PhD from the University of Wisconsin in 2006. She then undertook a post-doctoral fellowship at the University of Texas on lipoprotein metabolism before returning to Wisconsin for a residency, becoming board-certified in 2011. After over a decade at Cornell College of Veterinary Medicine as a tenure-track clinical pathologist, she moved to her current position as chief medical officer for Ellie diagnostics.
References
- Kohn B, Weingart C, Eckmann V, et al. Primary immune-mediated hemolytic anemia in 19 cats: diagnosis, therapy, and outcome (1998-2004). J. Vet. Intern. Med. 2006;20(1):159-166.
- Johnson V, Burgess B, Morley P, et al. Comparison of cytokine responses between dogs with sepsis and dogs with immune-mediated hemolytic anemia. Comp. Study Vet. Immunol. Immunopathol. 2016;1:180:15-20. Doi: 10.1016/j.vetimm.2016.08.010. Epub 2016 Aug 20
- Kosters A, Karpen SJ. The role of inflammation in cholestasis – clinical and basic aspects Semin. Liver Dis. 2010;30(2):186-194. Doi:10.1055/s-0030-1253227.
- Jenniskens M, Langouche L, van den Berghe G. Cholestatic alterations in the critically ill: Some new light on an old problem. Chest 2018;153(3):733-743. Doi:10.1016/j.chest.2017.08.018. Epub 2017 Aug 26.
- Stockham S, Scott M. Enzymes. In; Fundamentals of Veterinary Clinical Pathology. 2nd ed. Oxford, Blackwell Publishing. 2002;639-661.
- Evans J, Levesque D, Shelton GD. Canine inflammatory myopathies: a clinicopathologic review of 200 cases. J. Vet. Intern. Med. 2004;18(5):679-691. Doi: 10.1892/0891-6640(2004)18<679:cimacr>2.0.co;2.
- Michalopoulos GK. Liver regeneration. J. Cell Physiol. 2007;213(2):286-300. Doi:10.1002/jcp.21172.
- Nikumhang P, Thornton JR. Plasma and tissue activities in the cat. J. Small Anim. Pract. 1979;20(3):169-174. Doi: 10.1111/j.1748-5827.1979.tb07026.x.
- Dirksen K, Burgener IA, Rothuizen J, et al. Sensitivity and specificity of plasma ALT, ALP, and bile acids for hepatitis in Labrador Retrievers. J. Vet. Intern. Med. 2017;31:1017-1027.
- Ullal TV, Lakin S, Gallagher B, et al. Demographic and histopathologic features of dogs with abnormally high concentrations of hepatic copper. J. Vet. Intern. Med. 2022;36(6):2016-2027. PMID: 36318874
- Whittemore JC, Newkirk KM, Reel DM, et al. Hepatic copper and iron accumulation and histologic findings in 104 feline liver biopsies. J. Vet. Diagn. Invest. 2012;24(4):656-661.
- Thoday KL, Mooney CT. Historical, clinical and laboratory features of 126 hyperthyroid cats. Vet. Rec. 1992;131(12):257-264. Doi: 10.1136/vr.131.12.257.
- Putzki H, Reichert B, Heymann H. The serum activities of AP, gamma-GT, GLDH, GPT and CHE after complete biliary obstruction and choledochocaval fistula in the rat. Clin. Chim. Acta. 1989;28;181(1):81-85. Doi: 10.1016/0009-8981(89)90320-3.PMID: 2566401
- Zollner G, Trauner M. Mechanisms of cholestasis. Clin. Liver Dis. 2008;12:1-26.
- Slott PA, Liu MH, Tavoloni N. Origin, pattern, and mechanism of bile duct proliferation following biliary obstruction in the rat. Gastroenter. 1990;99(2):466-477. Doi: 10.1016/0016-5085(90)91030-a.PMID: 169480.
- Wiedmeyer CE, Solter PE, Hoffmann WE. Alkaline phosphatase expression in tissues from glucocorticoid-treated dogs. Am. J. Vet. Res. 2002;63(8):1083-1088. Doi: 10.2460/ajvr.2002.63.1083.PMID: 12171158.
- Horney BS, Farmer A, Hono DJ, et al. Agarose gel electrophoresis of alkaline phosphatase isoenzymes in the serum of hyperthyroid cats. Vet. Clin. Pathol. 1994;23(3):98-102. Doi: 10.1111/j.1939-165x.1994.tb00687.
- Müller PB, Taboada J, Hosgood G, et al. Effects of long-term phenobarbital treatment on the liver in dogs. J. Vet. Intern. Med. 2000;14(2):165-171. Doi: 10.1892/0891-6640(2000)014<0165:eolpto>2.3.co;2.
- McCullough S. Immune-mediated hemolytic anemia: Understanding the nemesis. Vet. Clin. North Am. Small Anim. Pract. 2003;33:1295-1315.
- Lyngby JG, Sellon RK. Hypoadrenocorticism mimicking protein-losing enteropathy in 4 dogs. Can. Vet. J. 2016;57(7):757-760.
- Kull PA, Hess RS, Craig LE, et al. Clinical, clinicopathologic, radiographic, and ultrasonographic characteristics of intestinal lymphangiectasia in dogs: 17 cases (1996-1998). J. Am. Vet. Med. Assoc. 2001;15:219(2):197-202. Doi: 10.2460/javma.2001.219.197.
- Moore PF, Affolter VK, Vernau W. Canine hemophagocytic histiocytic sarcoma: a proliferative disorder of CD11d+ macrophages. Vet. Pathol. 2006;43(5):632-645. Doi: 10.1354/vp.43-5-632
- Center SA, Erb HN, Joseph SA. Measurement of serum bile acids concentrations for diagnosis of hepatobiliary disease in cats. J. Am. Vet. Med. Assoc. 1995;207(8):1048-1054. PMID: 7559044.
- Ruland K, Fischer A, Hartmann K. Sensitivity and specificity of fasting ammonia and serum bile acids in the diagnosis of portosystemic shunts in dogs and cats. Vet. Clin. Pathol. 2010;39(1):57-64. Doi: 10.1111/j.1939-165X.2009.00178.x. Epub 2009 Aug 26.
- Toulza O, Center SA, Brooks MB, et al. Evaluation of plasma protein C activity for detection of hepatobiliary disease and portosystemic shunting in dogs. J. Am. Vet. Med. Assoc. 2006;229(11):1761-1771. Doi: 10.2460/javma.229.11.1761. PMID: 17144823.
Other articles in this issue
แบ่งปันบนโซเชียลมีเดีย